
中国海洋湖沼学会主办。
文章信息
- 李彬, 景斐, 武敏敏, 张建设. 2017.
- LI Bin, JING Fei, WU Min-Min, ZHANG Jian-She. 2017.
- 太平洋真宽水蚤(Eurytemora pacifica)热休克蛋白70(HSP70) 基因克隆及在金属胁迫下的表达分析
- CLONING AND EXPRESSION ANALYSIS OF HEAT SHOCK PROTEIN 70 GENE IN EURYTEMORA PACIFICA UNDER METAL STRESS
- 海洋与湖沼, 48(5): 1060-1070
- Oceanologia et Limnologia Sinica, 48(5): 1060-1070.
- http://dx.doi.org/10.11693/hyhz20170400100
-
文章历史
- 收稿日期:2017-04-23
- 收修改稿日期:2017-05-22
热休克蛋白又称热激蛋白, 在生物体内按照其分子量的大小基本上分成小分子的HSP、HSP60、HSP70、HSP90以及HSP100几种(陈曦, 2011)。其中HSP70基因(Mayer et al, 2005; Shu et al, 2011)在其结构上具有高度的保守性, 这种特殊的结构为其在启动转录之后能够快速产生成熟的mRNA, 以便HSP70快速大量表达。HSP70作为非特异性的细胞保护蛋白, 主要负责细胞内蛋白质的折叠, 多肽的合成, 保证蛋白质按照通路进行, 通过以ATP形式与为未折叠疏水区相结合从而稳定蛋白未折叠下的稳定状态, 并通过有控制的释放帮助其折叠。目前来看, HSP70功能的研究主要包括在参与细胞耐热和细胞保护、分子伴侣、抗细胞凋亡与抗氧化、以及肿瘤免疫几个方面。研究表明HSP70在机体面临氧化损伤时可以通过促使机体内源性抗氧化剂的合成与释放增加, 从而使之具有抗氧化的活性, 并且其结合物可以激活蛋白激酶C来增强蛋白酶的活性, 从而起到促进ATF水解生成超氧化物歧化酶来使细胞抵御氧化伤害(陈兰英等, 2004; 任宝波等, 2005)。目前对HSP70已经相继在多种甲壳类动物中克隆, 同时HSP70基因在甲壳类动物面临不同环境胁迫下的表达也有了少量报道(Kim et al, 2014; Petkeviciute et al, 2015), 但桡足类HSP70基因克隆以及在重金属胁迫中的研究相对不足。
随着海洋环境污染监测要求的提高, 海洋生物标志物的研究逐渐兴盛开来, 有研究表明HSP70可以作为海洋环境监测与预警的有效生物标志物(Mayer et al, 2005; Dakappagari et al, 2010)。太平洋真宽水蚤作为我国近海海洋浮游生物的重要组成部分, 在我国海洋生态环境监测与防控以及维持近海海洋生态系统平衡中发挥着举足轻重的作用, 而目前对太平洋真宽水蚤HSP70基因的克隆与重金属胁迫下的表达研究尚未见报道。本研究以太平洋真宽水蚤为实验材料, 通过RACE方法获得HSP70基因序列, 利用生物学信息方法, 鉴定太平洋真宽水蚤热休克蛋白70基因, 从分子水平解析Ep.HSP70基因的基本结构和金属胁迫下表达特征。
1 材料与方法 1.1 材料实验所用太平洋真宽水蚤采集自浙江省舟山市长峙岛附近海域, 体长为1.20—1.40mm, 经解剖镜下筛选纯化, 实验室暂养7天后取样实验, 暂养条件:水温(20±0.5)℃, 海水盐度28, 光暗周期12h:12h, 24小时充氧, 饵料为海水小球藻。实验时, 选取子代中外观形态与附肢完整, 生命活性强的健康的太平洋真宽水蚤的成体为实验对象; 实验样品处理后, 由液氮速冻后, 置于-80℃保存。克隆材料为对照组太平洋真宽水蚤, qRT-PCR的实验材料为不同金属胁迫处理后的太平洋真宽水蚤的总RNA, 每个实验组下个体重复3次。
1.2 试剂OMEGA Total RNA Kit Ⅱ购自美国Omega公司; PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit购自TaKaRa公司; 3′-Full RACE Core Set with PrimeScriptTMRTases试剂盒、pMDTM18-T Vector Cloning Kit等购自TaKaRa公司; 其它试剂均为国产分析纯试剂。实验引物由上海华大生物科技合成。
1.3 RACE获得目的基因全长序列根据已知桡足类HSP70全长序列设计简并引物获得太平洋真宽水蚤Ep.HSP70基因的中间片段, 再采用RACE技术, 设计HSP70基因特异性引物进行5’cDNA和3’cDNA末端的克隆。5’RACE和3’RACE的操作按照TaKaRa的RACE试剂盒说明书进行, 将获得的目的片段经分离纯化后链接到pMD18-T载体上, 然后转化到DH5α感受态细胞中, 挑选阳性克隆送往上海美吉生物技术有限公司测序。实验所用引物见表 1。
| 基因 | 引物 | 引物序列(5′—3′) | 扩增长度(bp) | 作用 |
| HSP70 | DP-HSP70.F | CTTAYGGGTTSGACAAGAA | 496 | Degenerated primer |
| DP-HSP70.R | ATCTTGGGGATRCGRGTGG | |||
| 5GSP1 | TGTTCCCCTTGATGTCCTTCTTG | 228 | 5’RACE | |
| 5GSP2 | TTGATGTCCTTCTTGTGCTTCCT | 220 | ||
| 3GSP1 | CAACGAGTTCAAGAGGAAGCACA | 312 | 3’RACE | |
| 3GSP2 | AGAAGGACATCAAGGGGAACAAG | 289 | ||
| AP | GGCCACGCGTCGACTAGTACGGGGGGGG | Adaptor primer |
用DNAMAN 8.0软件将测序结果进行拼接, 得到太平洋真宽水蚤HSP70基因的全长cDNA序列。编码区及非编码区的预测利用NCBI在线网站ORF finder (http://www.ncbi.nlm.nih.gov/gorf/orfig.cgi)来预测。分子量和等电点在Expasy网站(http://web.expasy.org/compute pi/)进行分析, 使用SignalP 4.1 Server网址为与TMHMM Server v.2.0分别对其进行信号肽以及跨膜区的预测; 使用Swissport在线软件对HSP70基因的蛋白质结构进行预测分析http://swissmodel.expasy.org/; 用SMS在线序列处理工具包对Ep.HSP70基因氨基酸序列与其他物种进行同源性多重比对, 使用MEGA6.0以邻位相连法(Neighbor-joining)构建系统进化树。
1.5 实时荧光定量PCR(qRT-PCR)表达分析利用Prime primer 5.0软件在HSP70基因编码区范围内设计荧光定量PCR所需的特异性引物, 内参引物为18S rRNA, 见表 2。实验所用引物由上海华大生物公司合成, 采用PAGE纯化方式。样品经过三种重金属铜、镉、锌半致死浓度LC50(马桢红等, 1999), 以及1/2LC50、1/4LC50、1/8LC50以及1/16LC50暴露处理, 提取总RNA后反转录得到cDNA模板进行荧光定量PCR。目的基因与内参基因设置3个技术重复与3个实验重复。实验数据以未金属胁迫组太平洋真宽水蚤为对照, 排除每3个重复中差异较大的数据, 其余数据采用2-ΔΔCT法(Livak et al, 2001)进行HSP70基因相对表达分析, 数据分析采用SPSS 22.0进行单因素方差分析(张苏江等, 2003)以及显著性差异分析, 当P<0.05时为显著差异。
| 引物 | 引物序列(5’—3’) | 扩增长度(bp) | 作用 |
| HSP70 qRT-PCR F | CGTTGGCGGCAAACCTAA | 155 | qRT-PCR primer |
| HSP70 qRT-PCR R | CGGGAACAGTGACCACAGCA | ||
| 18S rRNA F | TGCATGGCCGTTCTTAGTTG | 209 | qRT-PCR control primer |
| 18S rRNA R | TCAATTCAGTGTAGCGCGTG |
以太平洋真宽水蚤RNA反转录后cDNA为模版, 以DP-HSP70.F/R为引物扩增获得492bp目的片段, 根据该终极那序列设计RACE引物, 采用RACE方法获得HSP70基因863bp的5’端序列以及1425bp的3’端序列(图 1)。
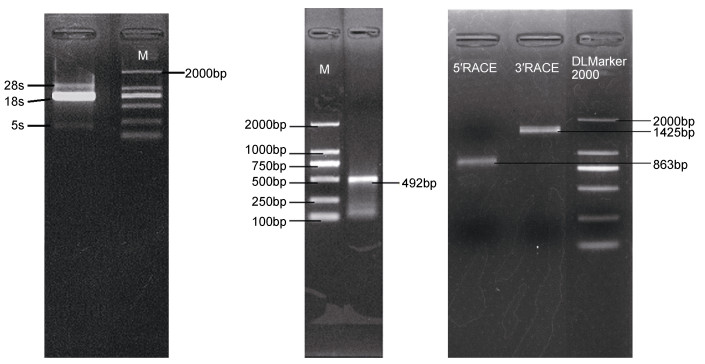 |
| 图 1 RNA、Ep.HSP70核心片段以及5’/3’RACE电泳图片 Fig. 1 The electrophoresis image of RNA, core sequences, and 5'/3'RACE of Ep.HSP70 |
利用DNAMAN 8.0软件将扩增得到的长度为的492bp的核心片段以及863bp的3’RACE和1425bp的5’RACE序列片段进行拼接, 得到太平洋真宽水蚤Ep.HSP70基因的cDNA序列全长(KY807149) 为2252bp, ORF长1947bp, 编码649个氨基酸(aa), 5’UTR与3’UTR分别由99bp、206bp的核苷酸组成, 具有典型的polyA尾巴以及AATAAA加尾信号(图 2)。
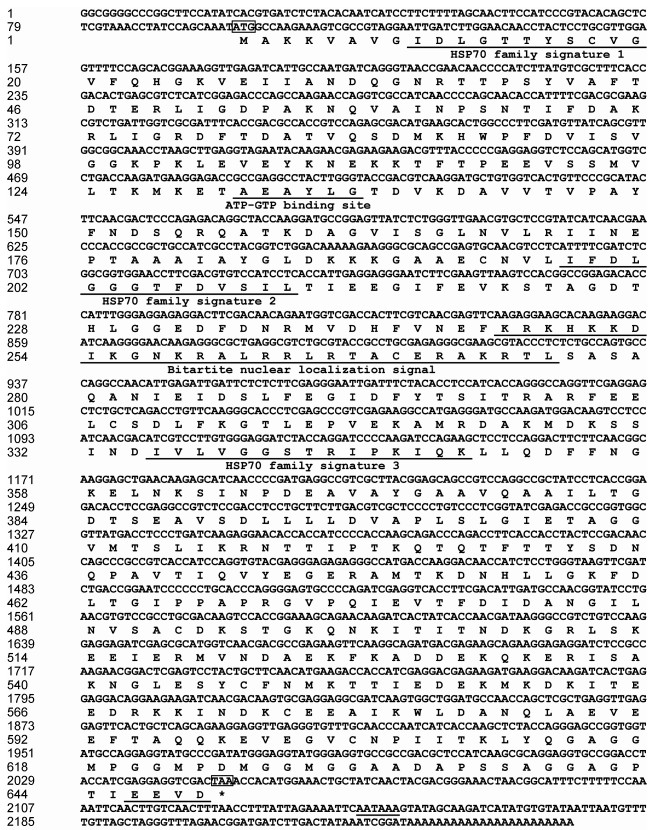 |
| 图 2 Ep.HSP70 cDNA序列及编码氨基酸序列 Fig. 2 Nucleotide and deduced amino acid sequences of Ep.HSP70 注:预测的开放阅读框中起始密码子(ATG)和终止密码子(TAA)用黑色线框标示出, HSP70家族结构特征用下划线标注, “*”表示终止密码子 |
使用在线分析软件SMS多重序列同源性比对, 将Ep.HSP70基因编码的氨基酸序列与目前已经公布的部分甲壳类的HSP70基因进行比对(图 3), 并通过DNAMAN8.0软件对所有序列与太平洋真宽水蚤HSP70蛋白序列之间的同源相似性进行计算(表 3)。结果显示, 太平洋真宽水蚤(Eurytemora pacifica)与安氏伪镖水蚤(Pseudodiaptomus annandalei)相似度最高为92.14%, 与其他水蚤如日本虎斑猛水蚤(Tigriopus japonicus)相似度为88.37%, 与矮小拟镖水蚤(Paracyclopina nana)为85.67%等, 表明Ep.HSP70基因为属于HSP70家族基因成员。
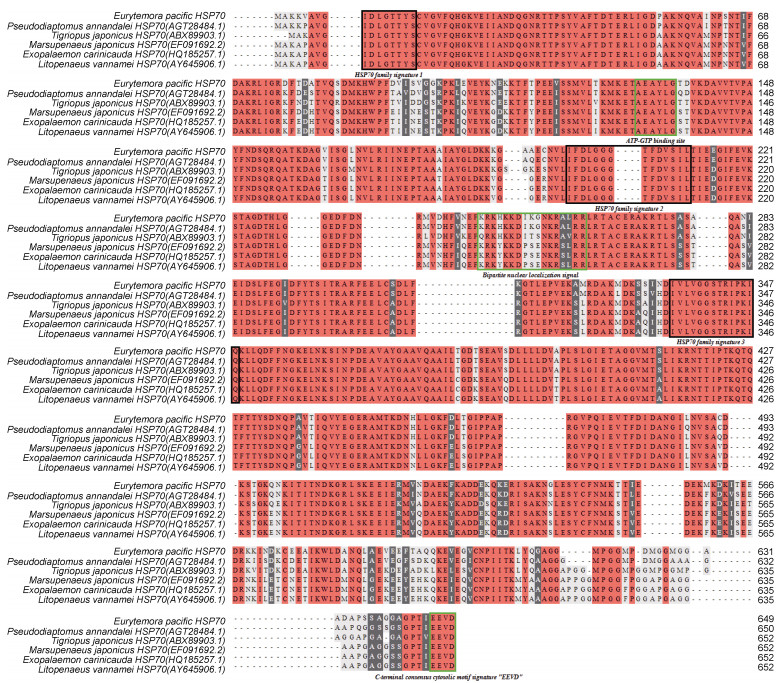 |
| 图 3 Ep.HSP70基因氨基酸序列多重比对 Fig. 3 Multiple sequence alignment of the deduced amino acid sequence of Ep.HSP70 gene |
| 序列名称 | GenBank登录号 | 来源物种 | 同源性 |
| 太平洋真宽水蚤HSP70 | KY807149 | Eurytemora pacifica | |
| 安氏伪镖水蚤HSP70 | AGT28484.1 | Pseudodiaptomus annandalei | 92.14% |
| 日本虎斑猛水蚤HSP70 | ABX89903.1 | Tigriopus japonicus | 88.37% |
| 矮小拟镖水蚤HSP70 | ADV59560.1 | Paracyclopina nana | 85.67% |
| 大型溞HSP70B | KZS19529.1 | Daphnia magna | 83.59% |
| 晶磷虾HSP70B | AIR72266.1 | Euphausia crystallorophias | 83.95% |
| 北极磷虾HSP70B | AQL57186.1 | Thysanoessa inermis | 85.34% |
| 南极磷虾HSP70B | AIR72271.1 | Euphausia superba | 83.93% |
| 美洲螯龙虾HSP70 | ABA02165.1 | Homarus americanus | 84.26% |
| 日本对虾HSP70 | ABK76338.1 | Marsupenaeus japonicus | 83.80% |
| 斑节对虾HSP70 | AAQ05768.1 | Penaeus monodon | 83.95% |
| 凡纳滨对虾HSP70 | AAT46566.1 | Litopenaeus vannamei | 83.95% |
| 脊尾白虾HSP70 | ADN78256.1 | Palaemon carinicauda | 83.95% |
| 普通黄道蟹HSP70 | CAL68995.1 | Cancer pagurus | 79.06% |
| 锯缘青蟹HSP70 | CAL68992.1 | Xantho incisus | 78.16% |
| 泥蟹HSP70 | CAL68987.1 | Bythograea thermydron | 77.74% |
使用MEGA 6.0软件构建NJ系统进化树, 计算方法采用Bootstrap法(陈红等, 1997)重复计算1000次。NJ系统进化树中所用物种名及GenBank的登录号等相关信息在表 4列出。结果如图 4所示, 太平洋真宽水蚤HSP70基因与安氏伪镖水蚤(P. annandalei)位于同一进化枝, 氨基酸序列相似度最高, 表明亲缘关系最近; 总体上, 桡足类(Copepods)与虾类(Shrimps)系统进化发育树聚为一簇, 与蟹类的进化关系较远。
| 内切酶 | 酶切位点数 |
| Arg-Cproteinase | 25 |
| Asp-N endopeptidase | 50 |
| Asp-Nendopeptidase+N-terminalGlu | 100 |
| BNPS-Skatole | 2 |
| CNBr | 16 |
| Caspase1 | 1 |
| Chymotrypsin-highspecificity (C-termto[FYW], notbeforeP) | 38 |
| Chymotrypsin-lowspecificity (C-termto[FYWML], notbeforeP) | 98 |
| Clostripain | 25 |
| Enterokinase | 2 |
| Formicacid | 50 |
| Glutamylendopeptidase | 50 |
| Hydroxylamine | 3 |
| Iodosobenzoicacid | 2 |
| LysC | 58 |
| LysN | 58 |
| NTCB(2-nitro-5-thiocyanobenzoicacid) | 8 |
| Pepsin (pH1.3) | 98 |
| Pepsin (pH>2) | 116 |
| Proline-endopeptidase[*] | 1 |
| ProteinaseK | 326 |
| StaphylococcalpeptidaseⅠ | 42 |
| Thermolysin | 172 |
| Trypsin | 82 |
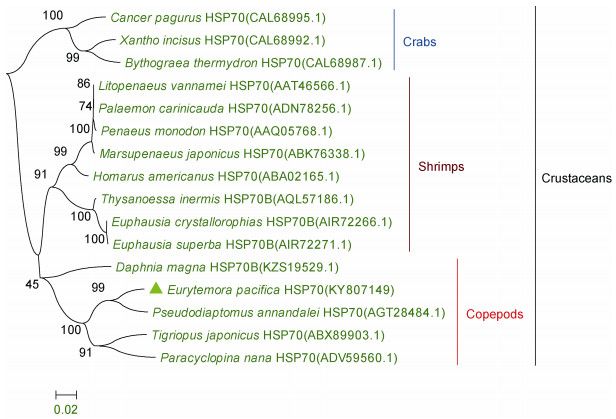 |
| 图 4 Ep.HSP70的NJ系统进化树 Fig. 4 Neighbor-Joining phylogenetic tree analysis of Ep.HSP70 |
分析结果如下:太平洋真宽水蚤Ep.HSP70基因编码蛋白包括341个亲水性氨基酸和305个疏水性氨基酸, 氨基酸疏水性最大为2.64, 最小为-3.88, 平均亲水系数(GRAVY)-0.407, 亲水性氨基酸多于疏水性氨基酸, 为亲水性蛋白(图 5); 此外, 蛋白的消光系数为29380 M-1 cm-1, 脂肪系数79.83, 带负电残基总数(Asp+Glu)为100, 带正电残基总数(Arg+Lys)为83。Compute pI/Mw结果显示其等电点/理论蛋白分子质量(pI/Mw)为5.16/70812.197; Peptide cutter进行蛋白酶切位点分析结果如表 4所示。SignalP 4.1 Sever对HSP70蛋白信号肽预测无信号肽结构(图 6), TMHMM蛋白质跨膜区域预测结果显示该蛋白无跨膜区(图 7)。GOR方法对蛋白二级结构分析显示该蛋白由α-螺旋23.74%, 延伸链23.02%, 无规则卷曲53.24%组成(图 8)。Swiss model蛋白的3D立体结构分析结果如图 9所示, 该蛋白具有明显的11个α-螺旋以及6个β-折叠结构组成(b、c、d), C末端(MET1) 以及N末端(GLU555)。
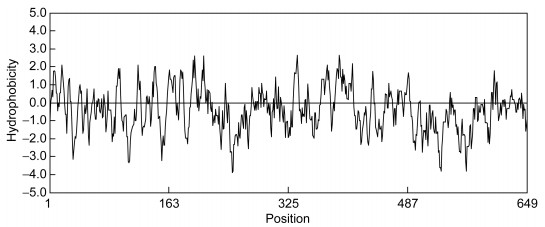 |
| 图 5 Ep.HSP70氨基酸疏水性分析 Fig. 5 Hydrophobic amino acid analysis of Ep.HSP70 |
 |
| 图 6 Ep.HSP70信号肽预测结果 Fig. 6 The signal peptide prediction of Ep.HSP70 |
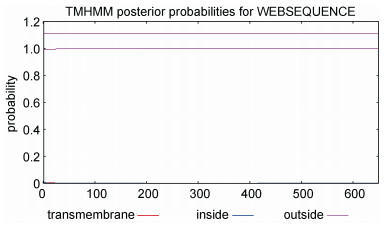 |
| 图 7 Ep.HSP70氨基酸序列跨膜区预测结果 Fig. 7 Transmembrane region analysis of Ep.HSP70 amino acid sequence |
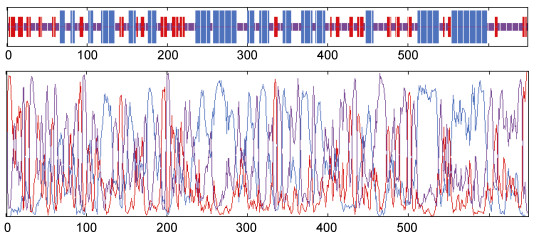 |
| 图 8 Ep.HSP70蛋白质二级结构 Fig. 8 Secondary structure model of Ep.HSP70 |
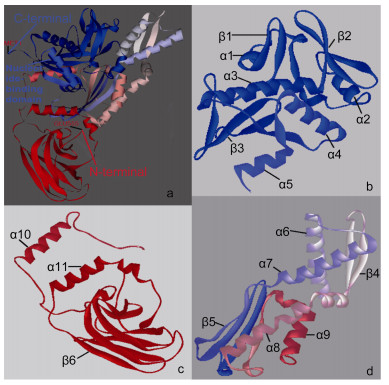 |
| 图 9 Ep.HSP70蛋白质三级结构预测图 Fig. 9 The 3-dimensional structures of Ep.HSP70 domain predicted by Cn3D-4.1 |
Swiss-PdbViewer4.0.4蛋白功能位点模式(prosite patterns)分析显示存在10个蛋白翻译后修饰位点, PS00001N糖基化位点N-{P}-[ST]-{P}, PS00004环磷酸鸟苷-环磷酸腺苷蛋白激酶[RK](2)-x-[ST], PS00005蛋白激酶c磷酸化位点[ST]-x-[RK], PS00006磷酸化位点[ST] -x(2)-[DE], PS00007酪氨酸激酶磷酸化位点[RK]-x(2, 3)-[DE]-x(2, 3)-Y, PS00008酰基化位点G-{EDRKHPFYW}-x(2)-[STAGCN]-{P}, PS00342微体c端靶信号[STAGCN]-[RKH]-[LI VMAFY], 以及热休克蛋白HSP70家族信号PS00297 [Ⅳ]-D-L-G-T-[ST]-x-[SC], PS00329 [LIVMF]-[LIVMFY]-[DN]-[LIVMFS]-G-[GSH]-[GS]-[AST]-x(3)-[ST]-[LIVM]-[LIVMFC], PS0 1036[LIVMY]-x-[LIVMF]-x-G-G-x-[ST] -x-[LIVM]-P-x-[LIVM]-x-[DEQKRSTA]。蛋白结构域分析显示该蛋白具有HSP70家族结构特征: 9—16位氨基酸IDLGTTYS, 198—211位氨基酸IFDLGGGTF DVSIL, 335—349位氨基酸IVLVGGSTRIPKIQ, 131—136位氨基酸处AEAYLG的ATP/GTP机构域, 247—275位氨基酸处核信号位点序列KRKHKKDI KGNKRA LRRLRTACERAKRTL, 646—649位氨基酸处HSP70羧基末端保守区域EEVD(图 2)。
2.5 太平洋真宽水蚤Ep.HSP70基因在重金属胁迫下的表达分析通过real time PCR方法对Ep.HSP70基因在重金属铜镉锌胁迫下的表达情况进行检测, 以太平洋真宽水蚤18S rRNA基因作为内参基因, 选取正常组下太平洋真宽水蚤的表达量作为参照, 每个处理下做了3个重复, 采用2-ΔΔCt方法计算相对表达量, 并用SPSS 22.0软件进行显著性分析。实验结果表明, Ep.HSP70基因在三种重金属胁迫下均有表达, 但不同时间段以及不同浓度下的表达量高低有所不同(图 10, 图 11, 图 12), 24、48、96h铜胁迫各浓度下, 48、120h镉胁迫以及锌胁迫各时间具有显著差异(P<0.05)。
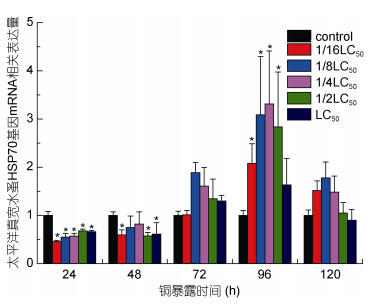 |
| 图 10 铜暴露下Ep.HSP70 mRNA表达量水平 Fig. 10 The mRNA expression levels of Ep.HSP70 under Cu exposure 注:星号表示差异显著(P<0.05, n=3) |
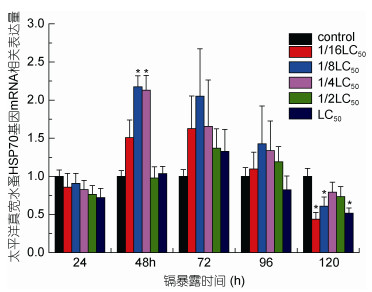 |
| 图 11 镉暴露下Ep.HSP70 mRNA表达量水平 Fig. 11 The mRNA expression levels of Ep.HSP70 under Cd exposure 注:星号表示差异显著(P<0.05, n=3) |
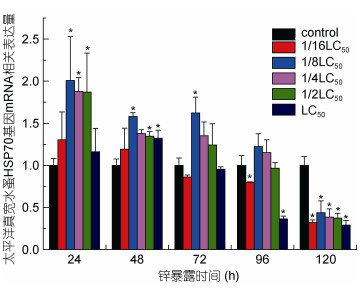 |
| 图 12 锌暴露下Ep.HSP70 mRNA表达量水平 Fig. 12 The mRNA expression levels of EpHSP70 under Zn exposure 注:星号表示差异显著(P<0.05, n=3) |
分析结果如下: Ep.HSP70基因mRNA表达水平铜胁迫下24、48h低量表达, 72h上升于96h各浓度下达到峰值, 随后降低(图 10); 镉胁迫下, 与实验对照组相比, 24h各浓度低量表达, 48h的1/16、1/8及1/4LC50低浓度表达量峰值, 72h的1/2LC50与LC50高浓度达到峰值(图 11)。锌胁迫下, 除半致死浓度LC50在48h表达量到达峰值外, 各浓度下基因表达量在24h达到峰值, 随后基因总体表达呈现下降趋势(图 12)。Ep.HSP70基因在三种金属胁迫下表达量结果表明:铜对HSP70表达的抑制作用要明显的高于镉与锌; 金属胁迫下Ep.HSP70基因在低浓度下的表达量高于高浓度下的表达量, 高浓度组金属胁迫对基因的表达抑制性较强, 表明重金属离子对Ep.HSP70表达水平的抑制率高浓度高于低浓度; 金属胁迫下, 浓度效应与时间效应趋势明显。
3 讨论HSP70热休克蛋白是生物体保留下来的可用于对抗外界损害并能够进行自我保护的重要机制之一, 在应激的不利条件下, 提高细胞的抵抗力, 起到应激保护作用。克隆得到的2252bp的Ep.HSP70 cDNA序列, 氨基酸分析发现无跨膜结构与信号肽, 因此不属于细胞内分泌的蛋白, 但能有效促进细胞内分泌蛋白的表达, 充当分子伴侣参与相关功能免疫以及蛋白折叠表达。此外, 氨基酸序列中存在多个磷酸化的位点, 在细胞信号转导中起重要作用。保守结构域分析表明Ep.HSP70及其同源蛋白结构中均具有HSP70家族基因的保守签名序列以及结构特征, 包括HSPA1-2_6-8-like_NBD结构域以及DNAK结构域, ATP/GTP结合位点, 核定位信号等, 其中核定位信号结构域富含赖氨酸和精氨酸, 为选择性的转运HSP70s进入核中而发挥其功能。其亲疏水性、等电位点、信号肽预测、蛋白二级以及三维结构分析结果与其他相关HSP70研究结果相似(吴圣楠等, 2017)。螺旋结构的复杂性与多重折叠也说明了HSP70基因功能的多样性, 在参与细胞耐热和细胞保护、分子伴侣、抗细胞凋亡与抗氧化、以及肿瘤免疫几个方面发挥着重要作用(张静, 2007)。同源性分析表明HSP70作为生物体内相对保守的一类蛋白在各物种内广泛存在, 其与桡足类、虾蟹类等甲壳类中具有较高的相似性, 为HSP70s家族成员。系统进化显示整个HSP70系统发育树Ep.HSP70基因与十足目虾蟹类的HSP70分为两个大支, 三个小支。两大支中MEGA 6.0将虾类(Shrimps)与桡足类(Copepods)或分到一个大支, 将蟹类(Crabs)单独到一个分支, 从外观形态以及游泳形式来看虾类与桡足类的相似性较近一些, 而分子序列同源性上也相对较近(表 4)。
荧光定量PCR法(Heid et al, 1996)对Ep.HSP70基因在金属胁迫下表达特异性分析发现, Ep.HSP70基因的表达在不同的金属暴露下表达不同; 同种金属胁迫下, Ep.HSP70表达量具有一定的时间效应与浓度效应表达模式。铜胁迫下, Ep.HSP70表达在96h内成递增表达趋势, 并96h表达量达到峰值, 120h表达量下降。其中在24h表达差异性显著(P<0.05) 低于对照组的表达水平, 这可能是源于太平洋真宽水蚤初期机体受到重金属的暴露性损伤而导致机体内相关的蛋白功能受到抑制, 热休克蛋白无法短时间内高量表达所造成的(Jiang et al, 2016), 镉暴露中表达规律几近一致; 锌暴露下Ep.HSP70基因在24h高量表达(Shu et al, 2011)。这种差异性的与三种金属的生理毒性相关, 本实验前期半致死以及产卵孵化变化中结果显示的毒性强弱: Cu>Cd>Zn具有一致性。而随后的表达量逐渐上升, 说明了在经受了一定时间的暴露后, Ep.HSP70蛋白开始发挥其功能且表达量递增并在一定时间段内达到表达的最高值(Jiang et al, 2016), 但由于海洋生物对不同重金属的耐受性不同以及海洋污染重金属生物毒性的大小也存在差异(Rhee et al, 2009), 因此在本实验研究中, 铜离子对Ep.HSP70的抑制胁迫作用要强于镉离子与锌离子。此外, Ep.HSP70最高表达量峰值出现在1/8LC50浓度下Ep.HSP70表达量从浓度1/8LC50开始降低, 在低浓度实验组中(即浓度低于1/8LC50时)表达量水平呈现上升态势; 在较高浓度实验组中, Ep.HSP70表达量变化趋势呈现出随着浓度升高表达量逐渐降低的特点。因此推断, 在重金属暴露下Ep.HSP70表达量特点为:在一定的浓度范围内, 重金属污染浓度越高, 应激和免疫相关基因的表达越高。然而, 当表达量在达到一定的表达峰值之后, 其基因的表达量不仅不会随着浓度升高不断上升, 反而会呈现下降趋势(Kim et al, 2014)。HSP70表达水平的上下波动变化反映了生物有机体提高自身对外来环境胁迫阈值与自我保护的机制需要, 也表明HSP70在抵御外界环境胁迫与机体调控中起着重要作用。此外, 鉴于生物体内HSP70对海洋重金属污染的敏感性与抗逆性, HSP70被用作一种较为稳定而方便的海洋水环境监测的分子标志物(蔡中华等, 2012), 在海洋水体污染的监测与前期预防发挥重要作用。因此, 研究浮游桡足类太平洋真宽水蚤体内HSP70在海洋环境重金属暴露中的表达特征, 为海洋污染对浮游生物的总体影响提供较为准确的预测与判断, 为HSP70作为海洋污染监测的生物标志物理论提供支撑。
4 结论本研究通过RACE技术首次克隆获得太平洋真宽水蚤HSP70基因全长cDNA序列, 并对其序列生物学特征进行了分析与探讨, 采用荧光定量RT-PCR技术检测了重金属胁迫下HSP70基因在太平洋真宽水蚤体内的差异表达, 研究结果为进一步探讨太平洋真宽水蚤HSP70蛋白相关功能性研究和HSP70家族其他基因的克隆奠定了基础, 为其他桡足类HSP70基因的研究及系统演化与分类系统提供借鉴; 同时为HSP70作为海洋水体污染监测与防控的有效生物标志物以及桡足类在海洋污染指示生物中的研究价值与研究意义等提供借鉴。
| 马桢红, 马良才, 1999. 生物测定中LC50或LD50的Excell运算方法. 医学动物防制, 15(11): 612–614 |
| 任宝波, 王玉艳, 王纯净, 等, 2005. HSP70家族的分类及基因结构与功能. 动物医学进展, 26(1): 98–101 |
| 吴圣楠, 隗黎丽, 李海军, 等, 2017. 三角帆蚌热休克蛋白70基因克隆及其表达分析. 水生生物学报, 41(1): 50–55 DOI:10.7541/2017.7 |
| 张静, 2007. 铅诱导热应激蛋白70基因表达的研究. 天津: 天津医科大学硕士学位论文 http://cdmd.cnki.com.cn/article/cdmd-11904-2007178256.htm |
| 张苏江, 陈庆波, 2003. 数据统计分析软件SPSS的应用(四)——广义因素方差分析(GLM-General Factorial ANOVA). 畜牧与兽医, 35(8): 24–26 |
| 陈红, 吴汇川, 1997. Bootstrap方法及其应用. 青岛大学学报, 12(3): 78–83 |
| 陈曦, 2011. 热休克蛋白及热休克蛋白70家族进化保守性的系统分析. 大连: 辽宁师范大学硕士学位论文 http://cdmd.cnki.com.cn/Article/CDMD-10165-1011151695.htm |
| 陈兰英, 朱泮民, 李冰冰, 等, 2004. HSP70的结构、特性和功能研究进展. 平顶山工学院学报, 13(2): 41–43 |
| 蔡中华, 陈艳萍, 周进, 等, 2012. 生物标志物(Biomarkers)在海洋环境监测中的研究与进展. 生命科学, 24(9): 1035–1048 |
| Dakappagari N, Neely L, Tangri S, et al, 2010. An investigation into the potential use of serum Hsp70 as a novel tumour biomarker for Hsp90 inhibitors. Biomarkers, 15(1): 31–38 DOI:10.3109/13547500903261347 |
| Heid C A, Stevens J, Livak K J, et al, 1996. Real time quantitative PCR. Genome Research, 6(10): 986–994 DOI:10.1101/gr.6.10.986 |
| Jiang X Y, Guan X T, Yao L L, et al, 2016. Effects of single and joint subacute exposure of copper and cadmium on heat shock proteins in common carp (Cyprinus carpio). Biological Trace Element Research, 169(2): 374–381 DOI:10.1007/s12011-015-0402-8 |
| Kim B M, Rhee J S, Jeong C B, et al, 2014. Heavy metals induce oxidative stress and trigger oxidative stress-mediated heat shock protein (hsp) modulation in the intertidal copepod Tigriopus japonicus. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 166: 65–74 |
| Livak K J, Schmittgen T D, 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CT method. Methods, 25(4): 402–408 DOI:10.1006/meth.2001.1262 |
| Mayer M P, Bukau B, 2005. Hsp70 chaperones:cellular functions and molecular mechanism. Cellular and Molecular Life Sciences, 62(6): 670–684 DOI:10.1007/s00018-004-4464-6 |
| Petkeviciute E, Kania P W, Skovgaard A, 2015. Genetic responses of the marine copepod Acartia tonsa (Dana) to heat shock and epibiont infestation. Aquaculture Reports, 2: 10–16 DOI:10.1016/j.aqrep.2015.04.001 |
| Rhee J S, Raisuddin S, Lee K W, et al, 2009. Heat shock protein (Hsp) gene responses of the intertidal copepod Tigriopus japonicus to environmental toxicants. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 149(1): 104–112 |
| Shu Y H, Du Y, Wang J W, 2011. Molecular characterization and expression patterns of Spodoptera litura heat shock protein 70/90, and their response to zinc stress. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 158(1): 102–110 |
 2017, Vol. 48
2017, Vol. 48


