中国海洋湖沼学会主办。
文章信息
- 付媛媛, 刘磊, 母昌考, 朱芳, 任志明, 李荣华, 宋微微, 王春琳. 2017.
- FU Yuan-Yuan, LIU Lei, MU Chang-Kao, ZHU Fang, REN Zhi-Ming, LI Rong-Hua, SONG Wei-Wei, WANG Chun-Lin. 2017.
- 生长前期三疣梭子蟹(Portunus trituberculatus)附肢再生系统解析及阶段划分
- ON LIMB REGENERATION IN EARLY STAGE OF PORTUNUS TRITUBERCULATUS IN HISTOMORPHOLOGY
- 海洋与湖沼, 48(5): 1084-1091
- Oceanologia et Limnologia Sinica, 48(5): 1084-1091.
- http://dx.doi.org/10.11693/hyhz20170500123
-
文章历史
- 收稿日期:2017-05-13
- 收修改稿日期:2017-06-10
断肢再生是动物肢体损坏、自然脱落或者自残之后全部或部分重新生成的现象, 是动物的一种自我保护机制(Mattoni et al, 2015), 多种动物均存在断肢再生的现象(Wilkie, 2001; Konstantinides et al, 2014; Shibata et al, 2016)。已有研究表明, 甲壳类, 尤其是蟹类在断肢后具有较强的再生能力, 且激素、温度、光周期等环境因素对蟹类断肢再生有较大的影响(Mykles, 2001; Gong et al, 2015; 岳武成等, 2016), 但相关研究主要集中在统计学分析和生理现象描述层面, 关于蟹类断肢及再生生理基础及再生生长能力的研究较少。Hopkins(1993)对招潮蟹(Uca pugilator)附肢再生过程进行了研究, 描述了断肢再生肢芽原基的形成及基底的发育阶段。同时, 动物再生能力及机制研究一直是生物医学研究热点, 相关研究集中在小鼠、果蝇、斑马鱼、蝾螈(Bhaja et al, 2010; 张卓航等, 2012)等模式动物上, 研究结果可供人类再生医学研究参考。因此, 建立甲壳类断肢再生动物研究模板, 开展甲壳类断肢再生机制研究对于再生生物学、再生医学、及甲壳类养殖都具有重要意义。
三疣梭子蟹(Portunus trituberculatus)味鲜美, 营养丰富, 是我国的重要经济蟹类(薛俊增等, 1997; 陈晨等, 2015), 2015年海水养殖产量近12万吨(农业部渔业局, 2016)。然而, 在三疣梭子蟹苗种培育、养殖、运输过程中存在因蟹互相攻击及其它物理损伤造成的附肢断肢现象, 影响了蟹的摄食和运动能力, 且断肢处易发生感染, 造成蟹的成活率和养殖产量下降, 经济损失巨大, 因此断肢个体能否成功再生出附肢对提高三疣梭子蟹存活率和经济效益具有重要作用。目前, 关于三疣梭子蟹断肢再生的报道极少, 对不同生长期三疣梭子蟹的断肢再生生理学和再生能力的研究也尚未见报道。因此, 针对三疣梭子蟹断肢再生生理过程及能力的认识和研究具有重要的基础及应用意义。
本研究应用人工外力断肢法将不同生长期的蟹断肢后, 研究其附肢再生和发育能力, 并采用组织切片法观察再生肢的发育状态, 研究结果将为进一步探究三疣梭子蟹及其它甲壳类断肢再生机制提供基础数据和理论参考。
1 材料与方法 1.1 实验用蟹的养殖管理取同一家系的三疣梭子蟹(Portunus trituberculatus)Ⅰ期幼蟹5000只, 饲养于6000升循环水养殖池中作为实验材料。海水盐度控制在25, 温度28℃, 然后根据图 1方法进行分组, 其中对断肢组采用压力法迫使其自切掉其1只大螯(左右随机), 每天早晚各投喂1次饲料, 每3天换水1次, 试验期间各个水族箱的养殖环境保持一致。期间观察记录蜕壳和再生肢发育情况, 统计记录蟹蜕皮、附肢再生和存活数。每12h观察各期幼蟹断肢肢芽的发育情况, 并拍照记录, 统计各生长时期螃蟹附肢再生的时间。平均蜕壳周期定义为三疣梭子蟹所有个体完成一次蜕壳所经历的平均天数。断肢再生率=再生出完整附肢幼蟹数/断肢幼蟹总数; 存活率=实验组幼蟹存活数/饲养总数; 第一次蜕壳未生附肢率=蜕壳未再生附肢存活的幼蟹数/断肢幼蟹总数。
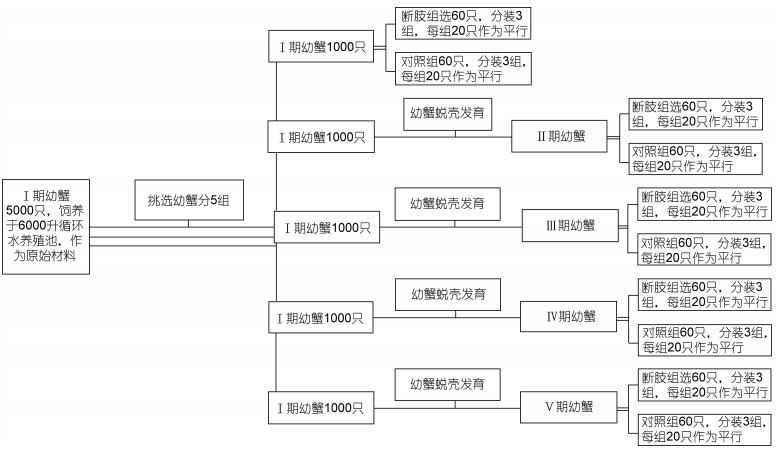 |
| 图 1 实验用蟹的养殖管理 Fig. 1 The experiment with crab culture management |
试验期间, 另取Ⅳ期幼蟹50只随机断掉其1只大螯, 分别单独放养在50个长13cm*宽7cm*高7cm的孵化盒里, 每天早晚各投喂1次饲料, 每3天换水1次, 试验期间各个孵化盒的养殖环境保持一致, 分别于断肢后第1d, 2d, 3d, 4d, 5d各取5只幼蟹, 置于解剖显微镜(novel)下观察其肢芽发育情况, 并用HDCE-X3系列摄像头及ScopeImage 9.0软件测出肢芽实际横向生长长度和纵向生长长度, 并且取其肢芽, 于1.5ml含有1ml的4%多聚甲醛溶液中固定保存, 用于组织切片。
1.3 组织石蜡包埋切片和H.E染色 1.3.1 组织石蜡包埋切片取材:取固定于4%多聚甲醛24h以上的肢芽, 在通风橱内用手术刀将目的部位组织修平整, 将修切好的组织和对应的标签放于脱水盒内。
脱水:将脱水盒放进吊篮里于脱水机内依次梯度酒精进行脱水。75%酒精4h-85%酒精2h-90%酒精2h-95%酒精1h-无水乙醇Ⅰ 30min-无水乙醇Ⅱ 30min-醇苯5-10min-二甲苯Ⅰ 5-10min-二甲苯Ⅱ 5-10min-蜡Ⅰ 1h-蜡Ⅱ 1h-蜡Ⅲ 1h。
包埋:将浸好蜡的组织于包埋机内进行包埋。先将融化的蜡放入包埋框, 待蜡凝固之前将组织从脱水盒内取出按照包埋的要求放入包埋框并贴上对应的标签。于-20°冻台冷却, 蜡凝固后将蜡块从包埋框中取出并修整蜡块。
切片:将修整好的蜡块置于石蜡切片机上切片, 片厚4μm。切片漂浮于摊片机40℃温水上将组织展平, 用载玻片将组织捞起, 并放进60℃烘箱内烤片。待水烤干蜡烤化后取出常温保存备用。
1.3.2 H.E染色石蜡切片脱蜡至水:依次将切片放入二甲苯Ⅰ20min-二甲苯Ⅱ20min-无水乙醇Ⅰ10min-无水乙醇Ⅱ10min-95%酒精5min-90%酒精5min-80%酒精5min-70%酒精5min-蒸馏水洗。
苏木素染细胞核:切片入Harris苏木素染3-8min, 自来水洗, 1%的盐酸酒精分化数秒, 自来水冲洗, 0.6%氨水返蓝, 流水冲洗。
伊红染细胞质:切片入伊红染液中染色1—3min。
脱水封片:将切片依次放入95%酒精Ⅰ 5min -95%酒精Ⅱ 5min-无水乙醇Ⅰ5min -无水乙醇Ⅱ5min -二甲苯Ⅰ5min -二甲苯Ⅱ5min中脱水透明, 将切片从二甲苯拿出来稍晾干, 中性树胶封片。
1.4 镜检将切片置于40×、400×的显微镜下观察、拍片。
1.5 数据分析利用SPSS20.0、Excel 2013、ScopeImage 9.0等处理软件, 分析不同生长期的幼蟹再生能力和Ⅳ期幼蟹肢芽发育分期及分期的组织切片。
统计5期再生附肢肢芽比值, 再生附肢肢芽比值=横向生长L1/纵向生长L2。
2 实验结果 2.1 不同生长期幼蟹断肢后第一次蜕壳再生率和存活率, 及未再生附肢蜕壳率分析如表 1所示, 不同发育时期的幼蟹断肢后经过第一次蜕壳均可再生, Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ期幼蟹的第一次蜕壳后附肢再生率分别为59.9%, 75.3%, 74.2%, 80.4%, 69.5%, 再生率随着发育时期呈现逐渐上升后下降的变化趋势, Ⅳ期最高; 各发育期第一次蜕壳未生附肢率分别为14.1%, 9.7%, 9.9%, 15.2%, 4.9%, 断肢组的存活率分别为89.4%, 84.9%, 85.2%, 89.4%, 74.2%。其中, 第Ⅳ期的存活率(89.4%)和附肢再生率(80.4%)均比其余各组高, 且差异显著(P<0.05)。三疣梭子蟹第Ⅰ期与第Ⅴ期断肢幼蟹存活率相同, 均为89.4%, 但第Ⅰ期附肢再生率显著低于第Ⅴ期附肢再生率(P<0.05), 而第Ⅰ期蟹未再生存活率(即第一次蜕皮未生附肢率)比第Ⅴ期幼蟹要高, 说明第Ⅰ期幼蟹大螯即使不能再生, 但是存活的能力仍然较强。通过对平均蜕壳周期数据分析发现, Ⅰ、Ⅱ、Ⅲ期断肢组在去大螯后到完成第1次蜕壳所需的平均天数分别为3.33d, 4.47d和6.27d, 显著高于正常组的2.13d, 3.89d和5.63d (P<0.05), 而Ⅳ、Ⅴ期完成第1次蜕壳所需的平均天数(7.12d、10.86d)极显著的高于正常组(6.11d、8.09d) (P<0.01), 且随着发育期的增加断肢再生的时间也随之延长。
| 组别 | 第一次蜕壳附肢再生率(%) | 存活率(%) | 第一次蜕壳未生附肢率(%) | 蜕壳时间(d) |
| 断肢蟹Ⅰ | 59.9±0.56* | 89.4±0.11 | 14.1±0.42 | 3.33±0.49b |
| 正常Ⅰ | 0 | 98.2±0.45 | 0 | 2.13±0.21c |
| 断肢蟹Ⅱ | 75.3±0.32** | 84.9±0.25 | 9.7±0.19 | 4.47±0.52b |
| 正常Ⅱ | 0 | 90.3±0.16 | 0 | 3.89±0.36c |
| 断肢蟹Ⅲ | 74.2±0.62** | 85.2±0.13 | 9.9±0.53 | 6.27±0.46b |
| 正常Ⅲ | 0 | 95.1±0.23 | 0 | 5.63±0.33c |
| 断肢蟹Ⅳ | 80.4±0.12** | 89.4±0.43 | 15.2±0.33 | 7.12+0.70d |
| 正常Ⅳ | 0 | 90.2±0.21 | 0 | 6.11+0.39e |
| 断肢蟹Ⅴ | 69.5±0.42** | 74.2±0.19 | 4.9±0.59 | 9.86±0.91d |
| 正常Ⅴ | 0 | 80.3±0.42 | 0 | 8.09±0.43e |
| 注: *和**标注两组差异显著(P<0.05), b和c上标两组差异显著(P<0.05), d和e上标两组差异极显著(P<0.01) | ||||
如图 2所示, 在解剖镜下观察肢芽外部形态变化, 三疣梭子蟹Ⅳ期幼蟹从大螯断肢到再生附肢大致经历6个发育时期, 分别是: A-再生芽基、B-肢芽趾缝期、C-肢芽分化期、D-肢芽斑点期、E-肢芽成熟期、F-肢体出膜期。三疣梭子蟹的幼蟹大螯被截断后, 伤口逐渐愈合封闭, 并在其下形成一个再生芽即再生芽基期, 此时再生肢芽透明没有明显的外部特征; 随着细胞的不断分化, B期会出现一条明显的趾缝, 这个趾缝即为图 2-F再生大螯附肢的长节(图 2-F-f)和掌节(图 2-F-d)分节线; 再生肢芽不断的发育, C期外部形态分化显著, 出现腕节(图 2-C-c)及大螯可动趾(图 2-C-e)的分化, 肢芽仍然是透明的, 这时肢芽的细胞分化已经结束; 在C期的基础上, 各分化细胞在原有的细胞构架上继续增殖, 最明显的特征为D期出现色素沉淀(图 2-D-g), 色素不断聚集增多, 变暗直至深黑色, 再生肢芽为成熟E期; 经过蜕皮伸展出再生附肢F期, 再生肢体的外部形态接近正常肢体水平, 但能观察到显著的大小差异。
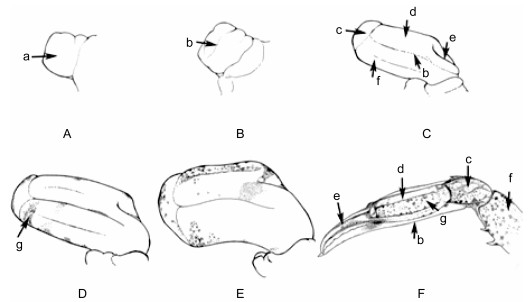 |
| 图 2 第Ⅳ幼蟹断肢再生肢芽外部形态示意图 Fig. 2 The external morphology of limb buds regenerated from the fourth juvenile crab 注: A:再生芽基期, B:肢芽趾缝期, C:肢芽分化期, D:肢芽斑点期, E:肢芽成熟期, F:肢体出膜期; a:再生芽基, b:趾缝, c:腕节, d:掌节, e:大螯可动趾, f:长节, g:色素 |
通过对外部发育及其对应切片进行分析, 如图 2-A所示在大螯附肢被截断瞬间, 创伤的修复从伤口边缘表皮扩展并且覆盖切口表面, 伤口愈合表皮增殖, 产生一个多层的细胞团形成去分化的细胞, 在断肢24h内, 形成再生的肢芽。如切片图 3-A2-a箭头所指, 在新生的芽基中出现大片的组织溶解, 细胞形成松散的间质, 出现结缔组织, 结缔组织细胞呈现类似胚胎期间质细胞形态, 有去分化的功能。随着肢芽迅速分裂增生形成B期, 对应组织切片图 3-B2显示结缔组织逐渐被分化的细胞所代替, 出现颗粒性的类似血细胞的嗜酸性细胞, 为其他细胞提供营养, 随后再生附肢细胞组织(图 3-C2) 发生分化现象, 在切片显示上皮细胞和成纤维细胞排列整齐, 按照已经分化好的细胞团的位置形成分化支架, 再生肢芽不断依靠支架(图 3-F2) 进行成熟发育。总体上说, 三疣梭子蟹大螯再生附肢所经历的6个发育时期, 按照发育顺序进行组织切片发现, A期有大量未分化的结缔组织(图 3-A2-a); 结缔组织逐渐出现分化的细胞团, 可以分辨出有营养功能的嗜酸性颗粒细胞(图 3-B2-b); 紧接着的C期中, 细胞团逐渐增殖分化, 肢芽明显分出三层:一层是中性粒细胞脱颗粒、第二层是松散组合的细胞和第三表皮细胞; 最终松散组合的细胞充满肢芽, 表皮细胞也从最初的不规则, 经过不断增殖迁移形成规则的上皮细胞; 到D期初现肌纤维细胞, 此时肢芽骨架已经形成(图 3-F2), 称之为上皮-间质系统, 再生肢芽不断依靠支架进行组织分化, 最终完善附肢的各个组织系统。
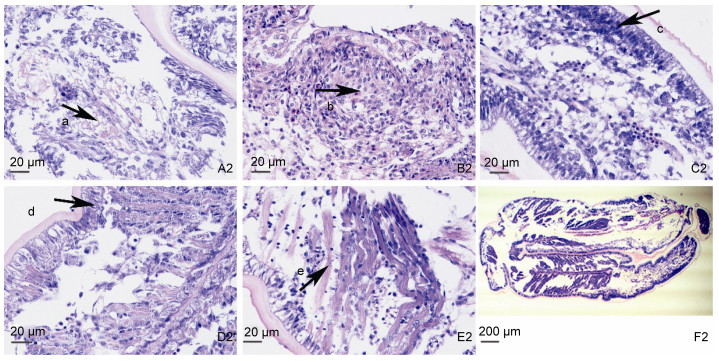 |
| 图 3 第Ⅳ幼蟹断肢再生肢芽外部形态组织切片 Fig. 3 Histopathological observation on limb buds of the fourth juvenile crab 注: A2, B2, C2, D2, E2: ×400倍; F2: ×40倍。A2:再生芽基切片, B2:肢芽趾缝期切片, C2:肢芽分化期切片, D2:肢芽斑点切片, E2:肢芽成熟期切片, F2:上皮-间质系统。a:结蹄组织, b:嗜酸性细胞, c:上皮细胞, d:规则的上皮细胞, e:肌纤维 |
由图 4可以看出, 肢芽沿着纵向方向不断延伸, 在短时间(A期、B期和C期)内变化幅度较大, 到D期和E期时生长速度放缓, 而横向生长也有所增长(A期和B期), 但是变化幅度不明显, 直至横向生长有显著的变化(C期、D期和E期), 可能与细胞的分化先后顺序及基因的调控有关系, 有待后续研究证实。
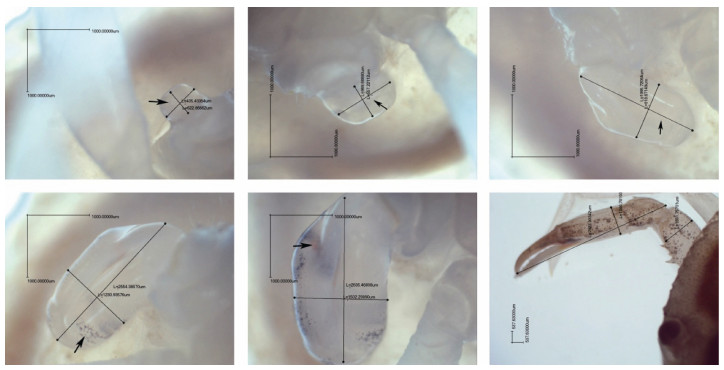 |
| 图 4 第Ⅳ幼蟹断肢再生肢芽横纵生长数据测量示意图 Fig. 4 Measurement of cross-longitudinal growth data of the limb buds regenerated from amputation of juvenile crab 注: L1:横向生长, L2:纵向生长, L3:再生附肢大螯长节横向长度 |
按照图 4所示的测量方法(再生附肢肢芽比值=横向生长L1/纵向生长L2), 统计计算第Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ期各20只幼蟹肢芽横纵生长比值, 绘制了不同生长期三疣梭子蟹再生附肢肢芽比值变化趋势图(图 5)。由图 5可得, 断肢2天后Ⅰ期幼蟹肢芽比值显著下降, 到第三天时就趋于平衡达到临界点, Ⅱ期幼蟹与Ⅰ期幼蟹变化趋势相似, 而Ⅱ期幼蟹完全生出附肢的时间要比Ⅰ期晚1天; Ⅲ、Ⅳ期幼蟹肢芽的比值在第2天也显著降低, 接下来的变化趋于缓和, 直至第7天实验组完全生出附肢; 第Ⅴ期幼蟹的肢芽比值没有显著下降的过程这个与其余各期有显著的差别。各期断肢幼蟹附肢再生比值随着时间的变化而逐渐降低, 且第Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ期变化趋势相似, 且当比值分别达到0.32、0.318、0.398、0.518、0.538断肢幼蟹完全再生出附肢。
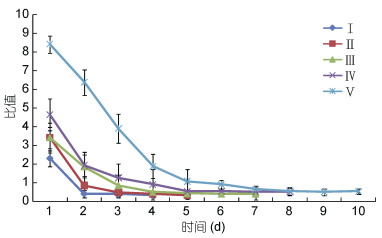 |
| 图 5 不同生长期三疣梭子蟹再生附肢肢芽比值变化趋势图 Fig. 5 The trends of limb buds ratio in different developmental stages of P. trituberculatus |
以Ⅳ期三疣梭子蟹幼蟹断肢再生为例, 可将断肢再生过程描述如下:幼蟹首先会在断肢的部位形成“棒状”的肢芽, 有膜包被, 其长节和掌节迂回弯曲, 有明显趾缝出现; 在肢芽膜内前端, 出现大螯不动趾和大螯动趾的分化, 趾缝和腕节明显; 当膜蜕去后, 附肢各个节蜕皮展开来, 这与纪成林(1980)的研究相似。本研究数据结果表明, 第Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ期幼蟹断肢后均会再生出肢芽, 再生肢体的外部形态与正常附肢相同, 但显著小于正常附肢。螃蟹蜕壳是随着个体的大小不同而有差异, 个体越小蜕壳的时间越短, 如果在蜕壳过程发生障碍, 蜕壳的时间就会延长, 甚至而致螃蟹死亡。本研究发现断肢的各期幼蟹蜕壳时间均比正常幼蟹时间要长, 且断肢组幼蟹的死亡率也比正常的幼蟹要高。张琼宇等(2005)研究发现一龄、二龄的草鱼抵抗细菌和病毒的能力要低于三龄的, 断肢对幼蟹有机械性的损伤, 同时不同发育时期幼蟹免疫能力也是有差别的, 通过实验数据分析, Ⅴ期幼蟹断肢存活率和正常组相比差异不显著(P>0.05), 且蜕皮附肢再生率高于其余各组且差异显著(P<0.01), Ⅴ期幼蟹展示出了较强的附肢再生能力及存活能力, 这可能是表达或增强了Ⅰ、Ⅱ期一些断肢相关基因, 从而构建了一个较健全的断肢再生系统; 本研究还发现Ⅰ、Ⅱ、Ⅲ、Ⅳ期断肢组的存活率高于Ⅴ期幼蟹, 这可能与Ⅴ期断肢组幼蟹在机械性损伤期间恢复能力差, 蜕壳时间长, 抵抗细菌和病毒的能力较弱有关。同时, 每一期幼蟹都有蜕一次壳未再生大螯的情况发生, 已有研究表明, 幼蟹断肢后存在第2次蜕壳后肢体也无法完成再生的情况(Yasuda et al, 2014)。上述现象可能与断肢后机体物质及能量在不同器官的分配以维护动物的生存机制有关(Wrinn et al, 2007), 另一方面还可能与蟹本身所处的蜕壳时期和体内代谢产物有关, 如视磺酸等(岳武成等, 2016)。已有研究的是花背蟾蜍、斑马鱼等通过特殊的遗传机制(肖能文等, 2009; Deimling et al, 2009), 用视黄酸控制胚基形成从而完成鳍的再生, 断肢招潮蟹的肢芽用视黄酸处理后, 蜕壳产出的步足会产生畸形(Hopkins, 1986)。
有研究显示, 甲壳类动物在受到外界伤害后, 与肢体连接处的关节在压力作用下可自动断掉(McVean, 1982), 本研究中当三疣梭子蟹大螯受到外力伤害时绝大部分个体都可自动脱掉, 且在相同养殖条件下的同一生长期的幼蟹, 断肢组存活率均低于正常组(表 1), 主要原因可能是蟹断肢时肌肉等组织受损, 并伴有少量失血, 且断肢处易感染细菌。在断肢后短短的几个小时内生长出的肢芽明显分出三层(图 3-C2切片结果显示):第一层主要中性粒细胞; 第二层是松散组合的细胞, 这层细胞最终充满整个肢芽; 第三为表皮迁移细胞, 这与Hopkins(1986)对招潮蟹断肢再生研究结果相似。断肢后24h, 有一些伸长和运动的表皮细胞进行有丝分裂, 许多迁移表皮细胞在肢芽突出处开始有丝分裂(Emmel, 1910), 这些表皮细胞发育构成了肢芽的新表皮, 并分泌产生角质层(Adiyodi, 1972)。此时, 新产生的芽基是具有表皮壳的空心结构, 内部细胞尚未开始分裂(图 2-A)。通过本研究发现, 三疣梭子蟹断肢后的2—3天内, 断肢处充满了新的细胞:其中有一些新的表皮细胞, 也有新生出有丝分裂细胞。再生的肌肉组织(图 3-D2) 落后表皮1—2天, 这可能和基因的调控顺序有关系(McCroskery et al, 2005; Wagner et al, 2005)。两栖类蝾螈的再生肌纤维来自于机体相应组织的前体细胞, 通过肌纤维相应的前体细胞去分化再生出肌纤维, 而同是两栖类的爪蟾再生尾并没有转分化现象(杨荔等, 2015)。本文虽然通过切片初步研究发现表皮细胞进行迁移形成芽基空心结构, 并且有未分化的结缔组织进而填充肢芽, 但是具体如何形成再生肌纤维的, 还需要进一步的通过遗传学与分子手段进行研究。
本研究中, 不同生长期幼蟹附肢再生肢芽比呈现逐渐下降的趋势, 并且达到一定的数值就会蜕壳伸展出附肢, 可能与能量与物质积累有关。已有研究表明, 甲壳类动物蜕壳前需积累一定的营养物质(Anger et al, 1981), 如幼蟹需积累足够的能量与营养, 才能达到蜕壳周期的某一点(潘鲁青等, 1997), 幼体摄取能量后, 首先满足蜕壳要求, 剩余的食物能量摄取才用于生长(黄国强等, 2004)。Ⅰ、Ⅱ期幼蟹获取较少的能量就可以满足断肢发育的需要, 因此48h内就会促使体内的物质能量转化, 加速肢芽发育; 此外, 耗氧量也随生物个体的增大而增加, 且骨骼和肌肉比脑及各内脏器官的耗氧低(Mio, 1962), 这样也会降低了肢芽的形成速度。除了外部环境因素外, 也可能与某些基因在发育阶段中表达有关, 断肢发育需要启动再生信号通路, 目前在斑马鱼、两栖动物中与再生相关的信号通路中有BMP、Notch、Wnt以及FGF, 这些都对动物器官再生起了重要的调控作用, 其中Wnt及其下游的RA和Fgf信号通路对尾鳍再生发挥着重要作用, 这就使促使基因的表达模式呈现出高度的发育阶段特异性, 而对于三疣梭子蟹再生信号通路的研究目前还没有相关报道, 这需要进一步的研究。
4 结论(1) 本文以第Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ期幼蟹为材料研究幼蟹大螯断肢再生的能力, 幼蟹断肢后均能在1个蜕壳周期内完成大螯再生, 且相关的实验数据显示第Ⅴ期幼蟹的再生率和存活率均最高。
(2) 以Ⅳ期幼蟹为研究对象, 发现断肢再生附肢需经过6个具有标志性事件的发育阶段, 通过外部肢芽形态及其对应组织切片的变化, 可以分为再生芽基、肢芽趾缝期、肢芽分化期、肢芽斑点期、肢芽成熟期、肢体出膜期。
(3) 各期再生肢芽横纵比值具有一定临界值, 越接近临界值离肢体出膜期越近。
| 农业部渔业局, 2016. 中国渔业年鉴2015. 北京: 中国农业出版社, |
| 纪成林, 1980. 虾蟹蜕壳及其在养殖上的意义. 动物学杂志, 15(2): 26–29 |
| 杨荔, 林古法, 2015. 两栖动物器官再生的细胞与分子机制. 中国细胞生物学学报, 37(6): 764–771 |
| 肖能文, 戈峰, 李俊生, 2009. 视黄酸诱导动物再生研究进展. 江西农业学报, 21(11): 127–131 DOI:10.3969/j.issn.1001-8581.2009.11.041 |
| 张卓航, 姜振宇, 杨忠, 2012. 肢体再生——自有尾两栖类的认知. 生命科学, 24(10): 136–140 |
| 张琼宇, 罗琛, 2005. 草鱼不同发育阶段免疫相关基因表达差异分析. 见: 中国细胞生物学学会2005年学术大会、青年学术研讨会论文摘要集. 武夷山: 中国细胞生物学学会 |
| 陈晨, 母昌考, 宋微微, 等, 2015. 三疣梭子蟹"科甬1号"生长速率、形态特征和对溶藻弧菌的耐受性. 水产学报, 39(6): 818–823 |
| 岳武成, 陈娇, 慈元吉, 等, 2016. 断肢再生对中华绒螯蟹蜕壳、生长及相关基因表达的影响. 浙江大学学报(农业与生命科学版), 42(4): 502–508 DOI:10.3785/j.issn.1008-9209.2015.09.102 |
| 黄国强, 董双林, 王芳, 2004. 饵料种类和摄食水平对中国对虾蜕皮的影响. 中国海洋大学学报(自然科学版), 34(6): 942–948 |
| 潘鲁青, 马甡, 王克行, 1997. 温度对中国对虾幼体生长发育与消化酶活力的影响. 中国水产科学, 4(3): 17–22 |
| 薛俊增, 堵南山, 赖伟, 1997. 中国三疣梭子蟹Portunus trituberculatus Miers的研究. 东海海洋, 15(1): 60–65 |
| Adiyodi R G, 1972. Wound healing and regeneration in the crab Paratelphusa hydrodromous. International Review of Cytology, 32: 257–289 DOI:10.1016/S0074-7696(08)60342-3 |
| Anger K, Dawirs R R, 1981. Influence of starvation on the larval development of Hyas araneus (Decapoda, Majidae). Helgoländer Meeresuntersuchungen, 34(3): 287–311 DOI:10.1007/BF02074124 |
| Bhaja K Padhi, Lucille Joly, Patricia Tellis, et al, 2010. Screen for genes differentially expressed during regeneration of the zebrafish caudal fin. Developmental Dynamics, 231(3): 527–541 |
| Deimling S J, Drysdale T A, 2009. Retinoic acid regulates anterior-posterior patterning within the lateral plate mesoderm of Xenopus. Mechanisms of Development, 126(10): 913–923 DOI:10.1016/j.mod.2009.07.001 |
| Emmel V E, 1910. A study of the differentiation of tissues in the regenerating crustacean limb. Developmental Dynamics, 10(1): 109–158 |
| Gong J, Yu K, Shu L, et al, 2015. Evaluating the effects of temperature, salinity, starvation and autotomy on molting success, molting interval and expression of ecdysone receptor in early juvenile mud crabs, Scylla paramamosain. Journal of Experimental Marine Biology and Ecology, 464: 11–17 DOI:10.1016/j.jembe.2014.12.008 |
| Hopkins P M, 1986. Ecdysteroid titers and Y-organ activity during late anecdysis and proecdysis in the fiddler crab, Uca pugilator. General and Comparative Endocrinology, 63(3): 362–373 DOI:10.1016/0016-6480(86)90135-8 |
| Hopkins P M, 1993. Regeneration of walking legs in the fiddler crab Uca pugilator. American Zoologist, 33(3): 348–356 DOI:10.1093/icb/33.3.348 |
| Konstantinides N, Averof M, 2014. A common cellular basis for muscle regeneration in arthropods and vertebrates. Science, 343(6172): 788–791 DOI:10.1126/science.1243529 |
| Mattoni C I, García-Hernández S, Botero-Trujillo R, et al, 2015. Scorpion sheds 'tail' to escape:consequences and implications of autotomy in scorpions (Buthidae:Ananteris). PLoS One, 10(1): 755–757 |
| McCroskery S, Thomas M, Platt L, et al, 2005. Improved muscle healing through enhanced regeneration and reduced fibrosis in myostatin-null mice. Journal of Cell Science, 118(Pt 15): 3531–3541 |
| McVean A. 1982. Autotomy. In:Bliss D E ed. The Biology of Crustacea. New York, Academic Press |
| Mio S I, 1962. Studies on population biology of coastal fishes in Kyushu (Ⅳ):age-determination and growth of Chrysophrys major Temminck et Schlegel. Science Bulletin of the Faculty of Agriculture, Kyushu University, 19(4): 507–520 |
| Mykles D L, 2001. Interactions between limb regeneration and molting in decapod crustaceans. American Zoologist, 41(3): 399–406 |
| Shibata E, Yokota Y, Horita N, et al, 2016. Fgf signalling controls diverse aspects of fin regeneration. Development, 143(16): 2920–2929 DOI:10.1242/dev.140699 |
| Wagner K R, Liu X, Chang X, et al, 2005. Muscle regeneration in the prolonged absence of myostatin. Proceedings of the National Academy of Sciences of the United States of America, 102(7): 2519–2524 DOI:10.1073/pnas.0408729102 |
| Wilkie I C, 2001. Autotomy as a prelude to regeneration in echinoderms. Microscopy Research and Technique, 55(6): 369–396 DOI:10.1002/(ISSN)1097-0029 |
| Wrinn K M, Uetz G W, 2007. Impacts of leg loss and regeneration on body condition, growth, and development time in the wolf spider Schizocosa ocreata. Canadian Journal of Zoology, 85(7): 823–831 DOI:10.1139/Z07-063 |
| Yasuda C I, Matsuo K, Wada S, 2014. Rapid regeneration of the major cheliped in relation to its function in male-male contests in the hermit crab Pagurus middendorffii. Plankton and Benthos Research, 9(2): 122–131 DOI:10.3800/pbr.9.122 |
 2017, Vol. 48
2017, Vol. 48


