中国海洋湖沼学会主办。
文章信息
- 王志铮, 张思铭, 蒋宏雷, 申屠基康, 刘伟健, 任夙艺, 张晓霞, MsumenjiPhiri, DonathaKajuna. 2017.
- WANG Zhi-Zheng, ZHANG Si-Ming, JIANG Hong-Lei, SHENTU Ji-Kang, LIU Wei-Jian, REN Su-Yi, ZHANG Xiao-Xia, Msumenji Phiri, Donatha Kajuna. 2017.
- 日本囊对虾(Marsupenaeus japonicus)秋繁仔虾形态表型对氨氮耐受性能的影响效应
- THE CORRELATION BETWEEN AMMONIA ENDURANCE AND MORPHOLOGICAL TRAITS OF THE MARSUPENAEUS JAPONICUS POST LARVA
- 海洋与湖沼, 48(5): 1092-1099
- Oceanologia et Limnologia Sinica, 48(5): 1092-1099.
- http://dx.doi.org/10.11693/hyhz20170500151
-
文章历史
- 收稿日期:2017-05-31
- 收修改稿日期:2017-06-27
2. 宁波市海洋与渔业研究院 宁波 315000
2. Marine and Fishery Research Institute of Ningbo, Ningbo 315000, China
日本囊对虾(Marsupenaeus japonicus)又名日本对虾, 隶属于甲壳纲、十足目、对虾科, 系广泛分布于我国长江口以南海域的土著种, 是我国传统海水养殖虾类品种和出口创汇的重要水产品。氨氮既是评价养殖水质优劣程度的重要监测指标, 也是影响进而威胁水产养殖动物正常存活、生长和繁衍的重要无机污染物。已有研究表明, 氨氮对日本囊对虾幼体具明显致毒作用(姚庆祯等, 2002), 水环境中过高的氨氮质量浓度常会引发日本囊对虾鳃组织排氨作用的受阻和耗氧量的增加(Chen et al, 1992)、血淋巴蛋白和血蓝蛋白浓度的显著降低(Chen et al, 1994)、免疫活性以及对WSSV抗病力的显著下降(Jiang et al, 2004)等一系列氨毒生理反应, 且其血氨含量随氨氮攻毒时间的延长而上升(Chen et al, 1991)并造成暴发性死亡。因此, 开展该虾仔虾耐氨氮性能的等级筛选与定向选择研究也就显得十分必要。
形态表型受遗传因子和环境因子的共同影响(Mayr et al, 1953)。据报道, 分布于西太平洋海域的日本囊对虾具很高的遗传多样性, 可根据其头胸甲侧面斜纹的延伸特征将其分型为形态变异Ⅰ型和Ⅱ型(Tsio et al, 2005, 2007); 微卫星标记法研究发现, 取自浙江、福建、广东和海南等四个省份的6个地理居群野生日本囊对虾均具丰富的遗传多样性, 且遗传变异贡献率的93.06%源自群体内(何永琴等, 2012); 主布于东海和南海北部的形态变异Ⅰ型, 其稚虾的耐高温性能弱于主布于南海水域的形态变异Ⅱ型(宋晓红等, 2014), 且在室内同池饲养条件下, 形态变异Ⅰ型的群体生长性能优于Ⅱ型, 但性成熟时间却晚于Ⅱ型(董宏标等, 2014); 对取自福建厦门的野生群体和养成于海南而种苗源自福建厦门的人工养成群体间形态差异进行比较研究, 发现两者在形态比例特征上已出现了较大程度的偏离(李义军等, 2010)。无疑, 日本囊对虾群体内丰富的遗传多样性可为其表型的强环境可塑性提供证据支持, 而其表型的强环境可塑性则可为具不同抗逆性能的群体分型研究提供线索和标记。另, 日本囊对虾秋繁同生群仔虾在不同抗流性能群体间和不同耐干露性能群体间均表露出较为显著的表型差异特征(王志铮等, 2016a, b)的结果, 则进一步印证了对不同抗逆等级仔虾群体开展表型分型的可行性。鉴于此, 本文作者于2014年10月开展了日本囊对虾秋繁同生群仔虾形态比例性状对耐氨氮性能的影响研究, 旨为不同耐氨氮性能等级仔虾的形态筛分提供基础资料。
1 材料与方法 1.1 实验用仔虾仔虾来源、总长规格以及暂养处理方法完全同王志铮等(2016a, b)。
1.2 理化条件实验用水的来源及其理化条件完全同王志铮等(2016a, b)。实验用NH4Cl(AR)购自无锡市晶科化工有限公司, 用双蒸水将其配成1.667g/L的母液, 现配现用。
1.3 实验方法以96h为实验周期。采取静水停食法, 将经预实验确认的实验用仔虾最终存活率略低于5%的氨氮攻毒质量浓度52.37mg/L, 设为本研究氨氮急性攻毒实验质量浓度。于暂养水槽中随机选取3000ind实验用仔虾, 以150ind/L为实验密度, 以圆底塑料盆(实验实际容积1L)为实验容器单元, 开展氨氮对仔虾的急性攻毒实验。实验期间及时取出死亡个体, 并将氨氮急性攻毒0—24h、24—48h、48—72h、72—96h等4个实验时段内的死亡个体和96h时的残存个体分别定义为A、B、C、D、E实验类群(图 1)。于各实验类群中分别随机选取100ind个体作为其测定样本, 并完全按王志铮等(2016a, b)所述方法逐尾进行形态学指标测定。
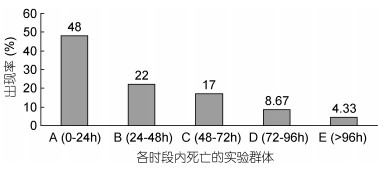 |
| 图 1 不同耐氨氮仔虾实验群体的出现率 Fig. 1 The occurrence rate of different ammonia-nitrogen resistance of post larval experiment populations |
借助SPSS 17.0软件, 按王志铮等(2016a, b)所述方法, 对所得测量结果依次进行组间形态表型差异显著性检验(P<0.05视为显著水平)、基于标准化欧式距离(全距为1.00) 的组间体型相似性程度分析、基于形态比例指标的主成分分析, 以及针对氨氮急性攻毒处理淘汰群(A、B、C、D实验群体)和选留群(E实验群体)的体型判别分析。
2 结果 2.1 形态表型差异由表 1可见, 在所测15项形态学指标中, 仅X1和X10无组间差异(P>0.05), X2呈D>C>A≈B且E与D、C均无差异, X3呈A≈B≈C≈E (P>0.05) 且D仅与E无差异, X4、X6、X11、X14均呈E>D>C>B>A (P<0.05), X5仅B、D间具差异, X7、X9、X12、X13、X15等5项指标均呈仅D与A、B间具差异, X8呈D>E≈C≈A≈B; 由表 2可见, 在所涉17项形态比例指标中, 仅C9、C13和C17无组间差异(P>0.05), C1仅D与A间具差异, C2、C4、C5、C6、C7、C8、C10、C11等8项指标均呈B>C>D>E>A (P<0.05), C3仅C与E间具差异, C12仅D与E间具差异, C14、C15、C16等3项指标均呈A>E>D>C>B (P<0.05)。由此可见, 各实验群体间形态表型特征的差异会导致它们在氨氮耐受性能上的分化, 且形态性状比例性状在甄别不同耐氨氮性能实验群体间的差异上较形态性状本身更具有序性。
| 代码/测量指标 | A实验群体 | B实验群体 | C实验群体 | D实验群体 | E实验群体 | |||||||||
| 均值 | 标准差 | 均值 | 标准差 | 均值 | 标准差 | 均值 | 标准差 | 均值 | 标准差 | |||||
| X1/总长 | 7.053a | 0.223 | 7.211a | 0.198 | 7.378a | 0.196 | 7.566a | 0.215 | 7.669a | 0.216 | ||||
| X2/第一触角柄长 | 0.982a | 0.116 | 1.006a | 0.122 | 1.045b | 0.110 | 1.083c | 0.119 | 1.074bc | 0.126 | ||||
| X3/额剑长 | 1.382a | 0.040 | 1.382a | 0.039 | 1.384a | 0.038 | 1.398b | 0.040 | 1.390ab | 0.038 | ||||
| X4/眼径 | 0.297a | 0.009 | 0.304b | 0.009 | 0.310c | 0.009 | 0.319d | 0.009 | 0.324e | 0.009 | ||||
| 头胸甲长/X5 | 2.678ab | 0.116 | 2.666a | 0.132 | 2.687ab | 0.126 | 2.704b | 0.121 | 2.693ab | 0.130 | ||||
| 头胸甲高/X6 | 0.911a | 0.026 | 0.932b | 0.028 | 0.952c | 0.029 | 0.978d | 0.029 | 0.996e | 0.029 | ||||
| 第一腹节长/X7 | 0.429a | 0.020 | 0.430a | 0.020 | 0.433ab | 0.019 | 0.436b | 0.020 | 0.432ab | 0.020 | ||||
| 第二腹节长/X8 | 0.384a | 0.017 | 0.384a | 0.018 | 0.385a | 0.018 | 0.390b | 0.016 | 0.384a | 0.018 | ||||
| 第三腹节长/X9 | 0.438a | 0.013 | 0.437a | 0.013 | 0.439ab | 0.013 | 0.442b | 0.013 | 0.441ab | 0.012 | ||||
| 第四腹节长/X10 | 0.364a | 0.010 | 0.364a | 0.011 | 0.364a | 0.011 | 0.367a | 0.010 | 0.366a | 0.011 | ||||
| 第五腹节长/X11 | 1.586a | 0.046 | 1.615b | 0.048 | 1.659c | 0.051 | 1.697d | 0.047 | 1.720e | 0.049 | ||||
| 尾节长/X12 | 0.833a | 0.023 | 0.834a | 0.025 | 0.836ab | 0.025 | 0.841b | 0.021 | 0.838ab | 0.024 | ||||
| 尾扇长/ X13 | 1.175a | 0.032 | 1.175a | 0.035 | 1.177ab | 0.032 | 1.184b | 0.032 | 1.179b | 0.037a | ||||
| 腹节高/ X14 | 0.712a | 0.019 | 0.726b | 0.022 | 0.744c | 0.022 | 0.762d | 0.020 | 0.774e | 0.022 | ||||
| X15/尾节高 | 0.214a | ±0.006 | 0.214a | 0.007 | 0.215ab | 0.006 | 0.216b | 0.006 | 0.215ab | 0.006 | ||||
| 注: ① A实验群体:氨氮攻毒0—24h时段内的死亡群体; B实验群体:氨氮攻毒24—48h时段内的死亡群体; C实验群体:氨氮攻毒48—72h时段内的死亡群体; D实验群体:氨氮攻毒72—96h时段内的死亡群体; E实验群体:氨氮攻毒96h时的残存群体; ② 同一行均值上标不同字母示组间显著差异(P<0.05)。下同 | ||||||||||||||
| 代码/形态比例指标 | A实验群体 | B实验群体 | C实验群体 | D实验群体 | E实验群体 | |||||||||
| 均值 | 标准差 | 均值 | 标准差 | 均值 | 标准差 | 均值 | 标准差 | 均值 | 标准差 | |||||
| C1/(第一触角柄长/总长) | 0.140a | 0.014 | 0.139ab | 0.014 | 0.139ab | 0.014 | 0.141b | 0.013 | 0.143ab | 0.013 | ||||
| C2/(额剑长/总长) | 0.181a | 0.004 | 0.196b | 0.004 | 0.192c | 0.004 | 0.188d | 0.004 | 0.185e | 0.004 | ||||
| C3/(眼径/总长) | 0.042ab | 0.001 | 0.042ab | 0.001 | 0.042a | 0.001 | 0.042ab | 0.001 | 0.042b | 0.001 | ||||
| C4/(头胸甲长/总长) | 0.351a | 0.011 | 0.380b | 0.011 | 0.370c | 0.012 | 0.364d | 0.012 | 0.357e | 0.011 | ||||
| C5/(第一腹节长/总长) | 0.056a | 0.002 | 0.061b | 0.002 | 0.060c | 0.002 | 0.059d | 0.002 | 0.058e | 0.002 | ||||
| C6/(第二腹节长/总长) | 0.050a | 0.002 | 0.054b | 0.002 | 0.053c | 0.002 | 0.052d | 0.002 | 0.052e | 0.002 | ||||
| C7/(第三腹节长/总长) | 0.057a | 0.001 | 0.062b | 0.001 | 0.061c | 0.001 | 0.060d | 0.001 | 0.058e | 0.001 | ||||
| C8/(第四腹节长/总长) | 0.048a | 0.001 | 0.052b | 0.001 | 0.051c | 0.001 | 0.049d | 0.001 | 0.048e | 0.001 | ||||
| C9/(第五腹节长/总长) | 0.224a | 0.005 | 0.225a | 0.004 | 0.224a | 0.005 | 0.225a | 0.005 | 0.224a | 0.005 | ||||
| C10/(尾节长/总长) | 0.109a | 0.002 | 0.118b | 0.002 | 0.116c | 0.002 | 0.113d | 0.002 | 0.111e | 0.002 | ||||
| C11/(尾扇长/总长) | 0.154a | 0.003 | 0.167b | 0.004 | 0.163c | 0.003 | 0.159d | 0.003 | 0.157e | 0.003 | ||||
| C12/(第一触角柄长/头胸甲长) | 0.398ab | 0.035 | 0.366ab | 0.033 | 0.377ab | 0.034 | 0.388a | 0.029 | 0.400b | 0.032 | ||||
| C13/(额剑长/头胸甲长) | 0.517a | 0.017 | 0.517a | 0.015 | 0.519a | 0.018 | 0.516a | 0.017 | 0.518a | 0.016 | ||||
| C14/(眼径/头胸甲长) | 0.121a | 0.004 | 0.111b | 0.003 | 0.114c | 0.004 | 0.115d | 0.004 | 0.118e | 0.003 | ||||
| C15/(头胸甲高/头胸甲长) | 0.370a | 0.012 | 0.341b | 0.010 | 0.350c | 0.012 | 0.355d | 0.012 | 0.362e | 0.010 | ||||
| C16/(腹节高/第一腹节长) | 1.794a | 0.057 | 1.661b | 0.054 | 1.690c | 0.051 | 1.719d | 0.049 | 1.749e | 0.057 | ||||
| C17/(尾节高/尾节长) | 0.257a | 0.006 | 0.257a | 0.005 | 0.257a | 0.006 | 0.257a | 0.006 | 0.257a | 0.005 | ||||
据表 2所列各项形态比例指标的均值, 依次计算本研究所涉5个不同耐氨氮性能实验群体间的欧氏距离。由表 3可见, 各实验群体间的欧氏距离均达到极显著水平(P<0.01), 且均有随耐氨氮性能差异的增大而呈显著增大的趋势, 进一步表明可借助形态比例性状来甄别各实验群体间的耐氨氮性能差异。
| 群体类别 | A实验群体 | B实验群体 | C实验群体 | D实验群体 |
| B实验群体 | 1.524 | 0 | ||
| C实验群体 | 1.942 | 1.776 | 0 | |
| D实验群体 | 3.029 | 2.045 | 1.566 | 0 |
| E实验群体 | 3.598 | 2.631 | 2.001 | 1.274 |
经Bartlett球形检验(P<0.05) 和KMO适合度检验(KMO=0.816>0.700, 尚可), 对表 2所列形态比例指标进行主成分分析, 得表 4。由表 4可见, 表中所列5个主成分的方差累计贡献率为85.940%, 表明这些主成分可概括不同耐氨氮性能群体间的表型差异。其中, PC1的方差贡献率(46.12%)及其所含载荷绝对值p>0.5的主要影响变量的个数(11个)均远高于其它主成分之和, 无疑其在甄别不同耐氨氮性能群体间的表型差异上具关键性作用。但由PC1与其它4个主成分间的得分散布图(图 2)可见, 沿FAC1轴自左向右, 氨氮急性攻毒下相邻及相间死亡时段的实测样本间却均存在一定程度的重叠, 表明PC1在归纳本研究实测样本的类群归属上明显受到了某些关键影响变量的干扰。
| 代码/形态比例指标 | 载荷 | ||||
| PC1 | PC2 | PC3 | PC4 | PC5 | |
| C1/(第一触角柄长/总长) | 0.235 | -0.763* | 0.543* | 0.122 | -0.112 |
| C2/(额剑长/总长) | 0.852* | 0.362 | 0.095 | 0.116 | 0.007 |
| C3/(眼径/总长) | 0.242 | 0.220 | 0.673* | -0.389 | 0.144 |
| C4/(头胸甲长/总长) | 0.891* | -0.298 | -0.102 | -0.243 | 0.141 |
| C5/(第一腹节长/总长) | 0.842* | -0.088 | 0.123 | 0.290 | -0.109 |
| C6/(第二腹节长/总长) | 0.820* | -0.033 | 0.169 | 0.091 | -0.009 |
| C7/(第三腹节长/总长) | 0.861* | 0.255 | 0.018 | 0.007 | 0.008 |
| C8/(第四腹节长/总长) | 0.856* | 0.282 | 0.031 | 0.043 | 0.037 |
| C9/(第五腹节长/总长) | 0.354 | 0.145 | 0.601* | -0.316 | 0.246 |
| C10/(尾节长/总长) | 0.871* | 0.283 | 0.035 | -0.124 | -0.244 |
| C11/(尾扇长/总长) | 0.870* | 0.270 | 0.036 | 0.035 | 0.007 |
| C12/(第一触角柄长/头胸甲长) | -0.153 | -0.675* | 0.622* | 0.240 | -0.186 |
| C13/(额剑长/头胸甲长) | -0.233 | 0.777* | 0.234 | 0.437 | -0.172 |
| C14/(眼径/头胸甲长) | -0.761* | 0.412 | 0.427 | 0.049 | -0.070 |
| C15/(头胸甲高/头胸甲长) | -0.757* | 0.373 | 0.366 | 0.177 | -0.079 |
| C16/(腹节高/第一腹节长) | -0.694* | 0.195 | 0.127 | -0.457 | 0.216 |
| C17/(尾节高/尾节长) | 0.009 | -0.050 | 0.044 | 0.482 | 0.866* |
| 特征值 | 7.841 | 2.586 | 1.952 | 1.173 | 1.058 |
| 贡献率(%) | 46.121 | 15.211 | 11.482 | 6.902 | 6.223 |
| 累计贡献率(%) | 46.121 | 61.333 | 72.815 | 79.717 | 85.940 |
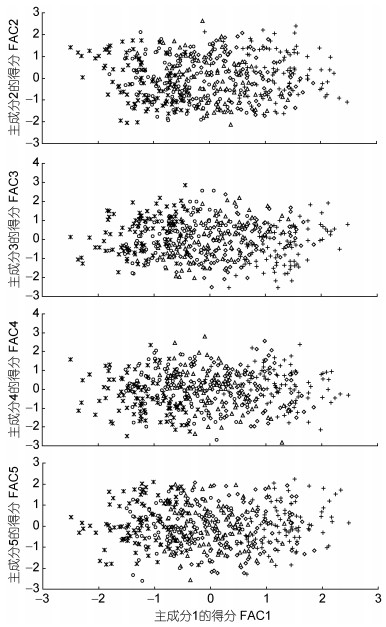 |
| 图 2 主成分散布图 Fig. 2 The scatter diagram of principal component of morphological proportion traits for all tested groups 注: +、◇、△、○、*依次示A、B、C、D、E实验群体个体 |
基于主成分分析, 采用逐步导入剔除法, 对C2、C4、C6、C10、C13、C14、C15、C16、C17等9个对淘汰群和选留群判别贡献率较大的表型变量进行判别分析。经检验, 上述变量的F值均达到极显著水平(P<0.01)。据此, 建立基于实测样本的Fisher分类函数方程组(表 5), 绘制“选留群典型函数判别方程得分/淘汰群典型函数判别方程得分”散布图(图 3)并计算判别准确率(表 6)。由图 3和表 6可见, 选留群和淘汰群实测样本的判别准确率P1分别为99%和86.75%, P2分别为88.20%和98.86%, 两者综合判别准确率为92.88%, 具较强的判别可靠性。
| 类群 | 自变量系数 | 常数项 | ||||||||
| C2 | C4 | C6 | C10 | C13 | C14 | C15 | C16 | C17 | ||
| 淘汰群 | -373239.473 | 59971.405 | -204.015 | -5345.370 | 2773.543 | 160584.988 | 6394.044 | 566.017 | 7468.213 | -15349.352 |
| 选留群 | -374237.401 | 60262.529 | -482.009 | -5837.357 | 2728.598 | 161295.154 | 6521.543 | 575.301 | 7363.539 | -15438.198 |
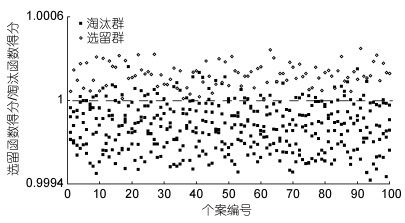 |
| 图 3 淘汰群与选留群实验样本的典型判别函数判别得分散布图 Fig. 3 The scatter diagram of the typical discriminant function for all the tested groups |
| 类群 | 样本数 (ind) |
预测分类(ind) | 判别准确率(%) | 综合判别率 (%) |
|||
| 淘汰群 | 选留群 | P1 | P2 | ||||
| 淘汰群 | 400 | 347 | 53 | 86.75 | 98.86 | 92.88 | |
| 选留群 | 100 | 1 | 99 | 99.00 | 88.20 | ||
公式SC=0.1×96hLC50 (Sprague, 1971)常用于估算目标水产养殖动物的安全质量浓度, 故毒物对目标水产养殖动物的急性攻毒实验周期常设为96h。鉴于此, 本研究亦将氨氮对日本囊对虾秋繁仔虾的急性攻毒处理周限设定为96h。根据小概率事件实际不可能性原理, 农业试验研究中常将大样本水平下P值等于0.05设为表露组间差异的临界(盖钧镒, 2000)。因此, 为获得具统计学意义的耐氨氮性能优质仔虾群体, 本研究以随机选取的3000ind实验用仔虾作为实验样本, 将经氨氮急性攻毒处理后最终存活率略低于5%水平的残存群体定义为氨氮急性攻毒处理选留群, 而将急性攻毒处理期间的所有死亡个体统归为氨氮急性攻毒处理淘汰群, 以确保所得实验结果的可靠性。为进一步阐释形态表型组合与耐氨氮性能梯次变化间的相关性, 本研究按死亡先后时序将淘汰群中的实验样本依次分为A、B、C、D实验测定群体。
3.2 耐氨氮性能与形态比例表型间的相关性由表 4可见, 尽管PC1的方差贡献率及所含主要影响变量的个数均远大于其它主成分, 但就图 2中各相邻及相间不同类群实测样本间所表露的较大重叠现象, 以及图 3和表 6所示选留群和淘汰群中分别有1%和13.25%的个体被误判的结果, 既反映了本研究所涉不同耐氨氮性能仔虾群体间在形态表型适应上所具的梯级连续变化特征, 也揭示了仔虾在耐氨氮性能上的间断性与相邻及相间实验群体间在形态表型变化上的连续性的辩证统一。
一般而言, 虾类性成熟之前均处于以体型增长为主和体型增粗为辅的异速生长阶段。王吉桥等(1999)也指出, 虾体各部位的异速生长特征取决于其体内新陈代谢中起主导地位的方面的时序性和阶段性变化, 并与其器官结构和功能的完善与强化秩序密切相关。故所测部位在横轴维度(体长轴)上的占比越大, 或横向与纵向测量值间的比值越大, 则表明该部位的增长速度越快, 所涉生理机能也就愈加获得强化, 反之亦然。由此, 本研究所涉日本囊对虾仔虾同生群在总长相近(P>0.05) 的条件下, 其C2、C4、C6、C10均呈B>C>D>E>A(P<0.05) 和C14、C15、C16均呈A>E>D>C>B(P<0.05) 的结果(表 2), 既揭示了形态比例特征与氨氮耐受性能间具强相关性的原因, 系具不同耐氨氮性能的仔虾在额剑、眼径、头胸部、腹节和尾节上具不同增长速度所致, 也反映了这些测量部位所涉生理机能与氨氮耐受性能间有着较为密切的关系。姚庆祯等(2002)发现, 日本囊对虾仔虾受氨氮高质量浓度急性攻毒后, 活动即显异常, 大部分狂游, 有的头翘尾打旋, 随攻毒时间推移, 沉入底部经微弱挣扎后死亡, 死前体色由透明渐变为乳白, 死后虾体僵直或呈弓形。这一中毒致死过程与本研究的观察结果一致, 即仔虾受氨氮胁迫后, 首先表露为极为强烈的应激避趋运动, 待逃逸无望, 体能极度衰竭并伴随鳃、肝胰腺及腹部肌肉的坏死而亡。据报道, 虾蟹类体内能量流动和转换的基本模型为:摄食能=生长能+呼吸能+排泄能+排粪能+蜕壳能(Breteler, 1975), 多数虾蟹类的呼吸能占其摄入能量的50%以上(王兴强等, 2005); 高质量浓度的氨氮不仅会妨碍日本囊对虾鳃组织的排氨作用, 而且还会通过显著降低血淋巴蛋白和血蓝蛋白的浓度以迫使其增大耗氧量(Chen et al, 1992, 1994), 进而导致其血氨含量快速上升和机体免疫力的显著下降(Chen et al, 1991; Jiang et al, 2004)。综上可知, 本研究所涉5个实验类群间耐氨氮性能差异的实质, 缘于它们表型特征所映射的各不相同的体质状况及与之相匹配的机体能量获取和分配策略。
本研究所涉诸实验类群中, A实验群体的耐氨氮性能与E实验群体差异最大, 与B实验群体差异最小(图 1、图 2)的情形, 与表 5所涉判别自变量除C13、C17均呈A≈B≈C≈D≈E (P>0.05) 外, 其余均呈B>C>D>E>A (P<0.05) 均或A>E>D>C>B (P<0.05) 的实测结果(表 2)完全相悖, 表明日本囊对虾仔虾具两种截然不同的机体能量获取和分配策略。据报道, 对虾脏器主要集中于其头胸甲内(王吉桥等, 1999), 额剑系表征对虾体质和生长代谢旺盛程度的重要形态体征(王志铮等, 2012), 在御敌攻击和维系运动平衡中具重要作用(王安利等, 1993; 沈辉等, 2010), 张开尾扇, 腹部迅速向前弯曲, 使虾体向后上方突然跃起是对虾类御敌避害的主要运动方式(堵南山, 1993)。故上述判别表型差异既反映了A实验群体通过显著增大眼径、头胸甲高与头胸甲长间的比值(依次为C14、C15)并增粗腹节(C16), 发展了以增强眼部寻食定位能力, 提高头胸部呼吸与血循效率以及腹部弹跃强度为特征的表型生长方式, 揭示了其通过提高捕食成功率以减少捕食频次和降低运动能耗为主旨的机体能量获取和分配策略, 也反映了B实验群体通过显著增大额剑长、头胸甲长、第二腹节长以及尾节长与总长间的的比值(依次为C2、C4、C6、C10), 发展了以增强额剑御敌攻击强度、扩大胸腔血容量、提高腹部肌肉弯曲幅度和尾部后跃强度为特征的表型生长方式, 揭示了其通过增强捕食攻击强度和提高运动能力以扩大寻食空间和增加捕食频次为主旨的机体能量获取和分配策略。无疑, 这也与日本囊对虾仔虾在抗流性能上存在“低能耗慢长型”和“高能耗速生型”两种不同的运动能量代谢机制及相应的形态分型特征(王志铮等, 2016a)的判断相吻。显然, 前者表型生长方式所映射的“节能型”捕食对策更有利于游泳能力和体质均较弱个体的生存和发展, 而后者所映射的“耗能型”捕食对策则更有利于游泳能力和体质个体均较强个体的生存和发展。故, A实验群体首先被淘汰的原因无疑与其游泳能力和体质过弱有关, 而B实验群体随后被淘汰的原因则应与其具过强的游泳能力, 致使其鳃组织、肝胰腺和肌肉生理功能在强烈的应激避趋运动中更易受损进而坏死有关。综上可知, E实验群体因其机体能量获取和分配策略最倾向于A, 致使其与A实验群体的体质差异随两者间各判别表型数值差异的增大被进一步放大, 并最终被选留, 而C、D实验群体因其机体能量获取和分配策略更倾向于B, 致使两者在氨氮高质量浓度急性攻毒下其鳃组织、肝胰腺和肌肉生理功能受损程度明显高于E而先后被淘汰。
鉴于表 6和图 3所得判别结果的准确性。实践应用时, 应于选定的仔虾培养池中随机抽取足够数量的测定样本(n≥60ind), 并经统计获得表 5中所列各自变量均值后, 将这些自变量均值分别代入表 5所列方程组中, 若其在淘汰群与选留群形态比例特征Fisher分类函数方程中的判别得分之比小于或等于1, 则可判定该池仔虾具较强的耐氨氮性能, 反之亦然。
4 结论日本囊对虾秋繁同生群仔虾的耐氨氮性能与其形态表型具强相关性, 仔虾群体间耐氨氮性能等级的差异, 有随其体型相似性程度降低而增大, 和形态比例表型主成分散布图中重合度减少而增大的趋势, 可依据形态比例表型C2、C4、C6、C10、C13、C14、C15、C16和C17来判别仔虾群体的耐氨氮性能等级。日本囊对虾秋繁同生群仔虾间耐氨氮性能差异的实质, 缘于C2、C4、C6、C10、C13、C14、C15、C16和C17这些形态比例特征所映射的体质状况及与之相匹配的机体能量获取和分配策略。无疑, 对通过提高捕食成功率以减少捕食频次和降低运动能耗, 与通过增强捕食攻击强度和提高运动能力以扩大寻食空间和增加捕食频次这两种机体能量获取和分配策略的权衡与选择是引起仔虾群体间表露体质状况和耐氨氮性能差异的主要原因。
| 王吉桥, 靳翠丽, 姜静颖等, 1999. 中国对虾和日本对虾身体不同部位生长的研究. 见: 中国动物科学研究——中国动物学会第十四届会员代表大会及中国动物学会65周年年会论文集. 郑州: 中国动物学会, 92-98 http://cpfd.cnki.com.cn/Article/CPFDTOTAL-ZGDX199900001017.htm |
| 王兴强, 马甡, 董双林, 2005. 虾蟹类生物能量学研究进展. 海洋科学, 29(10): 65–69 DOI:10.3969/j.issn.1000-3096.2005.10.015 |
| 王安利, 母学全, 周世梅, 等, 1993. 中国对虾行为的观察. 海洋科学, 17(4): 16–18 |
| 王志铮, 朱海军, 任夙艺, 等, 2016a. 日本囊对虾(Marsupenaeus japonicus)秋繁仔虾形态表型与抗流性能间的相关性. 海洋与湖沼, 47(2): 360–368 |
| 王志铮, 杨磊, 施建军, 等, 2012. 日本沼虾(Macrobrachium nipponensis)池养越冬抱卵亲虾表型性状对个体繁殖力的影响效应. 海洋与湖沼, 43(1): 166–173 DOI:10.11693/hyhz201201027027 |
| 王志铮, 祝本强, 任夙艺, 等, 2016b. 日本囊对虾(Marsupenaeus japonicus)秋繁同生群仔虾不同耐干露性能群体间的形态表型差异. 海洋与湖沼, 47(3): 673–680 |
| 李义军, 李婷, 王平, 等, 2010. 日本囊对虾(Marsupenaeus japonicus)3个野生种群和1个养殖种群的形态差异与判别分析. 海洋与湖沼, 41(4): 500–504 DOI:10.11693/hyhz201004005005 |
| 何永琴, 苏永全, 毛勇, 等, 2012. 用微卫星标记分析不同形态变异类型日本囊对虾的遗传多样性. 水产学报, 36(10): 1520–1528 |
| 沈辉, 万夕和, 许璞, 等, 2010. 脊尾白虾的行为学观察研究. 海洋科学, 34(10): 53–56, 61 |
| 宋晓红, 毛勇, 董宏标, 等, 2014. 两种形态变异类型日本囊对虾稚虾高温耐受性的比较. 水产学报, 38(1): 84–90 |
| 姚庆祯, 臧维玲, 戴习林, 等, 2002. 亚硝酸盐和氨对凡纳对虾和日本对虾幼体的毒性作用. 上海水产大学学报, 11(1): 21–26 |
| 堵南山, 1993. 甲壳动物学. 北京: 科学出版社, 743 |
| 盖钧镒, 2000. 试验统计方法. 北京: 中国农业出版社, 49 |
| 董宏标, 苏永全, 毛勇, 等, 2014. 室内环境下日本囊对虾2种形态变异类型群体生长特性比较研究. 热带海洋学报, 33(4): 51–60 DOI:10.11978/j.issn.1009-5470.2014.04.007 |
| Breteler W C M K, 1975. Food consumption, growth and energy metabolism of juvenile shore crabs, Carcinus maenas. Netherlands Journal of Sea Research, 9(3-4): 255–272 DOI:10.1016/0077-7579(75)90002-2 |
| Chen J C, Cheng S Y, Chen C T, 1994. Changes of haemocyanin, protein and free amino acid levels in the haemolymph of Penaeus japonicus exposed to ambient ammonia. Comparative Biochemistry and Physiology, 109A(2): 339–347 |
| Chen J C, Kou Y Z, 1991. Accumulation of ammonia in the hemolymph of Penaeus japonicus exposed to ambient ammonia. Diseases of Aquatic Organisms, 11: 187–191 DOI:10.3354/dao011187 |
| Chen J C, Lai S H, 1992. Oxygen consumption and ammonia-N excretion of Penaeus japonicus adolescents exposed to ambient ammonia. Comparative Biochemistry and Physiology Part C:Comparative Pharmacology, 102(1): 129–133 |
| Jiang G J, Yu R C, Zhou M J, 2004. Modulatory effects of ammonia-N on the immune system of Penaeus japonicus to virulence of white spot syndrome virus. Aquaculture, 241(1-4): 61–75 DOI:10.1016/j.aquaculture.2004.08.020 |
| Mayr E, Linsley E G, Usinger R L, 1953. Methods and Principles of Systematic Zoology. New York and London:McGraw Hill, 23-39, 125-154 |
| Sprague J B, 1971. Measurement of pollutant toxicity to fish-Ⅲ:sublethal effects and "safe" concentrations. Water Research, 5(6): 245–266 DOI:10.1016/0043-1354(71)90171-0 |
| Tsio K H, Wang Z Y, Chu K H, 2005. Genetic divergence between two morphologically similar varieties of the kuruma shrimp Penaeus japonicus. Marine Biology, 147(2): 367–379 DOI:10.1007/s00227-005-1585-x |
| Tsio K H, Wang Z Y, Chu K H, 2007. Molecular population structure of the kuruma shrimp Penaeus japonicus species complex in western Pacific. Marine Biology, 150(6): 1345–1364 DOI:10.1007/s00227-006-0426-x |
 2017, Vol. 48
2017, Vol. 48

