
中国海洋湖沼学会主办。
文章信息
- 吴宗泽, 丁国芳, 杨最素, 余方苗, 唐云平, 贾盈露, 郑媛媛, 陈锐. 2017.
- WU Zong-Ze, DING Guo-Fang, YANG Zui-Su, YU Fang-Miao, TANG Yun-Ping, JIA Ying-Lu, ZHENG Yuan-Yuan, CHEN Rui. 2017.
- 绿侧花海葵(Anthopleura anjunae)寡肽制备的关键技术与抗前列腺癌作用研究
- ENZYMATIC PREPARATION OF OLIGOPEPTIDE FROM ANTHOPLEURA ANJUNAE AND ITS ANTI-CANCER ACTIVITY OF PROSTATE CANCER CELLS
- 海洋与湖沼, 48(5): 1114-1123
- Oceanologia et Limnologia Sinica, 48(5): 1114-1123.
- http://dx.doi.org/10.11693/hyhz20161200268
-
文章历史
- 收稿日期:2016-12-02
- 收修改稿日期:2017-02-16
2. 浙江省海洋水产研究所 舟山 316021
2. Marine Fisheries Research Institute of Zhejiang, Zhoushan 316021, China
前列腺癌(Prostate, PCa)一种早期难被发现、却高危性的疾病, 相比欧美国家, 我国前列腺癌发病率要低得多, 但是近年来由于人们饮食不均衡和环境污染, 发病率也呈现明显的上升趋势(景奕文等, 2014), 并成为威胁我国男性健康的重要因素。前列腺癌的发生发展与宿主免疫系统对肿瘤失去调控有关, 如果得不到及时有效的治疗将发展为雄性激素非依赖性前列腺癌, 加上晚期骨转移, 给治疗带来极大的难度(Michalaki et al, 2004)。因此, 寻找既能提高人体免疫能力又能有效诱导癌细胞凋亡的活性物就显得尤其重要。
海葵(sea anemone)属于原始海洋生物, 六放珊瑚亚纲的一目, 有6科、37种, 分布广泛, 常见于热带和温带海底岩石和泥沙中(胡波, 2011)。目前, 各国科学家对海葵毒素(张均顺等, 1998)钾离子通道和钠离子通道活性进行了大量的研究(Rodríguez et al, 2014); 另外, 其降血压(Shkrob et al, 2005)、抗真菌、免疫调节(Chi et al, 2011)和抗肿瘤(Soletti et al, 2008)的研究也有大量报道。但是由于海葵毒素含量极少、提取困难, 严重制约生理学和病理学方面的研究(Monroy-Estrada et al, 2007)。参考海洋生物活性肽的研究进展发现用酶解法制备生物活性肽已经成为新的研究热点, 提取得到的活性肽既能补充机体营养成分, 又具有抗氧化、抗凝血、降血压、抗肿瘤等活性(张岩等, 2012)。
据窦光宇(2003)报道, 在众多海葵中, 数量最多的为绿侧花海葵(Anthopleura anjunae)。在我国东海部分海域, 每平方米绿侧花海葵的数量可达数百个。实验前期调查发现在舟山海域, 绿侧花海葵数量庞大, 在部分海水养殖区, 绿侧花海葵与其它水产品(如贻贝等)形成竞争共生, 对水产养殖造成一定的危害。虽然绿侧花海葵资源丰富, 但到目前为止, 对绿侧花海葵的研究却鲜有报道, 而利用酶法开发海葵活性肽尚未见有报道。本实验以绿侧花海葵肉为原料, 采用酶解法制备具有抗前列腺癌的活性肽, 通过正交实验优化酶解条件, 并通过超滤、阴离子交换层析、G-25凝胶过滤层析和高效液相分离纯化, 以MTT法检测产物对前列腺癌细胞系DU-145增殖抑制率为指标筛选活性肽; 最后通过倒置显微镜观察细胞形态, 检验纯化肽的抗前列腺癌活性, 旨在为绿侧花海葵抗肿瘤药物和保健品的开发提供参考依据。
1 材料与方法 1.1 材料绿侧花海葵:采集舟山海域野生海葵, 经浙江海洋大学赵盛龙教授鉴定为绿侧花海葵(Anthopleura anjunae)。碱性蛋白酶、胰蛋白酶、中性蛋白酶和胃蛋白酶:亚太恒信生物科技有限公司; 甲醇、乙腈:色谱纯, 德国默克公司; 聚凝胺:上海博普生物技术有限公司; F12培养基:美国Gibco公司; 无支原体胎牛血清(FBS):杭州四季青生物制品有限公司。
CF16RN型高速冷冻离心机、L8900氨基酸自动分析仪:日立仪器有限公司; Agilent-1260型高效液相色谱仪:美国安捷伦公司; ALPHA1-4/LDplus超滤系统:德国默克密理博公司; Forma 3111型CO2培养箱:美国Thermo公司; 倒置显微镜:日本OLYMPUS公司; 酶标仪:美国BioRad科技公司。
1.2 材料预处理实验参考海葵解剖(李霞等, 2004)及营养成分分析(朱春晓等, 2011)并稍作修改, 取新鲜野生绿侧花海葵置于室温干净海水中养一天, 清洗除去杂质。用剪刀从中间剖开后, 在大烧杯中加水覆盖, 置于-20℃下冷冻12h, 室温自然解冻后, 反复操作三次。挤出触手毒液, 冲洗至得到白色海葵肉。然后高速匀浆(10000r/min, 5min), 将匀浆液浸泡于异丙醇中去脂, 每4h更换一次, 连续换3次, 再用纯水将异丙醇冲洗干净, 置于通风橱中沥干, 最后分装标记, 置于-20℃保存备用。冻融液参考(Anderluh et al, 2002)海葵毒素的提取方法处理, 收集海葵毒素。
1.3 绿侧花海葵相关指标测定 1.3.1 基础成分测定参考GB 5009.3-2016测定水分; 参考GB5009.4-2016测灰分; 参考GB50095-2016测粗蛋白含量; 参考GB5009.6-2016测定海葵肉的粗脂肪含量。
1.3.2 海葵氨基酸组成及含量分析参考GB5009.124-2016, 称取海葵肉匀浆样品经6mol/L盐酸水解后, 用日立L8900氨基酸自动分析仪测定氨基酸的组成及含量。
1.4 酶种的筛选分别取10g预处理后的海葵肉匀浆加50mL纯水, 加酶量为1000U/g, 根据酶试剂盒上的说明调节最佳pH和温度(表 1), 置于恒温水浴锅中进行酶解。期间匀速缓慢搅拌, 结束后煮沸灭活15min, 然后用三层纱布过滤除去粗杂质, 滤液在4℃、12000r/min离心10min, 连续离心两次。收集上清液用0.45μm针式滤膜过滤, 调节pH=7并对产物进行旋蒸浓缩和冷冻干燥。产物分装置于-20℃冰箱保存备用。
| 序号 | 酶种 | pH | 温度(℃) |
| 1 | 胃蛋白酶 | 4 | 37 |
| 2 | 胰蛋白酶 | 8 | 37 |
| 3 | 中性蛋白酶 | 7.5 | 40 |
| 4 | 碱性蛋白酶 | 9 | 45 |
前列腺癌细胞系DU-145用含10%胎牛血清的F12培养液于37℃、5% CO2细胞培养箱中培养, 待细胞贴壁生长至70%—80%汇合度时进行传代或实验。
MTT法参考张国梅等(2015)并稍作修改, 将DU-145细胞接种于96孔板中, 设置空白对照组及药物组, 药物组加入含不同剂量酶解产物的培养液, 每组设3个复孔, 培养24h后加入200μL含有10% MTT的PBS缓冲液, 并孵育4h。弃MTT培养液, 加入DMSO震荡反应, 酶标仪检测吸光度A值, 计算抑制率(IR), 计算公式为: IR=(对照组A值-药物组A值)/对照组A值×100%
在六孔板中培养细胞, 并按照产物的IC50加药处理24h, 倒置显微镜观察细胞形态, 分析产物对细胞增殖抑制的原因。
1.6 正交实验优化绿侧花海葵抗肿瘤酶解寡肽的制备工艺通过方法1.4确定最佳的蛋白酶后, 以L16(45)正交实验优化绿侧花海葵抗肿瘤酶解寡肽的制备工艺, 以确定最佳的温度、时间、pH、加酶量和料液比, 产物经浓缩冷冻干燥并采用MTT法检测对DU-145增殖抑制活性, 正交实验的因素和水平如表 2所示。
| 水平 | 因素 | ||||
| A料液比 (W/V) |
B pH | C加酶量 (U/g) |
D温度 (℃) |
D时间 (h) |
|
| 1 | 1:2 | 8 | 1000 | 35 | 2 |
| 2 | 1:3 | 9 | 1500 | 45 | 4 |
| 3 | 1:4 | 10 | 2000 | 55 | 6 |
| 4 | 1:5 | 11 | 2500 | 65 | 8 |
按照1.6确定的最佳酶解条件进行酶解, 制备绿侧花海葵抗肿瘤寡肽(Anthopleura anjunae Anti-tumor Peptide, AAP), 用ALPHA1-4/LDplus超滤系统8kDa和20kDa的滤膜分级, 并按分子量由小到大命名为AAP-Ⅰ (MW<8kDa)、AAP-Ⅱ (8kDa ≤ MW<20kDa)、AAP-Ⅲ (MW ≥ 20kDa)。MTT法筛选活性最好组分。
1.7.2 DEAE-Sepharose Fast Flow阴离子交换层析提前活化、平衡交换柱(2cm×35cm), 上样浓度为30mg/mL溶液, 超声5min, 0.45μm针式滤膜过滤, 每次上样3mL, 分别以纯水、0.1、0.3、0.5、0.8mol/L的NaCl溶液梯度洗脱, 各梯度分别洗脱30min, 流速为1mL/min, 用DBS-100-LCD电脑全自动部分收集器每4min收集一管, 于280nm检测吸光度, 并根据吸光度曲线合并洗脱峰。产物浓缩冷冻干燥, 分装保存于-20℃冰箱中备用。MTT法筛选活性最好组分。
1.7.3 SephadexG25凝胶层析法分离纯化将对DU-145增殖抑制率最高的AAP-Ⅰ-1采用G-25凝胶层析继续分离纯化, 将样品配制成30mg/mL溶液, 超声5min, 然后用0.45μm针式滤膜过滤, 每次加3mL到处理好的Sephadex G-25层析柱(2cm×50cm), 用超纯水洗脱, 流速为1.0mL/min, 用DBS-100-LCD电脑全自动部分收集器每4min收集一管, 于280 nm检测吸光度, 并根据吸光度曲线合并洗脱峰, 产物浓缩冷冻干燥。MTT法筛选活性最好组分。
1.7.4 反相高效液相色谱分离纯化将AAP-Ⅰ-1-2配制成0.5mg/mL溶液经0.22μm针式滤膜过滤后用反相高效液相色谱分离纯化。进样前平衡Agilent 1260 ZORBAX SB-C18 (9.4mm×250mm)柱, 柱温30℃; 洗脱液用乙腈超纯水混合液按1mL/min洗脱, 0—15min乙腈(20%—50%), 15—30min:乙腈(50%); 检测波长为280 nm。纯品采用PPSQ-31A蛋白质测序仪测定肽链氨基酸序列。
1.8 AAP-H活性检测采用倒置显微镜观察AAP-H抗前列腺癌活性。DU-145细胞接种在六孔板中培养至80%—90%的汇合度后加药(1、5和10mg/mL), 24h后终止培养, 于倒置显微镜下观察并拍照分析。
1.9 统计分析实验结果采用SPASS19.0统计软件分析, 并采用*x±s表示, *表示P<0.05, 具有显著性。
2 结果与分析 2.1 绿侧花海葵基础成份检测结果绿侧花海葵肉的基础成分检测结果见表 3, 含有丰富的粗蛋白占(19.76%)和较低的粗脂肪(仅为0.89%), 表明绿侧花海葵是一种高蛋白, 低脂肪的海产品。
| 成分 | 水分 | 灰分 | 粗蛋白 | 粗脂肪 |
| 含量 | 76.67±1.31 | 0.42±0.13 | 19.76±1.37 | 0.89±0.12 |
绿侧花海葵肉的氨基酸组成及含量见表 4, 发现其包含常见的17种氨基酸, 种类比较齐全, 其中七种必需氨基酸含量占24.31%, 低于太平洋侧花海葵的37.37% (朱春晓等, 2011); 鲜味氨基酸(天冬氨酸、谷氨酸、甘氨酸、丙氨酸)高达50.58%, 高于太平洋侧花海葵(45.45%), 这可能也是绿侧花海葵味道鲜美的原因之一。
| 氨基酸 | 含量 |
| 天门冬氨酸Asp* | 7.067 |
| 苏氨酸Thr# | 2.700 |
| 丝氨酸Ser | 3.198 |
| 谷氨酸Glu* | 8.988 |
| 甘氨酸Gly* | 13.084 |
| 丙氨酸Ala* | 4.111 |
| 胱氨酸Cys | 0.263 |
| 缬氨酸Val# | 2.572 |
| 蛋氨酸Met# | 1.176 |
| 异亮氨酸Ile# | 1.868 |
| 亮氨酸Leu# | 2.951 |
| 酪氨酸Tyr | 1.004 |
| 苯丙氨酸Phe# | 1.643 |
| 赖氨酸Lys# | 3.099 |
| 组氨酸His | 0.675 |
| 精氨酸Arg | 6.693 |
| 脯氨酸Pro | 4.649 |
| 总氨基酸TAA | 65.74 |
| 鲜味氨基酸FTAA | 33.25 |
| 必需氨基酸EAA | 16.01 |
| F/T(%) | 50.58% |
| E/T(%) | 24.35% |
| 注: “*”表示鲜味氨基酸; “#”表示必需氨基酸; 色氨酸(Trp)因条件限制不检测 | |
根据FAO/WHO对氨基酸评价标准, 绿侧花海葵必需氨基酸之间比值与理想的人体氨基酸比值有一定的差异(结果见表 5), 但研究表明, 亲水性多肽(含有Asp、Thr、Ser、Glu、Arg、Lys、His和Gln等亲水性氨基酸)可通过静电吸引方式, 特异性作用于肿瘤细胞, 导致其细胞膜迅速破裂, 细胞内容物渗漏, 最终引起肿瘤细胞死亡(谢书越等, 2015)。然而绿侧花海葵肉酶解产物的亲水性氨基酸占总氨基酸含量的49.3%, 亲水性氨基酸的高比例可为今后开发抗癌药物或者功能食品提供依据。
| 必需氨基酸 | Ile | Leu | Lys | Met+Cys | Phe+Tyr | Thr | Val |
| 绿侧花海葵 | 2.8 | 4.5 | 4.7 | 2.2 | 4.0 | 4.1 | 4.0 |
| FAO/WHO模式谱 | 4.0 | 7.0 | 5.5 | 3.5 | 6.0 | 4.0 | 5.0 |
将不同提取方法所得产物与前列腺癌细胞系DU-145共同培养24h后, 进行MTT活性测试, 结果如图 1所示。结果发现所有产物的抑制率都表现出剂量依赖性, 中剂量(5mg/mL)的胃蛋白酶、胰蛋白酶、中性蛋白酶和碱性蛋白酶的酶解产物以及毒素对DU-145细胞增殖抑制率分别是(24.98±6.04)%、(28.55±5.29)%、(31.66±4.04)%、(73.7±4.31)%和(99.12±3.96)%, 对DU-145细胞增殖抑制活性顺序由大到小分别是:毒素>碱性蛋白酶>中性蛋白酶>胰蛋白酶>胃蛋白酶, 所以确定碱性蛋白酶为最优酶种。胃蛋白酶、胰蛋白酶、中性蛋白酶、碱性蛋白酶的酶解产物和毒素的IC50分别是: 12.57、12.40、10.66、3.87和0.76mg/mL。
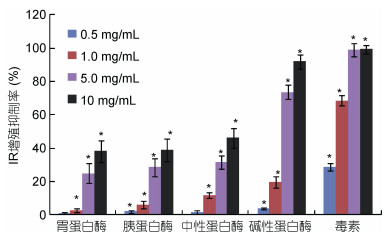 |
| 图 1 不同产物作用24h后对DU145细胞增殖抑制效果 Fig. 1 Effects on proliferative inhibition to DU-145 cells after 24h with different enzymatic hydrolysates 注: “*”表示有显著性差异(P<0.05) |
图 2显示不同酶解产物作用24h对前列腺癌DU-145细胞形态的影响, 空白对照组细胞生长良好, 细胞间排列紧密, 细胞形态饱满; 经酶解产物作用后, B组到E组细胞之间的间隙增大, 细胞膜收缩变圆, 并有较多细胞脱离培养瓶壁, 即细胞死亡, 同时相对空白组细胞数目明显减少; 经毒素作用后的F组细胞出现破碎, 被裂解成碎片。
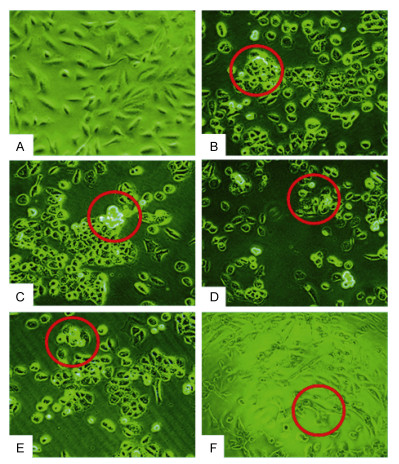 |
| 图 2 不同产物对DU-145细胞形态的影响, 24h, 倒置显微镜(×200) Fig. 2 Morphologic changes in DU-145 cells affected by different enzymatic hydrolysates in 24h, inverted microscope (×200) 注: A:空白对照组细胞形态规则, 生长良好; B: 12.6mg/mL (IC50)的胃蛋白酶解产物作用于DU-145细胞24h后, 细胞收缩, 细胞间隙增大(圆圈所示); C: 12.4mg/mL (IC50)的胰蛋白酶解产物作用于DU-145细胞24h后, 细胞间隙增大, 部分细胞死亡、脱离培养瓶壁(圆圈所示); D: 10.7mg/mL (IC50)的中性蛋白酶解产物作用于DU-145细胞24h后, 视野中细胞数目明显减少, 细胞收缩, 细胞间隙增大(圆圈所示); E: 3.9mg/mL (IC50)的碱性蛋白酶解产物作用于DU-145细胞24h后, 细胞数目明显减少, 出现较多漂浮的死亡细胞(圆圈所示); F: 0.8mg/mL (IC50)的毒素作用于DU-145细胞24h后, 相对比空白组, 细胞形态发生明显的变化, 但并没有出现酶解产物所引起的收缩状态, 而是出现较明显的破碎(圆圈所示) |
虽然无论是毒素还是酶解产物都能促进DU-145细胞死亡, 但是从细胞形态变化初步判断其作用机制不同。海葵毒素能在细胞上形成特异穿孔, 使细胞破碎造成溶解(Marino et al, 2004)。而细胞凋亡的形态特征主要是细胞染色质固缩, 凝聚与核边缘, 呈块状、环状或者新月状(马岚, 2006)。因此初步推断, 酶解法制备的活性肽肽很可能是通过诱导细胞凋亡而抑制细胞增殖。
2.4 Alcalase正交实验结果采用正交实验设计以料液比、温度、pH值、加酶量和时间5个因素, 以IR值作为指标, 检测碱性蛋白酶产物抑制前列腺癌细胞DU-145增殖活性的最优条件, 结果见表 6。采用极差法进行分析, 从Rj值大小可以看出, A(料液比)>E(时间)>D(温度)>C(加酶量)>B(pH值)。而IR值最大时的水解条件为A4B4C3D1E3, 即料液比为1:5、pH为11、加酶量为2000U/g、温度为35℃和时间为6h。并且按该条件酶解产物得率为10.32%±0.69%。
| 序号 | A 料液比 |
B pH值 |
C 加酶量 |
D 温度 |
E 时间 |
抑制率 IR(%) |
| 1 | 1(1:2) | 1(8) | 1(1000) | 1(35) | 1(2) | 25.22 |
| 2 | 1 | 2(9) | 2(1500) | 2(45) | 2(4) | 24.58 |
| 3 | 1 | 3(10) | 3(2000) | 3(55) | 3(6) | 22.58 |
| 4 | 1 | 4(11) | 4(2500) | 4(65) | 4(8) | 22.05 |
| 5 | 2(1:3) | 1 | 2 | 3 | 4 | 23.21 |
| 6 | 2 | 2 | 1 | 4 | 3 | 20.68 |
| 7 | 2 | 3 | 4 | 1 | 2 | 23.95 |
| 8 | 2 | 4 | 3 | 2 | 1 | 30.08 |
| 9 | 3(1:4) | 1 | 3 | 4 | 2 | 35.57 |
| 10 | 3 | 2 | 4 | 3 | 1 | 33.56 |
| 11 | 3 | 3 | 1 | 2 | 4 | 55.53 |
| 12 | 3 | 4 | 2 | 1 | 3 | 73.81 |
| 13 | 4(1:5) | 1 | 4 | 2 | 3 | 75.60 |
| 14 | 4 | 2 | 3 | 1 | 4 | 73.81 |
| 15 | 4 | 3 | 2 | 4 | 1 | 30.92 |
| 16 | 4 | 4 | 1 | 3 | 2 | 24.48 |
| Ⅰj | 23.61 | 39.9 | 25.36 | 49.20 | 22.43 | |
| Ⅱj | 24.48 | 38.16 | 38.13 | 46.45 | 27.15 | |
| Ⅲj | 49.62 | 33.25 | 40.51 | 26.71 | 47.42 | |
| Ⅳj | 51.20 | 40.32 | 38.79 | 27.31 | 43.65 | |
| Rj | 27.59 | 7.07 | 15.15 | 22.49 | 24.99 |
将碱性蛋白酶酶解液超滤后, 初步分离得到三种组分, 并命名为AAP-Ⅰ、AAP-Ⅱ和AAP-Ⅲ, 经MTT法活性筛选(图 3)后, 发现三种组分皆可对DU-145增殖产生抑制作用, 并表现剂量依赖效应, 当剂量为10mg/mL时, 三个组分几乎可以完全抑制细胞增殖。当剂量为5mg/mL时, 抑制率分别是87.18±1.41%、74.36±2.30%和83.05±2.03%, 综合三个剂量的抑制率, 以及到作为药品和保健品开发原材料分子量的适用性问题, AAP-Ⅰ是最好的选择, 所以采用阴离子交换层析对AAP-Ⅰ进一步分离。
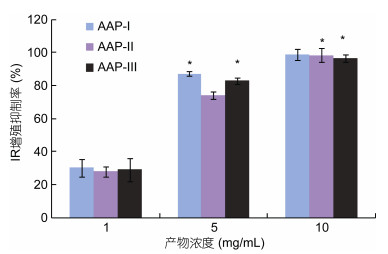 |
| 图 3 超滤后不同分子量产物对DU-145细胞增殖抑制 Fig. 3 Effects on proliferative inhibition in different molecular weights to DU-145 cells 注: “*”表示有显著性差异(P<0.05) |
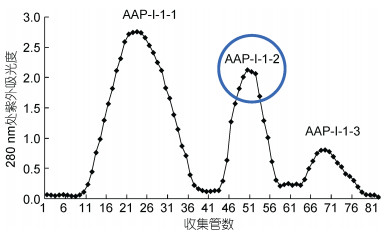
将超滤得到的AAP-Ⅰ用DEAE-Sepharose Fast Flow阴离子交换层析得到三个峰产物(图 4), 分别命名为AAP-Ⅰ-1、AAP-Ⅰ-2和AAP-Ⅰ-3。将每个峰产物浓缩冷冻干燥, 同样采用MTT法检测产物对DU-145的增殖抑制活性。结果(图 5)显示三种组分都能抑制DU-145细胞增殖, 都呈现剂量依赖效应, 并且在每一剂量下, 三种组分的抑制率皆表现为AAP-Ⅰ-1>AAP-Ⅰ-2>AAP-Ⅰ-3。对于中剂量组(5mg/mL), 抑制率分别是37.12±1.70%、34.78±2.20%和24.21±1.61%, 因此选取细胞增殖抑制率最高的AAP-Ⅰ-1进一步分离纯化。
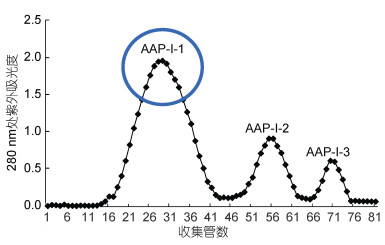 |
| 图 4 AAP-Ⅰ的DEAE-Sepharose Fast Flow阴离子交换层析曲线图 Fig. 4 The elution curve of AAP-Ⅰ in anion exchange chromatography 注:圆圈所示AAP-Ⅰ-1为目标产物 |
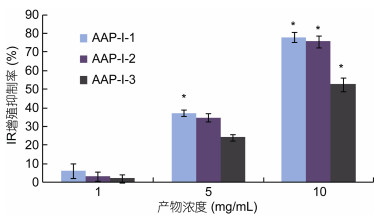 |
| 图 5 阴离子交换柱洗脱后三个峰产物对DU-145细胞增殖抑制 Fig. 5 Effects on proliferative inhibition with three products after elution to DU-145 cells 注: “*”表示有显著性差异(P<0.05) |
将AAP-Ⅰ-1采用Sephadex G-25凝胶层析分离, 结果得到三个峰(图 6), 分别命名为AAP-Ⅰ-1-1、AAP-Ⅰ-1-2和AAP-Ⅰ-1-3, 收集后冷冻干燥, 分装于-20℃冰箱保存。采用MTT法检测抑制活性, 结果(图 7)显示三种组分都能抑制DU-145细胞增殖, 都呈现剂量依赖关系, 浓度越高抑制率越高。在较低浓度(1和5mg/mL)时, 三种组分的抑制率AAP-Ⅰ-1-2>AAP-Ⅰ-1-3>AAP-Ⅰ-1-1, 但是在高浓度组(10mg/mL), 抑制率为AAP-Ⅰ-1-2>AAP-Ⅰ-1-1>AAP-Ⅰ-1-3。对于中剂量(5mg/mL)时, 三个组分的抑制率分别是30.01± 2.16%、46.14±2.29%和40.53±1.76%, 结果表明, 三个组分的产物对于剂量增加的敏感性有所不同, 但是对于各个浓度, AAP-Ⅰ-1-2对DU-145增殖的抑制率最好。
 |
| 图 6 AAP-Ⅰ-1 G-25凝胶过滤洗脱曲线 Fig. 6 Elution curve of AAP-Ⅰ-1 in gel filtration chromatography 注:圆圈所示AAP-Ⅰ-1-2为目标产物 |
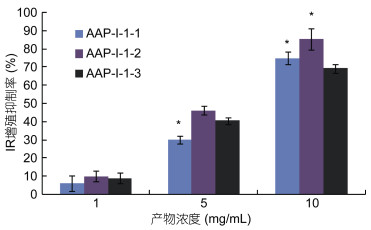 |
| 图 7 G-25各洗脱峰产物DU-145细胞增殖活性示意图 Fig. 7 Effects on the proliferative inhibition with different elution from gel filtration to DU-145 cells 注: “*”表示有显著性差异(P<0.05) |
将AAP-Ⅰ-1-2经HPLC纯化后结果如图 8所示, 收集主峰产物浓缩冷冻干燥, 并命名为AAP-H, 进行MTT活性测试, 24h、5mg/mL对DU-145增殖抑制率为49.14%±2.29%, 比同等时间和剂量的AAP-Ⅰ-1-2 (46.14%±2.29%)略微偏高, 因此推断主峰AAP-H是AAP-Ⅰ-1-2的主要活性物, AAP-H经高效液相检测基本单一样品, 纯度大于95%, 符合氨基酸序列测定要求, AAP-H高效液相检测如图 9所示。
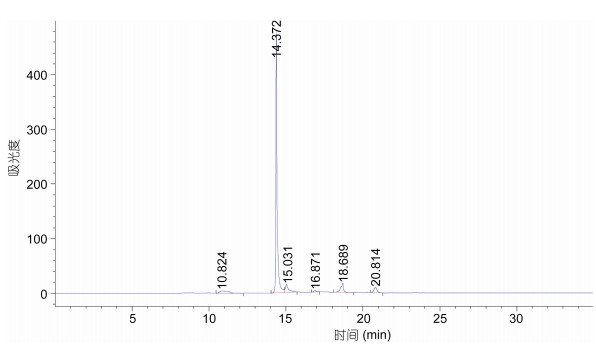 |
| 图 8 AAP-Ⅰ-1-2的C18-HPLC图 Fig. 8 C18 HPLC chromatogram of AAP-Ⅰ-1-2 |
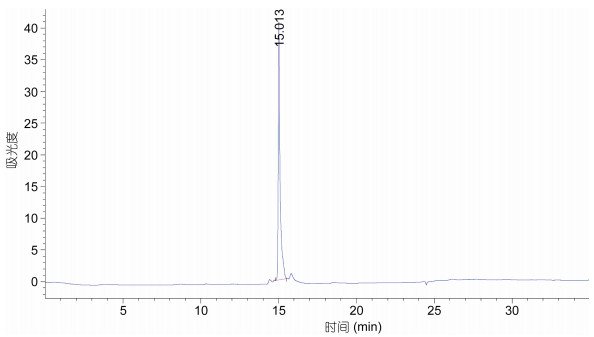 |
| 图 9 AAP-H的C18-HPLC图 Fig. 9 C18 HPLC chromatogram of AAP-H |
将AAP-H进行氨基酸测序, 见图 10。结果为: Tyr-Val-Pro-Gly-Pro, 分子式为: C26H37N5O7, 分子量为531.68Da, 与质谱的532.27Da基本吻合。因此推断, AAP-H是比较纯的单一组分, 且是测序检测到的Tyr-Val-Pro-Gly-Pro寡肽。
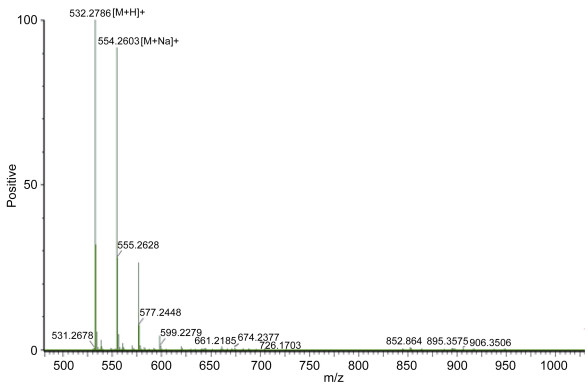 |
| 图 10 AAP-H质谱图 Fig. 10 Mass spectrogram of AAP-H |
倒置显微镜观察结果如图 11所示, 经AAP-H作用24h后, 空白对照组(A)的细胞生长良好, 细胞间排列紧密, 形态饱满。随着AAP-H浓度增加, 细胞形态发生变化, 如1mg/mL组(B)细胞出现细胞间隙增大, 轮廓模糊, 相对比空白组死细胞明显增多; 5mg/mL组(C)细胞出现细胞收缩, 间隙增大, 胞膜出现空泡(C); 10mg/mL组(D)的高剂量组, 细胞收缩变圆, 胞间间距增大, 细胞数量明显减少。表明AAP-H改变细胞形态同时抑制细胞增殖。
 |
| 图 11 AAP-H作用DU-145细胞24h后倒置显微镜观察细胞形态(×400) Fig. 11 Cellular morphology of DU-145 under inverted microscope after treated with APP-H for 24h (×400) 注: A:空白对照组细胞形态饱满, 生长情况良好; B: 1mg/mL的APP-H作用DU-145细胞后, 细胞开始收缩变圆(圆圈所示); C: 5mg/mL的AAP-H作用于DU-145细胞后, 细胞出现收缩变圆现象更明显, 同时出现空泡(圆圈所示); D: 10mg/mL的AAP-H作用于DU-145细胞后, 视野中细胞数目明显减少, 细胞间间隙增大, 部分细胞脱离培养瓶壁(圆圈所示) |
我国海域幅员辽阔, 海葵资源丰富, 常见的种类有:中华仙影海葵(Cereus sinensis Verrill)、太平洋侧花海葵(A. pacifica)、黄侧花海葵(A. xanthogrammica)、纵条矶海葵(Haliplanella luciae Hand)和绿侧花海葵(A. anjunae)等。目前对海葵的研究主要是海葵毒素, 从海葵触手毒素中分离出多种具有细胞毒、神经毒作用的多肽和蛋白质; 另外, 也有研究表明, 海葵中还有丰富的甘油酯、神经酰胺、嘧啶、甾醇和生物碱等活性物(张均顺等, 1998)。这些毒素具有多种生物活性, 如抗菌、降血压、中枢神经抑制和镇痛等, 另外海葵抗肿瘤活性物的研究也取得一定的进展, 如Tejuca等(2009)研究的三种海葵毒素通过使细胞膜成孔而抑制细胞增值。但是到目前为止对海葵的研究基本都还停留在实验研究阶段, 并不能转化成产品, 其中重要的原因一方面是因为海葵毒素含量少, 提取困难; 另一方面由于海葵毒素毒性强, 在应用中副作用大, 这些因素都严重制约了海葵的研究进展。因此寻找新的途径开发海葵资源就显得尤为重要。
目前制备海洋生物活性肽比较常用的方法有三种:一是化学合成方法制备生物活性肽; 二是以生物体或者组织为原料通过各种分离手段直接分离提取; 三是采用酶解法降解生物组织或者大分子产物制备生物活性肽(黄芳芳, 2011)。由于蛋白酶酶解法生产生物活性肽具有安全性高、反应条件温和、产率相对较高的优点, 因此该方法已经成为近年来制备活性肽的研究热点。海洋生物生长环境独特于陆生生物, 有的甚至生长在极高压或极低温等环境中, 造成海洋生物在生长过程中形成结构独特, 功能新颖的活性肽。这种活性肽部分以天然状态存在, 部分作为蛋白质大分子的结构域, 蛋白酶通过对特定的点位剪切, 可以得到活性比蛋白质更好的肽链, 这些生物活性肽在调节免疫系统、抗菌、抗血栓、抗高血压、调节胃肠道运动、清除自由基、抗病毒、促进矿物元素吸收和抗癌方面发挥重要的作用(黎观红等, 2004)。根据Samaranayaka等(2011)的研究表明:肽链的生物活性主要受氨基酸组分和肽链分子量大小影响, 活性肽比蛋白质、多聚肽和单纯的氨基酸具有更强的生物活性。另外肽链中的Trp、Tyr、Met、Gly、Lys、His和Pro等芳香族氨基酸或者疏水性氨基酸能很好地增强肽链的生物活性(Saito et al, 2003; Guo et al, 2009)。本实验结合舟山实际情况, 以绿侧花海葵肉为原料, 通过酶解法制备海葵抗肿瘤肽, 旨在为海葵资源的开发提供参考依据。
4 结论通过实验确定碱性蛋白酶为最佳酶种, 采用正交实验进一步优化酶解法提取海葵抗肿瘤肽的最佳工艺条件为:料液比为1:5 (W/V)、pH=11、加酶量为2000U/g、酶解温度为35℃和最佳酶解时间为6h。通过超滤、阴离子交换层析、G-25凝胶层析和反向高效液相等方法分离纯化, 以产物对DU-145增殖抑制率为指标, 最终纯化获得寡肽且氨基酸序列为: Tyr-Val-Pro-Gly-Pro, 并且Tyr、Pro和Gly结构可能是产物具有抗肿瘤活性的重要原因之一。综上所述, 绿侧花海葵肉是一种蛋白含量很高脂肪含量很低的天然食品, 通过酶解法制备的寡肽, 具有抗前列腺癌的活性。
| 马岚, 2006. 槐定碱对人肝癌HepG-2细胞诱导凋亡作用及其基因调控机制的实验研究. 兰州: 兰州大学硕士学位论文, 16-31 http://cdmd.cnki.com.cn/article/cdmd-10730-2006088157.htm |
| 朱春晓, 王远红, 吕志华, 2011. 太平洋侧花海葵的营养成分分析. 中国海洋大学学报, 41(S1): 365–368 |
| 李霞, 贾玉妹, 李雅娟, 2004. 黄海葵解剖学和主要器官组织学的研究. 大连水产学院学报, 19(3): 171–175 |
| 张岩, 吴燕燕, 李来好, 等, 2012. 酶法制备海洋活性肽及其功能活性研究进展. 生物技术通报, 28(3): 42–48 |
| 张国梅, 杨最素, 丁国芳, 等, 2015. 沙蚕活性蛋白酶诱导人肺癌SPC-A-1细胞凋亡的机制研究. 现代食品科技, 31(3): 6–11 |
| 张均顺, 张培军, 1998. 海葵多肽神经毒素结构与功能研究新进展. 海洋与湖沼, 29(2): 212–218 |
| 胡波, 2011. 海葵溶细胞素Gigantoxin-4的分离、鉴定和功能研究. 上海: 第二军医大学硕士论文, 8-30 http://cdmd.cnki.com.cn/Article/CDMD-90024-1011118245.htm |
| 黄芳芳, 2011. 乌贼墨寡肽酶解工艺及抗前列腺癌机制研究. 舟山: 浙江海洋学院硕士学位论文, 20-33 http://cdmd.cnki.com.cn/Article/CDMD-10340-1011161816.htm |
| 景奕文, 杨最素, 黄芳芳, 等, 2014. 乌贼墨多肽诱导人前列腺癌DU-145细胞凋亡的机制研究. 现代食品科技, 30(9): 1–6 |
| 谢书越, 穆利霞, 廖森泰, 等, 2015. 抗肿瘤活性肽的研究进展. 食品工业科技, 36(2): 368–372 |
| 窦光宇, 2003. 胜似鲜花的海洋动物——海葵. 森林与人类,(8): 38–38 |
| 黎观红, 乐国伟, 施用晖, 2004. 动物蛋白质营养中小肽的吸收及其生理作用. 生物学通报, 39(1): 20–22 |
| Anderluh G, Maček P, 2002. Cytolytic peptide and protein toxins from sea anemones (Anthozoa:Actiniaria). Toxicon, 40(2): 111–124 DOI:10.1016/S0041-0101(01)00191-X |
| Chi V, Pennington M W, Norton R S, et al, 2011. Development of a sea anemone toxin as an immunomodulator for therapy of autoimmune diseases. Toxicon, 59(4): 529–546 |
| Guo H, Kouzuma Y, Yonekura M, 2009. Structures and properties of antioxidative peptides derived from royal jelly protein. Food Chemistry, 113(1): 238–245 DOI:10.1016/j.foodchem.2008.06.081 |
| Gutiérrez-Aguirre I, Barlič A, Podlesek Z, et al, 2004. Membrane insertion of the N-terminal α-helix of equinatoxin Ⅱ, a sea anemone cytolytic toxin. Biochemical Journal, 384(2): 421–428 DOI:10.1042/BJ20040601 |
| Marino A, Valveri V, Muià C, et al, 2004. Cytotoxicity of the nematocyst venom from the sea anemone Aiptasia mutabilis. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 139(4): 295–301 |
| Michalaki V, Syrigos K, Charles P, et al, 2004. Serum levels of IL-6 and TNF-α correlate with clinicopathological features and patient survival in patients with prostate cancer. British Journal of CancerImmunology Letters, 90(12): 2312–2316 |
| Monroy-Estrada H I, Segura-Puertas L, Galván-Arzate S, et al, 2007. The crude venom from the sea anemone Stichodactyla helianthus induces haemolysis and slight peroxidative damage in rat and human erythrocytes. Toxicology in Vitro, 21(3): 398–402 DOI:10.1016/j.tiv.2006.10.003 |
| Rodríguez A A, Salceda E, Garateix A G, et al, 2014. A novel sea anemone peptide that inhibits acid-sensing ion channels. Peptides, 53: 3–12 DOI:10.1016/j.peptides.2013.06.003 |
| Saito K, Jin D H, Ogawa T, et al, 2003. Antioxidative properties of tripeptide libraries prepared by the combinatorial chemistry. Journal of Agricultural and Food Chemistry, 51(12): 3668–3674 DOI:10.1021/jf021191n |
| Samaranayaka A G P, Li-Chan E C Y, 2011. Food-derived peptidic antioxidants:a review of their production, assessment, and potential applications. Journal of Functional Foods, 3(4): 229–254 DOI:10.1016/j.jff.2011.05.006 |
| Shkrob M A, Yanushevich Y G, Chudakov D M, et al, 2005. Far-red fluorescent proteins evolved from a blue chromoprotein from Actinia equina. Biochemical Journal, 392(3): 649–654 DOI:10.1042/BJ20051314 |
| Soletti R C, de Faria G P, Vernal J, et al, 2008. Potentiation of anticancer-drug cytotoxicity by sea anemone pore-forming proteins in human glioblastoma cells. Anti-cancer drugs, 19(5): 517–525 DOI:10.1097/CAD.0b013e3282faa704 |
| Tejuca M, Anderluh G, Serra M D, 2009. Sea anemone cytolysins as toxic components of immunotoxins. Toxicon, 54(8): 1206–1214 DOI:10.1016/j.toxicon.2009.02.025 |
 2017, Vol. 48
2017, Vol. 48


