中国海洋湖沼学会主办。
文章信息
- 张芳, 孙松, 李超伦. 2017.
- ZHANG Fang, SUN Song, LI Chao-Lun. 2017.
- 黄海夏季沙海蜇食物需求的估算方法及应用
- ESTIMATION ON FOOD REQUIREMENT BY LARGE JELLYFISH NEMOPILEMA NOMURAI IN SUMMER
- 海洋与湖沼, 48(6): 1355-1361
- Oceanologia et Limnologia Sinica, 48(6): 1355-1361.
- http://dx.doi.org/10.11693/hyhz20170600174
-
文章历史
- 收稿日期:2017-06-27
- 收修改稿日期:2017-09-18
2. 海洋国家实验室海洋生态与环境科学功能实验室 青岛 266071;
3. 中国科学院海洋研究所 山东胶州湾海洋生态系统国家野外科学观测研究站 青岛 266071;
4. 中国科学院大学 北京 100049
2. Laboratory for Marine Ecology and Environmental Science, National Laboratory for Marine Science and Technology, Qingdao 266071, China;
3. Jiaozhou Bay Marine Ecosystem Research Station, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;
4. University of Chinese Academy of Sciences, Beijing 100049, China
自20世纪90年代末起, 沙海蜇Nemopilema nomurai (Cnidaria: Scyphozoa: Rhizostomeae频繁暴发于东亚海域, 包括渤海、黄海、东海北部、日本海及韩国海域(丁峰元等, 2005; 程家骅等, 2005; Kawahara et al, 2006; Uye, 2008; Yoon et al, 2008; Zhang et al, 2012; Sun et al, 2015)。在2003—2013十年间, 水母除2008、2010、2011、2013年没有大量暴发外, 其余年份均为暴发年或中度暴发年(Sun et al, 2015)。在黄东海的一周年中, 8、9月份为沙海蜇生物量的高峰时期。以往研究表明当水母类数量很大时, 它们集体的摄食率非常大, 这种捕食压力会直接或间接的控制其他浮游动物或鱼类的数量(Purcell, 1992; Schneider et al, 1994; Olesen, 1995; ;Riisgård et al, 1995; Nielsen et al, 1997), 因此当沙海蜇大量存在时对黄海浮游生态系统的影响问题有必要进行研究。这些主要影响包括: (1)沙海蜇以浮游动物, 鱼卵, 仔稚鱼等为食, 其与鱼类形成捕食和摄食竞争, 大量暴发的沙海蜇可通过下行控制机制对其他浮游动物或仔、稚鱼数量进行调控。(2)鲳鱼类以水母为食, 黄海沙海蜇的暴发对鲳鱼类的生长影响。(3)通过自身代谢的营养盐, 通过上行控制机制或营养级级联效应对浮游植物的种群数量的影响。(4)其在暴发后向海底沉降, 造成的碳通量的增加。在研究这些影响之前, 首先要研究沙海蜇现场的摄食率、消化率及排泄率等生物生态学参数。但是以往有关黄东海沙海蜇对浮游动物的摄食率、呼吸率的研究未见报道。本文通过计算沙海蜇的代谢率(以氧为指标的呼吸率)来反估算其摄食率, 估算沙海蜇的食物需求量, 为探讨沙海蜇暴发对黄海生态系统的影响程度提供理论依据。
1 材料与方法 1.1 采样站位、时间、方法利用沙海蜇生物量最高的月份2006年9月2—12日南黄海大面调查航次, 2006年9月18—27日, 2007年8月3—9日两个断面调查航次(调查范围为32—36.5°N, 120.5—124°E, 调查站位见图 1)共三个航次的调查结果。所有调查航次均利用中国水产科学研究院黄海水产研究所的“北斗”号科学调查船, 所有的调查均不分白天和黑夜, 在24h内连续进行。水母样品采集均用“北斗号”调查船装配的渔业资源底层拖网采集。该渔网网具主尺寸836目×20cm, 囊网10cm, 衬网2.4cm。网口高度根据水深和曳纲长度一般变动在6.1—7.1m, 网口宽度一般随着水深的不同而不同, 网口周长167.2m, 网具总长度83.2m。拖网速度约3节。各站拖网时间为0.3—1h(大部分站位为1h)。采样方法详见(Zhang et al, 2012)。
 |
| 图 1 三个航次站位图 Fig. 1 Stations of the study area 注: a. 2006年9月上旬; b. 2006年9月下旬; c. 2007年8月 |
沙海蜇的摄食率F(单位水柱的沙海蜇每天需要消耗的碳量, mgC/(m2d))由下公式计算得到, 摄食率包括两个部分:一部分为代谢所需要的碳量, 一部分为生长所需要的碳量(Uye, 2008, 2011)。
F = (K×R×RQ×24 + g×CW) ×WW / Ae
其中, K为转换常数0.375mgC/mgO2, R代表单位湿重的呼吸率(mgO2/(kg h), 根据Uye(2008), R由12mLO2/(kg h), 转换为17.15mgO2/(kg h)得到。RQ为呼吸商, 这里取0.8; g为生长率(d-1), 由于沙海蜇不同生长时期的生长率不同(张芳等, 未发表), 本文取8月至9月份生长率的平均值0.02, CW为碳重, 以碳重占湿重的0.28%计算, 由干重占湿重的4.2%, 碳重占干重的6.6%计算得到(Iguchi, unpublished)。WW代表沙海蜇的湿重生物量(mg/m2)。Ae为同化效率, 这里取0.8 (0.80, Schneider, 1989)。
1.3 中、大型浮游动物生物量(干重)和生产力的测定对于两个断面调查航次, 中大型浮游动物(下面简称浮游动物)的干重生物量数据用同步调查的浮游动物样品测得的干重(g/m2)。采用标准的浮游生物大网(网口直径0.8m, 网孔直径500μm)和浮游生物中网(网口直径0.5m, 网孔直径160μm)在每个站位从底到表垂直拖网取样, 将分不同粒级过滤获得的样品到事先称重和煅烧(450℃)过的玻璃纤维滤膜上(Whatman GF/C), 再将滤获物快速的用去离子水进行冲洗后, 置于烘箱内, 60℃烘干24—36h, 干燥器干燥, 用感量为0.01mg的电子天平称重, 减去膜的初始重量, 即得到浮游动物干重。考虑到标准大型浮游生物网对个体较大的浮游动物捕获效率要高于中型浮游生物网, 相反, 中型浮游生物网对小型浮游动物的捕获效率要远高于大型浮游生物网(王荣等, 2003), 因此用大网获得浮游动物样品用于测定≥ 1mm粒径的浮游动物干重, 小于1mm的浮游动物生物量用中网获得的样品测定, 浮游动物总干重等于两个粒级浮游动物干重之和(Huo et al, 2012)。对于大面调查航次, 由于没有同步的浮游动物干重数据, 这里取相同月份浮游动物干重的平均值代替(1.87g/m2, 相当于746.98mgC/m2)。
浮游动物的生产力估算用浮游动物的呼吸率R(μL O2/(animal h))是干重(W)和栖息环境的水体温度(T, ℃)的函数, 可以表示成如下的关系式(Ikeda, 1985):
lnR = –0.2512 + 0.7886 lnW + 0.0490T
式中, R为呼吸率(μL O2/(animal h)), W为个体干重(mg/animal)。
根据RQ=0.97 (Gnaiger, 1983), 我们将呼吸率转化成以碳含量表示的单位。总生长效率和吸收效率以0.3和0.7计算(Ikeda, 1985), 那么浮游动物的生产力就可以表示为下面的公式(Ikeda et al, 1978):
P = 0.75R
式中, P为生产力(mgC/(animal h))。
不同粒径浮游动物每天的生产力就等于P乘以不同粒径组内浮游动物的丰度(animal/m2)和24h。
1.4 对浮游动物现存量及生产力的潜在摄食压力的估算获得沙海蜇的摄食率后, 假设网采浮游动物均为沙海蜇的摄食对象, 那么其摄食率(即:单位水柱的水母所需的碳量)除以浮游动物的碳量现存量及生产力(根据黄东海的经验参数, 碳量为干重的40%), 就可得到对浮游动物现存量及生产力的摄食压力。
2 结果 2.1 沙海蜇摄食率(单位时间单位水柱内的沙海蜇的需碳量)的分布根据2006年9月上旬的大面调查的估算结果(图 2A, 表 1), 如果取捕获率为0.1, 这时沙海蜇的摄食率为(47.84±60.52)mgC/(m2d) (mean±STDEV), 摄食率范围为0.70—215.03mgC/(m2d)。如果生物量以捕获率0.4估算, 那么摄食率(11.96±15.13)mgC/(m2d)为上述摄食率的四分之一, 范围为0.18—53.76mgC/ (m2d)。沙海蜇摄食率的分布格局与生物量的分布一致, 均在锋区为最高值。2006年9月下旬的断面捕获率取0.1的情况下沙海蜇的摄食率范围为: 0.09—23.32mgC/(m2d), 平均为5.59±6.03(图 2B, 表 1)。摄食率高值仍然出现在锋区附近, 其次之外南黄海中心海域摄食率也较高。2007年8月断面调查在捕获率为0.1的情况下, 沙海蜇的摄食率范围为: 0.11—59.27mgC/(m2d), 9.83±14.95mgC/(m2d), 高值的分布仍然在锋区附近(图 2C, 表 1)。
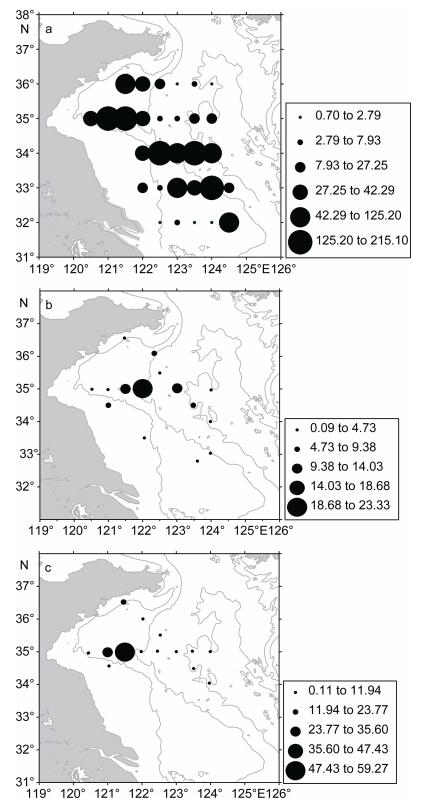 |
| 图 2 南黄海沙海蜇在生物量高值时期的摄食率(mgC/(m2d)) Fig. 2 The feeding rate (mgC/(m2d)) of N. nomurai during blooming period in the southern Yellow Sea 注: a. 2006年9月上旬; b. 2006年9月下旬; c. 2007年8月 |
| 项目 | 网捕获率 | 2006年9月上旬 | 2006年9月下旬 | 2007年8月 | |||||
| 平均值 | 范围 | 平均值 | 范围 | 平均值 | 范围 | ||||
| 摄食率(mgC(m2d)) | 0.1 | 47.84 | 0.70—215.03 | 5.59 | 0.09—23.33 | 9.83 | 0.11—59.27 | ||
| 0.4 | 11.96 | 0.18—53.76 | 1.40 | 0.02—5.83 | 2.46 | 0.03—14.82 | |||
| 对浮游动物现存量的摄食压力(%) | 0.1 | 6.40 | 0.09—28.79 | 1.20 | 0.02—4.07 | 3.35 | 0.02—16.69 | ||
| 0.4 | 1.60 | 0.02—7.20 | 0.30 | 0.005—1.02 | 0.84 | 0.005—4.17 | |||
| 对浮游动物生产力的摄食压力(%) | 0.1 | 76.60 | 1.12—344.28 | 11.63 | 0.13—33.27 | 26.57 | 0.28—135.32 | ||
| 0.4 | 19.15 | 0.28—86.07 | 2.91 | 0.03—8.32 | 6.64 | 0.07—33.83 | |||
2006年9月大面调查航次, 由于没有同步的浮游动物干重数据, 这里取相同月份浮游动物干重的平均值代替(1.87g/m2, 换算成碳重为746.98mgC/m2), 平均生产力为62.46mgC/m2, 生产力占碳重生物量的8.4%。2006年9月下旬浮游动物的碳生物量为(565.71±509.61)mgC/m2, 生物量范围为207.35—1490.27mgC/m2; 生产力为(62.46±29.08)mgC/(m2d), 范围为23.13—135.20mgC/(m2d); 平均生产力占碳重生物量的30%。2007年8月浮游动物的碳生物量为(468.77±202.70)mgC/m2, 生物量范围为168.648—942.36mgC/m2; 生产力为(39.23±7.64)mgC/(m2d), 范围为26.06—59.32mgC/(m2d); 平均生产力占碳重生物量的8.3%。
2.3 沙海蜇对浮游动物现存量及生产力的潜在摄食压力2006年9月上旬, 当沙海蜇的生物量最高时, 网捕获率为0.1时, 如果假设文中所用的网采工具采集的浮游动物都是沙海蜇可以摄食的对象, 那么沙海蜇每天对浮游动物现存量的摄食压力为0.09—28.79% mgC/(m2d), 平均为6.4%, 对浮游动物生产力的摄食压力为1.12%—344.28%, 平均为76.6%。到9月下旬时, 沙海蜇每天对浮游动物现存量的摄食压力0.02—4.07%, 平均为1.2%, 对生产力的摄食压力为0.26%—58.5%, 平均为20.8%。2007年8月, 沙海蜇每天对浮游动物的现存量的摄食压力为0.02%—16.69%, 平均为3.35%, 对生产力的摄食压力为0.28%—135.32%, 平均为26.57%。渔网的捕获率为0.4时, 不同航次的各项值是上述值的四分之一。
3 讨论目前国际上对大型水母的摄食率的测定尚没有统一的研究方法, 比如利用现场围格实验, 小容器直接培养等方法, 这些方法被认为会对大型水母摄食率的估计不准, 不能真实反映自然状况下大型水母的摄食状况(Hansson, 2006)。现场潜水跟踪的方法对摄食率的估计相对较准确, 但对于我国研究大型水母来讲, 该方法可操作性差, 几乎不能实现。鉴于对水母呼吸率的测定较容易, 可通过对沙海蜇个体呼吸率的测定间接推算摄食率。根据本文中推算摄食率的公式可知, 除了呼吸率之外, 生物量和生长率是影响现场水母摄食率估算的重要影响因素, 生长率的大小很大程度上也是由生物量决定的, 因此沙海蜇的生物量很大程度上决定了沙海蜇的野外摄食率, 因此本文的研究结果体现出摄食率的分布格局与生物量分布格局一致是容易理解的。而水母的重量及滤水量是决定准确定量生物量的关键, 虽然大型水母的重量可以由不同伞径的水母数量来计算获得(Zhang et al, 2012), 但是由于捕获沙海蜇的水体体积/滤水量的估计存在误差, 因此野外现场大型水母生物量的定量比较困难, 因此很多时候这种方法只能对单个大型水母的摄食率进行研究和估计, 而无法对现场原位大型水母种群的摄食率进行估计。Uye(2011)在对马海峡的沙海蜇的生物量有初步估计后, 进而对沙海蜇的食物需求及浮游动物的摄食压力进行了估计, 沙海蜇在对马海峡2005年7月底对浮游动物现存量的摄食压力可以达到24%, 表示出很高的数值。
本文采用底拖网扫海面积的方法对大型水母的生物量进行定量的方法通常应用于渔业资源评估。用该方法对大型水母生物量的估算有几个导致生物量估计不准的可能性原因, 比如Barz等(2007)报道北海南部的水母主要分布在5—25m, Brodeur等(2002)报道在白令海水母主要分布在跃层, 在垂直方向上并非均匀分布, 在本文的调查期间我们也发现在许多站位的表层或次表层出现大量的水母个体。考虑到渔网为底拖网, 是绝对不能完全把上层的水母体收入囊中, 大大低估了水母真实的生物量, 因此这里需要对捕捉效率进行估计。但遗憾的是以往并没有相应的水母的捕获系数作为参考用来估计生物量。如果用底拖渔网具对上层鱼的捕获率的选值作为参考, 比如, 对于中上层鱼类, 鉴于它们在中上层分布, 有较强的活动能力, 拖网所过的地方只有小部分被捕获, 通常选0.1—0.4作为捕获率(金显仕等, 2005)。鉴于大型水母有一定的游泳能力而且个体大, 不易捕获, 仍然参考0.1—0.4为大型水母的捕获率, 把0.4作为最小生物量估计, 0.1作为最大生物量的估计。事实上, 采用扫海面积法得到的大型水母的生物量/丰度值与日本广岛大学的Uye教授采用目测计数海水表层可见的大型水母所获得的丰度相比, 前者大约是后者的十分之一, 因此本文有理由选用0.4—0.1作为网具对水母的捕获率。
本文利用摄食率的方法对黄东海的沙海蜇的食物需求进行估算, 尽管在估算过程中对于生物量的估计存在一定程度的误差, 但是仍然可以在很大程度上说明了海蜇在暴发期间的食物需求。相比较现场潜水跟踪大型水母对摄食率的进行估计以及用实验室直接测定沙海蜇摄食率的方法, 本文描述的以呼吸率间接估算摄食率的方法, 弥补了只在室内测量而无法代表现场实际摄食率的缺点, 也弥补了在野外潜水对个体水母摄食率现场估测的危险性及用于大范围海域代表性不足的缺点。另外, 本文间接估算摄食率关键参数的定量和参数化过程明确, 参数化相对准确, 可操作性强, 可以真实反映广阔海域大型水母摄食率的情况, 因此在我国近海计算大型水母的摄食率方面有很强的应用性。唯一的缺点是必须要求对海域大型水母的生物量进行准确估计, 随着今后对水母生物量监测和定量方法的不断改进, 对大型生物量定量的准确性不断提高, 本文所述方法将会成为很好的测定大型水母摄食率的方法。在对白令海海域的水母生物量进行估计时, Brodeur等(2002)比较了底拖网和中层拖网的效率, 发现在整个调查海域的生物量中中层拖网对生物量的估计是底层拖网的300倍。本文选底拖网的最大捕获效率为0.1, 具有可能的现实性。在白令海, 据估计数量增多的水母Chrysaora melanaster平均消耗各季节浮游动物现存量的三分之一, 每年消耗浮游动物生产力的4.7%, 认为对浮游动物的消耗是较适中的(Brodeur et al, 2002)。Pitt等(2007)对围格实验的研究表明存在的水母Catostylus mosaicus会把实验中的中型浮游动物消耗殆尽。本文在2006年9月上旬水母大量暴发时, 沙海蜇每天对浮游动物的平均摄食压力6.4%, 对浮游动物生产力的平均摄食压力为76.6%, 属于高水平的摄食率, 对浮游动物的摄食几乎是毁灭性的。特别在黄海南部和东海北部通常容易暴发水母的海域(33—34°N, 122—125°E)中最高的生物量站位, 每天对浮游动物的摄食率达到了50%以上, 对生产力的摄食压力( > 100%)远远超过了每天浮游动物的生产力。即使用0.4作为渔网的捕获率计算的沙海蜇生物量, 每天对浮游动物的现存量及生产力的消耗也是非常高的。因此2006年沙海蜇暴发后对食物的需求的升高应该会对与食物竞争的鱼类造成很严重的影响。相比之下, 2006年9月下旬, 随着沙海蜇生物量的减少, 摄食压力也随之减小。2007年8月, 在锋区的两个高生物量站位, 沙海蜇每天对浮游动物的摄食压力约 > 20%, 对其生产力的摄食约为200%。2006年9月上旬、下旬和2007年8月份, 不同时期沙海蜇摄食率的差异主要取决于不同时期的平均生物量的大小不同, 以及水母的平均伞径大小。
从本文估算的沙海蜇在暴发期2006年9月上旬的食物需求及其对浮游动物的摄食压力来看, 沙海蜇的摄食率为47.84±60.52mgC/(m2d), 摄食率范围为0.70—215.03mgC/(m2d)。沙海蜇每天对浮游动物现存量的摄食压力为0.09%—28.79% mgC/(m2d), 平均为6.4%, 对浮游动物生产力的摄食压力为1.12%—344.28%, 平均为76.6%。可见沙海蜇在暴发期的食物需求是很大的, 尽管平均值看来浮游动物的生产力可以基本满足沙海蜇对浮游动物的摄食, 但是在很多沙海蜇暴发的高生物量站位, 沙海蜇对浮游动物的摄食压力远超过了浮游动物本身的生产力(大于100%), 因此这时的浮游动物远远不能满足沙海蜇的食物需求。那么这就需要其他的饵料来源来补充其食物需求。李洁等(2016)、Wang等(2013)、丁军军等(2012)研究了沙海蜇暴发期间微小型浮游动物的组成及生物量变化, 研究认为纤毛虫、鞭毛虫等其他微小型浮游动物也是沙海蜇暴发时的重要的食物来源。但是到目前为止, 大、中型浮游生物和微小型浮游动物对沙海蜇食物需求的贡献率仍然不清楚, 需要进一步的室内实验和现场实验的验证才能得到全面的量化。
水母大量存在时, 它们对浮游动物的大量摄食不仅对鱼类形成了食物竞争, 同样通过营养级级联效应使浮游植物的数量增加, 在富营养化的海域造成可能的赤潮暴发。Hansson等(2005)和Møller等(2007)对丹麦的Limfjorden海域的研究表明海月水母对桡足类的摄食造成桡足类很高的死亡率的海域, 正好与当时的叶绿素的高值(40μg/L)相对应。Pitt等(2007)在实验上也证明了在富营养化的水体中发生的水母暴发可能会增加赤潮的形成。在本文调查的两个航次中, 沙海蜇虽然达到数量的高峰, 在高峰区的叶绿素a值并不高, 因此该海域此时营养盐的水平也是水母数量较高时并不一定与赤潮相伴而生的原因。
4 小结本文对黄海2006年9月份和2007年8月份沙海蜇生物量的最高峰或暴发时期的呼吸率, 摄食率进行了估算, 获得其每天对浮游动物现存量及生产力的潜在摄食压力, 结果表明:沙海蜇大量暴发的2006年9月上旬, 在对沙海蜇最大捕获率的情况下, 沙海蜇的摄食率最高, 摄食率在黄海的分布格局与沙海蜇的生物量一致, 沙海蜇每天对浮游动物现存量的摄食压力为0.09%—28.79% mgC/(m2d), 平均为6.4%, 对浮游动物生产力的摄食压力为1.12%—344.28%, 平均为76.6%。可看出在沙海蜇暴发期间对浮游动物的潜在消耗是非常大的, 甚至为毁灭性的, 尤其沙海蜇在高生物量站位对浮游动物的食物需求是非常高的, 沙海蜇对浮游动物的摄食压力远超过了浮游动物本身的生产力(大于100%), 因此这时的浮游动物远远不能满足沙海蜇的食物需求。
致谢 感谢课题组霍元子博士在浮游动物采样、干重测量、生产力估算方面给予的大力协助, 感谢北斗号船员在大型水母采集方面给予的帮助, 谨致谢忱。| 丁军军, 徐奎栋, 2012. 黄海水母旺发区浮游鞭毛虫和纤毛虫群落结构分布及其与水母发生关系初探. 海洋与湖沼, 43(3): 527–538 DOI:10.11693/hyhz201203019019 |
| 丁峰元, 程家骅, 2005. 东海区夏、秋季大型水母分布区渔业资源特征分析. 海洋渔业, 27(2): 120–128 |
| 王荣, 王克, 2003. 两种浮游生物网捕获性能的现场测试. 海洋与湖沼, 27(增刊): 98–102 |
| 李洁, 徐奎栋, 2016. 南黄海夏秋季纤毛虫等微小型浮游动物丰度和生物量变动及其与沙海蜇旺发的关系. 海洋与湖沼, 47(3): 612–625 |
| 金显仕, 赵宪勇, 孟田湘, 等, 2005. 黄、渤海生物资源与栖息环境. 北京: 科学出版社, 1-405 |
| 程家骅, 丁峰元, 李圣法, 等, 2005. 东海区大型水母数量分布特征及其与温盐度的关系. 生态学报, 25(3): 440–445, 660 |
| Barz K, Hirche H J, 2007. Abundance, distribution and prey composition of Scyphomedusae in the southern North Sea. Marine Biology, 151(3): 1021–1033 DOI:10.1007/s00227-006-0545-4 |
| Brodeur R D, Sugisaki H, Hunt Jr G L, 2002. Increases in jellyfish biomass in the Bering Sea:implications for the ecosystem. Marine Ecology Progress Series, 233: 89–103 DOI:10.3354/meps233089 |
| Gnaiger E, 1983 Calculation of energetic and biochemical equivalents of respiratory oxygen consumption. In Gnaiger E, Horstner H ed. Polarographic Oxygen Sensors. Springer-Verlag, Berlin, 337-347 |
| Hansson L J, 2006. A method for in situ estimation of prey selectivity and predation rate in large plankton, exemplified with the jellyfish Aurelia aurita (L.). Journal of Experimental Marine Biology and Ecology, 328(1): 113–126 DOI:10.1016/j.jembe.2005.07.002 |
| Hansson L J, Moeslund O, Kiørboe T, et al, 2005. Clearance rates of jellyfish and their potential predation impact on zooplankton and fish larvae in a neritic ecosystem (Limfjorden, Denmark). Marine Ecology Progress Series, 304: 117–131 DOI:10.3354/meps304117 |
| Huo Y Z, Sun S, Zhang F, et al, 2012. Biomass and estimated production properties of size-fractionated zooplankton in the Yellow Sea, China. Journal of Marine Systems, 94: 1–8 DOI:10.1016/j.jmarsys.2011.09.013 |
| Ikeda T, 1985. Metabolic rates of epipelagic marine zooplankton as a function of body mass and temperature. Marine Biology, 85: 1–11 DOI:10.1007/BF00396409 |
| Ikeda T, Motoda S, 1978. Estimated zooplankton production and their ammonia excretion in the Kuroshio and adjacent seas. Fishery Bulletin, 76: 357–367 |
| Kawahara M, Uye S, Ohtsu K, et al, 2006. Unusual population explosion of the giant Jellyfish Nemopilema nomurai (Scyphozoa:Rhizostomeae) in East Asian waters. Marine Ecology Progress Series, 307: 161–173 DOI:10.3354/meps307161 |
| Møller L F, Riisgård H U, 2007. Population dynamics, growth and predation impact of the common jellyfish Aurelia aurita and two hydromedusae, Sarsia tubulosa and Aequorea vitrina, in Limfjorden (Denmark). Marine Ecology Progress Series, 346: 153–165 DOI:10.3354/meps06960 |
| Nielsen A S, Pedersen A W, Riisgård H U, 1997. Implications of density driven currents for interaction between jellyfish (Aurelia aurita) and zooplankton in a Danish fjord. Sarsia, 82(4): 297–305 DOI:10.1080/00364827.1997.10413658 |
| Olesen N J, 1995. Clearance potential of jellyfish Aurelia aurita, and predation impact on zooplankton in a shallow cove. Marine Ecology Progress Series, 124: 63–72 DOI:10.3354/meps124063 |
| Pitt K A, Kingsford M J, Rissik D, et al, 2007. Jellyfish modify the response of planktonic assemblages to nutrient pulses. Marine Ecology Progress Series, 351: 1–13 DOI:10.3354/meps07298 |
| Purcell J E, 1992. Effects of predation by the scyphomedusan Chrysaora quinquecirrha on zooplankton populations in Chesapeake Bay, USA. Marine Ecology Progress Series, 87: 65–76 DOI:10.3354/meps087065 |
| Riisgård H U, Christensen P B, Olesen N J, et al, 1995. Biological structure in a shallow cove (Kertinge Nor, Denmark)-control by benthic nutrient fluxes and suspension-feeding ascidians and jellyfish. Ophelia, 41(1): 329–344 DOI:10.1080/00785236.1995.10422051 |
| Schneider G, 1989. The common jellyfish Aurelia aurita:standing stock, excretion and nutrient regeneration in the Kiel Bight, western Baltic. Marine Biology, 100(4): 507–514 DOI:10.1007/BF00394827 |
| Schneider G, Behrends G, 1994. Population dynamics and the trophic role of Aurelia aurita medusae in the Kiel Bight and western Baltic. Ices Journal of Marine Science, 51(4): 359–367 DOI:10.1006/jmsc.1994.1038 |
| Sun S, Zhang F, Li C L, et al, 2015. Breeding places, population dynamics, and distribution of the giant jellyfish Nemopilema nomurai (Scyphozoa:Rhizostomeae) in the Yellow Sea and the East China Sea. Hydrobiologia, 754(1): 59–74 DOI:10.1007/s10750-015-2266-5 |
| Uye S I, 2008. Blooms of the giant jellyfish Nemopilema nomurai:a threat to the fisheries sustainability of the East Asian Marginal Seas. Plankton and Benthos Research, 3(S1): 125–131 |
| Uye S I, 2011. Human forcing of the copepod-fish-jellyfish triangular trophic relationship. Hydrobiologia, 666(1): 71–83 DOI:10.1007/s10750-010-0208-9 |
| Wang L, Xu K D, 2013. Spatiotemporal distribution of protozooplankton and copepod nauplii in relation to the occurrence of giant jellyfish in the Yellow Sea. Chinese Journal of Oceanology and Limnology, 31(6): 1226–1240 DOI:10.1007/s00343-014-3095-5 |
| Yoon W D, Yang J Y, Shim M B, et al, 2008. Physical processes influencing the occurrence of the giant jellyfish Nemopilema nomurai (Scyphozoa:Rhizostomeae) around Jeju Island, Korea. Journal of Plankton Research, 30(3): 251–260 |
| Zhang F, Sun S, Jin X S, et al, 2012. Associations of large jellyfish distributions with temperature and salinity in the Yellow Sea and East China Sea. Hydrobiologia, 690(1): 81–96 DOI:10.1007/s10750-012-1057-5 |
 2017, Vol. 48
2017, Vol. 48


