中国海洋湖沼学会主办。
文章信息
- 徐勇, 马林, 李新正, 孙悦, 龚琳. 2017.
- XU Yong, MA Lin, LI Xin-Zheng, SUN Yue, GONG Lin. 2017.
- 春季长江口外海底层鱼类群聚特征及其与环境因子的关系
- DEMERSAL FISH ASSEMBLAGE CHARACTERISTICS AND THEIR RELATIONSHIP WITH ENVIRONMENTAL VARIABLES IN THE SEA OFF CHANGJIANG RIVER ESTUARY
- 海洋与湖沼, 48(6): 1383-1391
- Oceanologia et Limnologia Sinica, 48(6): 1383-1391.
- http://dx.doi.org/10.11693/hyhz20170700182
-
文章历史
- 收稿日期:2017-07-07
- 收修改稿日期:2017-09-26
2. 中国科学院大学 北京 100049;
3. 青岛海洋科学与技术国家实验室 海洋生物学与生物技术功能实验室 青岛 266237
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China
长江口外海是指长江口和杭州湾的外侧海域, 有长江口渔场和舟山渔场两大著名渔场(李建生等, 2007)。该海域生态环境复杂, 同时受到长江冲淡水、苏北沿岸流、台湾暖流以及近岸黑潮底层分支的影响(Yang et al, 2012)。受长江径流带来的大量营养盐和有机质的影响, 长江口外海初级生产力高, 饵料生物资源丰富, 是许多生物的产卵、育幼及索饵洄游场所。由于人类工业化活动的加剧和捕捞强度的持续增加, 长江口外海的鱼类资源发生了重大变化, 主要经济种群均处于过度利用状态, 一些非经济种类和利用价值低的幼体比重增加(罗秉征, 1992)。在长江口以北的黄海海域, 鱼类资源优势种从底层鱼类(20世纪50、60年代)变为中上层鱼类(20世纪80年代) (Jin et al, 1996)。
受近岸黑潮底层分支(Yang et al, 2011, 2012)的影响, 在长江口以南的浙江近海, 大型底栖动物(阿氏网采集)表现出明显的空间分布格局, 某些种类如黑潮新鼬鳚(Neobythites sivicola)在黑潮主干流经的台湾东北部海域也被大量发现(Chen et al, 1991; Xu et al, 2017)。虽然针对长江口外海鱼类群聚结构的研究很多, 但这些研究主要是针对渔业资源网捕获的鱼类(Yu et al, 2009; 于海成等, 2010; 张迎秋等, 2013)以及海水表层的鱼类浮游生物(鱼卵和仔稚鱼) (刘淑德等, 2008, 2009; 丁月旻等, 2011; Zhang et al, 2016), 对于长江口外海底层鱼类群聚结构的研究很少。本研究使用大型底栖动物调查中常用的阿氏网, 进行海洋底层鱼类的拖网调查, 研究春季长江口外海底层鱼类群聚结构及其与环境因子的关系, 并探讨近岸黑潮底层分支的影响。
1 材料与方法 1.1 调查方法在长江口外海122°24′—124°00′E、28°30′— 33°00′N范围内共设置17个站位(图 1), 于2015年5月进行底层鱼类阿氏网拖网调查。使用1.5m×0.5m的阿氏网, 最大网目在网口处, 为2cm, 网目大小从网口到囊网递减, 囊网处为0.7cm。拖网时间约15min, 速度2—3节(约4—6km/h)。在每次拖网开始和结束时, 使用GPS进行定位。每个站位拖网采样一次, 样品使用75%酒精保存。在实验室中进行种类鉴定, 计数和称重。物种的中文名和拉丁名的确定参照《中国海洋生物名录》(刘瑞玉, 2008)和WoRMS网站。
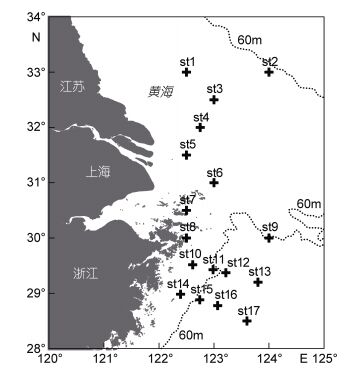 |
| 图 1 长江口外海采样调查站位 Fig. 1 Sampling sites in the sea off Changjiang (Yangtze) River estuary |
各站位同步调查的环境因子包括底层水体的温度、盐度、溶解氧、磷酸盐、铵盐和硝(亚硝)酸盐和深度。其中深度使用声波反射法测定; 温度和盐度使用Sea-Bird CTD测定; 溶解氧使用碘量滴定法测定; 磷酸盐、铵盐和硝(亚硝)酸盐使用QuAAtro营养盐流动分析仪测定。
1.2 数据处理丰度(生物量)的标准化采用以下公式(杨纪明等, 1986):
R= y/(a×q)
式中: R表示丰度(生物量), y表示样本数量(样本重量), a表示拖网的扫海面积; q表示可捕系数, 由于底层鱼类活动能力相对较弱, 多栖息在沉积物表层, 本文可捕系数定为1。
采用相对重要性指数(Index of Relative Importance, IRI)确定群落优势种(Pinkas et al, 1971)。
IRI = (W×100+N×100)×F×100
式中: W为某物种的生物量占总生物量的百分比, N为某物种的丰度占总丰度的百分比, F为某物种出现的站位数占总站位数的百分比。
通过物种数(S)、Margalef丰富度指数(d)、Shannon-Wiener多样性指数(H′)和Pielou均匀度指数(J′)分析底层鱼类多样性(Shannon et al, 1963; Pielou, 1966; Margalef, 1968)。
Margalef丰富度指数: d = (S-1)/lnn,
Shannon-Wiener多样性指数: H′ = -∑ Pi log2 Pi,
Pielou均匀度指数: J′ = H′/lnS,
式中: S为物种数; n为总个体数; Pi为第i种鱼类个体数占总个体数的比例。
应用聚类分析(Cluster)和非参数多维标度排序(Non-metric Multi-dimensional Scaling, NMDS)来分析底层鱼类群聚结构, 通过SIMPROF检验(P<0.05)来划分群组(Clarke et al, 2006)。分析之前, 构建Bray-Curtis相似性矩阵, 物种丰度数据经过四次方根转化。通过相似性分析(ANOSIM)判断不同群组之间差异的显著性。通过相似性百分比分析(SIMPER)确定群组内主要贡献种及群组间主要差异种(Clarke et al, 1994)。使用t检验分析不同区域间多样性指数、丰度和生物量差异的显著性。
使用典型对应分析(Canonical Correspondence Analysis, CCA)研究底层鱼类与环境因子的关系(Ter Braak et al, 2002), 通过Monte-Carlo检验(999次)确定显著影响底层鱼类的环境因子。分析之前, 物种丰度数据经ln(x+1)转化以减小异常值的影响。由于缺少环境资料, 在CCA分析中去除st10、st14和st17站位。
群聚结构分析使用PRIMER 6.0软件, CCA排序使用CANOCO 4.5软件, t检验使用SPSS 16.0软件完成。
2 结果 2.1 种类组成和优势种2015年5月长江口外海共捕获底层鱼类58种, 隶属于12目36科50属。其中鲈形目种类数最多, 包括14科20属21种, 占总种类数的36.2%;鲽形目次之, 5科9属12种; 鲉形目6科7属7种; 其余各目均在3种以下。
IRI计算表明(表 1), 六丝钝尾虾虎鱼(Amblychaeturichthys hexanema)、断线舌鳎(Cynoglossus interruptus)、短吻红舌鳎(Cynoglossus joyneri)和棘头梅童鱼(Collichthys lucidus)是长江口外海的优势种(IRI>500)。其中六丝钝尾虾虎鱼的IRI值远高于其他底层鱼类, 成为优势度最高的优势种。
| 种名 | N% | W% | F% | IRI |
| 六丝钝尾虾虎鱼Amblychaeturichthys hexanema | 57.21 | 20.19 | 82.35 | 6374.30 |
| 断线舌鳎Cynoglossus interruptus | 4.68 | 14.61 | 47.06 | 907.61 |
| 短吻红舌鳎Cynoglossus joyneri | 0.76 | 16.25 | 41.18 | 700.48 |
| 棘头梅童鱼Collichthys lucidus | 16.45 | 1.67 | 29.41 | 533.09 |
| 绿鳍鱼Chelidonichthys kumu | 4.45 | 2.08 | 41.18 | 268.75 |
| 细条天竺鲷Apogon lineatus | 0.51 | 3.92 | 35.29 | 156.14 |
| 短鳄齿鱼Champsodon snyderi | 1.96 | 3.78 | 23.53 | 135.04 |
| 虻鲉Erisphex pottii | 1.32 | 2.91 | 29.41 | 124.46 |
| 细纹狮子鱼Liparis tanakae | 3.19 | 2.68 | 17.65 | 103.69 |
| 多棘腔吻鳕Coelorinchus multispinulosus | 0.93 | 1.74 | 29.41 | 78.54 |
| 注:表中粗体表示优势种 | ||||
对长江口外海底层鱼类丰度-站位矩阵分别进行聚类分析和NMDS排序, 并通过SIMPROF检验(P<0.05)找出群落差异显著的群组。结果发现底层鱼类可划分为3个群组, 分别为近海组、南部中间组和南部远海组(图 2a, b):其中近海组位于调查海域123°E以西, 包括站位st3-8、st10和st14;南部中间组位于调查海域南部60 m等深线附近, 包括站位st11和st15-16;南部远海组位于调查海域南部外海, 包括站位st9和st17。ANOSIM分析表明, 3个群组的总体差异显著(Global R=0.442, P=0.002);两两检验表明, 近海组与南部中间组以及南部外海组之间差异显著(R=0.449, P=0.012;R=0.659, P=0.022), 而南部中间组与南部外海组之间差异不显著(R=0.833, P=0.100)。
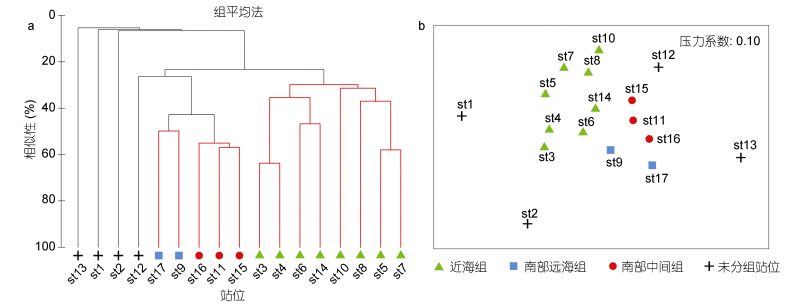 |
| 图 2 长江口外海底层鱼类群聚聚类图(a)和NMDS图(b) Fig. 2 The clustering plot (a) and NMDS plot (b) of demersal fish community in the sea off Changjiang River estuary |
SIMPER分析表明近海组的主要贡献种为六丝钝尾虾虎鱼(贡献率为58.55%)、绿鳍鱼(10.20%)和短吻红舌鳎(9.34%) (表 2); 南部中间组的主要贡献种为六丝钝尾虾虎鱼(贡献率为25.94%)、断线舌鳎(16.97%)和褐斑栉鳞鳎(Aseraggodes kobensis) (13.79%); 南部远海组的主要贡献种为断线舌鳎(贡献率为13.09%)、六丝钝尾虾虎鱼(12.38%)和丝鳍䲗(Repomucenus virgis) (12.38%)。近海组与南部中间组的差异主要由褐斑栉鳞鳎(贡献率为7.20%)、断线舌鳎(6.84%)和棘头梅童鱼(5.91%)的丰度差异引起; 近海组与南部远海组的主要差异物种为丝鳍䲗(贡献率为6.53%)、断线舌鳎(6.20%)和多棘腔吻鳕(Coelorinchus multispinulosus) (5.76%); 南部中间组与南部远海组的主要差异物种为丝鳍䲗(贡献率为6.71%)、六丝钝尾虾虎鱼(5.86%)和五眼斑鲆(Pseudorhombus pentophthalmus) (5.81%)。
| 物种 | 平均丰度 | 贡献率(%) | 累积贡献率(%) | |
| 近海组Inshore group (IG) | 平均相似性: 34.09 | |||
| 六丝钝尾虾虎鱼Amblychaeturichthys hexanema | 84.84 | 58.55 | 58.55 | |
| 绿鳍鱼Chelidonichthys kumu | 7.68 | 10.20 | 68.76 | |
| 短吻红舌鳎Cynoglossus joyneri | 1.77 | 9.34 | 78.09 | |
| 棘头梅童鱼Collichthys lucidus | 43.18 | 8.46 | 86.56 | |
| 南部中间组Southern-middle group (SMG) | 平均相似性: 55.62 | |||
| 六丝钝尾虾虎鱼Amblychaeturichthys hexanema | 55.17 | 25.94 | 25.94 | |
| 断线舌鳎Cynoglossus interruptus | 8.20 | 16.97 | 42.90 | |
| 褐斑栉鳞鳎Aseraggodes kobensis | 4.87 | 13.79 | 56.70 | |
| 细条天竺鲷Apogon lineatus | 1.64 | 11.70 | 68.39 | |
| 短鳄齿鱼Champsodon snyderi | 1.24 | 10.52 | 78.91 | |
| 南部远海组Southern-offshore group (SOG) | 平均相似性: 49.78 | |||
| 断线舌鳎Cynoglossus interruptus | 27.33 | 13.09 | 13.09 | |
| 六丝钝尾虾虎鱼Amblychaeturichthys hexanema | 179.40 | 12.38 | 25.46 | |
| 丝鳍䲗 Repomucenus virgis | 14.77 | 12.38 | 37.84 | |
| 多棘腔吻鳕Coelorinchus multispinulosus | 8.34 | 11.52 | 49.36 | |
| 五眼斑鲆Pseudorhombus pentophthalmus | 3.59 | 10.87 | 60.23 | |
| 双趾鼬鳚Dinematichthys iluocoeteoides | 4.17 | 9.69 | 69.91 | |
| 翼红娘鱼Lepidotrigla alata | 1.91 | 7.68 | 77.60 | |
| 丝刺虎鲉Minous pusillus | 2.28 | 7.68 | 85.28 | |
| 细条天竺鲷Apogon lineatus | 2.56 | 7.36 | 92.64 | |
| IG & SMG | IG | SMG | 平均不相似性: 73.65 | |
| 褐斑栉鳞鳎Aseraggodes kobensis | 0.00 | 4.87 | 7.20 | 7.20 |
| 断线舌鳎Cynoglossus interruptus | 2.33 | 8.20 | 6.84 | 14.04 |
| 棘头梅童鱼Collichthys lucidus | 43.18 | 0.00 | 5.91 | 19.95 |
| 细条天竺鲷Apogon lineatus | 0.00 | 1.64 | 5.65 | 25.59 |
| 短鳄齿鱼Champsodon snyderi | 0.00 | 1.24 | 5.25 | 30.85 |
| SMG & SOG | SMG | SOG | 平均不相似性: 57.30 | |
| 丝鳍䲗 Repomucenus virgis | 0.21 | 14.77 | 6.71 | 6.71 |
| 六丝钝尾虾虎鱼Amblychaeturichthys hexanema | 55.17 | 179.40 | 5.86 | 12.57 |
| 五眼斑鲆Pseudorhombus pentophthalmus | 0.00 | 3.59 | 5.81 | 18.39 |
| 短鳄齿鱼Champsodon snyderi | 1.24 | 18.78 | 5.22 | 23.61 |
| IG & SOG | IG | SOG | 平均不相似性: 79.15 | |
| 丝鳍䲗Repomucenus virgis | 0.00 | 14.77 | 6.53 | 6.53 |
| 断线舌鳎Cynoglossus interruptus | 2.33 | 27.33 | 6.20 | 12.73 |
| 多棘腔吻鳕Coelorinchus multispinulosus | 0.00 | 8.34 | 5.76 | 18.49 |
图 3表示长江口外海底层鱼类多样性、丰度和生物量的空间分布情况。由图可知, 物种数(S)、Margalef丰富度(d)、Shannon-Wiener多样性(H′)和Pielou均匀度(J′)整体上表现出从近海到与远海逐渐增加的趋势(其平均值分别为9、1.61、1.53和0.56)。这种趋势在最南部的调查断面最为明显。S、d和H′的最大值均出现在调查海域最南端的st17站位, 分别为20、3.969和3.194。
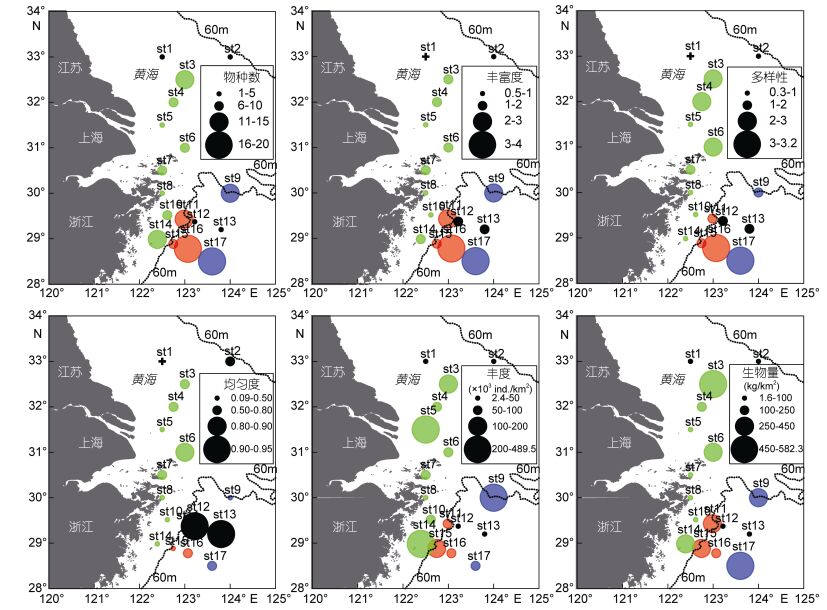 |
| 图 3 长江口外海底层鱼类物种数、Margalef丰富度、Shannon-Wiener多样性、Pielou均匀度、丰度(×103 ind./km2)和生物量(kg/km2) Fig. 3 The species number, Margalef richness, Shannon-Wiener diversity, Pielou evenness, abundance (×103 ind./km2) and biomass (kg/km2) of demersal fish in the sea off Changjiang River estuary 注:绿色:近海组; 红色:南部中间组; 蓝色:南部远海组; 黑色:未划分站位 |
丰度和生物量整体上没有明显的空间分布规律(其平均值分别为123.83×103 ind./km2和189.78kg/ km2), 但是从局部上看, 丰度在调查海域南部两个断面表现出从近海到远海逐渐减少的趋势, 生物量在调查海域中部和北部表现出从近海到远海逐渐增加的趋势。
若将123°E以西划为近海海域, 将123°E及以东划为远海海域, 则H′和J′在远海海域显著高于近海海域(t检验, H′:P=0.015, J′: P=0.004), 而S、d、丰度以及生物量在远海海域和近海海域之间没有显著差异(t检验, S: P=0.288, d: P=0.073, 丰度: P=0.663, 生物量: P=0.208)。
若将30°N以南划为南部海域, 将30°N及以北划为北部海域, 则S、d、H′、J′、丰度以及生物量在南部海域和北部海域均没有显著差异(t检验, S:P=0.298, d: P=0.194, H′: P=0.938, J′:P=0.481, 丰度: P=0.749, 生物量: P=0.881)。
2.4 生物-环境关系对群组内主要贡献种和群组间主要差异种(表 2)组成的丰度-站位矩阵(由于站位st2不含组内主要贡献种和组间主要差异种, 故在该矩阵中去除)进行去趋势对应分析(DCA), 最大梯度长度为4.271SD, 故使用典型对应分析(CCA)来分析底层鱼类与环境因子关系。将所有环境因子与物种数据进行CCA分析, 结果表明CCA前4个轴共解释了物种变异的62.2%以及物种-环境相关性的90.6% (表 3)。Monte-Carlo检验表明, 深度能够显著影响底层鱼类的分布(F=5.02, P<0.01), 其他环境因子不显著。近海组的主要贡献种(绿鳍鱼、短吻红舌鳎和棘头梅童鱼)主要出现在浅水环境中(其他环境因子表现为低温、低盐、高溶解氧、高硝(亚硝)酸盐和高磷酸盐); 南部中间组和南部远海组的主要贡献种(断线舌鳎、褐斑栉鳞鳎、细条天竺鲷、短鳄齿鱼、丝鳍䲗、多棘腔吻鳕、五眼斑鲆、双趾鼬鳚、翼红娘鱼、丝刺虎鲉)主要出现在深水环境中(其他环境因子表现为高温、高盐、低溶解氧、低硝(亚硝)酸盐和低磷酸盐)。底层鱼类群落的优势种六丝钝尾虾虎鱼位于CCA三序图的坐标原点附近, 与其他环境因子的对应关系不强, 几乎不受这些环境因子的影响。
| 项目 | CCA1 | CCA2 | CCA3 | CCA4 | 总惯量 |
| 特征值 | 0.503 | 0.185 | 0.149 | 0.054 | 1.431 |
| 物种-环境相关性 | 0.993 | 0.908 | 0.925 | 0.842 | |
| 物种数据累积解释变异百分比 | 35.1 | 48.0 | 58.4 | 62.2 | |
| 物种-环境相关性累积解释变异百分比 | 51.2 | 70.0 | 85.2 | 90.6 | |
| 所有特征值之和 | 1.431 | ||||
| 所有典型特征值之和 | 0.982 |
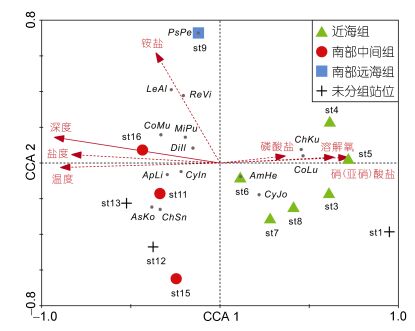 |
| 图 4 底层鱼类与环境因子CCA三序图 Fig. 4 CCA triplot of demersal fish and environmental factors 注: AmHe: Amblychaeturichthys hexanema六丝钝尾虾虎鱼; ApLi: Apogon lineatus细条天竺鲷; AsKo: Aseraggodes kobensis褐斑栉鳞鳎; ReVi: Repomucenus virgis丝鳍䲗; ChSn: Champsodon snyderi短鳄齿鱼; ChKu: Chelidonichthys kumu绿鳍鱼; CoMu: Coelorinchus multispinulosus多棘腔吻鳕; CoLu: Collichthys lucidus棘头梅童鱼; CyIn: Cynoglossus interruptus断线舌鳎; CyJo: Cynoglossus joyneri短吻红舌鳎; DiIl: Dinematichthys iluocoeteoides双趾鼬鳚; LeAl: Lepidotrigla alata翼红娘鱼; MiPu: Minous pusillus丝刺虎鲉; PsPe: Pseudorhombus pentophthalmus五眼斑鲆 |
本研究使用阿氏网进行调查, 发现2015年春季长江口外海共捕获底层鱼类58种, 捕获的鱼类总物种数与2011年春季和夏季该海域南部阿氏网拖网调查捕获的鱼类总物种数相等(Xu et al, 2017), 略低于2008年夏季东海北部(大部分调查站位所在海域与本研究重叠, 调查范围26°30′—30°30′N, 121°00′— 126°00′E)底层桁拖网(宽4.7m, 高0.28m, 网眼大小15×15mm2, 外形与阿氏网较为相似)调查获得的鱼类总物种数(71种) (Chang et al, 2012)。本研究发现六丝钝尾虾虎鱼是长江口外海优势度最高的底层鱼类, 与Chang等(2012)的研究结果一致。在邻近长江口外海的南黄海海域, 研究人员发现一些具有重要经济价值的底层鱼类, 其资源量随着捕捞压力增加逐渐减少, 在底层拖网中很难被捕到(Xu et al, 2005)。随着经济种类的衰退, 体型较小的六丝钝尾虾虎鱼得到发展, 常出现在渔业资源网的拖网调查中(陈华等, 2009; 俞存根等, 2010)。
3.2 群聚结构春季东海大陆架的底层鱼类群聚结构研究将鱼类划分3个群聚类型, 其中在长江口外海存在2个群聚类型, 其空间分布与本研究底层鱼类群聚结构的空间分布较为一致(图 2, 图 3):在长江口外海北部和南部近海为同一群聚类型, 在南部外海其物种组成与北部和南部近海差异较大, 为另一群聚类型(李圣法等, 2007)。在本研究中, 虽然将南部60m以深海域划分为南部中间组和南部远海组2个群聚类型, 但是这2者之间的相似性比较接近, 且都与近海组有较大差异(图 2)。在其他大部分鱼类群聚结构的研究中, 由于调查时间、调查范围以及数据分析方法的差异, 无法与本研究中群聚结构结果进行直接比较(Yu et al, 2009; 俞存根等, 2010; 张迎秋等, 2013)。本研究最南端断面(站位st14—st17)随着深度和离岸距离的增加, 底层鱼类群聚类型发生更替, 依次为近海组、南部中间组和南部远海组。Xu等(2017)在研究2011年春季该海域大型底栖动物(阿氏网拖网捕获)的群落结构时, 发现大型底栖动物群落类型也随着深度和离岸距离的增加而发生变化, 依次为近海群落、过渡群落和远海群落, 其空间分布与本研究最南端断面底层鱼类3个群聚类型的空间分布一致。
本研究中不同群聚的主要贡献种不同, 南部中间组和南部远海组的贡献种短鳄齿鱼和多棘腔吻鳕都是典型的外海种类。稀有种黑潮新鼬鳚被认为可能作为黑潮入侵东海的指示种(Xu et al, 2017)。该物种在本次调查中仅出现于站位st11, 位于60m等深线附近, 而60m等深线是近岸黑潮底层分支入侵东海的主要路径(Yang et al, 2011, 2012; Wang et al, 2016)。因此黑潮新鼬鳚可能指示黑潮入侵东海的路径。
3.3 多样性在东海北部, Chang等(2012)分析了底层鱼类群落的Margalef丰富度(d)、Shannon-Wiener多样性(H′)和Pielou均匀度(J′), 其中与本研究调查海域南部重叠部分的平均值分别为2.96、1.63和0.55, 其d值和H′值高于本研究中底层鱼类的d值(1.61)和H′值(1.53), 而J′值略低于本研究中底层鱼类的J′值(0.56)。在调查海域南部, 底层鱼类多样性(d、H′和J′)表现出从近海到远海逐渐增加的趋势。这与大型底栖动物多样性在东海的空间分布趋势一致, 距离黑潮主干区越近, 多样性越高(刘瑞玉等, 1986)。
3.4 生物-环境关系深度是影响海洋生物分布的重要环境因子之一。研究人员发现, 深度能够显著影响墨西哥湾北部底层鱼类群落的分布(Wei et al, 2012), 影响新西兰大陆坡海域底层鱼类的群落结构和多样性(Zintzen et al, 2012)。本研究发现深度是显著影响长江口外海底层鱼类的环境因子。在深水环境中, 短鳄齿鱼、丝鳍䲗、多棘腔吻鳕、黑潮新鼬鳚等东海外海种类较多, 它们适应黑潮水高温高盐低溶解氧的环境特点(图 5), 在台湾东北部海域也有大量分布(沈世杰, 1993)。有研究表明东海区短鳄齿鱼适宜的水深范围为70—110m, 温度17—23℃, 盐度34.3—35.2, 主要分布区为28°00′—30°00′N、123°00′—126°30′E (沈伟等, 2008)。东海盐度>34.2的底层水被认为源自入侵东海的黑潮次表层水, 而台湾海峡北部的盐度<34.2 (Yang et al, 2011)。因此短鳄齿鱼等东海外海种类的分布很可能受黑潮入侵东海的强度和范围的影响。绿鳍鱼、短吻红舌鳎和棘头梅童鱼等主要出现于浅海, 适应低温低盐高溶解氧的环境(图 5)。六丝钝尾虾虎鱼几乎不受所调查的环境因子的影响, 分布于整个调查海域, 并且成为各群组及整个底层鱼类群落的优势种, 这可能是由于过度捕捞导致底层经济鱼类资源衰退, 体型较小的六丝钝尾虾虎鱼因此得到发展。
4 结论通过对2015年5月长江口外海底层鱼类的阿氏网拖网调查资料分析, 共鉴定底层鱼类58种。IRI结果表明六丝钝尾虾虎鱼是优势度最高的物种。聚类分析将底层鱼类群落划分为3个群组—近海组、南部中间组和南部外海组, 不同群组之间物种组成差异显著。南部中间组和南部外海组的物种多为东海外海种类, 适应高温高盐低溶解氧的深水环境, 其分布范围受黑潮入侵强度的影响。近海组的物种为近海常见种, 适应低温低盐高溶解氧的浅水环境。六丝钝尾虾虎鱼受环境因子影响较小, 渔业资源衰退可能是其得到发展的主要原因。
致谢 中国科学院海洋研究所于非研究员提供CTD数据, 宋秀贤研究员提供营养盐和溶解氧数据, 窦硕增研究员对本文提出宝贵意见。王金宝、董栋、寇琦、隋吉星、甘志彬、王跃云、王亚琴等参加或部分参加了本研究的野外考察、实验室样品鉴定和处理、数据分析工作, 谨致谢忱。| 丁月旻, 线薇微, 2011. 秋季长江口鱼类浮游生物群落时空结构. 中国海洋大学学报, 41(10): 67–74 |
| 于海成, 线薇微, 2010. 1998-2001年长江口近海鱼类群聚结构及其与环境因子的关系. 长江科学院院报, 27(10): 88–92 DOI:10.3969/j.issn.1001-5485.2010.10.018 |
| 刘淑德, 线薇微, 2009. 长江口及其邻近水域鱼类浮游生物群落的时空格局. 生物多样性, 17(2): 151–159 |
| 刘淑德, 线薇微, 刘栋, 2008. 春季长江口及其邻近海域鱼类浮游生物群落特征. 应用生态学报, 19(10): 2284–2292 |
| 刘瑞玉, 2008. 中国海洋生物名录. 北京: 科学出版社, 1-1267 |
| 刘瑞玉, 崔玉珩, 徐凤山, 等, 1986. 黄海、东海底栖生物的生态特点. 海洋科学集刊, 27: 153–173 |
| 李圣法, 程家骅, 严利平, 2007. 东海大陆架鱼类群落的空间结构. 生态学报, 27(11): 4377–4386 DOI:10.3321/j.issn:1000-0933.2007.11.001 |
| 李建生, 李圣法, 丁峰元, 等, 2007. 长江口近海鱼类多样性的年际变化. 中国水产科学, 14(4): 637–643 |
| 杨纪明, 杨伟祥, 郭如新, 等, 1986. 1983年夏季渤海上层鱼类生物量的估计. 海洋科学, 10(1): 63 |
| 沈伟, 程家骅, 2008. 东海区短鳄齿鱼数量分布及其与环境因子的关系. 海洋渔业, 30(4): 319–326 |
| 沈世杰, 1993. 台湾鱼类志. 台北: 国立台湾大学动物学系, 1-955 |
| 张迎秋, 线薇微, 李文龙, 2013. 2004和2007年春季长江口近海鱼类群落特征及其与环境因子的关系. 中国海洋大学学报, 43(9): 67–74 |
| 陈华, 徐兆礼, 2009. 舟山渔场衢山岛海域春夏季鱼类数量变化. 海洋渔业, 31(2): 179–185 |
| 罗秉征, 1992. 河口及近海的生态特点与渔业资源. 长江流域资源与环境, 1(1): 24–30 |
| 俞存根, 陈全震, 陈小庆, 等, 2010. 舟山渔场及邻近海域鱼类种类组成和数量分布. 海洋与湖沼, 41(3): 410–417 DOI:10.11693/hyhz201003018018 |
| Chang N N, Shiao J C, Gong G C, 2012. Diversity of demersal fish in the East China Sea:implication of eutrophication and fishery. Continental Shelf Research, 47: 42–54 DOI:10.1016/j.csr.2012.06.011 |
| Chen L J, Shao K T, 1991. A review of the families ophidiidae and bythitidae from Taiwan. Bulletin of the Institute of Zoology Academia Sinica, 30(1): 9–18 |
| Clarke K R, Gorley R N, 2006. PRIMER v6:User Manual/Tutorial. Plymouth:PRIMER-E |
| Clarke K R, Warwick R M, 1994. Change in Marine Communities:An Approach to Statistical Analysis and Interpretation. Plymouth:Plymouth Marine Laboratory |
| Jin X S, Tang Q S, 1996. Changes in fish species diversity and dominant species composition in the Yellow Sea. Fisheries Research, 26(3-4): 337–352 DOI:10.1016/0165-7836(95)00422-X |
| Margalef R, 1968. Perspectives in Ecological Theory. Chicago, USA: University of Chicago Press, 1-111 |
| Pielou E C, 1966. Species-diversity and pattern-diversity in the study of ecological succession. Journal of Theoretical Biology, 10(2): 370–383 DOI:10.1016/0022-5193(66)90133-0 |
| Pinkas L, Oliphant M S, Iverson I L K, 1971. Food habits of albacore, bluefin tuna, and bonito in California waters. California Department of Fish and Game Fish Bulletin,(152): 1–105 |
| Shannon C E, Weaver W, 1963. The Mathematical Theory of Communication. Urbana, USA: University of Illinois Press, 1-117 |
| Ter Braak C F J, Šmilauer P, 2002. CANOCO Reference Manual and CanoDraw for Windows User's Guide:Software for Canonical Community Ordination (version 4.5). Ithaca, NY:Microcomputer Power |
| Wang W T, Yu Z M, Song X X, et al, 2016. The effect of Kuroshio Current on nitrate dynamics in the southern East China Sea revealed by nitrate isotopic composition. Journal of Geophysical Research:Oceans, 121(9): 7073–7087 DOI:10.1002/2016JC011882 |
| Wei C L, Rowe G T, Haedrich R L, et al, 2012. Long-term observations of epibenthic fish zonation in the Deep Northern Gulf of Mexico. PLoS One, 7(10): e46707 DOI:10.1371/journal.pone.0046707 |
| Xu B D, Jin X S, 2005. Variations in fish community structure during winter in the southern Yellow Sea over the period 1985-2002. Fisheries Research, 71(1): 79–91 DOI:10.1016/j.fishres.2004.07.011 |
| Xu Y, Li X Z, Ma L, et al, 2017. Seasonal and spatial variations of macro-and megabenthic community characteristics in two sections in the East China Sea. Chinese Journal of Oceanology and Limnology, 35(5): 1152–1164 DOI:10.1007/s00343-017-6085-6 |
| Yang D Z, Yin B S, Liu Z L, et al, 2011. Numerical study of the ocean circulation on the East China Sea shelf and a Kuroshio bottom branch northeast of Taiwan in summer. Journal of Geophysical Research:Oceans, 116(C5): C05015 |
| Yang D Z, Yin B S, Liu Z L, et al, 2012. Numerical study on the pattern and origins of Kuroshio branches in the bottom water of southern East China Sea in summer. Journal of Geophysical Research:Oceans, 117(C2): C02014 |
| Yu H C, Xian W W, 2009. The environment effect on fish assemblage structure in waters adjacent to the Changjiang (Yangtze) River estuary (1998-2001). Chinese Journal of Oceanology and Limnology, 27(3): 443–456 DOI:10.1007/s00343-009-9155-6 |
| Zhang H, Xian W W, Liu S D, 2016. Autumn ichthyoplankton assemblage in the Yangtze Estuary shaped by environmental factors. Peerj, 4:e1922 |
| Zintzen V, Anderson M J, Roberts C D, et al, 2012. Diversity and composition of demersal fishes along a depth gradient assessed by baited remote underwater stereo-video. PLoS One, 7(10): e48522 DOI:10.1371/journal.pone.0048522 |
 2017, Vol. 48
2017, Vol. 48


