
中国海洋湖沼学会主办。
文章信息
- 胡俊, 龚成, 夏纬, 池仕运, 陈明秀, 李嗣新. 2018.
- HU Jun, GONG Cheng, XIA Wei, CHI Shi-Yun, CHEN Ming-Xiu, LI Si-Xin. 2018.
- 天鹅洲长江段浮游植物群落季节演替及环境因子研究
- STUDY ON PHYTOPLANKTON COMMUNITY STRUCTURE AND ITS RELATIONSHIP WITH ENVIRONMENTAL FACTORS IN TIAN'E SECTION, CHANGJIANG RIVER
- 海洋与湖沼, 49(1): 70-77
- Oceanologia et Limnologia Sinica, 49(1): 70-77.
- http://dx.doi.org/10.11693/hyhz20170400093
-
文章历史
- 收稿日期:2017-04-12
- 收修改稿日期:2017-06-02
2. 湖北长江天鹅洲白鱀豚国家级自然保护区管理处 石首 434400;
3. 长江航道局 武汉 430060
2. Baiji National Nature Reserve Management Office of Xintankou-Luoshan of the Yangtze River in Hubei Section, Shishou 434400, China;
3. Changjiang Waterway Bureau, Wuhan 430060, China
长江是中国第一大河, 也是世界上保存比较完整的大流域性生态系统。在河流水生生物中, 浮游植物由于其个体小、细胞结构简单等特点, 对水质环境的变化极为敏感, 其种类组成和分布对环境变化具有指示作用, 而环境条件的变化也能直接或间接地影响浮游植物的群落结构(Lepistö et al, 2004; Rodrigues et al, 2015)。因此, 研究长江干流的浮游植物具有重要意义。
近年来, 有关长江浮游植物分布特征的研究受到了越来越多的生态学家关注。不过有关长江浮游植物群落的研究多集中于长江三峡和河口地区(张远等, 2006; 栾青杉等, 2007; 王越等, 2011; 王江涛, 2012; 李俊龙等, 2013; 张磊等, 2015), 对长江干流荆江段的研究较少。荆江河段位处于长江中游, 属于典型的蜿蜒型冲积平原河流, 河床演变剧烈, 河流景观类型多样, 尤其是下荆江属蜿蜒型河段, 自由河曲极为发育, 生态意义突出(王越等, 2011; 薛兴华等, 2012)。
本研究选择湖北石首附近急弯形长江河段(89km)为研究对象, 采用多元统计的方法, 研究该河段浮游动植物群落结构季节变化, 并采用多元统计方法探讨环境因子在浮游植物群落季节演替中的作用。此外, 该河段也属于长江天鹅洲白鱀豚国家级自然保护区长江段, 该区域生态环境的好坏直接关系到生活其中的保护动物如白鱀豚和江豚等栖息环境, 为此本研究也为该区域生态系统保护与研究工作提供基础资料和科学依据。
1 材料与方法 1.1 调查断面项目组对调查河段进行了四次采样(图 1), 分别为2014年10月(秋季)、2015年1月(冬季)、2015年5月(春季)和2015年7月(夏季)。
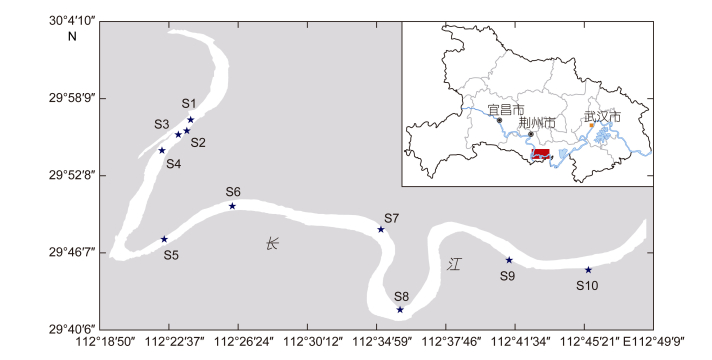 |
| 图 1 采样点位置示意图 Fig. 1 The study area and sampling sites |
浮游植物定性样品用25号浮游生物网在表层水0.5m处以20—30cm/s的速度做“8”字形缓慢拖动5—10min, 待水滤去后, 打开阀门将浮游生物倒入贴有标签的标本瓶中。定量样品采用2.5L采水器于0、2、4m水深处等量取水后, 充分混合采集1.5L混合水样。所有样品现场加鲁哥氏液进行固定。样品带回实验室后采取视野法计数并鉴定种类, 并用细胞体积法推算生物量(章宗涉等, 1991; 胡鸿钧等, 2006)。
| 组成 | 蓝藻门 | 金藻门 | 硅藻门 | 甲藻门 | 裸藻门 | 绿藻门 | 隐藻门 | 合计 |
| 种 | 12 | 3 | 58 | 4 | 2 | 22 | 3 | 104 |
| 百分比(%) | 11.54 | 2.88 | 55.77 | 3.85 | 1.92 | 21.15 | 2.88 | 100.00 |
水温、pH、电导率、氧化还原电位(ORP)、溶解氧(DO)、总溶解性固体(TDS)等指标使用便携式多参数水质分析仪(YSI plus)原位检测。浮游植物定量样品采集获取的混合水样, 除浮游植物定量分析外, 部分水样酸化后带回实验室采用相应的标准方法分析总氮(TN)、总磷(TP)、氨氮、硝态氮、高锰酸钾盐指数(CODMn)等指标, 剩余部分现场抽滤(Whatman GF/C)后, 采用便携式冷冻冰箱带回实验室检测叶绿素a (chl a)。具体分析按照《水和废水监测分析方法(第四版)》(国家环境保护总局, 2002)进行。
1.3 数据分析 1.3.1 优势度分析浮游植物优势种根据每个种的优势度值(Y)来确定:
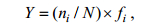
式中, ni为第i种的个体数, N为所有种类总个体数, fi为出现频率。Y值大于0.02种类为优势种。
1.3.2 多样性分析调查河段的多样性(β多样性)使用修正的Whittaker指数(Harrison et al, 1992)来表示:

式中, S表示总物种数; α是各采样点平均物种个数; n是采样点个数。β多样性结果从0(每个样本的种完全相同)到100(每个样本各有独一无二的种)。
1.3.3 统计分析本研究分别采用浮游植物种类数据和现存量数据与环境因子进行直接梯度分析(direct gradient analysis), 以期从浮游植物数量和质量等不同角度研究浮游植物群落特征结构与环境因子的联系。其中, 浮游植物种类组成采用浮游植物种类数据, 现存量则同时采用基于个体数量的密度数据(cell/L)和基于质量的生物量数据(mg/L)。环境因子则采用水质数据。
由于浮游植物种类组成为0—1数据类型, 且基于浮游植物密度和生物量的趋势对应分析(detrended correspondence analysis, DCA)中第1轴长大小为3.2, 所以根据数据类型及DCA分析中第1轴的大小(Šmilauer et al, 2014), 本研究采用基于单峰模型的典范对应分析(canonical correspondence analysis, CCA)进行排序。CCA是一种直接梯度分析方法, 可以结合多个环境因子一起分析从而更好地反映群落与环境的关系。具体分析过程中, 浮游植物现存量数据进行对数化处理(Šmilauer et al, 2014)。环境因子全部导入排序后, 首先手动剔除方差膨胀因子(variance inflation factor, VIF)大于10的环境变量, 确保剩余环境因子变量VIFE<10后(Allison, 1998)后, 再保留蒙特卡罗置换检验(Monte Carlo Permutation)检验有效的环境变量(P<0.05)。
排序分析采用Canoco 5.0软件完成。其他分析及绘图则采用office 365完成。
2 结果 2.1 种类组成特征本研究4次采样共检出浮游植物104种, 其中硅藻门58种, 甲藻门4种, 金藻门3种, 蓝藻门11种, 裸藻门2种, 绿藻门23种, 隐藻门3种(表 1)。年度出现频次超过50%的主要是:硅藻门10种, 分别为变异直链藻(Melosira varians)、奇异杆状藻(Bacillaria paradoxa)、小环藻(Cyclotella sp.)、尖针杆藻(Synedra acus)、曲壳藻(Achnanthes sp.)、美丽星杆藻(Asterionella Formosa)、肘状脆杆藻(Fragilaria ulna)、颗粒直链藻最窄变种螺旋变形(Melosira granulata var. angustissima f. spiralis)、谷皮菱形藻(Nitzschia palea)、颗粒直链最窄变种藻(Aulacoseira grannulata var. angustissima); 蓝藻门的小席藻(Phormidium tenue)、色球藻(Chroococcus sp.); 隐藻门的卵形隐藻(Cryptomonas ovata)和尖尾蓝隐藻(Chroomonas acuta)。
浮游植物无论种类, 还是出现频次均以硅藻门种类为首, 其次是绿藻门和蓝藻门种类。不过隐藻门种类虽只有3种, 但是其中有两种出现频次均超过了50%, 也属出现频次较高的门类。这与优势度分析结果类似, 即春季主要是隐藻门浮游植物, 夏季则是硅藻和隐藻, 秋季则是绿藻, 冬季则以硅藻为主(表 2)。进一步从物种多样性来看, 秋季调查河段物种多样性最高, 而冬季最低(表 2), 这也表明夏秋换季时, 浮游植物种类变化明显。
| 季节 | 优势度超过0.2的种类 | β多样性 |
| 春季 | 尖尾蓝隐藻 Chroomonas acuta (0.38) | 42.64 |
| 夏季 | 颗粒直链最窄变种藻 Aulacoseira grannulata var. angustissima (0.29)、卵形隐藻 Cryptomonas ovate (0.24) | 50.03 |
| 秋季 | 多形丝藻 Ulothrix variabilis (0.28) | 52.73 |
| 冬季 | 颗粒直链最窄变种藻 Aulacoseira grannulata var. angustissima (0.34)、小环藻 Cyclotella sp. (0.32) | 33.85 |
调查河段四次采样点的浮游植物细胞密度变动范围在1.93×105—9.12×106cell/L之间, 平均值为2.18×106cell/L; 生物量变动范围在0.12—5.31mg/L之间, 平均值为2.00mg/L。浮游植物细胞密度与生物量的四次采样的基本情况见表 3。从表中可以看到春季浮游植物密度最高, 是秋季浮游植物密度的5倍; 而生物量也是春季最高, 但是和第二位的夏季浮游植物生物量相差不大。
| 季节 | 最大值 | 最小值 | 平均值 | |||||
| 密度(×106cell/L) | 生物量(mg/L) | 密度(×106cell/L) | 生物量(mg/L) | 密度(×106cell/L) | 生物量(mg/L) | |||
| 春 | 9.12 | 5.23 | 2.45 | 1.73 | 4.16 | 2.95 | ||
| 夏 | 3.44 | 5.31 | 0.96 | 1.74 | 1.94 | 2.86 | ||
| 秋 | 1.28 | 2.52 | 0.19 | 0.12 | 0.80 | 0.56 | ||
| 冬 | 2.41 | 2.48 | 1.56 | 1.36 | 1.83 | 1.63 | ||
从浮游植物密度组成来看(图 2), 浮游植物密度组成年平均中硅藻比例最高, 其次是隐藻和蓝藻, 三者合计占90%以上。从季节来看, 春季主要是隐藻和蓝藻, 分别占47.31%和33.92%;秋季则主要是硅藻、绿藻和蓝藻, 分别占比为32.56%、32.89%、30.48%, 三者相差不大; 冬季和夏季硅藻密度最高, 均超过了50%, 隐藻位居其后。
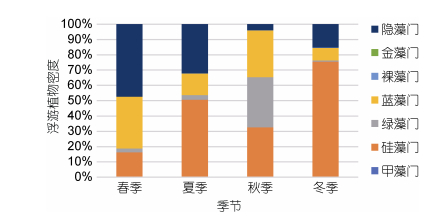 |
| 图 2 各季节浮游植物密度组成 Fig. 2 The proportion of phytoplankton densities in four seasons |
从浮游植物生物量组成来看(图 3), 则以硅藻、隐藻为主, 两者合计占了94%以上。从四季来看, 除了秋季绿藻门能占到24.14%外, 其余季节均以硅藻门和隐藻门为主。其中春、夏季隐藻门占了52.66%和72.72%。秋、冬季则是硅藻门占了65.25%和79.86%。
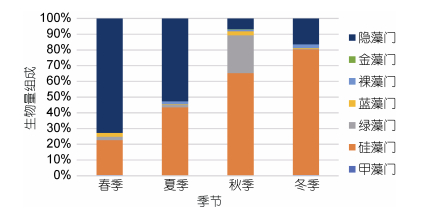 |
| 图 3 浮游植物各季节生物量组成 Fig. 3 The proportion of biomass in four seasons |
CCA分析的基本统计信息见表 4。结果显示采用物种/密度/生物量~环境因子以及站位~环境因子关系的双序图表示(图 4, 5)。图中环境因子用带有箭头的线段表示, 向量长短表示其在主轴中的作用, 线段所处象限代表环境因子与排序轴间的正负关系。
| 统计特征值 | 排序轴1 | 排序轴2 | 排序轴3 | 排序轴4 | |
| 物种数据 | 特征值 | 0.2654 | 0.1958 | 0.1670 | 0.1181 |
| 物种-环境数据累积解释率 | 20.33 | 35.34 | 48.13 | 57.18 | |
| 生物密度 | 特征值 | 0.3405 | 0.2334 | 0.1578 | 0.1184 |
| 密度-环境数据累积解释率 | 30.73 | 51.80 | 66.04 | 76.72 | |
| 生物量数据 | 特征值 | 0.3438 | 0.2305 | 0.1578 | 0.1190 |
| 生物量-环境数据累积解释率 | 31.17 | 52.06 | 66.37 | 77.16 |
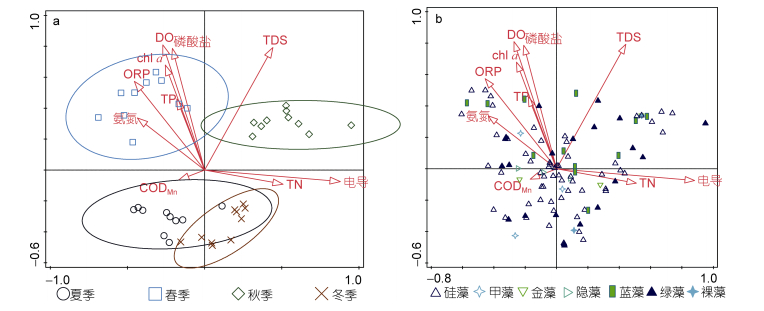 |
| 图 4 浮游植物物种数据CCA双序图 Fig. 4 The bioplot based on the phytoplankton species 注: a:站位~环境因子; b:种类~环境因子; ORP:氧化还原电位; DO:溶解氧; TDS:总溶解性固体; TN:总氮; TP:总磷; CODMn:高锰酸钾盐指数; chl a:叶绿素a |
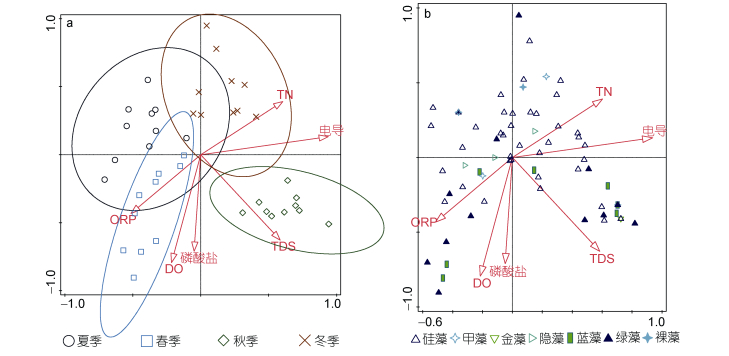 |
| 图 5 基于浮游植物密度的CCA双序图 Fig. 5 The bioplot based on the phytoplankton density 注: a:站位~环境因子(密度); b:种类~环境因子(密度) |
物种数据的CCA排序图显示第1轴(横轴)主要与电导、TN呈正相关, 而与氨氮、ORP等呈负相关, 第2轴则主要与磷酸盐、叶绿素a、TP呈正相关。春、夏、秋、冬四季各站点分别位于第2、第3、第1与第4象限, 空间位置上完全区分开来(图 4)。
现存量数据排序图则显示TN、电导与第1轴正相关, 第2轴主要与磷酸盐相关性较好, 不同季节采样点在四个象限的分布类似, 都是春、夏、秋、冬分别位于第3、第2、第1和第4象限(图 5, 6)。
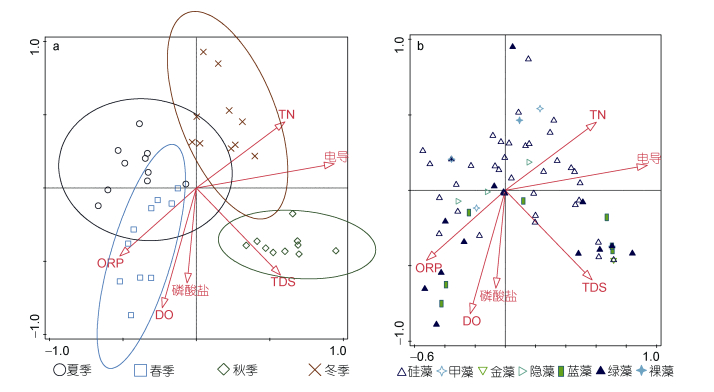 |
| 图 6 基于浮游植物生物量的CCA双序图 Fig. 6 The bioplot based on the phytoplankton biomass 注: a:站位~环境因子(生物量); b:种类~环境因子(生物量) |
物种数据和现存量数据的CCA分析均显示不同调查时段的采样点在排序图中被完全区分开来, 表明不同季节的浮游植物群落结构差异明显。物种数据CCA分析和现存量数据CCA分析结果显示的四季对应象限并不相同, 不过比较对应优势种类, 可以看到两者规律类似。图 4(物种数据)中硅藻主要集中于横轴下方第3和第4象限内, 即主要出现于冬季与夏季, 而蓝藻则更多地集中于横轴上方第1和第2象限内, 主要出现于春秋两季, 另一主要门类绿藻的分布则相对均匀; 而图 5、图 6(密度和生物量)则显示硅藻主要出现于横轴上方, 但也同样对应于夏、冬两季, 而相应地绿藻和蓝藻则主要分布于横轴下方, 即对应于春、秋两季。结果表明, 物种数据和现存量数据均显示在干流春、秋两季蓝绿藻占优, 而硅藻则主要夏冬两季占优。进一步分析环境因子, 也可以看到图 4中春季水体浮游植物现存量主要受磷酸盐、氨氮、DO、chl a的影响, 而冬季则是TN影响更为突出, 并且水体中氮、磷营养水平对夏季和冬季影响都不大。
不同类型的水体浮游植物群落结构具有不同的特征(Bellinger et al, 2015; 胡俊等, 2016, 2017)。浮游植物作为水生态系统的重要组成部分, 其种类组成、数量分布及丰度通常呈季节性变化(吴洁等, 2001)。例如, 在没有人为污染的自然淡水水体中, 浮游植物季节性变化的一般规律是:春、秋季以喜低温的硅藻、金藻为主; 夏季以喜高温的蓝藻、绿藻为主; 冬季浮游植物种类和数量都很少, 浮游植物群落的季节演替是从冬、春季硅藻到夏、秋季绿、蓝藻大量繁殖再到冬季的硅藻(Temponeras et al, 2000; Wang et al, 2007; 陈家长等, 2009)。中营养型湖泊常以甲藻、隐藻和硅藻类占优势, 富营养型湖泊则常以绿藻和蓝藻类占优势(马健荣等, 2013)。本研究中, 春季水体中较高的磷酸盐、氨氮以及光照, 都是有助于蓝藻生长的因素, 表明春季蓝藻的大量增殖是受到了营养因子的促进作用, 符合通常的浮游植物季节演替规律。同期间河段中浮游植物密度最高的是隐藻, 虽然隐藻在营养较高的水体中也容易出现(Bellinger et al, 2015), 不过主要出现在横轴附近(图 5, 6), 表明其受到营养水平影响很小。冬季, 则主要是TN含量和电导率较高(图 4, 5), TN也反映了水体营养水平, 不过一般而言, 浮游植物主要吸收的是氨氮形式的氮元素, 较高电导表明水体可溶性离子含量较高。事实上, 大多数水华硅藻的生长最适温度低于蓝绿藻(Reynolds, 2006), 所以冬季低温时硅藻无论数量或是种类均显著占优。
另外值得关注的是调查河段夏季浮游植物中以硅藻为主, 并非以蓝绿藻为主, 这可能与该河段营养水平总体较低有关, 本次调查TP平均值约为0.15mg/L, 介于Ⅱ类Ⅲ类之间。浮游植物没有或仅有微弱的运动能力, 主要是随波漂流, 调查河段作为下荆江的一部分, 属于长江中下游河流相对湍急的河段。河流的流速、水量等水文情势必然对浮游植物的组成起着重要作用(Soballe et al, 1987; 朱英等, 2008; 张怡等, 2012)。本研究中, 由于缺乏水文数据并未能将其纳入CCA的分析当中。事实上, 在CCA分析中物种/现存量~环境因子解释率为57%—77% (表5), 说明还有其他的环境因子对浮游植物群落存在影响。已有研究发现长江干流浮游植物与营养盐无显著的相关性, 更多可能是水文条件起了重要作用(曾辉, 2006)。调查河段最高水位出现在6—9月间, 受季风、梅雨影响以及洞庭湖出口来水顶托, 其水位变幅较大。最低水位一般出现在2—3月份, 水位变化幅度较小。径流量各月分布不均匀, 每年4月进入汛期, 到10月结束, 该时段水量较为充沛。夏季处于汛期, 属于水位最高时期。期间虽然光照充足, 但水流速度加快, 水体混合相对剧烈, 且水体浑浊, 削弱了蓝藻对硅藻的光竞争优势, 反而有利于喜流水性、耐混浊的硅藻生长(Huisman et al, 1999, 李世健等, 2012, Bellinger et al, 2015)。
此外, 秋季处于夏冬季之间, 本研究中秋季浮游植物密度和现存量均低于其他季节。考虑到本次秋季采样为10月份, 冬季采样为1月, 分别处于丰水期和枯水期, 故秋季浮游植物现存量低于冬季可能是由于不同水期江段水体容积量变小, 对水体中浮游植物等水生生物产生浓缩现象, 由此导致了全江段枯水期的浮游植物密度远大于丰水期的密度, 长江其他江段也有类似现象报道(陈校辉等, 2006)。因此, 水文情势可能对干流浮游植物群落起了重要作用(Naselli-Flores, 2000; 孙静等, 2015)。
4 结论此次调查显示长江天鹅洲白鱀豚国家级自然保护区长江段浮游植物共7门104种, 种类组成以硅藻、绿藻和蓝藻为主, 优势种多为硅藻、隐藻和绿藻。全年来看, 硅藻和隐藻现存量均占优, 但春秋季时蓝藻门浮游植物密度突出。CCA分析显示该河段浮游植物季节演替明显, 但各季节主要浮游植物种类变化具有自身特点, 即春秋两季蓝藻门浮游植物密度较高, 而冬夏季硅藻为主, 进一步分析显示这种特征除了与水质因子有关外, 该河段的水文情势也起了重要作用, 还有待深入研究。
总之, 通过这次调查有助于更好地了解荆江河段的浮游植物群落结构特征, 也为开展该区域的生态环境演变分析提供了重要的科学数据支撑。
| 马健荣, 邓建明, 秦伯强, 等, 2013. 湖泊蓝藻水华发生机理研究进展. 生态学报, 33(10): 3020–3030 |
| 王越, 丁艳荣, 范北林, 2011. 三峡工程蓄水后荆江河段河势变化及生态护岸研究. 长江流域资源与环境, 20(S1): 117–122 |
| 王江涛, 曹婧, 2012. 长江口海域近50a来营养盐的变化及其对浮游植物群落演替的影响. 海洋环境科学, 31(3): 310–315 |
| 孙静, 甄毓, 米铁柱, 2015. 长江干流浮游植物群落结构的DGGE分析. 中国海洋大学学报, 45(10): 96–102 |
| 朱英, 顾詠洁, 王耘, 等, 2008. 苏州河水文条件变化对浮游植物群落的影响. 华东师范大学学报(自然科学版), 106(2): 30–36, 106 |
| 吴洁, 虞左明, 2001. 西湖浮游植物的演替及富营养化治理措施的生态效应. 中国环境科学, 21(6): 540–544 |
| 张远, 郑丙辉, 刘鸿亮, 2006. 三峡水库蓄水后的浮游植物特征变化及影响因素. 长江流域资源与环境, 15(2): 254–258 |
| 张怡, 胡韧, 肖利娟, 等, 2012. 南亚热带两座不同水文动态的水库浮游植物的功能类群演替比较. 生态环境学报, 21(1): 107–117 |
| 张磊, 夏志强, 周伟, 等, 2015. 三峡水库春季营养盐和浮游植物空间分布及其影响机制. 环境科学研究, 28(7): 1069–1077 |
| 李世健, 范振华, 任玉芹, 等, 2012. 长江中游宜昌至城陵矶江段浮游植物群落结构的周年变化特征. 长江流域资源与环境, 21(S1): 62–68 |
| 李俊龙, 郑丙辉, 刘录三, 等, 2013. 长江口浮游植物群落特征及其与环境的响应关系. 环境科学研究, 26(4): 403–409 |
| 陈家长, 孟顺龙, 尤洋, 等, 2009. 太湖五里湖浮游植物群落结构特征分析. 生态环境学报, 18(4): 1358–1367 |
| 陈校辉, 陈学进, 唐建清, 等, 2006. 长江江苏段浮游植物群落结构特征调查报告. 水产养殖, 27(4): 11–16 |
| 国家环境保护总局, 2002. 水和废水监测分析方法. 4版. 北京: 中国环境科学出版社, |
| 胡俊, 杨玉霞, 池仕运, 等, 2017. 邙山提灌站浮游植物群落结构空间变化对环境因子的响应. 生态学报, 37(3): 1054–1062 |
| 胡俊, 胡鑫, 米玮洁, 等, 2016. 多沙河流夏季浮游植物群落结构变化及水环境因子影响分析. 生态环境学报, 25(12): 1974–1982 |
| 胡鸿钧, 魏印心, 2006. 中国淡水藻类——系统、分类及生态. 北京: 科学出版社, |
| 栾青杉, 孙军, 宋书群, 等, 2007. 长江口夏季浮游植物群落与环境因子的典范对应分析. 植物生态学报, 31(3): 445–450 |
| 章宗涉, 黄祥飞, 1991. 淡水浮游生物研究方法. 北京: 科学出版社, |
| 曾辉, 2006. 长江和三峡库区浮游植物季节变动及其与营养盐和水文条件关系研究. 武汉: 中国科学院研究生院(水生生物研究所)博士学位论文 http://cdmd.cnki.com.cn/Article/CDMD-80119-2006130507.htm |
| 薛兴华, 袁龙义, 2012. 河流景观生态学视角下三峡工程对荆江河段的生态效用分析. 长江大学学报(自然科学版), 9(3): 15–19, 23 |
| Allison P D, 1998. Multiple Regression:A Primer. California: Pine Forge Press, |
| Bellinger E G, Sigee D C, 2015. Freshwater Algae:Identification, Enumeration and Use as Bioindicators. 2nd ed. Hoboken, NJ: Wiley-Blackwell, |
| Harrison S, Ross S J, Lawton J H, 1992. Beta diversity on geographic gradients in britain. Journal of Animal Ecology, 61(1): 151–158 |
| Huisman J, Jonker R R, Zonneveld C, et al, 1999. Competition for light between phytoplankton species:experimental tests of mechanistic theory. Ecology, 80(1): 211–222 DOI:10.1890/0012-9658(1999)080[0211:CFLBPS]2.0.CO;2 |
| Lepistö L, Holopainen A L, Vuoristo H, 2004. Type-specific and indicator taxa of phytoplankton as a quality criterion for assessing the ecological status of Finnish boreal lakes. Limnologica-Ecology and Management of Inland Waters, 34(3): 236–248 DOI:10.1016/S0075-9511(04)80048-3 |
| Naselli-Flores L, 2000. Phytoplankton assemblages in twenty-one Sicilian reservoirs:relationships between species composition and environmental factors. Hydrobiologia, 424(1-3): 1–11 |
| Reynolds C S, 2006. The Ecology of Phytoplankton. London: Cambridge University Press, |
| Rodrigues L C, Simões N R, Bovo-Scomparin V M, et al, 2015. Phytoplankton alpha diversity as an indicator of environmental changes in a neotropical floodplain. Ecological Indicators, 48: 334–341 DOI:10.1016/j.ecolind.2014.08.009 |
| Šmilauer P, Lepš J, 2014. Multivariate Analysis of Ecological Data Using Canoco 5. 2nd ed. New York: Cambridge University Press, |
| Soballe D M, Kimmel B L, 1987. A large-scale comparison of factors influencing phytoplankton abundance in rivers, lakes, and impoundments. Ecology, 68(6): 1943–1954 DOI:10.2307/1939885 |
| Temponeras M, Kristiansen J, Moustaka-Gouni M, 2000. Seasonal variation in phytoplankton composition and physical-chemical features of the shallow Lake Do rani, Macedonia, Greece. Hydrobiologia, 424(1-3): 109–122 |
| Wang X L, Lu Y L, He G Z, et al, 2007. Exploration of relationships between phytoplankton biomass and related environmental variables using multivariate statistic analysis in a eutrophic shallow lake:A 5-year study. Journal of Environmental Sciences, 19(8): 920–927 DOI:10.1016/S1001-0742(07)60152-1 |
 2018, Vol. 49
2018, Vol. 49

