
中国海洋湖沼学会主办。
文章信息
- 童巧琼, 林重远, 朱晓静, 周伟, 徐善良, 王丹丽, 赵云龙. 2018.
- TONG Qiao-Qiong, LIN Chong-Yuan, ZHU Xiao-Jing, ZHOU Wei, XU Shan-Liang, WANG Dan-Li, ZHAO Yun-Long. 2018.
- RNA干扰蚤状溞(Daphnia pulex)doublesex1基因的表达研究
- ANALYSIS OF DOUBLESEX1 GENE EXPRESSION AFTER RNA INTERFERENCE IN DAPHNIA PULEX
- 海洋与湖沼, 49(1): 117-123
- Oceanologia et Limnologia Sinica, 49(1): 117-123.
- http://dx.doi.org/10.11693/hyhz20170200041
-
文章历史
- 收稿日期:2017-02-28
- 收修改稿日期:2017-11-10
2. 华东师范大学生命科学学院 上海 200062
2. School of Life Science, East China Normal University, Shanghai 200062, China
蚤状溞(Daphnia pulex)是一种常见的淡水枝角类, 其个体较小, 繁殖周期短, 是第一个获得全基因组序列的枝角类(Cladocera) (Colbourne et al, 2011)。枝角类有其特殊的生殖方式:当温度、食物、种群密度等外界环境条件适宜时, 枝角类进行孤雌生殖(无性生殖), 由雌性个体直接繁殖后代; 而当环境条件发生变化, 对其生存造成胁迫时, 会诱导雄溞和两性溞的产生, 继而发生交配行为, 进行两性生殖(有性生殖)。孤雌生殖有利于缩短枝角类繁殖周期, 使其能够以最快的速度在适宜环境下扩增种群大小, 同时又通过不利环境诱导发生有性生殖来保障其能够以休眠卵的形式来维持种群的延续。虽然枝角类生殖转化在很大程度上是受到外界环境因子的影响, 但生殖方式的转变并不是由环境条件直接决定的, 即在适宜的环境条件下仍存在雄溞和两性溞的发生(王金秋等, 2000; 曹文清等, 2001)。因此我们推测内部基因和蛋白的级联调控是枝角类发生生殖转化的关键内因, 外界环境的变化仅仅只是诱导内部调控发生的一个外在因素。目前, 蚤状溞已在枝角类研究中被作为一种全新的模式生物。
随着分子水平各类组学的高速发展, 结合高通量测序技术的广泛应用, 近年来已有众多国内外学者尝试从基因水平对枝角类生殖转化调控机制的进一步深入探索。研究表明, 雄性个体可以通过某些化学物质如保幼激素(Juvenile hormone, JH)及其类似物(JHA)直接诱导产生(Olmstead et al, 2002; Tatarazako et al, 2003; Lamper et al, 2012); Leblanc(2007)同样发现甲基法尼酯(Methyl farnesoate, MF)在枝角类的性别决定过程中起关键作用。这些都证明保幼激素及其类似物可能在枝角类性别决定通路中扮演着重要的角色。Kato等(2008)得到大型溞(Daphnia magna)的性别分化相关基因Dmrt, 并成功克隆该基因的三个亚型; 日本学者(Kato et al, 2011b)通过沉默Distal-less (Dll)基因观察雌、雄大型溞附肢的变化。我国学者于2009年构建了隆线溞(Daphnia carinata)两种生殖状态(孤雌、两性)的cDNA文库(秦芬, 2009; Xu et al, 2009), 并通过分析文库中的大量EST序列, 拼接筛选出一些与生殖转化相关的功能基因, 其中便有doublesex基因。
性别决定基因及其对性别分化的影响已在黑腹果蝇、线虫、家蚕、蜜蜂、大型溞、家鼠等不同物种中有所研究(Baker et al, 1988; Cline et al, 1996; De Grandi et al, 2000; Ohbayashi et al, 2001; Cho et al, 2007; Kato et al, 2011a)。Doublesex基因是性别决定级联反应的下游基因, 具有同时控制雄性和雌性性别分化的双重功能(Alvarez et al, 2009; Shukla et al, 2010)。大型溞的doublesex基因是溞属中第一个受到关注的, 结果表明该基因在雄溞发育中起重要作用(Kato et al, 2011a)。在胚胎发育时期, DapmaDsx1的表达量只在雄溞中有所上升, 并能够在雄性特有的生理结构中检测到(Kato et al, 2011a)。Dsx蛋白主要有两个结构域: N端DNA结合域(DM结构域)和C端的二聚化结构域(Dsx dimer) (Oliveira et al, 2009; Matson et al, 2012), 这个结构域控制着大部分性别特异性性状, 包括卵黄蛋白表达、分泌以及周围神经系统的刚毛形成(Chen et al, 2008; Alvarez et al, 2009)。这些研究表明, Dsx及其同源物在不同生物体的性别决定及在性别转化起重要作用。
RNA干扰(RNAi)是指将双链RNA(dsRNA)导入细胞, 通过目的基因沉默机制引起目标mRNA的降解进而产生功能表型缺失的技术(Zamore, 2001; Bellés, 2010)。这一技术作为逆遗传学技术被广泛应用于非模式生物中, 例如, 昆虫赤拟谷盗(Brown et al, 1999)、蜜蜂(Beye et al, 2002)、家衣鱼(Ohde et al, 2009)、六点黄蜘蛛(Khila et al, 2007)、原生动物(LaCount et al, 2000)、水螅(Lohmann et al, 1999)。这项技术也被应用于两种甲壳动物, 分别是卤虫(Copf et al, 2004)和钩虾(Liubicich et al, 2009)。为了检测RNA干扰的效果, 我们采用浸泡法, 利用蚤状溞的滤食作用将dsRNA摄入不同生殖状态的蚤状溞体内, 同时发现dsRNA干扰后dsx1基因的表达位点也大幅减少。因此我们推测这种方法在蚤状溞中是可行的, 且本实验为研究枝角类的生殖转化提供了可靠的分子基础理论依据。
1 材料与方法 1.1 实验材料蚤状溞(Daphnia pulex)原始活体样品采自上海闵行区某水池, 经专业物种鉴定后培养单克隆, 命名为Dp220, 在本实验室保种多年。本实验随机挑选大小均一, 健康活力强的个体暂养于25℃恒温培养箱内, “Banta粪土培养液”(兔粪1.5g, 干稻草2g, 土壤10g, 自来水1L, 经煮沸后取上清液)培养, 光周期14L:10D, pH 7-7.5。用浓度为4.0×106 cells/mL蛋白小球藻(Chlorella pyrenoidosa)隔天投喂。在上述适宜条件下培养两周后, 蚤状溞种群密度快速增大至3000只/L, 其主要生殖方式逐渐转变为有性生殖, 两性溞和雄溞大量出现, 利用显微镜观察蚤状溞第一触角鉴定其性别, 收集不同性别实验样品。
总RNA提取试剂盒(RNA Extraction Kit)购自Axygen公司; 胶回收试剂盒为上海捷瑞生物工程有限公司; Nco I和Spe I快速限制性内切酶, PrimeScript RT Master Mix Kit等主要试剂均购自TaKaRa公司; T7 RNA Polymerase、SP6 reverse transcripatse和PGEM-T载体购自Promega公司; NBT/BCIP Stocking、地高辛RNA标记试剂盒和Anti-Digoxingenin-AP购自Roche公司; 引物合成及产物测序由上海Invitrogen生物公司完成。
1.2 RNA干扰 1.2.1 dsRNA的制备pET-T7表达载体由浙江大学杨卫军老师实验室赠送, dsRNA制备方法参照刘玉磊(2009), 合成dsRNA经琼脂糖凝胶电泳检测后保存于–20℃, 实验所用到的引物见表 1。
| 引物名称 | 序列(5′-3′) |
| Dsx1-iF | GCTCTAGA ACACGATAACCGACAGCAACG |
| Dsx1-iR | CGGGATCCCAATGAAACATTCTGGCCCATG |
| T7 terminator | TGCTAGTTATTGCTCAGCGG |
取成体孤雌、两性和雄性溞各200只, 在纯水中暂养半天后浸泡在RNAi溶液(dsRNA, 0.1%溴百里酚蓝, 1×PBS, 4%的蔗糖)中作为干扰组。以浸泡在等体积无dsRNA溶液中作为实验对照组。根据Eaton等(2002)浸泡果蝇胚胎方法, 将dsRNA浓度设4个梯度: 0.1、0.5、1、2mg/mL为定量参考, 选出最优干扰效果的浓度。在25℃恒温条件下对不同生殖状态的蚤状溞进行独立浸泡实验。在不同的浸泡时间点(12h, 14h, 16h, 18h)观察蚤状溞活力并分别取出实验样品, 显微镜下检查溞对dsRNA的摄入程度。
1.3 荧光定量PCR据已获得dsx1 cDNA序列设计特异性荧光定量引物DsxF (GCGACGCAGAAGAG TTGTCC)/DsxR (GGCTGGCAGCAAAATCAACG)。根据Miyakawa等(2010)设计本实验所需的18S(内参基因)特异性引物。收集实验组和对照组浸泡的孤雌溞、两性溞和雄溞各150只, 分别提取总RNA, 反转录获得cDNA。每个样品进行3次独立重复实验。qPCR反应条件如下(20μL体系): 95℃预变性15s; 95℃变性5s, 57℃退火30s, 40个循环。数据采集和处理在ABI StepOnePlusTM Instrument上进行, 所测数据采用2-ΔΔCT法(Livak et al, 2001), 利用SPSS 17.0软件, 显著性检验One-Way ANOVA法进行数据分析。qPCR产物的溶解曲线均为单峰, 表明其特异性好。
1.4 整体原位杂交收集实验组和对照组中的三种生殖状态蚤状溞各50只, 用4%多聚甲醛固定2h后, 转移到无水甲醇中, –20℃保存。
根据已知Dpdsx序列设计探针模板引物Dsx-S、Dsx-A, 经PCR扩增后, 于1.5%琼脂糖凝胶电泳检测。将正确的目的片段连接pGEM-T载体, 并转化, 挑取阳性克隆送测。将含有目的条带的阳性克隆进行菌液扩增, 抽提质粒。分别使用Nco Ⅰ和Spe Ⅰ限制性内切酶分别对重组pGEM-T质粒进行线性化酶切, 纯化后回收线性化的模板质粒, 溶于0.1% DEPC处理水。以DIG RNA Labeling Mix做作为物, 纯化质粒作为体外转录DNA模板, 利用T7 RNA Polymerase、SP6 reverse transcripatse进行体外转录, 合成有DIG标记的正、反义RNA探针。避免合成探针中的残余DNA模板影响实验结果, 用无RNA酶活性的DNA酶将其除去, 加入一定量的5mol/L LiCl(经DEPC处理)和无水乙醇(冰预冷), –20℃过夜。RNA沉淀经70%酒精(DEPC水配制)洗涤后溶于20μL DEPC水, –20℃保存。整体原位杂交实验步骤主要参考Sagawa等(2005)和Thisse等(2008)。在37℃用Proteinase K处理两性溞和孤雌溞15min以增强细胞通透性, 同时调节杂交温度, 如果杂交温度太低, 可能会发生非特异性杂交, 导致背景颜色过深; 如果反应温度太高, 则可能会导致杂交不完整或不发生杂交。因此, 以1:100比例稀释RNA探针进行杂交温度梯度预实验, 并确立68℃、4h为最佳杂交条件。anti-DIG单抗以1:5000比例稀释, 于4℃孵育过夜。
2 结果 2.1 蚤状溞Dpdsx1 RNAi通过特异性引物获得dsx1 dsRNA的模板片段, 经序列比对验证后连接两端含有T7启动子的表达载体, 利用E. coli HT115菌株(RNA酶缺陷)获得表达的目的RNA。通过退火复性得到dsRNA, 并用RNaseA去除细菌RNA以及未结合成双链的单链RNA。纯化后的dsx1 dsRNA回收后经琼脂糖电泳检测, 结果如图 1所示。可见目的条带dsx1 dsRNA片段长度位于500bp, 且条带单一, 无杂带, 这表明了细菌自身RNA以及未结合成双链的RNA已被消化酶处理完全。
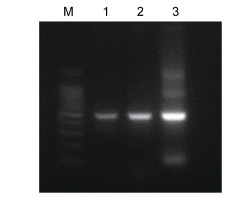 |
| 图 1 dsx1 dsRNA制备电泳图 Fig. 1 Preparation of dsx1 dsRNA on gel electrophoresis 注: M: 1500bp Marker; 1:纯化后dsRNA; 2:酶切后dsRNA; 3:未酶切dsRNA |
取浸泡不同时间(12h、14h、16h、18h)的三种生殖状态的蚤状溞样品, 在纯水中暂养洗净后置于莱卡显微镜下观察。结果发现, 用处理12h的蚤状溞活力较好, 与对照组相似, 且体腔中均有明显的RNAi溶液的指示淡蓝色位点(图 2)。在溶液处理12h后, 蚤状溞个体活力开始下降, 至14-18h时各生殖状态溞均开始出现活力下降甚至死亡的现象, 表明用RNAi溶液处理蚤状溞12h即能保证dsRNA充分进入体腔并发生作用, 又不对实验个体活力造成影响, 因此可以在此时收集样品进行后续实验。
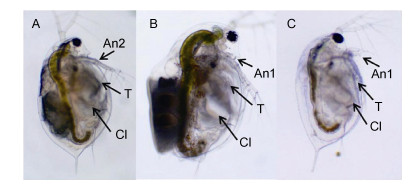 |
| 图 2 蚤状溞在RNAi溶液浸泡12h后浸染效率图 Fig. 2 Infiltration effects in different sexual reproductive stages of D. pulex after 12h soaking in dsRNA solution 注:蓝色信号为dsRNA浸入位点。An1:第一触角; T:胸肢; Cl:体腔。A:孤雌溞; B:两性溞; C:雄性溞 |
我们尝试以不同浓度梯度的dsRNA (0.1, 0.5, 1, 2mg/mL)处理蚤状溞, 通过荧光定量分析干扰效率, 选出最优dsRNA干扰浓度, 结果如图 3所示。结果所示, dsRNA浓度为0.5mg/mL时, RNAi效率基本达到饱和, 因此我们选择该浓度作为干扰实验的最优设置。
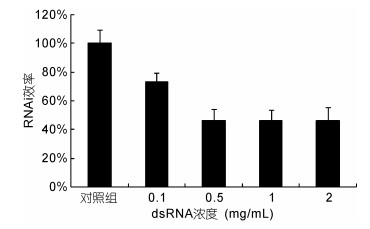 |
| 图 3 qPCR检测不同浓度dsRNA的干扰效率 Fig. 3 The interference efficiency of dsRNA in different concentrations |
用dsRNA浓度为0.5mg/mL的RNAi溶液处理不同生殖状态蚤状溞12h后收集样品, 分别提取总RNA并反转录获得cDNA。qPCR以18S作为内参, 检测dsx1 mRNA在干扰组和对照组的蚤状溞的表达水平差异(图 4)。结果表明浸泡法活体干扰蚤状溞使其dsx1 mRNA的表达水平下调是有效的, 雄性溞、两性溞、孤雌溞在RNAi后均出现了dsx1 mRNA表达水平的显著下调, 且下调量具有显著性差异(P < 0.05), 其中在孤雌溞中下调68%, 在三种生殖状态中最为显著, 其次是雄性溞(56%)和两性溞(20%)。
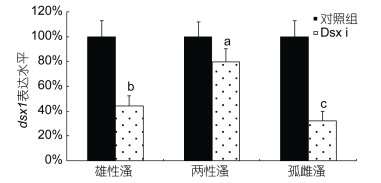 |
| 图 4 RNA干扰后dsx1 mRNA在不同蚤状溞中的表达 Fig. 4 qPCR results of dsx1 mRNA expression level from three reproductive modes of D. pluex after RNAi 注: a、b、c表示三者之间的下降量有显著性差异(P < 0.05) |
整体原位杂交结果显示, RNAi前, 在三种生殖状态蚤状溞中均能够检测到dsx1 mRNA的表达, 主要表达位点均在第一触角、复眼和胸肢。雄性溞与孤雌溞、两性溞中的dsx1的表达量差异存在显著性别差异。如图 5可见, 蓝色的阳性信号在雄溞的复眼, 第一触角和胸肢均清晰可见(图 5C), 而两性溞(图 5B)和孤雌溞(图 5A)对应部位表达相对较弱, 为淡紫红色。因此dsx1 mRNA在溞体内表达存在与性别相关的表达差异, 同时也表明该基因在调控蚤状溞雄性性状中发挥重要作用。正义探针对照组未检测到信号。
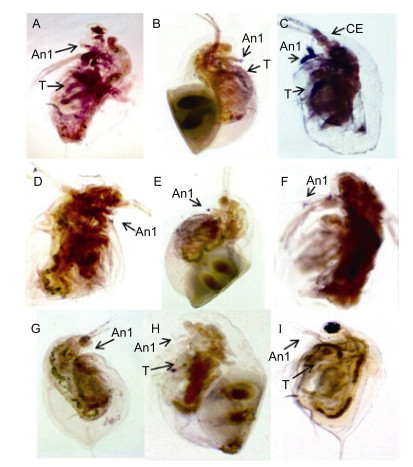 |
| 图 5 原位杂交检测RNAi后dsx1 mRNA在三种生殖状态蚤状溞中表达位点 Fig. 5 Expression of dsx1 mRNA in D. pulex was determined by whole-mount in situ hybridization after RNAi 注:蓝色区域为阳性信号, A:孤雌溞, B:两性溞, C:雄性溞; An 1:第一触角, CE:复眼, T:胸肢 |
dsRNA干扰后dsx1 mRNA在不同生殖状态蚤状溞中的表达位点和表达量发生显著变化, 表达位点和表达量明显减少和变弱。从图 5可见, RNAi后仅在样品溞的第一触角部位存在dsx1基因的少量表达, 干扰前有明显信号的第一胸肢和复眼在干扰后均未检测到dsx1基因信号位点。孤雌溞中无表达位点(图 5D); 两性溞和雄性溞的第一触角存在局部蓝色信号(图 5E, 图 5F)。另外, 不同生殖状态蚤状溞的阴性对照组均未检测到表达位点(图 5G, 图 5H, 图 5I)。
3 讨论随着RNAi技术的快速发展与成熟, 该技术己成功应用于众多高等、低等生物的基因功能研究中。Dunn等(2007)针对海葵Actin蛋白编码基因和Cys蛋白酶编码基因采用RNAi技术, 用特异性dsRNA对两个基因进行干扰, 抑制蛋白表达, 并结合原位杂交检测干扰成功; 刘玉磊(2009)采用RNAi技术对卤虫休眠卵壳相关基因SGEG进行了研究, 通过将特异性dsRNA注射进卤虫胚胎对SGEG进行表达沉默, 结果处理后卤虫的卵壳由褐色坚硬变为了淡黄色柔软, 干扰后的卵壳表面呈片层状, 且较为粗糙, 其皮质层厚度也仅为干扰前1/2; 陈宏健等(2014)通过投喂dsRNA有效抑制了方形网纹溞(Ceriodaphnia quadrangula)体内actin基因的表达, 并导致方形网纹溞死亡率明显提高; Kato等(2011b)在探究大型溞附肢末端基因Dll时首次在溞科实现了RNAi技术的使用, 通过显微注射法将体外合成的Dll特异性dsRNA注射到大型溞卵中, 经过72h的适宜环境培养获得孵化的新生干扰后大型溞, 结果发现干扰后孵化的大型溞不仅缺失部分附肢末端, 而存在表型的改变, 同时通过注射不同计量dsRNA的梯度实验, 根据抑制效果确定以300pg/egg为最佳计量; Kato等(2011a)将特异性dsRNA显微注射进大型溞的胚胎中, 成功沉默DapmaDsx1基因表达, 另设置该基因过量表达对照组, 发现DapmaDsx1是大型溞维持雄性表型特征的直接相关基因。
在本研究中, 我们主要通过RNAi技术对dsx1是否在蚤状溞生殖转化调控过程中存在重要的作用进行了初步的探究:利用蚤状溞滤食摄食的特点将体外合成的dsx1双链RNA(dsRNA)通过浸泡得方法分别摄入不同生殖状态的溞体中, 实现dsx1基因的表达沉默, 将荧光定量及整体原位杂交应用于干扰后蚤状溞基因表达水平的检测检测, 研究dsx1在蚤状溞生殖转换过程中的功能。结果表明, 虽然由于浸泡法处理的是蚤状溞成体, 没有直接影响个体发育导致形状的明显改变, 但干扰后的三种生殖状态蚤状溞体内dsx1 mRNA表达水平均显著下调(P < 0.05), 其中在孤雌溞中下调68%, 在三种生殖状态中最为显著, 其次是雄性溞(56%)和有性雌两性溞(20%)。对比干扰前后, dsx1 mRNA表达水平变化差异在孤雌溞中最为显著。另有研究表明, 整体原位杂交信号缺失与溞体表皮通透性有关, 因此会延长mRNA的干扰效应(Dunn et al, 2007)。原位杂交对目的基因mRNA的检测灵敏度并没有PCR检测的灵敏度高。Li等(2000)在斑马鱼中用qPCR和原位杂交分别对Zf-T基因mRNA进行干扰检测, 结果显示原位杂交无信号, 而qPCR则表明基因表达下调75%, 这也符合原位杂交中干扰后孤雌溞无法检测到表达位点的结果相符。在两性溞中干扰前后表达量下降差异最小的原因可能在于卵鞍, 下降的新陈代谢速率可能会导致对溶液中dsRNA摄入量的减少。雄溞在干扰前后存在dsx1 mRNA表达水平的显著差异, 第一触角作为雄性蚤状溞的特征性器官上有原位杂交信号位点, 但是干扰后阳性信号位点比干扰前位点数减少, 信号强度减弱, 表明dsx1基因可能在维持雄性蚤状溞表型特征的过程中起到关键作用。Kato等(2011a)对大型溞胚胎进行干扰实现dsx1表达沉默, 发现孵化后幼体缺失第一触角前端; Kijimoto等(2012)对食粪金龟(Onthophagus taurus)幼体进行dsx基因干扰, 培养后观察发现该昆虫的雄性特异性角变短, 均证明了在雄性的表型维持中dsx1扮演着至关重要的角色。本实验也发现雄溞的特征性器官第一触角在干扰前后其表达有明显差异, 因此我们推测dsx1可能参与调控了蚤状溞的生殖转换化过程, 并且在维持蚤状溞雄性性别特征的机制中发挥重要作用。
对三种生殖状态的蚤状溞进行RNA干扰前, 我们均能够在样品中检测到明显的dsx1表达位点, 且雄性溞中的信号强度明显高于两性溞以及孤雌溞。对比干扰前原位杂交结果, 干扰后的三种生殖状态蚤状溞个体上的表达位点数量显著减少, 且信号强度也明显低于干扰前。对比3种生殖状态蚤状溞中的荧光定量结果可知, dsx1 mRNA的表达水平以及表达定位存在生殖状态的特异性差异, 表明dsx1基因可能在蚤状溞机体在生殖转换调控过程中起到一定作用。由于研究条件的限制, 本研究没有能够直接对蚤状溞胚胎进行显微注射RNAi, 因此无法获得在胚胎发育期受到dsx1表达抑制的蚤状溞个体来更直观地观察该基因对蚤状溞性别相关性状发育的影响, 只是初步探究了dsx1是否参与了性别调控过程, 但本实验可以作为今后对该基因具体作用机理探究的研究基础, 进一步利用过量表达、免疫组化技术和形态特征比较等进行研究。
4 结论本研究利用体外合成的dsx1基因双链RNA (dsRNA)浸泡不同生殖状态的蚤状溞, 通过实时荧光定量PCR(qPCR)和以及整体原位杂交方法分别检测干扰不同生殖状态下蚤状溞在RNAi前后体内dsx1的表达水平变化, 进而研究dsx1在蚤状溞生殖转换过程中的作用。结果发现, dsx1可能参与了蚤状溞的生殖转换和维持雄性性征的过程, 并在雄性的表型维持中起到关键作用。本研究有助于确定dsx1是否参与蚤状溞生殖转换的基因调控, 且为探索枝角类生殖转化规律的分子机理提供理论基础。
| 王金秋, 张佳忆, 黄博, 2000. 生态因子的波动对多刺裸腹溞雄体发生的影响. 应用生态学报, 11(1): 135–137 |
| 刘玉磊, 2009. 卤虫休眠卵壳形成的分子机制及其抗逆功能的研究. 杭州: 浙江大学博士学位论文 http://cdmd.cnki.com.cn/Article/CDMD-10335-2010057049.htm |
| 陈宏健, 谢松, 李理想, 等, 2014. 一种基于干扰肌动蛋白基因导致方形网纹溞(Ceriodaphnia quadrangula)死亡的RNA干扰(RNAi)模型构建. 海洋与湖沼, 45(2): 322–327 DOI:10.11693/hyhz20121028001 |
| 秦芬, 2009. 隆线溞孤雌卵胚胎发育及其两性溞EST的初步研究. 上海: 华东师范大学硕士学位论文, 43-50 http://www.zjwd.net/MianFeiLunWenS-174/174282.html |
| 曹文清, 林元烧, 郭东晖, 2001. 若干生态因子对蒙古裸腹溞生殖方式转变效应的实验. 台湾海峡, 20(增刊): 190–195 |
| Alvarez M, Ruiz M F, Sánchez L, 2009. Effect of the gene doublesex of Anastrepha on the somatic sexual development of Drosophila. PLoS One, 4(4): e5141 DOI:10.1371/journal.pone.0005141 |
| Baker B S, Wolfner M F, 1988. A molecular analysis of doublesex, a bifunctional gene that controls both male and female sexual differentiation in Drosophila melanogaster. Genes & Development, 2(4): 477–489 |
| Bellés X, 2010. Beyond drosophila:RNAi in vivo and functional genomics in insects. Annual Review of Entomology, 55: 111–128 |
| Beye M, Härtel S, Hagen A, et al, 2002. Specific developmental gene silencing in the honey bee using a homeobox motif. Insect Molecular Biology, 11(6): 527–532 DOI:10.1046/j.1365-2583.2002.00361.x |
| Brown S J, Mahaffey J P, Lorenzen M D, et al, 1999. Using RNAi to investigate orthologous homeotic gene function during development of distantly related insects. Evolution & Development, 1(1): 11–15 |
| Chen S L, Dai S M, Lu K H, et al, 2008. Female-specific doublesex dsRNA interrupts yolk protein gene expression and reproductive ability in oriental fruit fly, Bactrocera dorsalis (Hendel). Insect Biochemistry and Molecular Biology, 38(2): 155–165 DOI:10.1016/j.ibmb.2007.10.003 |
| Cho S, Huang Z Y, Zhang J Z, 2007. Sex-specific splicing of the honeybee doublesex gene reveals 300 million years of evolution at the bottom of the insect sex-determination pathway. Genetics, 177(3): 1733–1741 DOI:10.1534/genetics.107.078980 |
| Cline T W, Meyer B J, 1996. Vive la différence:males vs females in flies vs worms. Annual Review of Genetics, 30: 637–702 |
| Colbourne J K, Pfrender M E, Gilbert D, et al, 2011. The ecoresponsive genome of Daphnia pulex. Science, 331(6017): 555–561 DOI:10.1126/science.1197761 |
| Copf T, Rabet N, Celniker S E, et al, 2004. Posterior patterning genes and the identification of a unique body region in the brine shrimp Artemia franciscana. Development, 130(24): 5915–5927 |
| De Grandi A, Calvari V, Bertini V, et al, 2000. The expression pattern of a mouse doublesex-related gene is consistent with a role in gonadal differentiation. Mechanisms of Development, 90(2): 323–326 DOI:10.1016/S0925-4773(99)00282-8 |
| Dunn S R, Phillips W S, Green D R, et al, 2007. Knockdown of actin and caspase gene expression by RNA interference in the symbiotic anemone Aiptasia pallida. The Biological Bulletin, 212(3): 250–258 DOI:10.2307/25066607 |
| Eaton B A, Fetter R D, Davis G W, 2002. Dynactin is necessary for synapse stabilization. Neuron, 34(5): 729–741 DOI:10.1016/S0896-6273(02)00721-3 |
| Kato Y, Kobayashi K, Oda S, et al, 2008. Molecular cloning and sexually dimorphic expression of DM-domain genes in Daphnia magna. Genomics, 91(1): 94–101 DOI:10.1016/j.ygeno.2007.09.002 |
| Kato Y, Kobayashi K, Watanabe H, et al, 2011a. Environmental sex determination in the branchiopod crustacean Daphnia magna:deep conservation of a doublesex gene in the sex-determining pathway. PLoS Genetics, 7(3): e1001345 DOI:10.1371/journal.pgen.1001345 |
| Kato Y, Shiga Y, Kobayashi K, et al, 2011b. Development of an RNA interference method in the cladoceran crustacean Daphnia magna. Development Genes and Evolution, 220(11-12): 337–345 DOI:10.1007/s00427-011-0353-9 |
| Khila A, Grbić M, 2007. Gene silencing in the spider mite Tetranychus urticae:dsRNA and siRNA parental silencing of the Distal-less gene. Development Genes and Evolution, 217(3): 241–251 DOI:10.1007/s00427-007-0132-9 |
| Kijimoto T, Moczek A P, Andrews J, 2012. Diversification of doublesex function underlies morph-, sex-, and species-specific development of beetle horns. Proceedings of the National Academy of Sciences of the United States of America, 109(50): 20526 DOI:10.1073/pnas.1118589109 |
| LaCount D J, Bruse S, Hill K L, et al, 2000. Double-stranded RNA interference in Trypanosoma brucei using head-to-head promoters. Molecular and Biochemical Parasitology, 111(1): 67–76 DOI:10.1016/S0166-6851(00)00300-5 |
| Lampert W, Lampert K P, Larsson P, 2012. Induction of male production in clones of Daphnia pulex by the juvenoid hormone methyl farnesoate under short photoperiod. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 156(2): 130–133 |
| LeBlanc G A, 2007. Crustacean endocrine toxicology:a review. Ecotoxicology, 16(1): 61–81 DOI:10.1007/s10646-006-0115-z |
| Li Y X, Farrell M J, Liu R, et al, 2000. Double-stranded rna injection produces null phenotypes in zebrafish. Developmental Biology, 217(2): 394 DOI:10.1006/dbio.1999.9540 |
| Liubicich D M, Serano J M, Pavlopoulos A, et al, 2009. Knockdown of Parhyale ultrabithorax recapitulates evolutionary changes in crustacean appendage morphology. Proceedings of the National Academy of Sciences of the United States of America, 106(33): 13892–13896 DOI:10.1073/pnas.0903105106 |
| Livak K J, Schmittgen T D, 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method. Methods, 25(4): 402–408 DOI:10.1006/meth.2001.1262 |
| Lohmann J U, Endl I, Bosch T C G, 1999. Silencing of developmental genes in Hydra. Developmental Biology, 214(1): 211–214 DOI:10.1006/dbio.1999.9407 |
| Matson C K, Zarkower D, 2012. Sex and the singular DM domain:insights into sexual regulation, evolution and plasticity. Nature Reviews Genetics, 13(3): 163–174 DOI:10.1038/nrg3161 |
| Miyakawa H, Imai M, Sugimoto N, et al, 2010. Gene up-regulation in response to predator kairomones in the water flea, Daphnia pulex. BMC Developmental Biology, 10: 45 DOI:10.1186/1471-213X-10-45 |
| Ohbayashi F, Suzuki M G, Mita K, et al, 2001. A homologue of the Drosophila doublesex gene is transcribed into sex-specific mRNA isoforms in the silkworm, Bombyx mori. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 128(1): 145–158 DOI:10.1016/S1096-4959(00)00304-3 |
| Ohde T, Masumoto M, Yaginuma T, et al, 2009. Embryonic RNAi analysis in the firebrat, Thermobia domestica:distal-less is required to form caudal filament. Journal of Insect Biotechnology and Sericology, 78(2): 99–105 |
| Oliveira D C S G, Werren J H, Verhulst E C, et al, 2009. Identification and characterization of the doublesex gene of Nasonia. Insect Molecular Biology, 18(3): 315–324 DOI:10.1111/imb.2009.18.issue-3 |
| Olmstead A W, Leblanc G A, 2002. Juvenoid hormone methyl farnesoate is a sex determinant in the crustacean Daphnia magna. Journal of Experimental Zoology, 293(7): 736–739 DOI:10.1002/(ISSN)1097-010X |
| Sagawa K, Yamagata H, Shiga Y, 2005. Exploring embryonic germ line development in the water flea, Daphnia magna, by zinc-finger-containing VASA as a marker. Gene Expression Patterns, 5(5): 669–678 DOI:10.1016/j.modgep.2005.02.007 |
| Shukla J N, Nagaraju J, 2010. Two female-specific DSX proteins are encoded by the sex-specific transcripts of dsx, and are required for female sexual differentiation in two wild silkmoth species, Antheraea assama and Antheraea mylitta (Lepidoptera, Saturniidae). Insect Biochemistry and Molecular Biology, 40(9): 672–682 DOI:10.1016/j.ibmb.2010.06.008 |
| Tatarazako N, Oda S, Watanabe H, et al, 2003. Juvenile hormone agonists affect the occurrence of male Daphnia. Chemosphere, 53(8): 827–833 DOI:10.1016/S0045-6535(03)00761-6 |
| Thisse C, Thisse B, 2008. High-resolution in situ hybridization to whole-mount zebrafish embryos. Nature Protocols, 3(1): 59–69 DOI:10.1038/nprot.2007.514 |
| Xu X Q, Song S H, Wang Q, et al, 2009. Analysis and comparison of a set of expressed sequence tags of the parthenogenetic water flea Daphnia carinata. Molecular Genetics and Genomic, 282(2): 197–203 DOI:10.1007/s00438-009-0459-1 |
| Zamore P D, 2001. RNA interference:listening to the sound of silence. Nature Structural Biology, 8(9): 746–750 DOI:10.1038/nsb0901-746 |
 2018, Vol. 49
2018, Vol. 49


