中国海洋湖沼学会主办。
文章信息
- 郑利兵, 刘志鸿, 吴彪, 周丽青, 孙秀俊, 杨爱国, 田吉腾, 董迎辉. 2018.
- ZHENG Li-Bing, LIU Zhi-Hong, WU Biao, ZHOU Li-Qing, SUN Xiu-Jun, YANG Ai-Guo, TIAN Ji-Teng, DONG Ying-Hui. 2018.
- 魁蚶(Scapharca broughtonii)热休克蛋白90(HSP90)基因的克隆及转录表达分析
- COLONING AND EXPRESSION ANALYSIS OF HEAT SHOCK PROTEIN 90 FROM SCAPHARCA BROUGHTONII (SbHSP90)
- 海洋与湖沼, 49(1): 124-133
- Oceanologia et Limnologia Sinica, 49(1): 124-133.
- http://dx.doi.org/10.11693/hyhz20170300071
-
文章历史
- 收稿日期:2017-03-24
- 收修改稿日期:2017-09-25
2. 海洋渔业科学与食物产出过程功能实验室 青岛海洋科学与技术国家实验室 青岛 266273;
3. 厦门大学海洋与地球学院 厦门 361102;
4. 浙江省水产种质资源高效利用技术研究重点实验室 浙江万里学院 宁波 315100
2. Laboratory for Marine Fisheries Science and Food Production Process, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266273, China;
3. College of Ocean and Earth Science, Xiamen University, Xiamen 361102, China;
4. Zhejiang Key Laboratory of Aquatic Germplasm Resources, Zhejiang Wanli University, Ningbo 315100, China
魁蚶(Scapharca broughtonii)主要分布于渤海及黄海北部, 具有很高的经济价值, 是我国出口换汇率较高的水产品之一(齐忠彦, 1998)。在过去十几年, 海洋生态环境的恶化, 加之过度捕捞, 魁蚶的野生资源急剧下降(周丽青等, 2013), 人工养殖逐渐发展, 为了防止像扇贝等其他贝类在人工养殖过程中发生的因疾病暴发引起巨大经济损失的现象发生, 加强魁蚶的抗病及免疫机制的研究显得尤为重要。然而, 有关魁蚶分子免疫的研究报道还较少, 作者曾做过一些常规免疫基因的相关研究, 如:半乳糖凝集素(郑利兵等, 2015)、锰超氧化物歧化酶(Zheng et al, 2015)、铁蛋白(Zheng et al, 2016)。
热休克蛋白(Heat shock protein, HSPs)是一类参与生物体抵御高温、缺氧、有机物污染和病原感染等环境胁迫且结构上高度保守的蛋白质。在正常生理状态下, HSPs行使分子伴侣的功能, 表达量较少; 当出现外在胁迫时, 其大量表达以使生物体能够抵抗伤害。作为机体内一种很重要的分子伴侣, HSPs主要参与蛋白质的代谢过程, 如正确折叠、变性蛋白的重折叠及帮助降解无法修复的损伤蛋白质等(Lindquist, 1986; Parsell et al, 1993)。HSPs家族种类较多, 根据分子量大小将HSPs分为: HSP100家族, HSP90家族, HSP70家族, HSP60家族, HSP40家族和小分子热休克蛋白家族(Lindquist et al, 1988)。其中, HSP90和HSP70的结构和功能是研究的较多的两类热休克蛋白。
HSP90除具有HSPs共有的分子伴侣功能外, 有研究报道其还参与到信号传导、细胞周期及机体免疫调节中(Nadeau et al, 1993; Parsell et al, 1993; Csermely et al, 1998a, b); 在机体遭受环境胁迫状况下, HSP90可对细胞和机体起重要的保护作用, 但其功能尚未完全了解。其中HSP90对环境适应的作用也同样在一些水生动物做过验证(Tomanek et al, 1999; Pan et al, 2000; Niu et al, 2008)。关于软体动物HSP90的研究仅见少量的海洋经济贝类, 如已对近江牡蛎Craassostrea hongkongensis (陈晨, 2011)、栉孔扇贝Chlamys farreri (Gao et al, 2007)、紫贻贝Mytilus edulis (Pantzartal et al, 2009)、海湾扇贝Argopecten irradians (Gao et al, 2008)、太平洋牡蛎Crassostrea gigas (Choi et al, 2008)、皱纹盘鲍Haliotis discus hanai的HSP90基因做过相关的分子研究。然而, 对魁蚶Scapharca broughtoii HSP90 (SbHSP90)基因的相关研究迄今未见报道。
本实验从魁蚶转录组文库中鉴定出热休克蛋白HSP90基因的unigene序列, 利用RACE技术克隆了该基因的cDNA全长序列; 分析其核酸、氨基酸序列及蛋白结构; 利用qRT-PCR技术检测分析其组织分布特点、鳗弧菌(Vibrio anguillrum)感染后其在不同组织中的转录差异, 以期为魁蚶的免疫相关提供理论数据。
1 材料与方法 1.1 样品来源试验用魁蚶(壳长55mm左右)从青岛台东水产品市场挑选, 于实验室条件下暂养在充气海水中一周(20℃), 每天换两次水, 期间投喂硅藻, 实验处理前两天停止投喂。鳗弧菌为–80℃保存的甘油菌进行活化。
1.2 SbHSP90基因全长cDNA的获得 1.2.1 RNA提取和cDNA合成异硫氰酸胍法提取总RNA:详细方法和步骤参照Zheng等(2015)。1.2%琼脂糖检测总RNA完整性, 核酸分析仪(Eppendorf)检测其纯度和浓度。
1.2.2 RACE模板的制备根据SMARTerTM RACE cDNA Amplication Kit说明书利用1.0μg总RNA分别进行3′端和5′端RACE模板的制备, 反应结束后, 加入100μL Tricine-EDTA Buffer用以提供cDNA模板一个稳定的环境, 并加以稀释。
1.2.3 全长cDNA克隆及测序通过已知序列利用Primer Premier 5.0设计RACE特异性引物HSP90-5R/3F(表 1)。RACE扩增体系为50μL, 内含ddH2O 34.5μL, 10× LA buffer 5.0μL, dNTP Mix (10mmol/L) 1.0μL, UPM 5.0μL, HSP90-5R/3F 1.0μL, 3′(5′) RACE cDNA模板2.5μL, LA Taq 1.0μL。反应程序为: 94℃ 30s, 68℃ 30s, 72℃ 3min, 30个循环; 巢式PCR利用NUP和巢氏引物进行扩增。1.2%琼脂糖凝胶电泳检测PCR产物扩增条带, 胶回收产物与pMD18-T连接, 亚克隆至Escherich coli Top10感受态细胞, 并挑阳性克隆进行测序。
| 引物 | 序列5′—3′ |
| 10×Universal Primer A Mix (UPM) | Long, CTAATACGACTCACTATAGGGCAAGCAGTGGTATCAACGCAGAGT; Short, CTAATACGACTCACTATAGGGC |
| NUP | AAGCAGTGGTATCAACGCAGAGT |
| HSP-5R | GGTCCAGATGGGTTTAGTTTTGTTCAGT |
| HSP-5R-1 | GTTATTCTTGGTCTCCACGACGACTCTA |
| HSP-3F | TAGTTATTTGTGTTGGGTAAGGTGC |
| HSP-3F-1 | TGAGGAACTGAACAAAACTAAACCC |
| β-actin-F | GGTTACACTTTCACCACCACAG |
| β-actin-R | ACCGGAAGTTTCCATACCTAAGA |
| Q-F | AACCTCCCTTCTATCTTC |
| Q-R | GGTGGCATTTCATCTA |
| M13F | CGCCAGGGTTTTCCCAGTCACGAC |
| M13R | AGCGGATAACAATTTCACACAGGA |
DNAStar软件对cDNA序列的开放阅读框进行搜索、氨基酸预测; ProtParam tool (http://web.expasy.org/protparam/)预测HSP90蛋白的分子量(Mw)及等电点pI; SignalIP 4.0 Server (http://www.cbs.dtu.dk/services/SignalP/)预测HSP90蛋白N端信号肽; SMART (http://www.expasy.ch/SMART)预测分析HSP90蛋白功能域; BLASTp (http://blast.ncbi.nlm.nih.gov/)在线对HSP90核苷酸序列进行同源检索分析; MEGA 5.0构建基于不同物种HSP90氨基酸序列的系统发育树。
1.3 SbHSP90组织分布及对鳗弧菌刺激的免疫应激变化 1.3.1 鳗弧菌感染实验微量注射器向预先挑选并分组的魁蚶处理组个体前闭壳肌处注射50μL经PBS (0.01mol/L, pH7.4)洗涤并悬浮的鳗弧菌菌悬液(OD600=0.4, 1OD=5×108 bacterium/mL), 对照组注射同剂量的灭菌PBS。分别在0h、4h、8h、16h、24h、32h、64h随机选取3个个体活体解剖取血淋巴(4℃, 800r/min, 15min)、外套膜、鳃、闭壳肌、肝胰腺、斧足, 立即置于液氮中速冻。
1.3.2 实时荧光定量PCR(qRT-PCR)根据定量引物设计原则, Primer Premier 5.0设计定量引物Q-F/R(表 1), 选取β-actin基因作为内参基因(Zheng et al, 2015)。qRT-PCR扩增(ABI 7500 PCR仪)体系为20μL, 包括: DEPC水6.0μL, SYBR Premix Ex TaqTMⅡ(2×) 10μL, Q-F (10μmol/L) 0.8μL; Q-R (10μmol/L) 0.8μL, ROX Reference Dye Ⅱ(50×) 0.4μL, cDNA模板2.0μL。反应程序为95℃ 30s; 95℃ 5s, 60℃ 34s, 40个循环; 95℃ 15s, 60℃ 1min, 95℃ 15s。实验设置3个平行组, 每组两个重复。
1.3.3 数据分析基于得到的CT值, 利用2-△△CT方法(Livak et al, 2001)进行相对定量分析。根据每个样品的3个平行实验所得的数据计算相对表达量平均值和标准差。
2 结果 2.1 SbHSP90基因cDNA序列分析将扩增并测序的5′-RACE、3′-RACE序列及已知序列通过重叠序列拼接后得到魁蚶HSP90基因的全长cDNA序列, 命名为SbHSP90 (GenBank Accession No.KT362154)。SbHSP90基因的cDNA全长2707bp, 包括195bp的5′-端非编码区(UTR), 2187bp的开放阅读框(ORF)和325bp的3′-UTR; 3′-UTR含有一个典型的AATAAA加尾信号、一个poly(A)尾和三个RNA不稳定体(图 1)。SbHSP90编码一个由728个氨基酸组成的蛋白质, 预测的蛋白分子量Mw为83.72kDa, 理论等电点pI为4.85; HSP90家族的功能序列标签同样保守的存在于SbHSP90编码的氨基酸序列中: FLRELISNASSDALDKIR (40-57), LGTIAKSGT (103-112), IGQFGVGFYSAYLVAD (127-143), IKLYVRRVFI (323-332), GVVDSEDLPLNISRE (349-364);预测到4个潜在糖基化位点, 分别为第5位的NQTM、第47位的NSSD、第286位的NKTK、第392位的NISR; C末端存在保守的MEEVD多肽结构; SMART结构域预测, 该序列含有由133个(36-169)氨基酸组成ATP酶结构域。
 |
| 图 1 SbHSP90核苷酸序列及相对应的氨基酸序列 Fig. 1 The nucleotide sequence and deduced amino acid sequence of SbHSP90 注: SbHSP90的五个标签序列用阴影标示, 糖基化位点加粗标示, 起始密码子(ATG)和终止密码子(TAA)分别加框标示, 加尾信号和多聚尾用下划线标示, RNA不稳定模体用波浪线标示, 保守的短肽标签用椭圆标示 |
在线BLASTp同源性分析结果显示SbHSP90编码的氨基酸与其他物种的HSP90氨基酸序列具有很高的同源性。与软体动物HSP90氨基酸序列相似性达83%以上, 其中与长牡蛎Crassostrea gigas和海湾扇贝A. irradians相似度最高为86%;与甲壳动物HSP90的相似度都在81%左右; 与所选脊椎动物HSP90-α和HSP90-β的同源性很接近, 与人Homo sapiens的相似性均为80%, 与牙鲆Paralichthys olivaceus的相似性为79%, 与斑马鱼Danio rerio HSP90-α的相似性为78%, HSP90-β的相似性为80%。
DNAman 8.0对14个代表物种HSP90的氨基酸序列进行了比对(图 2), 不同物种的HSP90氨基酸序列高度保守, 其家族的五个签名序列在所有比对物种中均存在, C端的MEEVD短肽序列也极其保守。
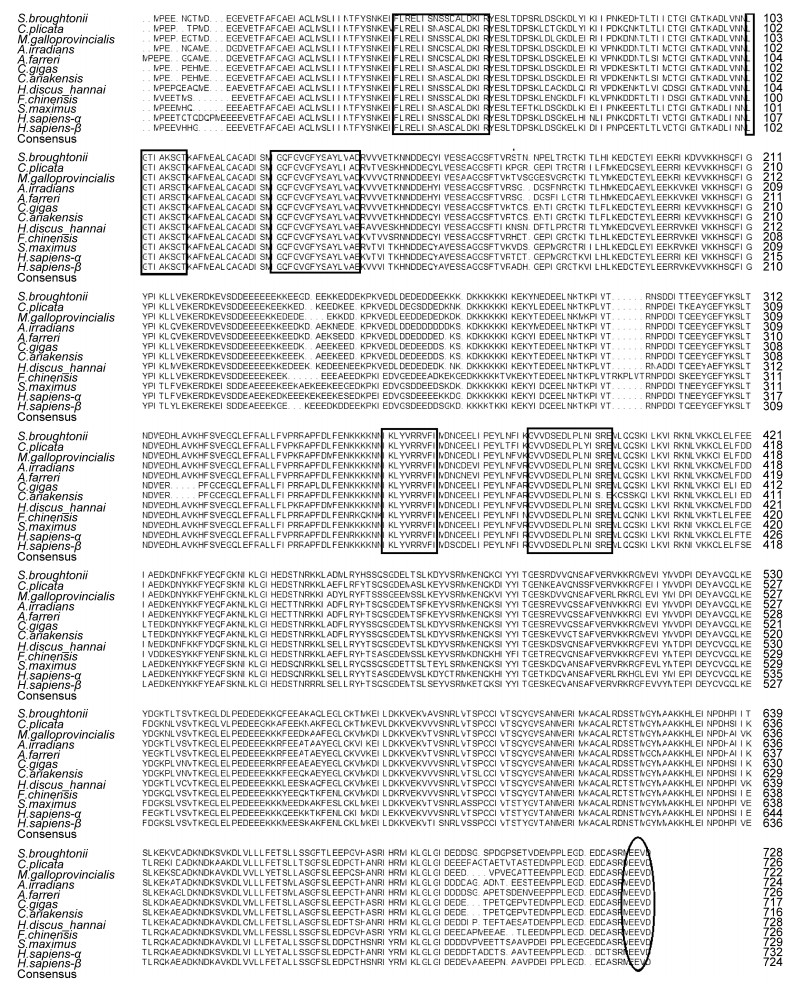 |
| 图 2 代表物种HSP90氨基酸多序列比对 Fig. 2 The multiple sequence alignment of HSP90 with DNAman 8.0 注: HSP90家族的五个签名序列用方框标出, 保守基序MEEVD用椭圆标出, 各物种GenBank登录号为:褶纹冠蚌Cristaria plicata (ADN87332), 紫贻贝M. galloprovincialis (CAJ85741), 长牡蛎C. gigas (ABS18268), 海湾扇贝A. irradians (ABS50431), 栉孔扇贝A. farreri (AAR11781), 近江牡蛎C. ariakensis (ADT63790), 皱纹盘鲍H. discus hannai (ACX94847), 大菱鲆Scophthalmus maximus (ABU50778), 中国对虾Fenneropenaeus chinensis (ABM92446), 人H. sapiens-(α, NP_005339; β, NP_031381) |
关于HSP90的Neighbor-joining系统进化树的进化分析结果如图 3:在HSP90分子进化树中可以分为脊椎动物、甲壳动物和软体动物三支。在脊椎动物聚类簇中, 分为HSP90-α和HSP90-β亚支; 在软体动物一支中, SbHSP90双壳类HSP90分子聚类后再与斧足类HSP90聚在一起。
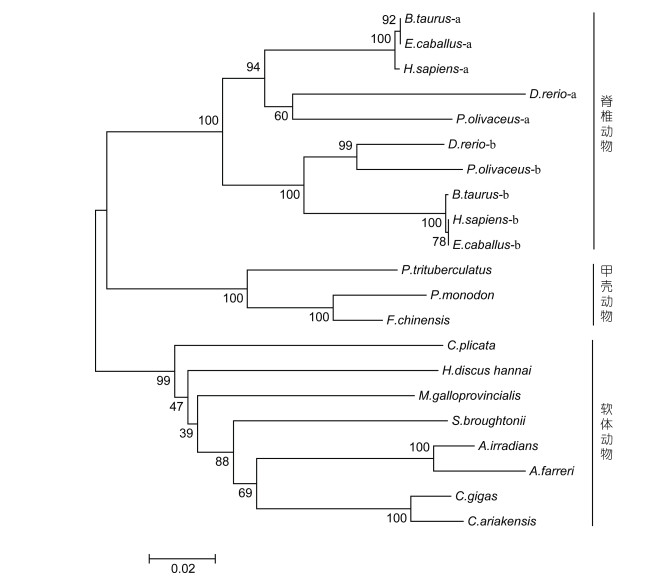 |
| 图 3 HSP90的Neighbour-Joining系统发育树 Fig. 3 The phylogenetic tree of HSP90s 注:来自不同物种HSP90的氨基酸序列的GenBank登录号如下:人H. sapiens-α (NP_005339), H.sapiens-β (NP_031381), 牛Bos taurus-α (NP_001012688), B. taurus-β (BAC82488), 马Equus caballus-α (Q9GKX7), E.caballus-β (Q9GKX8), 斑马鱼D. rerio-α (Q90474), D. rerio-β (O57521), 牙鲆P. olivaceus-α (ABG56393), P. olivaceus-β (ABG56394), 三疣梭子蟹Portunus trituberculatus (ACQ90225), 斑节对虾Penaeus monodon (ACO83357), 褶纹冠蚌C. plicata (ADN87332);紫贻贝M. galloprovincialis (CAJ85741), 长牡蛎C. gigas (ABS18268), 海湾扇贝A. irradians (ABS50431), 栉孔扇贝A. farreri (AAR11781);近江牡蛎C. ariakensis (ADT63790);皱纹盘鲍H. discus hannai (ACX94847), 中国对虾F. chinensis (ABM92446) |
qRT-PCR检测的组织分布结果(图 4)显示, SbHSP90分布于魁蚶所检测的外套膜、鳃、肝胰腺、血细胞、斧足和闭壳肌各组织中。相比于肝胰腺, SbHSP90在其他几种组织中表达量差异极显著, 且SbHSP90的表达量在除肝胰腺外的其他组织中彼此的表达量也呈极显著差异。斧足中的表达量明显地高于其他组织, 其次是血细胞。
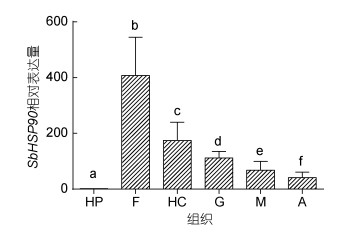 |
| 图 4 魁蚶SbHSP90的组织表达 Fig. 4 The tissue expression of SbHSP90 注: F.斧足; G.鳃; M.外套膜; HP.肝胰腺; A.闭壳肌; HC.血细胞。标不同字母表示差异极显著(P < 0.01) |
SbHSP90在鳗弧菌感染后上述6种组织中的免疫应激表达变化如图 5。结果显示:鳗弧菌刺激后, 诱导了SbHSP90的转录变化, 其在6种组织中的表达都显著上调:感染后4h, SbHSP90在各组织中的表达量无明显变化; 感染后8h在闭壳肌中的表达量达到最高值, 为对照组的4.19倍(P < 0.05);在斧足、鳃、外套膜和血细胞中, 于感染后16h其表达量到达最高值, 分别为对照组的6.48倍(P < 0.01)、4.72倍(P < 0.01)、10.33倍(P < 0.01)和8.67(P < 0.01)倍; 肝胰腺中是在感染后24h达到最高值, 为对照组的9.83倍(P < 0.01);随后, 各组织中的表达量开始回降; 然而, 在闭壳肌、血细胞及外套膜中SbHSP90的表达量分别于感染后32h、64h又一次出现表达高峰, 分别为对照组的6.60倍(P < 0.05)、3.94倍(P < 0.01)和5.97倍(P < 0.05)。总之, 经鳗弧菌感染后, SbHSP90的表达呈现出显著的时间依赖性, 并且在各组织中具有较明显的瞬时表达趋势。
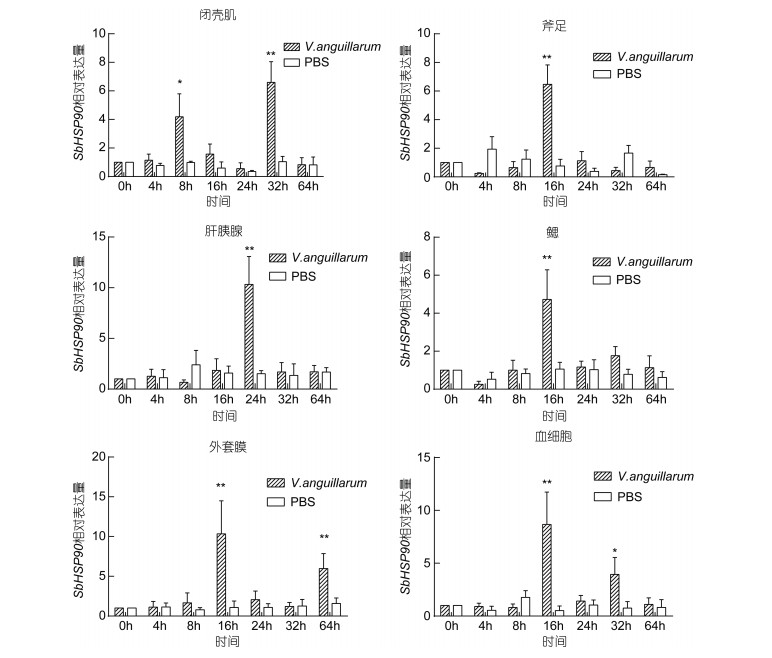 |
| 图 5 鳗弧菌感染后SbHSP90的免疫应激变化 Fig. 5 Change of SbHSP90 mRNA expression in six tissues after V. anguillarum challenge 注:与对照组相比, **表示组间差异极显著(P < 0.01), *表示组间差异显著(P < 0.05) |
HSP90参与调节多种蛋白质在非应激条件下的生物活性, 包括参与保护细胞免受损伤甚至凋亡的信号通路、细胞内多种的信号通路的激活和调控(Zhang et al, 2004; Brown et al, 2007)、免疫应答(Basu et al, 2001)以及生长、发育(Deane et al, 2003)、凋亡等。本文以魁蚶转录组文库中注释到的unigene为基础, 利用RACE技术克隆得到了HSP90基因的cDNA全长序列, 并分析其核苷酸及氨基酸序列。SbHSP90编码的由728个氨基酸残基组成的蛋白质具有5个保守的HSP90蛋白家族标签, 以及保守的ATPase功能位点, 其氨基酸序列的保守性说明成熟的SbHSP90很可能具有与高等动物HSP90蛋白的相似功能和活性; C末端的MEEVD短肽序列是所有胞质HSP90蛋白共同具有的特征(Gao et al, 2008), 也是HSP90与HSP70家族的一个唯一的共同特征(谢彦海, 2011), 该短肽间接调节HSP90与HSP70之间的联系, 使之形成一个多重分子伴侣复合体(Schenfler et al, 2000)。同源性分析结果显示SbHSP90编码的氨基酸与其它物种的HSP90氨基酸同源性都在80%左右。HSP90的序列比对、基因结构比对和同源性分析结果推测魁蚶HSP90很可能也是一个胞质蛋白, 但需要进一步的验证。
HSP90不仅对非生物因素如重金属、缺氧等产生反应, 而且对来自病原生物(如细菌、病毒)感染能产生免疫反应, 进而引起基因和蛋白水平的表达变化(谢彦海, 2011)。用鳗弧菌(V. anguillarum)、藤黄微球菌(Micrococcus luteus)刺激栉孔扇贝(A. farreri)和海湾扇贝(A. irradians), 发现两种菌对两种扇贝的HSP90都有正向调节作用, 于感染后9h达到表达高峰(Gao et al, 2008); 细菌刺激下, 褶纹冠蚌(C. plicata)HSP90基因的表达量随刺激时间的增加发生显著变化, 于刺激后12h表达量最大, 随后于刺激后48h恢复到初始水平。qRT-PCR分析结果显示SbHSP90在魁蚶所有的组织中均有表达, 这与其他物种HSP90的组织表达特点相似, 如皱纹盘鲍(H. discus hannai)(吴成龙, 2010)、中国对虾(F. chinensis)(栾伟, 2009)等; SbHSP90在血细胞中表达量较高, 可能是由于HSP90作为血淋巴细胞重要的免疫防御作用能够诱导氧化胁迫(Yu, 1994)。在细菌感染后, 不同生物体HSP90具有相似的表达规律, 说明存在一种共同的调节HSP90基因表达的机制, 但HSP90的诱导机制及其在免疫过程中的作用仍未知。鳗弧菌刺激后, 魁蚶各组织中HSP90基因的表达具有很明显的时间依赖性和瞬时表达趋势, 在鳃、斧足、外套膜和血细胞中, 刺激后16h SbHSP90表达量到达最高值, 在闭壳肌和肝胰腺中分别于刺激后8h、24h表达量达到最高值。有研究指出, 宿主被细菌感染后机体自身的免疫细胞会产生活性氧杀灭病原菌, 同时也对宿主自身的正常细胞产生损伤, 进而造成自身蛋白的变性, 变性蛋白在细胞内的累积诱导HSP90的产生(Gao et al, 2008); 也有研究表明, 宿主细胞的HSP90能识别并结合细菌表面的LPS, 使得细菌与某些免疫细胞结合(Erkeller-Yüksel et al, 1992; Huesea et al, 1998), 从而引起一系列的免疫反应清除异己成分(Trianiafilou et al, 2004)。SbHSP90的表达量达到表达高峰之后逐渐开始下降, 推测可能是因为感染的鳗弧菌在魁蚶体内大量繁殖, 降低了正常细胞的代谢能力; 抑或是少量鳗弧菌入侵细胞后, 被细胞启动的天然免疫过程抑杀。HSP90的上调表达有助于机体适应自身生理功能的改变(Rungrassamee et al, 2010), 作为生物环境适应性的一个指标, 在一定意义上体现着生物适应能力的增强(夏西超等, 2012)。
4 结论本研究成功克隆了魁蚶HSP90基因全长cDNA序列, 并分析了其核苷酸和氨基酸序列、蛋白结构和特点。qRT-PCR检测的组织表达模式结果显示SbHSP90基因在所检测的外套膜、斧足、血细胞、肝胰腺、鳃和闭壳肌中都有表达, 表达量有差异; 鳗弧菌免疫刺激后的表达变化在不同组织中显示出明显的时间依赖性和瞬间表达趋势。总之, 实验结果显示细菌感染魁蚶后引起SbHSP90显著变化, 暗示SbHSP90参与魁蚶的免疫过程。
| 齐忠彦, 1996. 中国经济软体动物. 北京: 中国农业出版社, |
| 吴成龙, 2010. 皱纹盘鲍抗氧化基因的克隆及其在营养调控下表达的研究. 青岛: 中国海洋大学博士学位论文, 1-155 http://cdmd.cnki.com.cn/Article/CDMD-10423-1011030171.htm |
| 陈晨, 2011. 近江牡蛎HSP90基因及其对理化胁迫和病原菌感染的反应. 广州: 暨南大学硕士学位论文, 1-72 http://cdmd.cnki.com.cn/Article/CDMD-10559-1011128035.htm |
| 周丽青, 杨爱国, 王清印, 等, 2013. 魁蚶血细胞分类及其免疫功能的初步分析. 水产学报, 37(4): 599–606 |
| 郑利兵, 吴彪, 刘志鸿, 等, 2015. 魁蚶(Scapharca broughtonii)半乳糖凝集素(SbGal)基因cDNA的克隆及表达分析. 海洋与湖沼, 46(5): 1061–1070 |
| 夏西超, 杨红, 王文锋等, 2012. 凡纳滨对虾热休克蛋白90基因cDNA全长克隆及表达分析, 31(11): 673-678 |
| 栾伟, 2009. 中国明对虾重要分子伴侣蛋白基因的克隆及表达研究. 青岛: 中国科学院海洋研究所博士学位论文, 1-143 http://cdmd.cnki.com.cn/Article/CDMD-80068-2009126121.htm |
| 谢彦海, 2011. 褶纹冠蚌热休克蛋白基因克隆与表达及2种淡水蚌的血细胞分析. 南昌: 南昌大学硕士学位论文, 1-134 http://cdmd.cnki.com.cn/Article/CDMD-11902-1012290858.htm |
| Basu S, Binder R J, Ramalingam T, et al, 2001. CD91 is a common receptor for heat shock proteins gp96, hsp90, hsp70, and calreticulin. Immunity, 14(3): 303–313 DOI:10.1016/S1074-7613(01)00111-X |
| Brown M A, Zhu L, Schmidt C, et al, 2007. Hsp90-From signal transduction to cell transformation. Biochemical and Biophysical Research Communications, 363(2): 241–246 DOI:10.1016/j.bbrc.2007.08.054 |
| Choi Y K, Jo P G, Choi C Y, 2008. Cadmium affects the expression of heat shock Protein 90 and metallothionein mRNA in the Pacific oyster, Crassostrea gigas. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 147(3): 286–292 |
| Csermely P, Schnaider T, Soti C, et al, 1998b. The 90-kDa molecular chaperone family:structure, function, and clinical applications. A comprehensive review. Pharmacology & Therapeutics, 79(2): 129–168 |
| Csermely P, Schnaider T, Szántó I, 1998a. Possible nuclear functions of the major molecular chaperones of the eukaryotic cytoplasm, Hsp90. Current Science, 74(5): 442–445 |
| Deane E E, Woo N Y, 2003. Ontogeny of thyroid hormones, cortisol, hsp70 and hsp90 during silver sea bream larval development. Life Sciences, 72(7): 805–818 DOI:10.1016/S0024-3205(02)02334-2 |
| Erkeller-Yüksel F M, Isenberg D A, Dhillon V B, et al, 1992. Surface expression of the heat shock protein 90 by blood mononuclear cells from patients with systemic lupus erythematous. Journal of Autoimmunity, 5(6): 803–814 DOI:10.1016/0896-8411(92)90194-U |
| Gao Q, Song L S, Ni D J, et al, 2007. cDNA cloning and mRNA expression of heat shock protein 90 gene in the haemocytes of Zhikong scallop Chlamys farreri. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 147(4): 704–715 DOI:10.1016/j.cbpb.2007.04.010 |
| Gao Q, Zhao J M, Song L S, et al, 2008. Molecular cloning, characterization and expression of heat shock protein 90 gene in the haemocytes of bay scallop Argopecten irradians. Fish & Shellfish Immunology, 24(4): 379–385 |
| Huesea M, Goodwin A, Bhagwansingh A, et al, 1998. Characterization of an acid-pH-inducible stress protein (hsp70), a putative sulfatide binding adhesin, from Helicobacter pylori. Infection and Immunity, 66(9): 4061–4067 |
| Lindquist S, 1986. The heat-shock response. Annual Review of Biochemistry, 55(1): 1151–1191 DOI:10.1146/annurev.bi.55.070186.005443 |
| Lindquist S, Craig E, 1988. The heat-shock proteins. Annual Review of Genetics, 22(1): 631–677 DOI:10.1146/annurev.ge.22.120188.003215 |
| Livak K J, Schmittgen T D, 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CT method. Methods, 25(4): 402–408 DOI:10.1006/meth.2001.1262 |
| Nadeau K, Das A, Walsh C T, 1993. Hsp90 chaperonins possess ATPase activity and bind heat shock transcription factors and peptidyl prolyl isomerases. Journal of Biological Chemistry, 268(2): 1479–1487 |
| Niu C J, Rummer J L, Brauner C J, et al, 2008. Heat shock protein (Hsp70) induced by a mild heat shock slightly moderates plasma osmolarity increases upon salinity transfer in rainbow trout (Oncorhynchus mykiss). Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 148(4): 437–444 |
| Pan F, Zarate J M, Tremblay G C, et al, 2000. Cloning and characterization of salmon hsp90 cDNA:upregulation by thermal and hyperosmotic stress. Journal of Experimental Zoology Part A:Comparative Experimental Biology, 287(3): 199–212 DOI:10.1002/(ISSN)1097-010X |
| Pantzartzl C N, Kourtidis A, Drosopoulou E, et al, 2009. Isolation and characterization of two cytoplasmic hsp90s from Mytilus galloprovincialis (Mollusca:Bivalvia) that contain a complex promoter with a p53 binding site. Gene, 431(1-2): 47–54 DOI:10.1016/j.gene.2008.10.028 |
| Parsell D A, Lindquist S, 1993. The function of heat-shock proteins in stress tolerance:degradation and reactivation of damaged proteins. Annual Review of Genetics, 27(1): 437–496 DOI:10.1146/annurev.ge.27.120193.002253 |
| Rungrassamee W, Leelatanawit R, Jiravanichpaisal P, et al, 2010. Expression and distribution of three heat shock protein genes under heat shock stress and under exposure to Vibrio harveyi in Penaeus monodon. Developmental & Comparative Immunology, 34(10): 1082–1089 |
| Scheufler C, Brinker A, Bourenkov G, et al, 2000. Structure of TPR domai-Peptide complexes:critical elements in the assembly of the HSP70-HSP90 multichaperone machine. Cell, 101(2): 199–210 DOI:10.1016/S0092-8674(00)80830-2 |
| Yu B P, 1994. Cellular defenses against damage from reactive oxygen species. Physiological Reviews, 74(1): 139–162 |
| Zhang H, Burrows F, 2004. Targeting multiple signal transduction pathways through inhibition of Hsp90. Journal of Molecular Medicine, 82(8): 488–499 |
| Zheng L B, Liu Z H, Wu B, et al, 2016. Ferritin has an important immune function in the ark shell Scapharca broughtonii. Developmental & Comparative Immunology, 59: 15–24 |
| Zheng L B, Wu B, Liu Z H, et al, 2015. A manganese Superoxide dismutase (MnSOD) from ark shell, Scapharca broughtonii:molecular characterization, expression and immune activity analysis. Fish & Shellfish Immunology, 45(2): 656–665 |
 2018, Vol. 49
2018, Vol. 49


