中国海洋湖沼学会主办。
文章信息
- 徐鹏, 刘好真, 刘懂, 焦海峰, 王一农, 尤仲杰. 2018.
- XU Peng, LIU Hao-Zhen, LIU Dong, JIAO Hai-Feng, WANG Yi-Nong, YOU Zhong-Jie. 2018.
- 基于多元统计分析的渔山列岛潮间带软体动物功能群和次级生产力比较
- THE SECONDARY PRODUCTIVITY OF MOLLUSK IN THE INTERTIDAL ZONE OF YUSHAN ISLANDS AND COMPARATION STUDY BASED ON MULTIVARIATE STATISTICAL ANALYSIS
- 海洋与湖沼, 49(1): 151-159
- Oceanologia et Limnologia Sinica, 49(1): 151-159.
- http://dx.doi.org/10.11693/hyhz20170600162
-
文章历史
- 收稿日期:2017-06-20
- 收修改稿日期:2017-07-23
2. 宁波市海洋与渔业研究院 宁波 315103
2. Zhejiang Ningbo Academy of Oceanology and Fisheries, Ningbo 315103, China
潮间带是海洋生态系统中生产力较高的区域, 对生态系统具有支撑、服务的作用(Cushing, 1988)。软体动物在潮间带生态系统扮演重要的角色, 对环境变化敏感, 其种类组成和数量变化能客观地反应环境变迁(Dittmann, 2000; Weis et al, 2003)。次级生产力作为衡量生物群落结构特征和生产能力的量值(Downing, 1984), 在生态学动力机制的定量研究方面具有重要的作用, 对合理配置自然资源具有重要的指导意义(Waters, 1977)。
国内外许多研究人员已经对河流、湖泊和海湾等地区开展了底栖动物次级生产力的研究。目前既有对单个物种次级生产力的专项研究, 如:欧洲南部褐虾(Crangon crangon) (Viegas et al, 2007), 地中海Paramuricea clavata (Mistri et al, 1994), 也有对于大型底栖动物次级生产力的报道, 如:德国Northern Wadden海域潮间带底栖动物(Asmus, 1987)。国内目前见有深圳湾北岸泥滩和湄洲湾泥滩大型底栖动物次级生产力的研究(金亮等, 2007, 2009), 福建海坛海峡潮间带大型底栖动物群落结构及次级生产力的研究(吕小梅等, 2008), 廉州湾滨海湿地潮间带大型底栖动物群落次级生产力(何斌源等, 2013), 渔山列岛岩礁潮间带大型底栖动物次级生产力的研究(焦海峰等, 2011), 但针对于潮间带软体动物在近30年来次级生产力的对比研究未见报道。
为此, 本文以1982年和2010年3个季节的渔山列岛潮间带软体动物样本数据为研究对象, 采用Excel、SPSS、R语言等软件进行数据处理与分析, 以了解渔山列岛潮间带软体动物的时空分布差异, 为保护渔山列岛的生态环境、可持续利用潮间带生物资源和维持潮间带生物多样性提供科学的数据分析。
1 研究区域与方法 1.1 研究区域渔山列岛位于浙江省沿海中部, 隶属于宁波市象山县石浦镇(28°52′40′′-28°53′40′′N, 121°14′10′′-121°16′10′′E)。岛礁总面积约2km2, 海岛岸线总长约20.8km。渔山列岛远离大陆, 受陆源排污的影响较小, 是我国东部沿海典型海岛, 贝藻资源丰富, 海洋环境质量相对较好, 生态系统较完整, 于2008年8月正式成为国家级海洋生态特别保护区。见图 1。
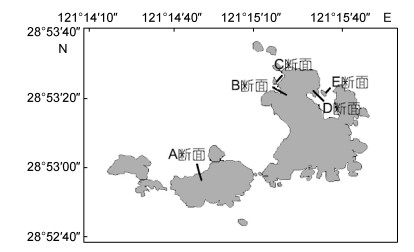 |
| 图 1 渔山列岛潮间带软体动物动物采样断面分布示意图 Fig. 1 Distribution of mosaic profiles of mollusks in the intertidal zone of Yushan Islands, East China Sea |
由同一课题组人员分别于1982年和2010年在北渔山列岛潮间带选取5个断面(图 1), 于潮水大潮期在每个断面的高、中、低潮区预设的3-5个采样站进行软体动物调查采样, 每站使用25cm×25cm定量采样框, 将获取的样本用5%福尔马林溶液进行现场固定后并带回实验室分析, 样本的采集、处理以及室内分析的资料均按照《海洋调查规范》(GB 12763.6)(中华人民共和国国家质量监督检验检疫总局, 2007)的要求进行, 所有标本鉴定到种。
1.3 数据计算Shannon-wiener多样性指数(Levins, 1968; 马克平, 1994):
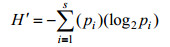 (1)
(1)式中, S为软体动物的种类总数, pi为第i种软体生物的生物量/栖息密度占总生物量/总栖息密度的比例, 即pi = ni /N。
Pielou均匀度指数(马克平, 1994; Pielou, 1994):
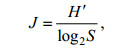 (2)
(2)式中, H′为群落的Shannon-Wiener指数, S为采集的生物种类总数。
软体动物次级生产力的计算采用于子山等(Pielou, 1994)的简化公式:
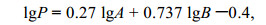 (3)
(3)式中, P为软体动物年平均次级生产力[AFDM, g/(m2·a)]; A为软体动物年均栖息密度(ind/m2); B为软体动物年均去灰干重生物量(g/m2); 由栖息密度和去灰干重生物量计算群落的次级生产力。国际文献中多用年次级生产(AFDM, g/m2)来描述次级生产力[AFDM, g/(m2·a)]。
1.4 数据分析利用Excel对每种软体动物生物量/栖息密度数据进行统计, 并分别计算这些站位软体动物的Shannon-Wiener多样性指数和Pielou均匀度指数。以上指数的计算中, 采用栖息密度数据进行运算。为减小计算结果受种间差异的影响, 各物种的生物量/栖息密度均进行四次方根转化(Clarke, 1993; Olsgard et al, 1997)。对1982年和2010年渔山列岛潮间带不同潮位的软体动物分别进行统计, 统计各种软体动物的生物量(湿质量: g/m2)和栖息密度(ind/m2), 其中生物量干质量占湿质量的1/5, 去灰干质量(ash free dry mass, AFDM)占干质量的9/10, 然后利用去灰干质量计算出各种软体动物的次级生产力。
本研究将获得的各个物种栖息密度和生物量按照潮带进行均数计算, 得到各个物种的年均栖息密度和年均生物量。再计算各软体动物的年次级生产力及年均次级生产力, 整个软体动物群落的年总次级生产力即是所有种群的年次级生产力总和。
利用SPSS 22.0进行独立样本T检验和方差分析, 利用R语言对P值进行层次聚类, 分析个体贡献值大小。
2 结果与分析 2.1 群落种类组成1982年定量调查获得软体动物36种, 2010年定量调查获得软体动物37种, 总种类数为51种, 年际间种类数差异不明显, 物种类别差异较大, 种类组成不同(图 2, 图 3)。1982年主要优势种包括:短滨螺(Littorina brevicula)、小结节滨螺(Nodilittorina radiata)、单齿螺(Monodonta labio)、日本菊花螺(Siphonaria japonica)、条纹隔贻贝(Septifer virgatus)、锈凹螺(Chlorostoma rustica)等; 2010年主要优势种包括:短滨螺、单齿螺、条纹隔贻贝、拟蜒单齿螺(Monodonta neritoides)、嫁蝛(Cellana toreuma)、疣荔枝螺(Thais clavigera)、覆瓦小蛇螺(Serpulorbis imbricata)等。
2.2 栖息密度、生物量及分布特征1982年, 渔山列岛潮间带软体动物年平均栖息密度为2758ind/m2, 年平均生物量为2100.26g/m2; 2010年, 渔山列岛潮间带软体动物年平均栖息密度为699ind/m2, 年平均生物量1101.85g/m2。1982年和2010年春、夏、冬三季总栖息密度和总生物量比较(表 1)。聚类分析表明, 1982年和2010年栖息密度和生物量存在明显的分组。1982年的栖息密度和生物量 > 2010年的栖息密度和生物量, 1982年年内季节间栖息密度差异显著(P < 0.05), 表现为春 > 夏 > 冬, 1982年年内季节间生物量差异显著(P < 0.05), 表现为夏 > 春 > 冬; 2010年年内季节间栖息密度差异显著(P < 0.05), 表现为春 > 夏 > 冬, 2010年内季节间生物量差异显著(P < 0.05), 表现为夏 > 冬 > 春。1982年年内不同潮间带栖息密度差异显著(P < 0.05), 表现为中潮带 > 高潮带 > 低潮带, 1982年年内不同潮间带生物量差异显著(P < 0.05), 表现为中潮带 > 低潮带 > 高潮带; 2010年年内不同潮间带栖息密度差异显著(P < 0.05), 表现为高潮带 > 低潮带 > 中潮带, 2010年年内不同潮间带生物量差异显著(P < 0.05), 表现为低潮带 > 中潮带 > 高潮带(图 2, 图 3)。
| 年份 | 季节 | 栖息密度(ind/m2) | 生物量(g/m2) |
| 1982 | 春 | 3082 | 2570.56 |
| 夏 | 2609 | 1806.12 | |
| 冬 | 2583 | 1924.10 | |
| 2010 | 春 | 837 | 650.20 |
| 夏 | 767 | 1594.60 | |
| 冬 | 492 | 1060.77 |
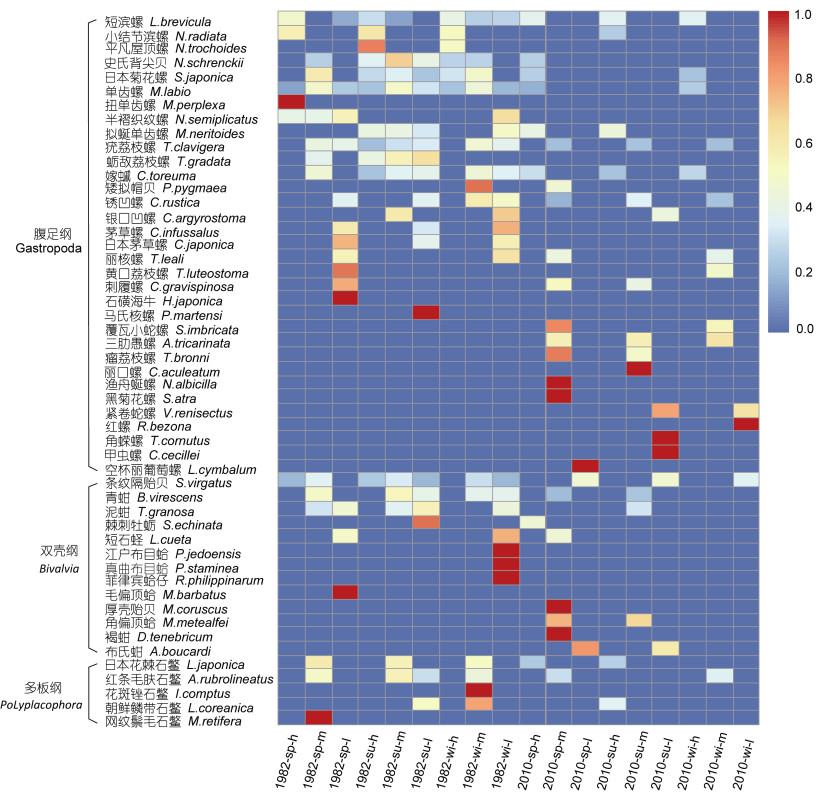 |
| 图 2 渔山列岛潮间带软体动物年际间栖息密度分布 Fig. 2 The interannual distribution of mollusks density in the intertidal zone of Yushan Islands 注: sp:春季; su:夏季; wi:冬季; h:高潮带; m:中潮带; l:低潮带 |
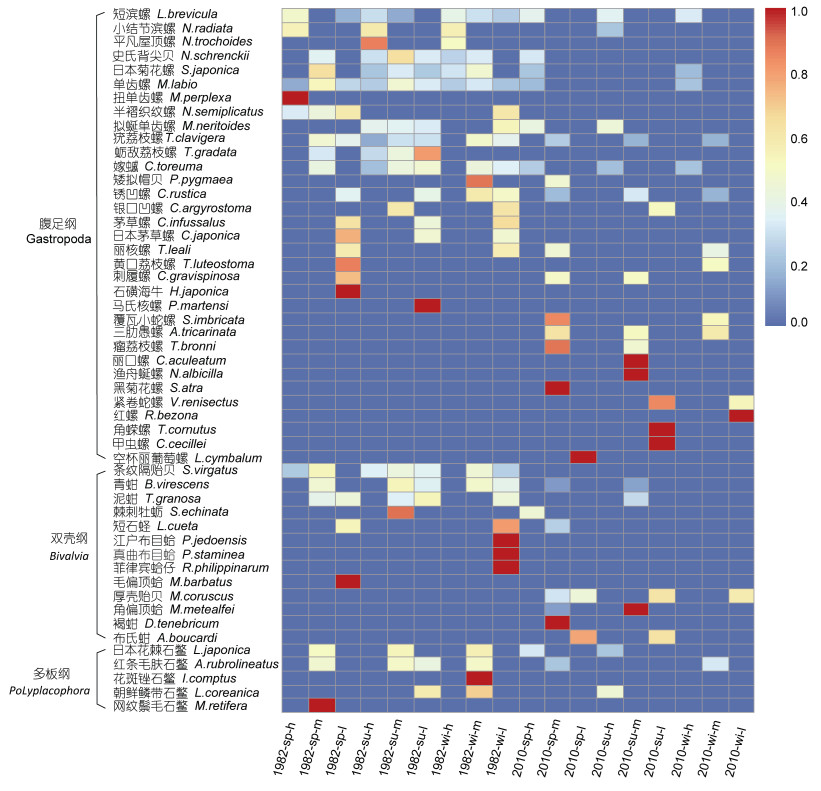 |
| 图 3 渔山列岛潮间带软体动物年际间生物量分布 Fig. 3 The interannual distribution of mollusks biomass in the intertidal zone of Yushan Islands 注: sp:春季; su:夏季; wi:冬季; h:高潮带; m:中潮带; l:低潮带 |
根据渔山列岛潮间带所获软体动物种类, 将渔山列岛软体动物划分为4种功能群:植食性(Ph)、肉食性(C)、滤食性(Pl)、杂食性(O), 并统计渔山列岛软体动物各功能群种类数、年均栖息密度、年均生物量所占百分比。1982年4种功能群所含种类数占全部种类数百分比顺序是Ph > O > Pl > C, 4种功能群年均栖息密度百分比的顺序是Ph > O > Pl > C, 4种功能群年均生物量百分比的顺序是Ph > Pl > O > C; 2010年4种功能群所含种类数占全部种类数百分比顺序是O > Ph > Pl > C, 4种功能群年均栖息密度百分比的顺序是Ph > Pl > O > C, 4种功能群年均生物量百分比的顺序是Pl > O > Ph > C。2010年相比较于1982年, 在功能群所含种类数占全部种类数百分比上, Ph功能群由33.33%下降到27.03%, Pl功能群几乎没有变化, 其它两种功能群均有所上升, 在功能群年均栖息密度百分比上, Pl功能群有着明显的上升, 从8.70%上升到43.45%, 其他三种功能群有着明显的下降, 在功能群年均生物量百分比上, Pl功能群也有明显的上升, 从19.82%上升到73.04%, 其他三种功能群同样有着明显的下降, 表明生物群落结构有着明显的变化(图 4)。
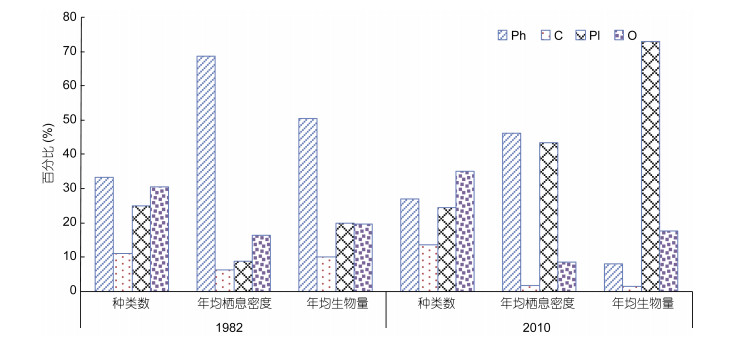 |
| 图 4 渔山列岛潮间带软体动物年际间不同功能群体种类数、年均丰度、年均生物量所占百分比 Fig. 4 The interannual percentage of species number, annual average density, annual average biomass of mollusks in the intertidal zone of Yushan Islands, East China Sea 注: Ph:植食性; C:肉食性; Pl:滤食性; O:杂食性 |
对该区域的软体动物物种多样性指数和均匀度指数统计, 显示该区域软体动物物种多样性指数和均匀度指数较低, 软体动物以短滨螺为高潮区主要生存种。单因素ANOVA检验表明, 1982年与2010年两年间软体动物物种多样性指数差异显著(F=5.846, P=0.028 < 0.05), 两年间软体动物物种均匀度指数差异不显著(F=2.447, P=0.137 > 0.05), 其中1982年物种多样性指数统计值为2.424介于2-3之间, 表明1982年属于轻度扰动状态, 而2010年物种多样性指数统计值为1.253介于1-2之间, 表明2010年属于受中度扰动状态, 物种均匀度指数统计值由1982年的0.814降到2010年的0.517, 表明随着时间的变化, 软体动物整体的多样性指数有明显的下降(图 5)。
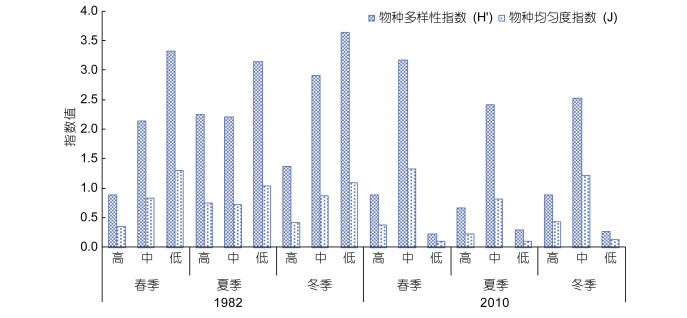 |
| 图 5 渔山列岛潮间带软体动物的物种多样性指数和均匀度指数 Fig. 5 The species diversity index and evenness index of mollusks in the intertidal zone of Yushan Islands, East China Sea |
1982年软体动物年平均次级生产力为240.04g/ (m2·a), 年均P/B的值为0.63a–1, 2010年软体动物年平均次级生产力为94.82g/(m2·a), 年均P/B的值为0.55a–1 (表 2)。基于P值进行条件聚类, 结果表明, 1982年软体动物次级生产力可分为3类, 第一类P > 18.83, 平均P值为51.5, 第二类11.36 < P < 18.83, 平均P值为17.0, 第三类P < 11.36, 平均P值为3.595, 种类最多, 占种类数的30/36。2010年软体动物次级生产力可分为2类, 第一类P > 9.7, 平均P值为36.0, 第二类P < 9.7, 平均P值为2.71, 种类最多, 占种类总数的35/37(表 3)。
| 年份 | 栖息密度(ind/m2) | 去灰干重生物量(g/m2) | 次级生产力[(AFDM, g/(m2·a)] | P/B |
| 1982 | 2758 | 378.05 | 240.04 | 0.63 |
| 2010 | 622 | 173.87 | 94.82 | 0.55 |
| 年份 | P值聚类 | 平均值 | 种类数 |
| 1982 | P > 18.83 | 51.5 | 2 |
| 11.36 < P < 18.83 | 17.0 | 4 | |
| P < 11.36 | 3.6 | 30 | |
| 2010 | P > 9.7 | 36 | 2 |
| P < 9.7 | 2.7 | 35 |
单因素方差分析表明, 软体动物次级生产力年际间差异显著(F=5.761, P < 0.05), 而季节间差异不显著(F=0.135, P > 0.05), 潮带间差异不显著(F=2.076, P > 0.05), LSD分析表明各因素交互作用不明显, 渔山列岛潮间带软体动物差异主要由时间差异产生(表 4)。分析表明年际间总次级生产力在不同季节和潮位上均有很明显的下降现象, 其中春季和冬季次级生产力的下降最为明显, 而且在中潮带和低潮带中次级生产力的下降最为明显, 其中比较特别的是夏季低潮带次级生产力有着明显的增加(图 6)。
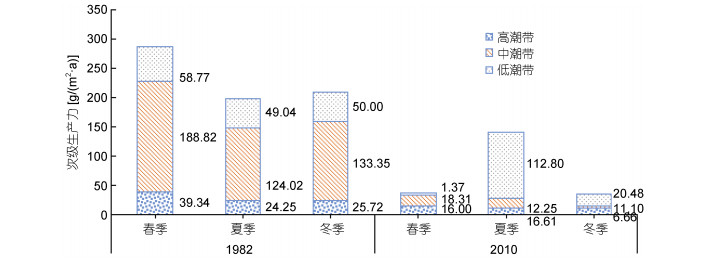 |
| 图 6 渔山列岛潮间带软体动物年际间各潮带次级生产力 Fig. 6 The interannual secondary productivity of each intertidal zone of mollusk in the intertidal zone of Yushan Islands, East China Sea |
| 单因素方差分析 | F值 | 显著性水平 | 自由度 |
| 年际间差异性 | 5.761 | 0.029 | 17 |
| 季节间差异性 | 0.135 | 0.874 | 17 |
| 潮带间差异性 | 2.076 | 0.160 | 17 |
本研究对渔山列岛潮间带共定量采集有51种软体动物, 其中1982年有36种, 2010年有37种, 不同年份间物种总种类数没有大的差别, 但物种组成发生了很大改变, 说明近30年间渔山列岛在软体动物类群上发生了明显的演替, 这与胶州湾物种由20世纪80年代的6个群落变为20世纪90年代的5个群落的演替(于子山等, 2001)现象相似。栖息密度和生物量都有明显下降, 造成这一结果的原因可能是由于随着渔山列岛海洋公园的开发, 渔山列岛知名度增加, 上岛从事海钓、专业采捕和散客旅游的人数越来越多。
3.2 次级生产力影响因素分析潮间带软体动物次级生产力受温度、盐度、溶氧、水深、沉积物中有机质含量、叶绿素a等各种环境因子的影响(Tumbiolo et al, 1994; 王宗兴等, 2011; 徐兆东, 2015), Tumbiolo等(1994)研究表明, 生物量、栖息密度分布与次级生产力密切相关, 且次级生产力与生物量相关性最显著(r=0.96), 袁伟等(2007)研究表明, 次级生产力与生物量呈极显著相关(P=0.000), 而与栖息密度相关性不显著, 叶绿素a与次级生产力和生物量均显著相关(P=0.028) (王宗兴等, 2011), 本研究也验证次级生产力与生物量和栖息密度相关, 但是相关程度有所差异。与杨泽华等(2011)、焦海峰等(2011)研究对比, 次级生产力贡献率大的关键软体动物种生物量的多少对次级生产力与生物量、栖息密度相关性大小有着重要影响, 关键种生物量大, 次级生产力与生物量相关性较强; 反之, 关键种生物量小, 次级生产力与栖息密度相关性较强, 这与严娟等(2012)的结果相一致, 其中2010年夏季低潮带次级生产力有着明显的增加, 这与条纹隔贻贝次级生产力有着明显的增加有关, 通过对当地人的调查, 发现此前条纹隔贻贝非当地人主要采食对象, 因此其人为采捕压力小, 在软体动物的竞争中占据着优势。
Brey等(Mistri et al, 2001)和袁伟等(2007)研究均指出, 随着水深的增加软体动物群落的次级生产力会随之下降, 本研究发现渔山列岛潮间带软体动物次级生产力并非一直随着水深的增加而下降, 说明软体动物在大型底栖生物群落次级生产力的贡献方式不随着整体的大型底栖生物次级生产力的变化而呈线性变化, 造成这种情况的原因可能是因为软体动物与其他动物存在生物竞争, 另一种原因是当地人比较喜欢捕食单齿螺、疣荔枝螺等软体动物, 造成了软体动物次级生产力的方向性改变。本研究还发现, 软体动物年总次级生产力与软体动物群落物种的食性变化有很大关系, 植食性软体动物是次级生产力的主要贡献种, 控制对次级生产力有极大贡献的食性种保护, 对于保护潮间带生产能力有着重要的意义。
3.3 P/B值与群落结构稳定性根据Tumbiolo等(1994)的论述, P/B值代表生物量轮回的次数, 该数值的大小与生物轮回的周期密切相关, 并且它是一个与生物及其环境因子有密切关系的比值, 能够间接反映生物的新陈代谢率和世代更替的快慢。一年多代的种类其年P/B值较分散, 但在3-13a–1区间内均匀分布; 年P/B峰值在5-6a–1之间代表一年两代, 而一年一代, 年P/B峰值在4-5a–1之间(Teske et al, 2001); 两年一代物种年P/B峰值在2-3a–1之间; 多年一代, 种类年P/B系数较小, 峰值在0-1a–1之间(Asmus, 1987), 本次研究渔山列岛潮间带年总平均P/B的值, 1982年为0.63, 2010年降到0.55, 分布在0.32-1.94a–1之间, 表明渔山列岛软体动物由1982年的一年0.63代变为2010年的一年0.55代, 说明近30年来渔山列岛潮间带软体动物稳定性变差, 其生存环境受到破坏。这一结果为亟需开展渔山列岛海洋生态环境保护提供了重要的科学依据。
4 结论1982年与2010年的调查结果比较表明, 近30年来研究区潮间带软体动物在物种总数上没有明显差别, 但物种组成结构发生了很大改变。此次调查发现次级生产力与生物量和栖息密度有着密切的关系。2010年的年均次级生产力小于1982年的年均次级生产力, 且2010年的年均P/B值小于1982年的年均P/B值, 说明近30年来该区潮间带软体动物的更新换代变慢, 其生存环境受到较大破坏。因此, 亟需开展渔山列岛的海洋生态环境保护。本文的研究结果对此提供了重要的科学依据, 可供相关部门参考。
| 于子山, 张志南, 韩洁, 2001. 渤海大型底栖动物次级生产力的初步研究. 青岛海洋大学学报, 31(6): 867–871 |
| 马克平, 1994. 生物群落多样性的测度方法Iα多样性的测度方法(上). 生物多样性, 2(3): 162–168 DOI:10.17520/biods.1994027 |
| 王宗兴, 孙丕喜, 刘彩霞, 等, 2011. 桑沟湾大型底栖动物的次级生产力. 应用与环境生物学报, 17(4): 495–498 |
| 中华人民共和国国家质量监督检验检疫总局, 2007. 海洋调查规范第6部分:海洋生物调查. 北京: 中国标准出版社, 1-157 |
| 吕小梅, 方少华, 张跃平, 等, 2008. 福建海坛海峡潮间带大型底栖动物群落结构及次级生产力. 动物学报, 54(3): 428–435 |
| 严娟, 庄平, 侯俊利, 等, 2012. 长江口潮间带大型底栖动物次级生产力及其影响因子. 应用与环境生物学报, 18(6): 935–942 |
| 杨泽华, 童春富, 陆健健, 2007. 盐沼植物对大型底栖动物群落的影响. 生态学报, 27(11): 4387–4393 DOI:10.3321/j.issn:1000-0933.2007.11.002 |
| 何斌源, 赖廷和, 王欣, 等, 2013. 廉州湾滨海湿地潮间带大型底栖动物群落次级生产力. 生态学杂志, 32(8): 2104–2112 |
| 金亮, 林秀春, 蔡立哲, 2009. 湄洲湾贝类养殖滩涂大型底栖动物次级生产力研究. 海洋环境科学, 28(S1): 8–11 |
| 金亮, 蔡立哲, 周细平, 等, 2007. 深圳湾北岸泥滩大型底栖动物次级生产力研究. 台湾海峡, 26(3): 415–421 |
| 袁伟, 张志南, 于子山, 2007. 胶州湾西部海域大型底栖动物次级生产力初步研究. 应用生态学报, 18(1): 145–150 |
| 徐兆东, 2015. 胶州湾大型底栖动物生态学研究及功能群初探. 青岛: 中国海洋大学硕士学位论文 http://cdmd.cnki.com.cn/Article/CDMD-10423-1015716208.htm |
| 焦海峰, 施慧雄, 尤仲杰, 等, 2011. 浙江渔山列岛岩礁潮间带大型底栖动物次级生产力. 应用生态学报, 22(8): 2173–2178 |
| Asmus H, 1987. Secondary production of an intertidal mussel bed community related to its storage and turnover compartments. Marine Ecology Progress Series, 39: 251–266 DOI:10.3354/meps039251 |
| Clarke K R, 1993. Non-parametric multivariate analyses of changes in community structure. Austral Ecology, 18(1): 117–143 DOI:10.1111/aec.1993.18.issue-1 |
| Cushing D H, 1988. The flow of energy in marine ecosystems, with special reference to the continental shelf. In: Postma H, Zijlstra J J eds. Ecosystems of the World: Continental Shelves, 27H. Amsterdam: Elsevier, 203-230 |
| Dittmann S, 2000. Zonation of benthic communities in a tropical tidal flat of north-east Australia. Journal of Sea Research, 43(1): 33–51 DOI:10.1016/S1385-1101(00)00004-6 |
| Downing J A, 1984. Assessment of secondary production: The first step. In: Downing J A, Rigler F H eds. A Manual on Methods for the Assessment of Secondary Productivity in Fresh Waters. IBP handbook No. 16. 2nd ed. Oxford: Blackwell Scientific Publications, 1-18 |
| Levins R, 1968. Evolution in Changing Environments:Some Theoretical Explorations. Princeton: Princeton University Press, |
| Mistri M, Ceccherelli V U, 1994. Growth and secondary production of the Mediterranean gorgonian Paramuricea clavata. Marine Ecology Progress Series, 103: 291–296 DOI:10.3354/meps103291 |
| Mistri M, Rossi R, Fano E A, 2001. Structure and secondary production of a soft bottom macrobenthic community in a Brackish Lagoon (Sacca di Goro, north-eastern Italy). Estuarine, Coastal and Shelf Science, 52(5): 605–616 DOI:10.1006/ecss.2001.0757 |
| Olsgard F, Somerfield P J, Carr M R, 1997. Relationships between taxonomic resolution and data transformations in analyses of a macrobenthic community along an established pollution gradient. Marine Ecology Progress Series, 149: 173–181 DOI:10.3354/meps149173 |
| Pielou E C, 1994. Into the ecology breach. (book reviews:an introduction to mathematical ecology). An introduction to the mathematical theory of the Navier-Stokes equations. Springer-Verlag, 169-174 |
| Teske P R, Wooldridge T, 2001. A comparison of the macrobenthic faunas of permanently open and temporarily open/closed South African estuaries. Hydrobiologia, 464(1-3): 227–243 |
| Tumbiolo M L, Downing J A, 1994. An empirical model for the prediction of secondary production in marine benthic invertebrate populations. Marine Ecology Progress Series, 114: 165–174 DOI:10.3354/meps114165 |
| Viegas I, Martinho F, Neto J, et al, 2007. Population dynamics, distribution and secondary production of the brown shrimp Crangon crangon (L.) in a southern European estuary. Latitudinal variations. Latitudinal variations. Scientia Marina, 71(3): 451–460 DOI:10.3989/scimar.2007.71n3 |
| Waters T F, 1977. Secondary production in inland waters. Advances in Ecological Research, 10: 91–164 DOI:10.1016/S0065-2504(08)60235-4 |
| Weis J S, Weis P, 2003. Is the invasion of the common reed, Phragmites australis, into tidal marshes of the eastern US an ecological disaster?. Marine Pollution Bulletin, 46(7): 816–820 DOI:10.1016/S0025-326X(03)00036-5 |
 2018, Vol. 49
2018, Vol. 49


