中国海洋湖沼学会主办。
文章信息
- 吴燕, 魏梦泽, 苏倡, 明庭红, 蒋琴琴, 司开学, 周君, 苏秀榕. 2018.
- WU Yan, WEI Meng-Ze, SU Chang, MING Ting-Hong, JIANG Qin-Qin, SI Kai-Xue, ZHOU Jun, SU Xiu-Rong. 2018.
- 泥蚶(Tegillarca granosa)重组铁蛋白富集锰铁后的磁学性质解析
- THE MAGNETIC PROPERTIES OF Fe-FERRITIN AND Mn-FERRITIN FROM TEGILLARCA GRANOSA LINNAEUS
- 海洋与湖沼, 49(1): 168-173
- Oceanologia et Limnologia Sinica, 49(1): 168-173.
- http://dx.doi.org/10.11693/hyhz20170600171
-
文章历史
- 收稿日期:2017-06-26
- 收修改稿日期:2017-07-28
2. 宁波职业技术学院 宁波 315800
2. Ningbo Polytechnic, Ningbo 315800, China
泥蚶(Tegillarca granosa Linnaeus), 隶属于软体动物门(Mollusca), 瓣鳃纲(Lamellibranchia), 蚶目(Arcoida), 蚶科(Arcidae), 泥蚶属(Tegillarca), 俗称花蚶、血蚶、粒蚶等, 在中国主要分布在山东半岛以南海区。因其富含营养, 味道美味, 同时含有特有的维生素B12和血红蛋白, 在补血养胃、除淤散积、化疾制酸上具有功效, 是一种滋补佳品, 颇受人们欢迎, 作为一种传统美食在沿海地区出现(苏秀榕等, 2005; 姚韩韩等, 2011)。
铁结合蛋白(ferritin)简称铁蛋白, 于1937年由捷克生物学家Laufberger教授在分离纯化马的脾脏过程中获得。存在的动物铁蛋白主要在脾、肝、骨骼肌、骨髓和肠黏膜中分布。植物铁蛋白则主要分布在低光合活性的非绿色质体种子、幼苗、根的顶部和豆科植物年幼的根瘤等中(陈静等, 2010)。由蛋白外壳和铁内核两部分构成典型的铁蛋白结构, 由24个亚基自组装形成的笼状结构是蛋白外壳, 铁内核的主要成分为水铁矿(5Fe2O3·9H2O), 具有耐受变性剂和高温等特点(Hamburger et al, 2005)。铁蛋白可以在70—75℃的高温环境下保持10min以上, 其天然蛋白结构不受影响(Santambrogio et al, 1997)。8条亲水性金属离子存在于通道铁蛋白外壳上, 使金属离子进入铁蛋白空腔, 而蛋白外壳内表面的静电特征, 有利于金属离子的沉积和成核, 铁蛋白本身粒径均一, 分散性好, 这一系列的特质使其可以作为优良的生物模版来合成铁蛋白纳米颗粒, 而其内部铁核主要为磁铁矿(Fe3O4), 因而除具有了纳米颗粒的特性外还具有超顺磁性和过氧化酶活性。目前铁蛋白主要是从动植物中提取, 其来源有限, 价格昂贵, 提取周期较长, 很难满足科研和临床应用的需要。
本研究以大肠杆菌表达体系获得的泥蚶重组铁蛋白, 通过富集不同浓度的锰铁制备Fe-铁蛋白和Mn-铁蛋白磁性纳米颗粒。在扫描电镜下观察颗粒的大小及均匀分散性, 利用PPMS综合物性测量系统测量其磁学特性, 为后续Fe-铁蛋白和Mn-铁蛋白磁性纳米颗粒的应用提供参考。
1 材料与方法 1.1 材料泥蚶重组铁蛋白为课题组体外表达、纯化制备, 浓度为0.1mg/mL; 氯化亚铁(FeCl2)和氯化锰(MnCl2)均为分析纯, 购于国药集团上海化学试剂有限公司; BCA总蛋白浓度测定试剂盒购于南京建成有限公司; PBS缓冲液购于上海索莱宝生物科技有限公司。
1.2 方法 1.2.1 重组铁蛋白的制备利用课题组已获得的泥蚶铁蛋白基因的全长序列, 根据三种铁蛋白基因开放式阅读框(ORF), 设计上下游引物用于基因表达, PCR扩增三种铁蛋白基因ORF, 选用pET-28a(+)作为表达载体, 构建泥蚶和重组铁蛋白工程菌。将该菌接种至卡那霉素浓度为50ng/mL的LB液体培养基中, 37℃, 100r/min振摇培养至OD60(0.4—0.6), 加入终浓度为1mmol/L IPTG, 37℃, 100r/min振荡, 培养过夜。8000r/min, 5min离心收集菌体。将获得的菌体用PBS进行重悬以洗净培养基, 然后将菌液进行超声波破碎30min, 12000r/min离心20min, 收集重组铁蛋白包涵体, 用盐酸胍溶液溶解并离心除去未溶解的杂质, 收集蛋白包涵体溶液(杜莉利等, 2008)。
1.2.2 重组铁蛋白的亲和层析纯化将Ni-IDA柱子用5—10倍体积尿素缓冲液(100mmol/L NaH2PO4, 300mmol/L NaCl, 8mol/L尿素, pH 8.0)平衡后上样, 再用5倍体积尿素缓冲液过柱, 洗去未结合的杂蛋白。接着用5—10倍体积的特异性洗脱液(100mmol/L NaH2PO4, 300mmol/L NaCl, 250mmol/L咪唑, 8mol/L尿素, pH 8.0)洗脱目标蛋白, 收集洗脱液。再用5—10倍的PBS缓冲液(50mmol/L NaH2PO4, 300mmol/L NaCl, pH 8.0)重新平衡介质。然后利用BCA试剂盒对最后得到的洗脱液进行检测, 确定蛋白液的浓度。最后利用SDS-PAGE对表达蛋白的纯化结果进行分析(初双双等, 2015)。
1.2.3 重组铁蛋白的复性将透析袋放置到溶液Ⅰ(pH 8.0, 0.1mol/L NaHCO3, 0.5mol/L EDTA)和溶液Ⅱ(pH 8.0, 0.5mol/L EDTA)中各煮沸10min, 然后用去离子水彻底清洗。将已纯化的重组铁蛋白浓度调整到50—100ng/mL, 转移到处理好的透析袋中, 依次于6、4、2mol/L尿素缓冲液中, 4℃, 透析12h。然后在复性缓冲液(20mmol/L Tris, 2mmol/L GSH, 0.2mmol/L GSSG, 5mmol/L EDTA, 50mmol/L Glycine, pH 8.0)中, 4℃, 透析24h, 中间更换一次复性缓冲液。最后于20mmol/L PBS, pH 8.5缓冲液中, 4℃透析12h, 并不断更换复性缓冲液。
1.2.4 重组铁蛋白的分子筛层析纯化和SDS电泳将分子筛层析预装柱于AKTA蛋白纯化仪上安装调试好后, 用流动相缓冲液Ⅰ(20mmol/L PBS, 50mmol/L NaCl, pH 7.5)平衡柱子。将复性好的重组铁蛋白用超滤管浓缩至总体积为2mL后上样, 设置流动相流速为1mL/min进行洗脱, 待出现蛋白峰时收集洗脱液至蛋白全部洗脱完成。12%分离胶、5%浓缩胶考马斯亮蓝R-250染色(Su et al, 2009)。
1.2.5 Fe-铁蛋白和Mn-铁蛋白的制备将纯化后的泥蚶重组铁蛋白(0.1mg/mL)利用透析袋装置, 分别在0.1、1、10mmol/L的氯化亚铁(FeCl2), 氯化锰(MnCl2)溶液中透析12h后, 然后在PBS溶液中透析12h, 以除去未被富集的重金属离子。反应过程中用磁力搅拌器模拟流动液体, 并每隔4h更换一次溶液。富集处理完成后置于4℃保存备用。
1.2.6 重组铁蛋白富集不同重金属后的聚集形貌观察取不同浓度锰铁制备的重组Fe-铁蛋白和Mn-铁蛋白10μL。在无菌环境中, 分别取样滴在干净无菌的云母片表层, 16℃, 静置。自然干燥后用高真空溅射镀膜仪进行喷金处理, 利用扫描电镜(S-3400N, 日本日立仪器公司)对Fe-铁蛋白和Mn-铁蛋白聚集形貌进行观察。利用软件Image-Pro Plus计算各个蛋白聚集体的大小。
1.2.7 Fe-铁蛋白和Mn-铁蛋白磁学性质的测定取重组Fe-铁蛋白和Mn-铁蛋白10mL分装于离心管中, 封口后放入冷冻干燥机(ALPHA 1-2LD plus)内冷冻干燥。取冷冻干燥的蛋白粉末1mg左右放入PPMS综合物性测量系统(Physical Property Measurement System, 美国Quantum Design公司)设定外加磁场为3T, 温度为300K进行磁滞回线测量。
2 结果与分析 2.1 重组铁蛋白SDS-PAGE电泳结果泥蚶重组铁蛋白的SDS-PAGE电泳图谱显示在20—30kDa之间出现目的蛋白的条带, 且加入诱导剂后该目的蛋白的表达量明显增加。经过镍柱亲和层析纯化后的泥蚶重组铁蛋白电泳条带单一, 无杂带且蛋白分子量大小与目的蛋白相一致(图 1)。
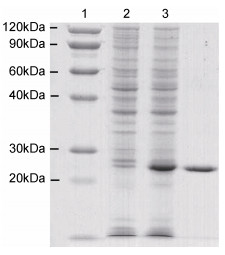 |
| 图 1 重组铁蛋白的诱导表达和纯化 Fig. 1 The expression and purification of recombinant proteins in E. coli BL21 注: 1.未诱导泥蚶重组铁蛋白工程菌总蛋白; 2.诱导泥蚶重组铁蛋白工程菌总蛋白; 3.泥蚶重组铁蛋白 |
泥蚶重组铁蛋白在富集不同浓度氯化亚铁(Fe2+)溶液后, 经扫描电镜观察发现:未富集Fe2+的泥蚶重组铁蛋白为均匀分散的小圆球体(图 2a); 在0.1mmol/L FeCl2溶液中聚集状态仍为均匀分散的小球, 一些蛋白球体发生形态的变异, 蛋白球体间发生聚集(图 2b); 当泥蚶重组铁蛋白在1mmol/L FeCl2溶液中富集Fe2+后, 重组Fe-铁蛋白小球体间聚集更加明显, 某些蛋白小球体聚集成大的不规则球体(图 2c)。泥蚶重组铁蛋白在更高浓度FeCl2溶液中富集Fe2+后, 蛋白球体均发生聚集现象, 蛋白小球也变异为无规则状态(图 2d)。
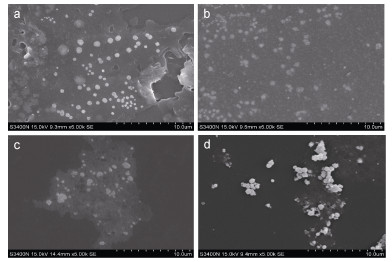 |
| 图 2 组铁蛋白在不同浓度FeCl2溶液中富集Fe2+的扫描电镜图 Fig. 2 SEM images of recombinant proteins under different concentrations of FeCl2 注: a.泥蚶重组铁蛋白对照组; b.泥蚶重组铁蛋白在0.1mmol/L FeCl2溶液中富集Fe2+组; c.泥蚶重组铁蛋白在1mmol/L FeCl2溶液中富集Fe2+组; d.泥蚶重组铁蛋白在10mmol/L FeCl2溶液中富集Fe2+组 |
泥蚶重组铁蛋白在0.1mmol/L的低浓度下富集Mn2+后均形成了均匀分散的小花团状球体, 球体直径与未富集的重组铁蛋白相比增加4倍左右, 球体表面也出了现片状的褶皱(图 2a)。在1mmol/L的中浓度MnCl2溶液中富集Mn2+后, 重组铁蛋白形成了直径更大的花团状球体, 球体表面的片层也更加伸展(图 2b)。在10mmol/L的高浓度MnCl2溶液中富集Mn2+后, 形成了直径约为10μm的花团状球体, 球体之间发生明显聚集粘连。可见随着MnCl2溶液浓度的升高, 泥蚶重组铁蛋白富集Mn2+后形成的花团状球体直径随之增大, 球体间的聚集越来越明显。
在低浓度的氯化亚铁(FeCl2)和氯化锰(MnCl2)溶液中, 泥蚶重组铁蛋白富集锰铁后形成的Fe-铁蛋白和Mn-铁蛋白表面形貌表现出良好分散性, 蛋白小球体大小均匀。当氯化亚铁(FeCl2)和氯化锰(MnCl2)浓度10倍和100倍升高后, 泥蚶重组铁蛋白富集锰铁后形成的Fe-铁蛋白和Mn-铁蛋白的小球体直径会明显增加, 小球体之间会发生聚集粘连。
 |
| 图 3 重组铁蛋白在不同浓度MnCl2溶液富集Mn2+组的扫描电镜图 Fig. 3 SEM images of recombinant proteins under different concentrations of MnCl2 注: e.泥蚶重组铁蛋白在0.1mmol/L MnCl2溶液中富集Mn2+组; f.泥蚶重组铁蛋白在1mmol/L MnCl2溶液中富集Mn2+组; g.泥蚶重组铁蛋白在10mmol/L MnCl2溶液中富集Mn2+组 |
空白对照组的泥蚶重组铁蛋白表现出极其微小的磁学特性, 在2T的磁场强度下几乎检测不到蛋白的磁场强度。但富集锰铁后形成的Fe-铁蛋白和Mn-铁蛋白表现出明显的磁学性质, Fe-铁蛋白在300K, 2T的磁场下可以检测到1.69emu/mg的磁化强度, 磁滞回线总体形状表现为超顺磁性。Mn-铁蛋白在300K, 2T的磁场下磁化强度为2.34emu/mg, 磁滞回线总体形状也表现为超顺磁性(图 4)。随着锰铁浓度的增加, Fe-铁蛋白和Mn-铁蛋白在相同磁场条件下的磁化强度明显增加, 增加趋势表现出低浓度范围下磁化强度增加速率较快, 高浓度范围下磁化强度增加速率明显降低。
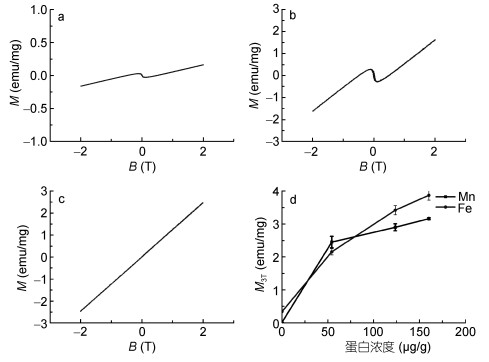 |
| 图 4 泥蚶Fe-铁蛋白和Mn-铁蛋白的磁滞回线 Fig. 4 The hysteresis loops of different ferritin treatment groups 注: a.泥蚶重组铁蛋白空白组; b.泥蚶Fe-铁蛋白组; c.泥蚶Mn-铁蛋白组; d.泥蚶Fe-铁蛋白和Mn-铁蛋白磁化强度变化曲线 |
由于铁蛋白具有电化学特性、磁性和化学性质稳定性等特点, 科研工作者最近几年对把铁蛋白作为模板或载体合成纳米材料产生了强烈的兴趣。铁蛋白合成的生物纳米材料既具有蛋白质的生物相容性(Li et al, 2012), 又具有纳米材料的特性。在食品工业、生物分子固定化、生物传感等方面均展现出优势, 这使得它在材料领域得到了广泛的应用。例如, 铁蛋白可以作为催化剂在碳纳米导管生长过程中, 也可以作为合成具有导电性或磁性的模版在半导体晶体材料应用方面。Lee等(2015)将铁蛋白作为碳纳米材料的生长催化剂, 成功制备具有良好导电性和柔韧性的碳纳米管(Lee et al, 2015); Shin等(2006)将处理的铁蛋白纳米颗粒混入到聚合物中, 明显使聚合物纳米纤维的机械性能增强。Uchida等(2008)利用铁蛋白构建的磁性铁蛋白兼具磁性和生物相容性, 研究的重组人铁蛋白-铁氧化物磁性纳米颗粒可以作为MRI造影剂标记巨噬细胞, 与氧化铁相比, 该磁性材料表现出的R2弛豫相近且更易获取由巨噬细胞和提供标记的细胞的显著信号损失。李正南(2002)通过以铁蛋白作为矿化模板进行仿生合成的磁性铁蛋白, 具有典型的核-壳型结构, 不仅为岩石磁学研究提供理想的模式材料, 而且在生物医学和磁传感器研制中具有重要的应用价值。
不同浓度锰铁制备的Fe-铁蛋白和Mn-铁蛋白的表面形貌有着明显的区别。可见锰铁浓度的不同对泥蚶重组铁蛋白的富集作用有着显著的影响。当锰铁浓度为0.1mmol/L时, 与空白组相比Fe2+-铁蛋白和Mn2+-铁蛋白, 表面形貌除小球体直径的增大外并无明显变化, 说明此时锰铁主要进入铁蛋白内核; 而当锰铁浓度升高时, 重组Fe2+铁蛋白和Mn2+铁蛋白形貌明显变化, 球体形状也变为无规则状态, 说明过高浓度(10mmol/L)的金属离子已超出重组铁蛋白富集能力, 铁蛋白亚基间的聚合受到破坏, 24聚体的球形无法维持(Nomngongo et al, 2011; Di Gaspare et al, 2015)。Ebrahimi等(2013)研究也发现铁蛋白在富集不同浓度Fe2+时, Fe2+与铁蛋白氨基酸侧链间的成键不同。而Mn-铁蛋白呈现出的独特花团状球体则与锰氧化物的层状或片状相对均匀的花球形形貌类似。初雪峰的研究则表明Mn2+的浓度、反应时间等条件对于锰氧化物的表面形貌有着重要影响(初学峰, 2013)。低浓度下制备的Fe-铁蛋白和Mn-铁蛋白具有分散性好, 粒径均一等优点, 为后期Fe-铁蛋白和Mn-铁蛋白纳米颗粒的应用提供优良的条件。
3.2 Fe-铁蛋白和Mn-铁蛋白超顺磁性Uchida等(2006)的研究发现, 重组铁蛋白内核为具有超顺磁性(Fe3O4), 可以发展为MRI显影剂。Mn-铁蛋白磁性纳米颗粒表现出的超顺磁性则是由于纳米锰氧化物的小尺寸效应, 当锰氧化物颗粒尺寸减小到一个磁畴的大小时, 所有的颗粒内部自旋沿着易磁化轴自发磁化, 因此可以将颗粒内部所有磁矩看作一个整体, 锰氧化物纳米颗粒就会表现出类似于超顺磁性的行为(Balcom et al, 2003)。
不同锰铁浓度的Fe-铁蛋白和Mn-铁蛋白磁性纳米颗粒在相同的磁场下表现出不同的磁化强度, 但磁化强度的增长速度并不与锰铁浓度的增加成正比, 这是由于高浓度下重组铁蛋白与锰铁的作用方式与低浓度下不同。在锰铁溶液浓度较低时, 重组铁蛋白通过外壳上的8条亲水性金属离子通道从而使锰铁进入蛋白核空腔, 使其氧化成内核(Treffry et al, 1993; Patra et al, 2015)。但在高浓度金属离子溶液中, 没有进入到重组铁蛋白核内部的金属离子吸附蛋白壳外表面, 造成蛋白壳外表面被氧化, 蛋白小球间发生聚集, 改变了原来的表面形貌和磁学性质(Moskowitz et al, 1997; Wong et al, 1998; Jung et al, 2011)。
4 结论泥蚶重组铁蛋白的Fe-铁蛋白和Mn-铁蛋白磁性纳米颗粒, 随着锰铁浓度的增加, Fe-铁蛋白和Mn-铁蛋白的蛋白球体直径不断增大, 同时球体之间发生聚集粘连, 低浓度锰铁制备的Fe-铁蛋白和Mn-铁蛋白磁性纳米颗粒分散性好、粒径均一, 磁滞回线均表现为超顺磁性。
| 苏秀榕, 吕振明, 李太武, 等, 2005. 泥蚶(Tegillarca granosa)个体发育过程中同工酶基因表达与调控的研究. 海洋与湖沼, 36(1): 81–87 |
| 杜莉利, 李太武, 苏秀榕, 等, 2008. 可口革囊星虫(Phascoloma esculenta)铁结合蛋白基因的研究. 海洋与湖沼, 39(3): 252–256 |
| 李正南, 2002. 生物分子筛法制备纳米磁性材料. 2002年材料科学与工程新进展.北京:中国材料研究学会,: 27–10 |
| 初双双, 张云云, 苏倡, 等, 2015. 可口革囊星虫(Phascolosoma esculenta)重组铁蛋白富集Pb2+等重金属特性和功能研究. 海洋与湖沼, 46(6): 1358–1364 |
| 初学峰, 2013.混合价态锰氧化物的可控合成与表征.长春:吉林大学博士学位论文, 40-46 |
| 陈静, 赵永亮, 王丹., 2010. 铁蛋白研究现状. 河南师范大学学报(自然科学版), 38(1): 152–155 |
| 姚韩韩, 董迎辉, 林志华, 等, 2011. 泥蚶4个快速生长家系的遗传变异分析. 水产学报, 35(3): 340–347 |
| Balcom B J, Barrita J C, Choi C, et al, 2003. Single-point magnetic resonance imaging (MRI) of cement based materials. Materials and Structures, 36(3): 166–182 DOI:10.1007/BF02479555 |
| Di Gaspare L, Pea M, De Seta M, et al, 2015. Morphological and spectroscopic analysis of argon-and oxygen-ions treated thin ferritin films. Microelectronic Engineering, 144: 19–22 DOI:10.1016/j.mee.2015.01.010 |
| Ebrahimi K H, Hagedoorn P L, Hagen W R., 2013. Phosphate accelerates displacement of Fe(Ⅲ) by Fe(Ⅱ) in the ferroxidase center of Pyrococcus furiosus ferritin. FEBS Letters, 587(2): 220–225 DOI:10.1016/j.febslet.2012.11.029 |
| Hamburger A E, West A P, Hamburger Z A, et al, 2005. Crystal structure of a secreted insect ferritin reveals a symmetrical arrangement of heavy and light chains. Journal of Molecular Biology, 349(3): 558–569 DOI:10.1016/j.jmb.2005.03.074 |
| Jung J H, Eom T W, Lee Y P, et al, 2011. Magnetic model for a horse-spleen ferritin with a three-phase core structure. Journal of Magnetism and Magnetic Materials, 323(23): 3077–3080 DOI:10.1016/j.jmmm.2011.06.060 |
| Lee B J, Jeong G H., 2015. Ferritin-mixed solution plasma system yielding low-dimensional carbon nanomaterials and their application to flexible conductive paper. Current Applied Physics, 15(11): 1506–1511 DOI:10.1016/j.cap.2015.08.022 |
| Li K, Zhang Z P, Luo M, et al, 2012. Multifunctional ferritin cage nanostructures for fluorescence and MR imaging of tumor cells. Nanoscale, 4(1): 188–193 DOI:10.1039/C1NR11132A |
| Moskowitz B M, Frankel R B, Walton S A, et al, 1997. Determination of the preexponential frequency factor for superparamagnetic maghemite particles in magnetoferritin. Journal of Geophysical Research:Solid Earth, 102(B10): 22671–22680 DOI:10.1029/97JB01698 |
| Nomngongo P N, Ngila J C, Nyamori V O, et al, 2011. Determination of selected heavy metals using amperometric horseradish peroxidase (HRP) inhibition biosensor. Analytical Letters, 44(11): 2031–2046 DOI:10.1080/00032719.2010.539738 |
| Patra S, Roy E, Madhuri R, et al, 2015. An imprinted Ag@CdS core shell nanoparticle based optical-electrochemical dual probe for trace level recognition of ferritin. Biosensors and Bioelectronics, 63: 301–310 DOI:10.1016/j.bios.2014.07.063 |
| Santambrogio P, Pinto P, Levi S, et al, 1997. Effects of modifications near the 2-, 3-and 4-fold symmetry axes on human ferritin renaturation. Biochemical Journal, 322(2): 461–468 DOI:10.1042/bj3220461 |
| Shin M K, Kim S I, Kim S J, et al, 2006. Reinforcement of polymeric nanofibers by ferritin nanoparticles. Applied Physics Letters, 88(19): 193901 DOI:10.1063/1.2200469 |
| Su X R, Du L L, Li Y, et al, 2009. Production of recombinant protein and polyclonal mouse antiserum for ferritin from Sipuncula Phascolosoma esculenta. Fish & Shellfish Immunology, 27(3): 466–468 |
| Treffry A, Bauminger E R, Hechel D, et al, 1993. Defining the roles of the threefold channels in iron uptake, iron oxidation and iron-core formation in ferritin:a study aided by site-directed mutagenesis. Biochemical Journal, 296(3): 721–728 DOI:10.1042/bj2960721 |
| Uchida M, Flenniken M L, Allen M, et al, 2006. Targeting of cancer cells with ferrimagnetic ferritin cage nanoparticles. Journal of the American Chemical Society, 128(51): 16626–16633 DOI:10.1021/ja0655690 |
| Uchida M, Terashima M, Cunningham C H, et al, 2008. A human ferritin iron oxide nano-composite magnetic resonance contrast agent. Magnetic Resonance in Medicine, 60(5): 1073–1081 DOI:10.1002/mrm.v60:5 |
| Wong K K W, Douglas T, Gider S, et al, 1998. Biomimetic synthesis and characterization of magnetic proteins (magnetoferritin). Chemistry of Materials, 10(1): 279–285 DOI:10.1021/cm970421o |
 2018, Vol. 49
2018, Vol. 49


