
中国海洋湖沼学会主办。
文章信息
- 郝贵杰, 林锋, 陈智慧, 黄小红, 潘晓艺, 袁雪梅, 徐洋, 姚嘉赟, 沈锦玉. 2018.
- HAO Gui-Jie, LIN Feng, CHEN Zhi-Hui, HUANG Xiao-Hong, PAN Xiao-Yi, YUAN Xue-Mei, XU Yang, YAO Jia-Yun, SHEN Jin-Yu. 2018.
- 逆转录环介导等温扩增联合横向流动试纸条快速检测草鱼(Ctenopharyngodon idellus)呼肠孤病毒(GCRV)的研究
- RAPID DETECTION OF GRASS CARP REOVIRUS BY A REVERSE-TRANSCRIPTION LOOP-MEDIATED ISOTHERMAL AMPLIFICATION ASSAY COMBINED WITH A LATERAL FLOW DIPSTICK METHOD
- 海洋与湖沼, 49(1): 183-191
- Oceanologia et Limnologia Sinica, 49(1): 183-191.
- http://dx.doi.org/10.11693/hyhz20170600173
-
文章历史
- 收稿日期:2017-06-27
- 收修改稿日期:2017-07-26
草鱼出血病(hemorrhage of grass carp)是由草鱼呼肠孤病毒(grass carp reovirus, GCRV)引起草鱼养殖业的一种严重的病毒性疾病, 对草鱼产业造成较大的威胁, 该病在养殖水温20℃时开始流行, 27—30℃时流行较为严重, 死亡率可达50%—80%, 据不完全统计, 每年草鱼养殖由该病导致的经济损失达21.26亿元, 因此, 草鱼出血病被中国农业部列入二类动物疫病病种名录(李军等, 1999; 陈爱平等, 2010)。其病原GCRV隶属于水生呼肠孤病毒属(Aquareovirus, ARV), 是中国分离鉴定的第一株鱼类病毒, 也是中国在国际上首次完成全基因序列分析的第一株水生呼肠孤病毒。GCRV作为水生呼肠孤病毒属成员中毒力最强的病毒, 是迄今研究得最为深入、最为系统的水生呼肠孤病毒, 该病毒为双链分节段RNA病毒, 基因组分11个节段(Francki et al, 1991; Fang et al, 2000, 2005; Qiu et al, 2001)。研究表明, 根据GCRV分离株基因序列的特征, 目前临床上共存在三种基因型GCRV, 其中基因Ⅰ型和Ⅱ型较为流行, 基因Ⅰ型以GCRV873为代表株, 基因Ⅱ型以HZ08为代表株(张超等, 2010; Wang et al, 2012; 李永刚等, 2013)。
目前, 对于该病毒还没有特效的治疗方法, 推行草鱼的健康养殖是最有效的预防措施, 而这主要依赖于疫苗免疫和早期的快速检测。据报道的检测方法有细胞分离法、电镜法、酶联免疫吸附试验(ELISA, Dot-ELISA)、逆转录聚合酶链式反应(RT-PCR)检测法、实时荧光定量(real-time PCR)检测法等(左文功等, 1986; 邵健忠等, 1996; 王铁辉等, 1997; 周勇等, 2011), 但由于这些方法实验设备要求高, 工作环境严格, 对病毒或模板质量要求高, 在实际检测工作中, 仅限于实验室诊断。日本学者Notomi等(2000)研发的环介导等温扩增技术(loop-mediated isothermal amplification, LAMP), 可特异、快速、灵敏地扩增靶序列, 只需在DNA聚合酶催化下扩增, 因其不需要高温变性, 所以摆脱了像对PCR仪这些昂贵仪器的依赖(Notomi et al, 2000)。逆转录环介导恒温扩增(RT-LAMP)是在常规LAMP反应体系中加入逆转录酶, 实现了RNA模板的一步扩增, 简化了操作步骤, 近年来, 该方法也成功应用于草鱼呼肠孤病毒的检测(杨水仙, 2013; 张金凤等, 2013; Zhang et al, 2013)。
对于LAMP产物的检测, 常见的有浊度观察、荧光染料观察及琼脂糖凝胶电泳等方法, 前两种方法不仅增加了检测成本, 比如需要昂贵的浊度仪, 而且易产生假阳性, 限制了该技术的应用; 而凝胶电泳法, 不仅需要购置专门的凝胶成像系统等仪器设备, 而且需要配制较大体积的电泳缓冲液, 费时费力。横向流动(Latteral flow detect, LFD)试纸条是一种检测LAMP扩增产物的新方法, 利用反应体系中异硫氰酸荧光素FITC标记的探针与生物素标记的LAMP扩增产物特异性杂交, 然后在横向流动试纸条上进行抗原抗体结合及显色, 完成结果判断, 从而排除了人为目测染料颜色的差异、减少了电泳环节以及由非特异性扩增造成的假阳性问题, 在实验室诊断和现场检测均体现出较好的应用潜力, 已在桃拉病毒(TSV) (Kiatpathomchai et al, 2008)、肝胰腺细小病毒(HPV) (Nimitphak et al, 2008)、传染性脾肾坏死病毒(ISKNV) (Ding et al, 2010)、黄头病毒(YHV) (Khunthong et al, 2013)等病毒; 非洲锥形病(HAT) (Njiru, 2011)等寄生虫, 以及海豚链球菌(王瑞娜等, 2014)等细菌的检测上得到了应用。
本研究将基因Ⅰ型和Ⅱ型GCRV第六基因片段作为检测靶标, 分别设计了2对特异性引物和1条异硫氰酸荧光素标记的探针, 经条件优化后, 分别建立了基因Ⅰ型和Ⅱ型GCRV的RT-LAMP-LFD检测方法。
1 材料与方法 1.1 主要仪器与试剂高速离心机(Beckman); 超微量分光光度计(NanoDrop2000); PCR扩增仪(Biometra); 凝胶成像仪(BIO-RAD); 恒温水浴锅和电泳仪(国产); Bst DNA聚合酶大片的(NEW ENGLAND); 甜菜碱Betaine、硫酸镁MgSO4(Sigma); dNTPs、AMV逆转录酶、RNA酶抑制剂(Takara); RNA提取试剂盒(Viral RNA mini kit, Qiagen); 一次性核酸检测试纸条(杭州某生物公司)。
1.2 毒株、菌株和细胞草鱼呼肠孤病毒GCRV-873株、鲤春病毒血症病毒(SVCV)由实验室保存; 草鱼呼肠孤病毒GCRV-HZ13株、嗜水气单胞菌Ah-BSK10株由本实验室分离并保存; 鲤疱疹病毒Ⅱ型(CyHV-2)由实验室保存阳性组织病样。草鱼卵巢细胞系(CO)、鲤上皮瘤细胞系(EPC)由本实验室保存。GCRV在CO细胞上增殖培养, SVCV在EPC细胞上增殖培养。
1.3 引物和探针的设计与合成根据GenBank公布的基因Ⅰ型和Ⅱ型GCRV第六基因序列, 由在线软件Primer Explorer V4 (http:// primerexplorer.jp/e/)设计和手工修改后获得扩增引物, 并根据已知模板扩增获得较优的两对引物和一条探针, 其中包括两条外引物(F3, B3)、两条内引物(FIP, BIP)以及一条5′端以FITC标记的特异性杂交探针(见表 1), 其中GCRVI-BIP为5′端生物素(biotin)标记引物; GCRVII-FIP为5′端生物素(biotin)标记引物; 引物和探针由南京金斯瑞生物公司合成。
| 引物和探针 | 序列(5′→3′) |
| GCRVI-F3 | CCCGTACTGCTACGTGAGA |
| GCRVI-B3 | GCTAGTCGCGGAATCATCC |
| GCRVI-FIP | CGACCTCCTCAGACGTTTGGTT-GCGAAGTCGTTGACGCTA |
| GCRVI–BIP | Biotin-CGACGCGATCGTGTTAGTGTCG-TCTTGAGGCGACGGGAAT |
| GCRVI-Probe | FITC-CGTACCAGCTACCGTCATGG |
| GCRVII-F3 | ACTCGCATGGATGAAAGTCG |
| GCRVII-B3 | CAACGTAGGCACTGAACTCA |
| GCRVII-FIP | Biotin-TACGGTGACCCGTCTGTTGC-CAGGATCAGGTATGGGACCA |
| GCRVII–BIP | TGGAAAAATCAGCAGGTGCCGT-CGTTCACTGTAGAGCAGGTT |
| GCRVII-Probe | FITC-CTCCGGACGCCATGTCTAGT |
称取病毒样本50—100mg或量取150—200μL细胞病毒悬液, 按照Qiagen公司的病毒RNA提取试剂盒说明书进行操作, 提取的RNA最后溶于50μL无RNA酶的双蒸水中, 并利用NanoDrop2000对核酸浓度进行定量分析, 提取单个样品RNA及定量测定约需15—20min, 所有RNA样品–80℃保存备用。
1.5 RT-LAMP反应体系确定根据筛选到的引物, 从引物浓度、Mg2+浓度、dNTPs、Betaine及探针浓度、反应温度等变量参数, 进行单因素变化实验, 对逆转录环介导等温扩增反应条件进行调试优化, 确定两种基因型GCRV RT-LAMP终体积为25μL的反应体系及温度。
1.6 RT-LAMP扩增产物的检测本研究中, 采用了两种检测方法对RT-LAMP反应产物进行对比分析:一是通过常规的琼脂糖凝胶电泳对扩增产物进行判定; 二是利用特异性核酸检测试纸条对扩增产物进行检测, 即吸取5—10μL扩增产物滴于试纸条的点样处, 将试纸条点样端置于缓冲液中, 反应液在其协助下横向移动, 根据显色的质控带和检测带判定样品是否阳性, 整个检测过程约5—10min。结果判读如下标准:阳性(+):出现两条红色条带。一条位于检测区(T)内, 另一条位于质控区(C)内。阴性(-):仅在质控区(C)出现一条红色条带, 在检测区(T)内无红色条带出现。无效:质控区(C)和检测区(T)内均无红色条带出现。
1.7 RT-LAMP-LFD特异性验证分别提取鲤疱疹病毒Ⅱ型(CyHV-2)、鲤春病毒血症病毒(SVCV)、嗜水气单胞菌等鱼类常见病原的核酸, 按照所建立的基因Ⅰ型、Ⅱ型RT-LAMP-LFD检测方法进行特异性试验, 同时通过琼脂糖凝胶电泳对反应产物进行判定, 结果表明两种基因型RT-LAMP方法只能检测本基因型GCRV, 特异性良好。
1.8 灵敏度实验分别取5μL基因Ⅰ型、Ⅱ型GCRV总RNA进行10–1—10–6的梯度稀释, 再分别取各稀释度RNA 2μL作为模板, 运用RT-LAMP和RT-PCR方法进行检测, RT-LAMP扩增产物采用1.6中两种检测方法进行分析。RT-PCR采用一步反应法, 反应体系: 2×1-Step PCR Master Mix 25μL, verso Enzyme Mix 1μL, RT Enhancer 2.5μL, 10μmol/L引物各1μL, 模板2μL, 用双蒸水补足至50μL。扩增反应条件: 52℃、30min进行cDNA合成; 95℃预变性2min; 94℃变性40s、56℃退火30s、72℃延伸45s, 扩增35个循环, 最后72℃延伸10min, 反应产物经1%琼脂糖凝胶电泳。
1.9 临床样品的检测利用建立的基因Ⅰ型、Ⅱ型GCRV RT-LAMP-LFD检测方法对实验室近两年参与的国家水生动物疫病监测计划中草鱼出血病监测样品(浙江样品), 以及收集的浙江、江苏及安徽疑似患草鱼出血病的草鱼肾组织提取RNA, 并进行GCRV检测。阳性样品经普通PCR扩增并测序鉴定。
2 结果 2.1 病毒RNA的提取根据1.2中方法, 对所提取样品的总RNA进行纯度及浓度测定, 其OD260/OD280的比值, 均在1.8—2.0之间, 表明所提取的RNA无蛋白质和氛类物质的干扰, 其纯度较高(如图 1)。其中基因Ⅰ型RNA含量119ng/μL, 基因Ⅱ型RNA含量188ng/μL, –80℃保存备用。
 |
| 图 1 GCRV RNA提取结果 Fig. 1 Result of RNA extraction of GCRV |
通过对GCRV RT-LAMP体系中引物浓度、Mg2+浓度、dNTPs、Betaine及探针浓度、反应温度进行调试优化, 确定了终体积为25μL的RT-LAMP反应体系, 具体见表 2。
| 组分 | 工作液浓度 | 加样量(μL) | 反应体系终浓度 |
| ThermolPol缓冲液 | 10× | 2.5 | 1× |
| 外侧上游引物(F3) | 2μmol/L | 引物混合物2.5 | 0.2μmol/L |
| 外侧下游引物(B3) | 2μmol/L | 引物混合物2.5 | 0.2μmol/L |
| 内侧上游引物(FIP) | 16μmol/L | 引物混合物2.5 | 1.6μmol/L |
| 内侧下游引物(BIP) | 16μmol/L | 引物混合物2.5 | 1.6μmol/L |
| 探针 | 8μmol/L | 引物混合物2.5 | 0.8μmol/L |
| dNTPs | 10mmol/L | 3.5 | 1.4mmol/L |
| 甜菜碱 | 5mol/L | 3.0 | 0.6mol/L |
| 硫酸镁 | 100mmol/L | 1.5 | 6mmol/L(不包括缓冲液中所含Mg2+) |
| Bst DNA聚合酶 | 8U/μL | 1 | 0.32U/μL |
| AMV逆转录酶 | 5U/μL | 0.5 | 0.1U/μL |
| RNA模板 | 50ng—250ng/μL | 2.0 | 4ng—20ng/μL |
| 水 | — | 8.5 | — |
如下图所示, RT-LAMP反应产物采用了两种检测方法进行对比分析, 均可进行结果的判定, 但LFD检测更加方便快速。
2.3 RT-LAMP最佳反应温度设置五个反应温度梯度依次为61、62、63、64和65℃进行基因Ⅰ型、Ⅱ型RT-LAMP扩增反应, 反应时间为40min, 结果如图 3所示, 表明在相同反应体系下, 反应温度为63℃时, 扩增条带最亮, 因此确定63℃为环介导等温扩增温度。
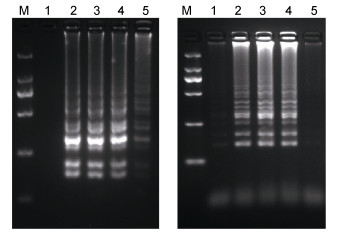 |
| 图 3 确定RT-LAMP最适反应温度 Fig. 3 Determination of the best temperature for the RT-LAMP assay 注:左图为基因Ⅰ型GCRV, 右图为基因Ⅱ型GCRV。M: DL2000 DNA Marker; 1: 61℃; 2: 62℃; 3: 63℃; 4: 64℃; 5: 65℃ |
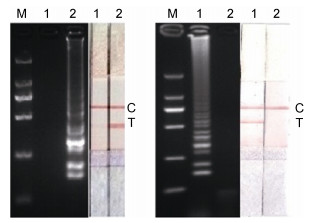
分别提取鲤疱疹病毒Ⅱ型(CyHV-2)、鲤春病毒血症病毒(SVCV)、嗜水气单胞菌等鱼类常见病原的核酸, 按照所建立的基因Ⅰ型、Ⅱ型RT-LAMP检测方法进行特异性试验, 反应产物进行琼脂糖凝胶电泳判定, 结果表明两种基因型RT-LAMP方法只能检测本基因型GCRV, 特异性良好。
 |
| 图 2 两种基因型GCRV RT-LAMP检测结果的对比 Fig. 2 Test results of two genotypes GCRV by RT-LAMP A:基因Ⅰ型GCRV; B:基因Ⅱ型GCRV(左为电泳检测, 右为LFD检测) |
 |
| 图 4 基因Ⅰ型GCRV RT-LAMP特异性实验 Fig. 4 The specificity test in the RT-LAMP assay for genotypeⅠ GCRV 注:左为电泳检测, 右为LFD检测。M: DL2000 DNA Marker; 1:基因Ⅰ型GCRV; 2:鲤疱疹病毒Ⅱ型(CyHV-2); 3:鲤春病毒血症病毒(SVCV); 4:基因Ⅱ型GCRV; 5:嗜水气单胞菌; 6:阴性对照 |
 |
| 图 5 基因Ⅱ型GCRV RT-LAMP特异性实验 Fig. 5 Specificity test in the RT-LAMP assay for genotype Ⅱ GCRV 注:左为电泳检测, 右为LFD检测。M: DL2000 DNA Marker; 1:基因Ⅱ型GCRV; 2:鲤疱疹病毒Ⅱ型(CyHV-2); 3:鲤春病毒血症病毒(SVCV); 4:基因Ⅰ型GCRV; 5:嗜水气单胞菌; 6:阴性对照 |
以10–1—10–6逐步梯度稀释的基因Ⅰ型GCRV总RNA为模板, 进行生物素标记的环介导等温扩增, 扩增产物同时采用琼脂糖凝胶电泳和LFD检测, RT-PCR产物采用琼脂糖凝胶电泳检测, 结果如图 6, RT-LAMP结果表明1—5号能够清楚观察到阶梯状条带及检测带, 而5号样品中RNA含量1.19pg/μL; 相比之下, RT-PCR方法能够检测到模板RNA含量为119pg/μL时的病毒, 因此, 基因Ⅰ型RT-LAMP-LFD灵敏度比RT-PCR方法高2个数量级。
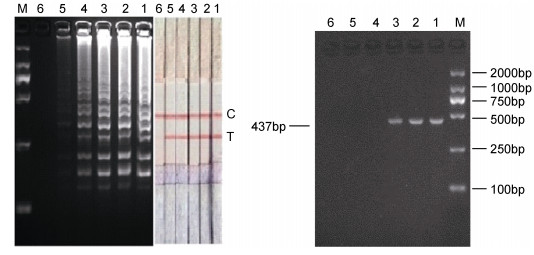 |
| 图 6 基因Ⅰ型GCRV RT-LAMP-LFD与RT-PCR灵敏度试验结果 Fig. 6 Sensitivity test in the RT-LAMP-LFD and RT-PCR assay for genotypeⅠ GCRV 注: M: DL2000 DNA Marker; 泳道1—6:模板分别为10–1, 10–2, 10–3, 10–4, 10–5, 10–6倍稀释的基因组RNA |
同样, 以10–1—10–6逐步梯度稀释的基因Ⅱ型GCRV总RNA为模板, 进行生物素标记的环介导等温扩增, 扩增产物同时采用琼脂糖凝胶电泳和LFD检测, RT-PCR产物采用琼脂糖凝胶电泳检测, 结果如图 7, RT-LAMP结果表明1—5号能够清楚观察到阶梯状条带, 而5号样品中RNA含量1.88 pg/μL; 相比之下, RT-PCR方法能够检测到模板RNA含量为18.8pg/μL时的病毒, 因此, 基因Ⅱ型RT-LAMP-LFD灵敏度比RT-PCR方法高1个数量级。
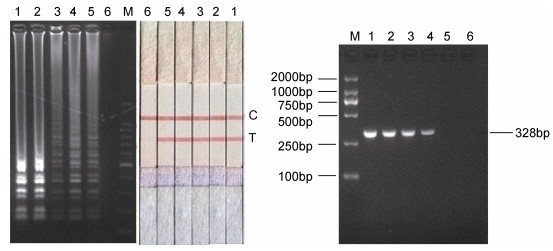 |
| 图 7 基因Ⅱ型GCRV RT-LAMP-LFD与RT-PCR灵敏度试验结果 Fig. 7 Sensitivity test in the RT-LAMP-LFD and RT-PCR assay for genotype Ⅱ GCRV 注: M: DL2000 DNA Marker; 泳道1—6:模板分别为10–1, 10–2, 10–3, 10–4, 10–5, 10–6倍稀释的基因组RNA |
对实验室近两年参与的国家水生动物疫病监测计划中草鱼出血病监测样品10份(浙江草鱼苗种样品), 以及收集的浙江、江苏及安徽收集的疑似患草鱼出血病的草鱼样本12份, 分别用基因Ⅰ型、Ⅱ型GCRV RT-LAMP-LFD进行检测。结果显示, 苗种样品检测结果均为阴性, 疑似样品的GCRV阳性率达75%, 其中Ⅰ型GCRV 2份, Ⅱ型GCRV 7份, 两种基因型阳性样品均经普通PCR扩增测序鉴定为正确的。
| 来源 | 样本数 | Ⅰ型GCRV阳性数(份) | Ⅱ型GCRV阳性数(份) | 阴性数(份) |
| 浙江 | 15 | 1 | 3 | 11 |
| 江苏 | 4 | 1 | 2 | 1 |
| 安徽 | 3 | 0 | 2 | 1 |
| 总计 | 22 | 2 | 7 | 13 |
| 注:浙江15份样品包括监测样品10份及疑似样品5份 | ||||
草鱼出血病在我国流行范围广, 危害严重且造成较大的经济损失, 具有高度传染性、致死性的特征, 一直以来是我国草鱼养殖的重点防控疫病。目前还没有找到针对病毒病有特效的治疗方法, 虽然疫苗免疫取得了一定的成效, 但随着病毒基因型的变异, 病毒毒力有增强趋势, 部分强毒株发病后可短期内造成全军覆没。因此, 目前控制该病的办法仍然是注射疫苗, 进行免疫预防(杨映等, 2015)。根据多年的防控经验, 控制和阻止草鱼出血病暴发的另一个有效的办法是早期诊断和尽早隔离感染鱼。目前有多种方法用来进行草鱼出血病的诊断, 包括细胞分离、电镜观察、基因组带型分析、PCR技术等。这些方法各具优势和缺陷, 病毒分离、电镜观察、核酸带型分析至今仍是检测草鱼呼肠孤病毒经典的方法, 但这些方法费时费力、操作比较复杂, 不能对病毒进行快速诊断, 不利于草鱼出血病的流行病学调查工作, 因此不利于推广使用。当前, 对于草鱼呼肠孤病毒的检测, 最为常用的方法是基于核酸扩增技术的各种分子生物学检测方法, 包括常规的RT-PCR、荧光定量PCR等(Zhang et al, 2010; Zeng et al, 2013; 殷亮等, 2014), 具有较高的敏感性和特异性, 但这些方法对实验的要求高, 且需要昂贵的仪器, 限制了大规模的应用。
随着技术的发展, 2000年日本的Notomi等建立了一种方便快捷的技术, 即环介导扩增技术, 因该技术较大的优越性, 目前已被广泛应用于多个领域, 如临床病原微生物检测、传染病监测、遗传病诊断、SNP分型以及转基因食品鉴定等等。2004年水产动物病原菌迟钝爱德华氏菌(Edwardsiella tarda)的LAMP检测的报道, 是该技术在水产养殖业中的首次应用(Savan et al, 2004), 之后逐步应用于各种水产常见细菌或病毒病原的诊断中(Gunimaladevi et al, 2005; Mao et al, 2008; Xu et al, 2010)。由于环介导等温扩增产物检测通常利用核酸电泳、浊度或荧光比色判定, 但这些方法都存在一定的弊端。因此, 2008年以来, 很多学者尝试将横向流动(LFD)试纸条检测法与环介导等温扩增技术相结合, 已成功应用于桃拉病毒(TSV) (Kiatpathomchai et al, 2008)、对虾白斑症病毒(WSSV) (Jaroenram et al, 2009)、传染性肌肉坏死病毒(IMNV)等的检测中(Puthawibool et al, 2009)。
本研究针对临床上流行的基因Ⅰ型和Ⅱ型GCRV, 根据其相对保守的第六基因片段设计扩增引物, 并优化反应体系, 该病毒为RNA病毒, 因此将逆转录酶加入反应体系中, 即可完成RNA的RT-LAMP扩增(赵飞等, 2007)。dNTP作为核酸扩增的原料, 浓度太低满足不了RT-LAMP的高效扩增, 浓度太高不仅造成试剂的浪费, 还会增加非特异反应, 根据本实验结果, 本反应体系最适dNTPs浓度为1.4mmol/L。Mg2+浓度过低会导致酶活力显著下降, 浓度过高又会催化非特异扩增, 本体系中除缓冲液中所含Mg2+, 另补充Mg2+浓度为6mmol/L。Betaine虽然不是LAMP反应的必需试剂, 但其具有降低螺旋DNA稳定性的作用, 因此对RT-LAMP反应中DNA二级结构的破坏有一定的促进作用(Zhang et al, 2002), 而过多的Betaine又会抑制RT-LAMP的扩增, 本反应体系中Betaine的最适浓度为0.6mol/L。
本研究建立的RT-LAMP-LFD技术, 与常规的GCRV检测方法相比, 具有较大的优势。第一, 灵敏度较高, 检测基因Ⅰ型和Ⅱ型GCRV的浓度分别为1.19pg/μL及1.88pg/μL, 具有超过一步RT-PCR的特点, 分别高2个及1个数量级, 且高于张金凤等的报道, 其RT-LAMP检测限为33pg(张金凤等, 2013); 第二, 操作简单, 所需时间较短, 从模板提取到结果判定仅需1.5h左右, 远低于像酶联免疫吸附法ELISA、逆转录聚合酶链反应RT-PCR等方法所需要的3—5h;第三, 特异性较好, 选取多个鱼类常见病原检测均为阴性, 表明该检测方法是可靠的, 而且探针杂交可以避免LAMP反应中的非特异性扩增, 降低假阳性的概率; 第四, 使用简便, 成本较低, 在实验中采用了国内生产的侧向层析检测试纸条, 对探针等条件进行优化后, 发现实验结果良好, 完全能够满足本检测方法的实际需要。
4 结论综上所述, 本研究建立的草鱼呼肠孤病毒RT-LAMP-LFD检测方法, 优点较为明显, 如特异、灵敏、快捷及低成本等, 适用于基层临床检测及快速诊断, 可为草鱼出血病的防控提供一个强有力的辅助手段, 也为其他病原的快速诊断提供一定的借鉴作用。
| 王铁辉, 李军, 易咏兰, 等, 1997. 用逆转录聚合酶链式反应检测草鱼出血病病毒的研究. 海洋与湖沼, 28(1): 1–6 |
| 王瑞娜, 周前进, 陈炯, 2014. 环介导等温扩增联合横向流动试纸条可视化检测海豚链球菌方法的建立. 农业生物技术学报, 22(12): 1584–1594 DOI:10.3969/j.issn.1674-7968.2014.12.014 |
| 左文功, 钱华鑫, 许映芳, 等, 1986. 草鱼肾组织细胞系CIK的建立及其生物学特性. 水产学报, 10(1): 11–17 |
| 李军, 王铁辉, 陆仁后, 等, 1999. 草鱼出血病病毒的研究进展. 海洋与湖沼, 30(4): 445–453 |
| 李永刚, 曾伟伟, 王庆, 等, 2013. 草鱼呼肠孤病毒分子生物学研究进展. 动物医学进展, 34(4): 97–103 |
| 杨映, 于辉, 古勇明, 2015. 草鱼呼肠孤病毒研究进展. 广东农业科学, 42(15): 92–97 DOI:10.3969/j.issn.1004-874X.2015.15.017 |
| 杨水仙, 2013. 草鱼呼肠孤病毒的RT-PCR及RT-LAMP检测方法建立. 雅安: 四川农业大学硕士学位论文 |
| 张超, 王庆, 石存斌, 等, 2010. 草鱼呼肠孤病毒HZ08株的分离与鉴定. 中国水产科学, 17(6): 1257–1263 |
| 张金凤, 曾令兵, 张辉, 等, 2013. 草鱼呼肠孤病毒逆转录环介导等温扩增(RT-LAMP)检测方法的建立. 中国水产科学, 20(1): 129–136 |
| 陈爱平, 江育林, 钱冬, 等, 2010. 草鱼出血病. 中国水产,(11): 56–57 DOI:10.3969/j.issn.1002-6681.2010.11.028 |
| 邵健忠, 项黎新, 李亚南, 等, 1996. 应用Dot-ELISA技术检测草鱼出血病病毒的研究. 水产学报, 20(1): 6–12 |
| 周勇, 曾令兵, 范玉顶, 等, 2011. 草鱼呼肠孤病毒TaqMan real-time PCR检测方法的建立. 水产学报, 35(5): 774–779 |
| 赵飞, 邹为民, 2007. LAMP法在水产动物病原快速检测中的应用. 南方水产, 3(2): 71–75 |
| 殷亮, 王庆, 曾伟伟, 等, 2014. 基因Ⅰ型草鱼呼肠孤病毒TaqMan Real-Time PCR检测方法的建立及应用. 水产学报, 38(4): 569–575 |
| Ding W C, Chen J, Shi Y H, et al, 2010. Rapid and sensitive detection of infectious spleen and kidney necrosis virus by loop-mediated isothermal amplification combined with a lateral flow dipstick. Archives of Virology, 155(3): 385–389 DOI:10.1007/s00705-010-0593-4 |
| Fang Q, Attoui H, Francois J, et al, 2000. Sequence of genome segments 1, 2, and 3 of the grass carp reovirus (genus Aquareovirus, family Reoviridae). Biochemical and Biophysical Research Communications, 274(3): 762–766 DOI:10.1006/bbrc.2000.3215 |
| Fang Q, Shah S, Liang Y Y, et al, 2005. 3D reconstruction and capsid protein characterization of grass carp reovirus. Science in China Series C:Life Sciences, 48(6): 593–600 DOI:10.1360/062004-105 |
| Francki R I B, Fauquet C M, Knudson D L, et al, 1991. Classification and nomenclature of viruses:Fifth Report of the International Committee on Taxonomy of Viruses. Archives of Virology, 2(S1): 186–192 |
| Gunimaladevi I, Kono T, Lapatra S E, et al, 2005. A loop mediated isothermal amplification (LAMP) method for detection of infectious hematopoietic necrosis virus (IHNV) in rainbow trout (Oncorhynchus mykiss). Archives of Virology, 150(5): 899–909 DOI:10.1007/s00705-004-0468-7 |
| Jaroenram W, Kiatpathomchai W, Flegel T W, 2009. Rapid and sensitive detection of white spot syndrome virus by loop-mediated isothermal amplification combined with a lateral flow dipstick. Molecular and Cellular Probes, 23(2): 65–70 DOI:10.1016/j.mcp.2008.12.003 |
| Khunthong S, Jaroenram W, Arunrut N, et al, 2013. Rapid and sensitive detection of shrimp yellow head virus by loop-mediated isothermal amplification combined with a lateral flow dipstick. Journal of Virological Methods, 188(1-2): 51–56 DOI:10.1016/j.jviromet.2012.11.041 |
| Kiatpathomchai W, Jaroenram W, Arunrut N, et al, 2008. Shrimp Taura syndrome virus detection by reverse transcription loop-mediated isothermal amplification combined with a lateral flow dipstick. Journal of Virological Methods, 153(2): 214–217 DOI:10.1016/j.jviromet.2008.06.025 |
| Mao X L, Zhou S, Xu D, et al, 2008. Rapid and sensitive detection of Singapore grouper iridovirus by loop-mediated isothermal amplification. Journal of Applied Microbiology, 105(2): 389–397 DOI:10.1111/jam.2008.105.issue-2 |
| Nimitphak T, Kiatpathomchai W, Flegel T W, 2008. Shrimp hepatopancreatic parvovirus detection by combining loop-mediated isothermal amplification with a lateral flow dipstick. Journal of Virological Methods, 154(1-2): 56–60 DOI:10.1016/j.jviromet.2008.09.003 |
| Njiru Z K, 2011. Rapid and sensitive detection of human African trypanosomiasis by loop-mediated isothermal amplification combined with a lateral-flow dipstick. Diagnostic Microbiology and Infectious Disease, 69(2): 205–209 DOI:10.1016/j.diagmicrobio.2010.08.026 |
| Notomi T, Okayama H, Masubuchi H, et al, 2000. Loop-mediated isothermal amplification of DNA. Nucleic Acids Research, 28(12) |
| Puthawibool T, Senapin S, Kiatpathomchai W, et al, 2009. Detection of shrimp infectious myonecrosis virus by reverse transcription loop-mediated isothermal amplification combined with a lateral flow dipstick. Journal of Virological Methods, 156(1-2): 27–31 DOI:10.1016/j.jviromet.2008.10.018 |
| Qiu T, Lu R H, Zhang J, et al, 2001. The molecular characterization of RNA segment S9 of grass carp hemorrhage virus (GCHV), an aquareovirus. Aquaculture, 203(1-2): 1–7 DOI:10.1016/S0044-8486(01)00613-5 |
| Savan R, Igarashi A, Matsuoka S, et al, 2004. Sensitive and rapid detection of Edwardsiellosis in fish by a loop-mediated isothermal amplification method. Applied and Environmental Microbiology, 70(1): 621–624 DOI:10.1128/AEM.70.1.621-624.2004 |
| Wang Q, Zeng W W, Liu C, et al, 2012. Complete genome sequence of a reovirus isolated from grass carp, indicating different genotypes of GCRV in China. Journal of Virology, 86(22): 12466 DOI:10.1128/JVI.02333-12 |
| Xu H D, Feng J, Guo Z X, et al, 2010. Detection of red-spotted grouper nervous necrosis virus by loop-mediated isothermal amplification. Journal of Virological Methods, 163(1): 123–128 DOI:10.1016/j.jviromet.2009.09.009 |
| Zeng W W, Wang Q, Wang Y Y, et al, 2013. A one-step molecular biology method for simple and rapid detection of grass carp Ctenopharyngodon idella reovirus (GCRV) HZ08 strain. Journal of Fish Biology, 82(5): 1545–1555 DOI:10.1111/jfb.12088 |
| Zhang L L, Luo Q, Fang Q, et al, 2010. An improved RT-PCR assay for rapid and sensitive detection of grass carp reovirus. Journal of Virological Methods, 169(1): 28–33 DOI:10.1016/j.jviromet.2010.06.009 |
| Zhang C X, Mei Q, Zhu Y, et al, 2002. Protein microarray-a new tool for detection of TORCH infection. Advanced Nanomaterials and Nanodevices, 7: 397–407 |
| Zhang Q L, Yan Y, Shen J Y, et al, 2013. Development of a reverse transcription loop-mediated isothermal amplification assay for rapid detection of grass carp reovirus. Journal of Virological Methods, 187(2): 384–389 DOI:10.1016/j.jviromet.2012.11.005 |
 2018, Vol. 49
2018, Vol. 49


