中国海洋湖沼学会主办。
文章信息
- 覃川杰, 龚全, 文正勇, 袁登越, 王均, 贺扬, 邵婷. 2018.
- QIN Chuan-Jie, GONG Quan, WEN Zheng-Yong, YUAN Deng-Yue, WANG Jun, HE Yang, SHAO Ting. 2018.
- 瓦氏黄颡鱼(Pelteobagrus vachellii)Toll样受体2(TLR2)基因克隆及免疫功能
- CLONING AND EXPRESSION OF THE TOLL-LIKE RECEPTOR 2 OF PELTEOBAGRUS VACHELLII
- 海洋与湖沼, 49(1): 198-206
- Oceanologia et Limnologia Sinica, 49(1): 198-206.
- http://dx.doi.org/10.11693/hyhz20170700193
-
文章历史
- 收稿日期:2017-07-21
- 收修改稿日期:2017-08-26
2. 四川省农业科学院水产研究所 成都 611731
2. Fisheries Institute, Sichuan Academy of Agricultural Sciences, Chengdu 611731, China
鱼类获得性免疫组成与结构较为简单, 获得性免疫应答的发生相对滞后, 应答效能较低。因此, 先天性免疫在抵御病原微生物入侵过程中发挥了重要作用(Zhu et al, 2013)。模式识别受体(pattern recognition receptors, PRRs)识别病原体细胞表面的病原相关分子模式(pathogen associated molecular patterns, PAMPs)后, 激活机体的先天性免疫和获得性免疫, 以清除入侵的病原(Kawai et al, 2009)。除TOLL样受体(Toll like receptors, TLRs), 模式识别受体家族还包括RIG-I样受体(retinoic acid-inducible gene-I-like receptors, RLRs)和核苷酸结合寡聚化结构域样受体(nucleotide-binding oligomerization domain-like receptors, NLRs) (Lee et al, 2007)。Toll样受体是天然免疫系统中的重要成分之一, TLR识别病原中的PAMP后, 通过级联反应, 激活下游的免疫细胞因子, 调节靶基因的表达, 发挥非特异性的免疫作用, 也能够促进机体发挥特异性免疫反应, 从而清除病原体(Akira et al, 2006)。目前, 在哺乳动物中, 至少有13种TLRs已被克隆分离, 而硬骨鱼类中已鉴定获得了至少17种不同的TLRs (Akira, 2004; Roach et al, 2005)。在鱼类中, LR3-5及TLR7等亚家族相关分子的基因序列、mRNA表达及蛋白功能的研究较为深入, 而鱼类TLR2的基因结构、mRNA表达分析仅见斑马鱼、牙鲆、斑点叉尾及大黄鱼等少数几种鱼类中(Meijer et al, 2004; Wei et al, 2011; Baoprasertkul et al, 2007; Fan et al, 2015)。TLR2一般包含6—10个LRR结构域, TIR结构域的氨基酸数在145—160。斑马鱼、牙鲆、斑点叉尾等鱼类中的病菌浸染实验表明, TLR2分子可能细菌及病毒都有识别作用, 包括革兰氏阳性细菌、革兰氏阴性细菌, 发挥了重要的非特异性免疫作用。
瓦氏黄颡鱼(Pelteobagrus vachellii)隶属于鲇形目、鲿科、黄颡鱼属, 其肉质细嫩、味道鲜美, 且生长较快, 深受养殖户和消费者青睐, 已成为一种重要的名优经济养殖鱼类。近年来, 随着养殖规模的扩大、养殖密度的提高、种质资源退化及养殖水体恶化等, 在苗种培育和养成阶段, 嗜水气单胞菌和迟钝爱德华氏菌等导致瓦氏黄颡鱼、黄颡鱼等暴发性发生“红头病”、“腐皮病”及“腹水病”等, 造成了大量经济损失(梁正生等, 2012; 李强等, 2014)。目前对于瓦氏黄颡鱼的抗细菌感染的分子机制及免疫机制的研究较少。嗜水气单胞菌能显著促进瓦氏黄颡鱼肝脏、脾脏和肾脏补体C8α、C8β mRNA表达等(Qin et al, 2017a)。作为一种重要的识别病原分子, TLR2参与瓦氏黄颡鱼先天性免疫, 抵御病原侵染机制还有待深入研究。因此, 本实验克隆瓦氏黄颡鱼TLR2 cDNA, 为深入了解TLR2在鱼类炎症反应中的分子免疫机制提供基础。
1 材料与方法 1.1 实验材料瓦氏黄颡鱼(Pelteobagrus vachellii)平均体重为15.49±2.18g, 驯养30天后。实验期间, 水温(25± 2) ℃, pH=7.27±0.4, 溶氧充足。选择健康的瓦氏黄颡鱼240尾随机分为对照组和实验组, 每组三个平行, 每个平行40尾。在腹腔处为对照组每尾鱼注射100μL的生理盐水, 采用相同方式为实验组每尾鱼注射100μL的嗜水气单胞菌菌液(0.85±109 CFU/mL), 分别在0h、6h、12h、24h、48h和96h随机从对照组和实验组取9尾瓦氏黄颡鱼(3尾/每个平行), 丁香酚麻醉后解剖, 分别取肝脏、脾脏和头肾, 无菌水清洗后置入液氮, 后保存于–80℃。
1.2 总RNA的提取和cDNA第一条链的合成按照RNAiso Plus (TaKaRa)试剂操作步骤提取瓦氏黄颡鱼肝脏的总RNA。以提取的总RNA为模板, 采用TaKaRa RNA PCR Kit (AMV) Ver.3.0试剂盒合成cDNA。
1.3 TLR2基因cDNA克隆从瓦氏黄颡鱼肝脏转录组(BioProject ID: PRJNA362523)挑取TLR2 Unigens (Qin et al, 2017b), 设计和合成基因特异性引物TLR2-S和TLR2-A(表 1)。以肝脏总RNA为模板, 按照5’-RACE System (Clonteck)试剂操作步骤合成cDNA后, 以引物为TLR2-A和UPM扩增TLR2 5’端。以肝脏总RNA为模板, 采用SMART ScribeTM Reverse Transcriptase (Clonteck)和引物3’-CDS primer A合成cDNA后, 以引物为TLR5-S和UPM扩增TLR2 3’端。扩增产物由上海生工生物技术有限公司纯化、克隆及测序。
| 引物名称 | 序列(5′—3′) |
| Adapter Primer | AAGCAGTGGTATCAACGCAGAGTA(T)30VN |
| Universal Primer Mix | CTAATACGACTCACTATAGGGCAAGCAGTGGTATCAACGCAGAGT |
| TLR2-A | GTCCCTTAGAGTAATCAAGT GGTCG |
| TLR2-S | GTGGCAGAAAGCGAAGTGGA |
| TLR2-Qa | TTCGCTTTCTGCCACCAACC |
| TLR2-Qs | GGAGTCACGCTCATTCTAAAAGTATTG |
| β-actin-Qs | CACTGTGCCCATCTACGAG |
| β-actin-Qa | CCATCTCCTGCTCGAAGTC |
| Myd88-Qa | GGTGTAAGAGGATGGTGGTTGTC |
| Myd88-Qs | TGTGGAGGGTCTGGTGTAGTCA |
| IL-1β-Qa | CTCCATGAAGATAGTGAAGAGGTCC |
| IL-1β-Qs | CAAAGGAATCCGTATCCAGGTCA |
| TNFα-Qa | CCTCAGGGAGTGCTTGATTTCTT |
| TNFα-Qs | TCAGGTTTTGTTGGATGTGGACG |
| NF-κB-Qa | CCTCGCTACCGAACAGGACA |
| NF-κB-Qs | TGTAGAGGCGTAGAGCCGTCAT |
| CASP8-Qa | CAGCAAACAAAAGCACGAAGG |
| CASP8-Qs | GAAGGTTCCGTTAAACAGGTCG |
分别采用BLAST (http://blast.ncbi.nlm.nih.gov/blast)、ORF finder (http://www.ncbi.nlm.nih.gov/gorf/orfig.cgi进行同源比较分析瓦氏黄颡鱼cDNA和推导瓦氏黄颡鱼cDNA氨基酸序列。采用Motif Scan和Expasy (http://hits.isb-sib.ch/cgi-bin/PFSCAN, http://prosite.expasy.org/)分析瓦氏黄颡鱼TLR2蛋白的序列特征。采用SWISS-MODEL (http://swissmodel.Expasy.org/))进行三级结构的预测, 以邻接法(Neighbourjoining, NJ)构建系统进化树, 用自展法(Bootstrap)进行1000次重复检验。
1.5 TLR2基因组织表达分析随机选取9尾健康的瓦氏黄颡鱼, 冰上麻醉后, 分别取机体的9个组织(鳃、脑、心脏、肝脏、脾脏、头肾、肠道、皮肤及肌肉), 分别采用RNAiso Plus (TaKaRa)试剂盒、Prime ScriptTM RT reagent Kit with gDNA Eraser试剂盒(TaKaRa)提取总RNA和合成cDNA。采用Roche Light Cycler Nano (USA)进行荧光定量PCR。PCR:稀释的cDNA模板1μL、Fast Start Essential DNA Green Master 10μL、10μmol/L引物Q-TLR2a和Q-TLR2s各2μL(表 1)、水5μL, 总体积20μL。反应条件均为: 95℃预变性5min; 95℃变性10s、65℃退火5s、72℃延伸10s, 共45个循环。以肝脏mRNA表达为对照, 以瓦氏黄颡鱼β-actin为内参基因(表 1) (Zheng et al, 2010), 采用Livak和chmittgen建立的2-△△CT法计算各组织TLR 2 mRNA的表达水平(Livak et al, 2001)。目的基因相对表达量用平均值±标准差表示。嗜水气单胞菌感染瓦氏黄颡鱼后, 肝脏、脾脏和头肾中基因TLR 2 mRNA表达分析方法同上。头肾中TLR 2信号通路下游的髓样分化因子(myeloid differentiation factor 88, MyD88), 半胱氨酸蛋白酶8 (Caspase 8, CASP8), 核转录因子kappa B (NF-κB), 肿瘤坏死因子(tumor necrosis factor alpha, TNFα), 白细胞介素1β (interleukin-1β, IL-1β) mRNA表达分析方法同上, 引物见表 1。
1.6 数据统计及分析采用平均值±标准差(mean ± S.D.)表示TLR2 mRNA相对表达量, 采用SPSS18.0统计分析软件t-检验分析不同组织和不同基因的相对表达水平, 当P < 0.05时差异显著。
2 结果 2.1 TLR2 cDNA克隆和序列分析从瓦氏黄颡鱼肝脏转录组挑取TLR2 Unigenes, 设计基因特异性引物, 采用RACE技术克隆获得TLR2基因5′和3′端, 拼接后获得TLR2 cDNA序列, 全长2611bp, 包含2370bp的开放阅读框, 138bp 5′-非编码区和106bp 3′-非编码区。开放阅读框编码的789个氨基酸(图 1), 其中包括20个氨基酸组成的信号肽。序列比对分析表明, 瓦氏黄颡鱼TLR2氨基酸与斑点叉尾
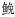
 |
| 图 1 瓦氏黄颡鱼TLR2 cDNA全长及推导的氨基酸序列 Fig. 1 Full-length of cDNA and deduced amino acid sequence of TLR2 from P. vachellii 注:虚线、双虚线、下划线及方框分别表示TIR、信号肽、LRR及Box基序 |
| 基因 | 物种 | 登录号 | 相似性(%) |
| TLR2 | 瓦氏黄颡鱼Pelteobagrus vachellii | KY982542 | |
| TLR2 | 斑点叉尾 Ictalurus punctatus
Ictalurus punctatus |
AEI59663.1 | 77 |
| TLR2 | 鲤Cyprinus carpio | BAU98381.1 | 61 |
| TLR2 | 南亚黑鲮Labeo rohita | ADQ74644.1 | 58 |
| TLR2 | 草鱼Ctenopharyngodon idella | ACT68333.1 | 62 |
| TLR2 | 团头鲂Megalobrama amblycephala | ANI19836.1 | 61 |
| TLR2 | 麦鲮Cirrhinus mrigala | AHI59129.1 | 63 |
| TLR2 | 黑鲫Carassius carassius | AGO57934.1 | 62 |
| TLR2 | 虹鳟Oncorhynchus mykiss | CCK73195.1 | 58 |
| TLR2 | 条石鲷Oplegnathus fasciatus | AFZ81806.1 | 48 |
| TLR2 | 大黄鱼Larimichthys crocea | AHB51066.1 | 48 |
| TLR2 | 欧洲舌齿鲈Dicentrarchus labrax | APM84341.1 | 48 |
| TLR2 | 牙鲆Paralichthys olivaceus | BAD01044.1 | 47 |
| TLR2 |  Miichthys miiuy
Miichthys miiuy
|
AFG21856.1 | 48 |
| TLR2 | 大菱鲆Scophthalmus maximus | AMQ35497.1 | 46 |
| TLR2 | 红鳍东方鲀Takifugu rubripes | AAW69370.1 | 50 |
| TLR2 | 绿头鸭Anas platyrhynchos | ADO39962.1 | 49 |
| TLR2 | 青蛤Cyclina sinensis | AIZ97750.1 | 45 |
| TLR2 | 猪Sus scrofa | NP_998926.1 | 42 |
| TLR2 | 狗Canis familiaris | NP_001005264.2 | 43 |
Motif Scan和Expasy分析得出, 瓦氏黄颡鱼TLR2氨基酸序列含有一个跨膜结构域(590—612)、一个TOLL/IL受体结构域(643—788)、9个富含亮氨酸的重复序列(51—72, 73—96, 98—120, 121—144, 359—384, 388—413, 414—437, 478—500, 535— 588)、一个LRRCT结构域(图 1, 图 2)。此外, 瓦氏黄颡鱼TLR2的TIR结构域还含有保守的Boxl、Box2和Box3基序, 分别是YDAFVSY、LCLHKRDFLPG、FW。由此可推断, 克隆得到的cDNA为瓦氏黄颡鱼TLR2基因, 将该cDNA序列提交GenBank, 登录号为KY982542。用MEGA6.1软件以邻接法(NJ)构建了TLR2的系统树(表 2), 采用bootstrap 1000个循环检验拓扑结构的置信度。结果表明瓦氏黄颡鱼TLR2与斑点叉尾
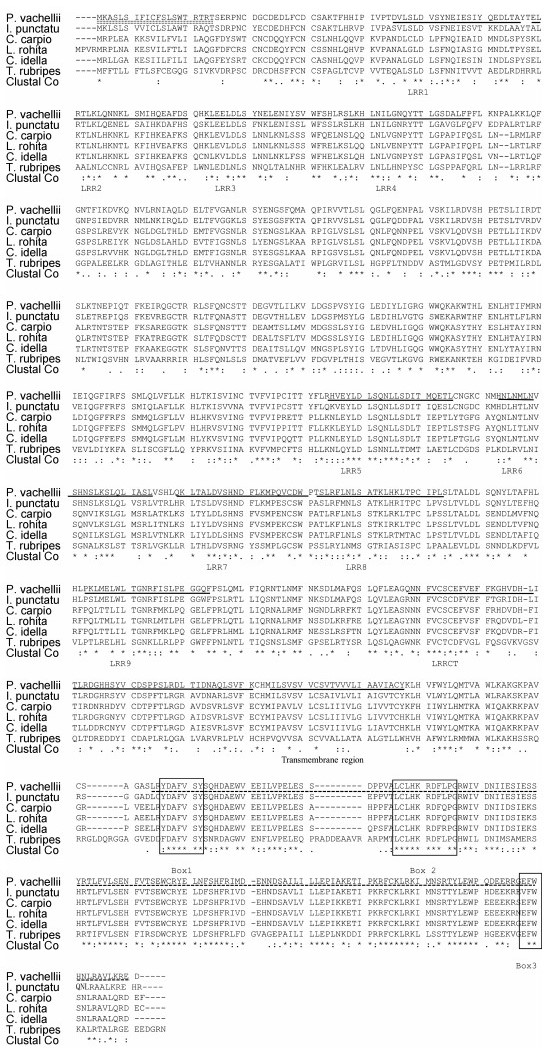 |
| 图 2 瓦氏黄颡鱼与其他动物的TLR2氨基酸的多序列比对结果 Fig. 2 Alignment of amino acid sequences of TLR2 from P. vachellii and other species 注:虚线、双虚线、下划线及方框分别表示TIR、信号肽、LRR及Box基序 |
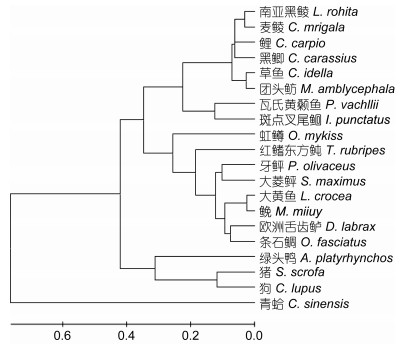 |
| 图 3 根据TLR2氨基酸序列构建的NJ系统进化树 Fig. 3 Neighbor-joining phylogenetic tree of TLR2 amino acid sequences from different species |
荧光定量PCR检测结果显示, TLR2 mRNA在健康瓦氏黄颡鱼的鳃、肝脏、脾脏、头肾、肠道、肌肉、皮肤、脑、心脏组织均有表达; TLR2 mRNA在瓦氏黄颡鱼脾脏中的含量最高, 其次是头肾, 两者显著高于肝脏、鳃和肾脏等组织(P < 0.05), 在肠道中表达量最低(图 4)。
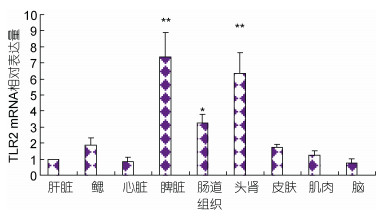 |
| 图 4 TLR2在瓦氏黄颡鱼不同组织的表达 Fig. 4 The expression level of TLR2 in tissues of P. vchellii 注:与肝脏组织相比, *代表P < 0.05; **代表P < 0.01;下同 |
嗜水气单胞菌侵染后, 瓦氏黄颡鱼肝脏、脾脏和头肾中TLR2 mRNA表达水平分别在6—48h、6—96h、6—96h内显著增加(P < 0.05), 且呈现先上升后下降趋势(图 5a, b, c), 分别在24h、24h及12h达到最大值。
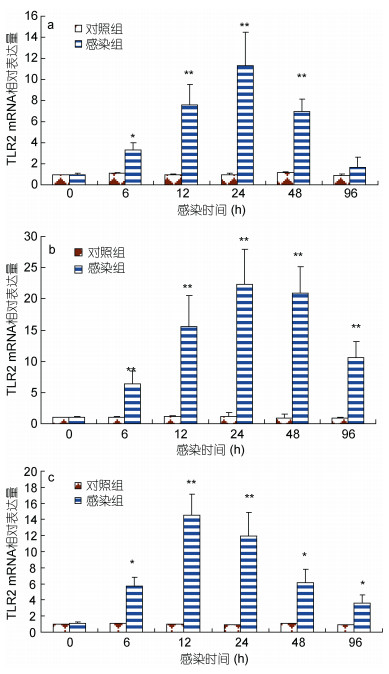 |
| 图 5 嗜水气单胞菌侵染后, TLR2 mRNA在肝脏(a)、脾脏(b)和头肾(c)内表达分析 Fig. 5 The expression level of TLR2 in tissues after Aeromonas hydrophila challenge |
嗜水气单胞菌侵染后, 头肾中TLR 2信号通路下游的髓样分化因子(MyD88)、半胱氨酸蛋白酶8 (CASP 8)、核转录因子kappa B (NF-κB) mRNA在6—96h内均显著上升(P < 0.05), 且分别在24h、12h、48h, 达到最大值。肿瘤坏死因子(TNFα), 白细胞介素1β (IL-1β) mRNA在6—192h内均显著上升(P < 0.05), 均在48h达到最大值(图 6)。
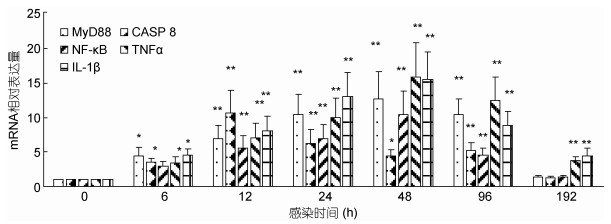 |
| 图 6 嗜水气单胞菌侵染后, TLR2下游基因在头肾内表达分析 Fig. 6 The expression level of downstream genes of TLR2 in head kidney after A. hydrophila challenge |
TLR属于模式识别受体家族, 是非特异性免疫系统中特异的I-型跨膜受体, 能识别病原体细胞表面的病原相关分子模式(PAMPs), 从而激活机体的免疫防御等(Takeuchi et al, 2010)。TLR2氨基酸结构域在点带石斑鱼、银鲳、斑点叉尾

据任毅鹏等(2014)报道, 青蛤TLR2基因在血淋巴中的表达量最高, 显著高于肝脏、鳃、外套膜、闭壳肌、性腺等组织。大黄鱼血液中TLR2 mRNA表达水平高于脾脏、头肾, 且在胃中的表达量最低(Wei et al, 2011)。瓦氏黄颡鱼TLR2 mRNA在头肾及脾脏中表达水平显著高于鳃、肌肉、皮肤、肠道等组织。在大菱鲆中, TLR2 mRNA主要在头肾、脾脏等免疫组织中表达, 显著高于脑、鳃、性腺等等非免疫器官(Zhang et al, 2016)。上述研究表达, 瓦氏黄颡鱼、大黄鱼及牙鲆等鱼类类似于哺乳动物, TLR2主要表达在富含免疫细胞的组织中, 如脾脏和头肾。哺乳动物的TLR2主要表达于巨噬细胞、树突状细胞、单核细胞、T淋巴细胞等免疫细胞表面, 是连接天然免疫与获得性免疫的桥梁(罗兵等, 2011)。
在哺乳动物中, Toll样受体存在于细胞膜上, 识别病源的脂多糖、肽聚糖、双链RNA、鞭毛蛋白等PAMP后, 通过髓样分化因子, 激活下游的核转录因子(NF-κB)、干扰素等调控分子, 诱导肿瘤坏死因子、白细胞介素、干扰素等刺激细胞大量生成, 以杀灭和清除入侵的病原; 此外, Toll样受体信号通路在连接先天性免疫与获得性免疫反应中起着重要的桥梁作用(Palti, 2011)。在鱼类中, 嗜水气单胞菌能显著诱导瓦氏黄颡鱼头肾、脾脏及肝组织中TLR2 mRNA的表达。海鱼分枝杆菌(Mycobacterium marinum)和爱德华氏菌(E. ictulari)能显著诱导斑马鱼、斑点叉尾血液、头肾和脾脏组织中的TLR2 mRNA表达(Meijer et al, 2004; Baoprasertkul et al, 2007)。肽聚糖和poly I:C刺激后, 大菱鲆外周血细胞中TLR2基因mRNA表达显著增强(Zhang et al, 2016)。白介素-1(IL-1)受体相关激酶家族(interleukin-1 receptor-associated kinases, IRAKs)是白介素-1受体家族(IL-1, IL-18和IL-33受体)和TOLL样受体(TLRs)信号通路中的重要信号分子, 能激活TLRs信号通路的下游免疫相关分子(Janssens et al, 2003)。IRAKs能与髓样分化因子(MyD88)的死亡结构域形成一个Myddosome复合体后, 与肿瘤坏死因子受体相关因子6 (TNF receptor associated factor 6, TRAF6)结合, 从而激活NF-κB介导的系列信号通路(Li et al, 2002; Lin et al, 2010)。嗜水气单胞菌侵染瓦氏黄颡鱼后, 头肾中的TLR2信号通路下游的髓样分化因子(MyD88)、半胱氨酸蛋白酶8 (CASP 8)、核转录因子kappa B (NF-κB), 肿瘤坏死因子α(TNFα), 白细胞介素1β (IL-1β) mRNA表达水平显著上调, 表明嗜水气单胞菌感染激活了瓦氏黄颡鱼头肾TLR 2下游的免疫分子, 如白细胞介素1β和肿瘤坏死因子, 从而促使组织应答感染和促炎症反应。据Samanta等(2012)报道, 酵母聚糖、肽聚糖、脂磷壁酸和迟钝爱德华菌(Edwardsiella tarda)等均能诱导野鲮TLR2 mRNA上调表达, 且能显著上调TLR通路下游的免疫细胞因子白细胞介素-8、髓样分化因子及核转录因子kappa B (NF-κB) mRNA表达。上述研究表明, 瓦氏黄颡鱼TLR2及下游的MyD88、CASP 8、NF-κB、TNFα和IL-1β在抵抗病菌感染过程中发挥了重要作用。
4 结论本实验探究了Toll样受体2(TLR2)及下游免疫分子对瓦氏黄颡鱼机体的保护作用, 序列同源性比对发现瓦氏黄颡鱼TLR2 cDNA与斑点叉尾、鲤及虹鳟的同源性分别为78%、62%及49%。系统进化树分析结果表明瓦氏黄颡鱼TLR2与斑点叉尾聚为一支。qRT-PCR分析表明TLR2 mRNA在被检测的组织中均有表达, 且在头肾和脾脏中表达水平显著高于其它组织(P﹤0.05)。嗜水气单胞菌感染激活了TLR2信号通路, 通过上调表达肿瘤坏死因子α、白细胞介素1β等。TLR2在瓦氏黄颡鱼抵御嗜水气单胞菌侵染的过程中起到了重要的免疫作用。
| 任毅鹏, 高晶, 潘宝平, 等, 2014. 青蛤(Cyclina sinensis)TLR2基因的克隆与表达分析. 海洋与湖沼, 45(5): 1037–1043 DOI:10.11693/hyhz20140600183 |
李强, 黄华, 张显昱, 等, 2014.  爱德华菌单克隆抗体的制备及其在黄颡鱼"红头病"研究中的应用. 大连海洋大学学报, 29(4): 323–328 爱德华菌单克隆抗体的制备及其在黄颡鱼"红头病"研究中的应用. 大连海洋大学学报, 29(4): 323–328 |
| 罗兵, 李涛, 徐元宏, 2011. TOLL样受体的信号转导及抗感染免疫研究进展. 免疫学杂志, 27(2): 165–169 |
| 梁正生, 黄钧, 施金谷, 等, 2012. 黄颡鱼腹水病病原菌的分离鉴定及药敏试验. 南方农业学报, 43(9): 1400–1404 |
| Akira S, Takeda K, 2004. Toll-like receptor signaling. Nature Reviews Immunology, 4(7): 499–511 |
| Akira S, Uematsu S, Takeuchi O, 2006. Pathogen recognition and innate immunity. Cell, 124(4): 783–801 DOI:10.1016/j.cell.2006.02.015 |
| Baoprasertkul P, Peatman E, Abernathy J, et al, 2007. Structural characterisation and expression analysis of toll-like receptor 2 gene from catfish. Fish & Shellfish Immunology, 22(4): 418–426 |
| Barton G M, Kagan J C, Medzhitov R, 2006. Intracellular localization of Toll-like receptor 9 prevents recognition of self DNA but facilitates access to viral DNA. Nature Immunology, 7(1): 49–56 DOI:10.1038/ni1280 |
| Fan Z J, Jia Q J, Yao C L, 2015. Characterization and expression analysis of Toll-like receptor 2 gene in large yellow croaker, Larimichthys crocea. Fish & Shellfish Immunology, 44(1): 129–137 |
| Gao Q X, Xiao Y P, Zhang C J, et al, 2016. Molecular characterization and expression analysis of toll-like receptor 2 in response to bacteria in silvery pomfret intestinal epithelial cells. Fish & Shellfish Immunology, 58: 1–9 |
| Janssens S, Beyaert R, 2003. Functional diversity and regulation of different interleukin-1 receptor-associated kinase (IRAK) family members. Molecular Cell, 11(2): 293–302 DOI:10.1016/S1097-2765(03)00053-4 |
| Kawai T, Akira S, 2009. The roles of TLRs, RLRs and NLRs in pathogen recognition. International Immunology, 21(4): 317–337 DOI:10.1093/intimm/dxp017 |
| Lee M S, Kim Y J, 2007. Signaling pathways downstream of pattern-recognition receptors and their cross talk. Annual Review of Biochemistry, 76: 447–480 DOI:10.1146/annurev.biochem.76.060605.122847 |
| Li S, Strelow A, Fontana J, et al, 2002. IRAK-4:a novel member of the IRAK family with the properties of an IRAK-kinase. Proceedings of the National Academy of Sciences of the United States of America, 99(8): 5567–5572 DOI:10.1073/pnas.082100399 |
| Lin S C, Lo Y C, Wu H, 2010. Helical assembly in the MyD88-IRAK4-IRAK2 complex in TLR/IL-1R signalling. Nature, 465(7300): 885–890 DOI:10.1038/nature09121 |
| Livak K J, Schmittgen T D, 2001. Analysis of relative gene expression data using Q real-time quantitative PCR and the 2-△△CT method. Methods, 25(4): 402–408 DOI:10.1006/meth.2001.1262 |
| Meijer A H, Krens S F G, Rodriguez I A M, et al, 2004. Expression analysis of the Toll-like receptor and TIR domain adaptor families of zebra fish. Molecular Immunology, 40(11): 773–783 DOI:10.1016/j.molimm.2003.10.003 |
| Palti Y, 2011. Toll-like receptors in bony fish:from genomics to function. Developmental & Comparative Immunology, 35(12): 1263–1272 |
| Qin C J, Shao T, Zhao D X, et al, 2017a. Effect of ammonia-N and pathogen challenge on complement component 8α and 8β expression in the darkbarbel catfish Pelteobagrus vachellii. Fish & Shellfish Immunology, 62: 107–115 |
| Qin C J, Gong Q, Wen Z Y, et al, 2017b. Comparative analysis of the liver transcriptome of Pelteobagrus vachellii with an alternative feeding time. Comparative Biochemistry and Physiology Part D:Genomics and Proteomics, 22: 131–138 DOI:10.1016/j.cbd.2017.04.001 |
| Roach J C, Glusman G, Rowen L, et al, 2005. The evolution of vertebrate Toll-like receptors. Proceedings of the National Academy of Sciences of the United States of America, 102(27): 9577–9582 DOI:10.1073/pnas.0502272102 |
| Samanta M, Swain B, Basu M, et al, 2012. Molecular characterization of toll-like receptor 2 (TLR2), analysis of its inductive expression and associated down-stream signaling molecules following ligands exposure and bacterial infection in the Indian major carp, rohu (Labeo rohita). Fish & Shellfish Immunology, 32(3): 411–425 |
| Takeuchi O, Akira S, 2010. Pattern recognition receptors and inflammation. Cell, 140(6): 805–820 DOI:10.1016/j.cell.2010.01.022 |
| Wei Y C, Pan T S, Chang M X, et al, 2011. Cloning and expression of Toll-like receptors 1 and 2 from a teleost fish, the orange-spotted grouper Epinephelus coioides. Veterinary Immunology and Immunopathology, 141(3-4): 173–182 DOI:10.1016/j.vetimm.2011.02.016 |
| Xu Y W, Tao X, Shen B H, et al, 2000. Structural basis for signal transduction by the Toll/interleukin-l receptor domains. Nature, 408(6808): 111–115 DOI:10.1038/35040600 |
| Zhang H Y, Hu G H, Liu Q M, et al, 2016. Cloning and expression study of a Toll-like receptor 2 (tlr2) gene from turbot, Scophthalmus maximus. Fish & Shellfish Immunology, 59: 137–148 |
| Zheng K K, Zhu X M, Han D, et al, 2010. Effects of dietary lipid levels on growth, survival and lipid metabolism during early ontogeny of Pelteobagrus vachellii larvae. Aquaculture, 299(1-4): 121–127 DOI:10.1016/j.aquaculture.2009.11.028 |
| Zhu L Y, Nie L, Zhu G, et al, 2013. Advances in research of fish immune relevant genes:a comparative overview of innate and adaptive immunity in teleosts. Developmental & Comparative Immunology, 39(1-2): 39–62 |
 2018, Vol. 49
2018, Vol. 49

