中国海洋湖沼学会主办。
文章信息
- 何杰, 王绪杰, 余方平, 许文军, 王庚申, 谢建军, 汪玮, 施慧. 2018.
- HE Jie, WANG Xu-Jie, YU Fang-Ping, XU Wen-Jun, WANG Geng-Shen, XIE Jian-Jun, WANG Wei, SHI Hui. 2018.
- 自切附肢对三疣梭子蟹(Portunus trituberculatus)幼蟹存活、生长和能量收支的影响
- EFFECTS OF LIMB AUTOTOMY ON SURVIVAL, GROWTH AND ENERGY BUDGET OF JUVENILE SWIMMING CRAB PORTUNUS TRITUBERCULATUS
- 海洋与湖沼, 49(1): 207-213
- Oceanologia et Limnologia Sinica, 49(1): 207-213.
- http://dx.doi.org/10.11693/hyhz20170700198
-
文章历史
- 收稿日期:2017-07-27
- 收修改稿日期:2017-08-30
2. 浙江海洋大学 舟山 316022
2. Zhejiang Ocean University, Zhoushan 316022, China
动物生存于自然环境下, 难免会遭遇到种间或种内的侵袭, 然而, 其在应对敌害生物或种内相残时通常会采取一定的防御对策以保证自身的生命安全(He et al, 2016a), 其中通过自切(自残)并放弃身体部分组织, 借以迷惑对方而趁机逃离并在后续生长发育中再生出身体残缺部分的防御形式常见于许多甲壳动物(Quinitio et al, 2011)、棘皮动物(Ramsay et al, 2001)、啮齿动物(Maginnis, 2006)和软体动物(Fleming et al, 2007)。虾蟹类甲壳动物在应对威胁时会自行切除部分附肢(包括螯足、步足或游泳足等)后逃离, 有时为避免病菌感染, 也会自动从基节处自切残缺的附肢以保护机体不被感染(He et al, 2016a)。
尽管动物的自切行为能使其暂时逃离危险, 但自切附肢后机体将处于高度应激状态, 其社会行为会发生巨大改变, 机体的生长发育亦会受到较大影响(岳武成等, 2016)。有关附肢自切与再生对甲壳动物的摄食、存活、生长、繁殖、种内竞争力以及抵御敌害能力等生理生态的影响已受到国外学者广泛的研究和关注(Frisch et al, 2011; Quinitio et al, 2011; Slos et al, 2011), 而我国在甲壳动物附肢自切与再生方面的研究甚少, 仅见少量有关中华绒螯蟹在附肢再生过程中生理生态和分子适应机制的报道(岳武成等, 2016; He et al, 2016a)。
三疣梭子蟹(Portunus trituberculatus)(以下简称梭子蟹)是我国重要的海水养殖蟹类, 其生性好斗, 种内互相残杀现象极其严重, 作者先前的研究发现池塘养殖条件下梭子蟹自切率高达30%左右(He et al, 2016b)。然而, 迄今为止, 有关梭子蟹的自残行为、自切对梭子蟹生理生态的影响以及梭子蟹应对自切行为的适应对策和响应机制仍处于空白阶段。鉴于此, 本研究将重点研究自切附肢对梭子蟹存活、生长及能量收支的影响, 为探明梭子蟹自切附肢后的生存对策与生命代谢特征, 研究与开发梭子蟹健康高效养殖技术提供理论基础。
1 材料与方法 1.1 实验材料2016年6月15日从浙江省海洋水产研究所西闪渔业科技岛养殖池塘捕捞并挑选800余只规格均匀的梭子蟹幼蟹, 从中挑选处于蜕壳期E期(参照沈洁等(2011)判断方法)的310只幼蟹暂养于室内水泥池(长×宽×高=4m×1.5m×0.5m), 水深0.3m, 水池内放置长度为10cm、直径为5cm的PVC管, 供幼蟹隐蔽。暂养12h后, 可发现大批量的幼蟹已集中蜕壳, 此时共收集到104只刚完成蜕壳的软壳蟹, 将这些软壳蟹暂养于另一相同条件的水槽, 12h后, 待该批蟹的甲壳已基本硬化后备用于实验。
1.2 实验方法从上述甲壳刚硬化的幼蟹中挑选96只(雌雄各半)十足健全、规格相近的个体, 逐个称取其体重(W), 并随机分成6组(A0, A1, A2, A3, A4, A5), 每组雌雄各8只。然后对各组幼蟹进行附肢自切处理, 使上述各组幼蟹分别自切0(对照组)、1、2、3、4、5条附肢, 具体的自切处理参考于He等(2016a)的方法:用手指轻轻抓住幼蟹的部分附肢, 幼蟹在不断挣扎后会主动自切下被手抓住的附肢。需要特别说明的是这里的自切附肢处理是随机的, 如A3组是随机自切幼蟹的任何3条附肢。经自切处理的幼蟹逐一称重后, 分别养殖于长宽高分别为30cm×20cm×18cm的塑料盒中, 每盒养殖1只幼蟹, 养殖用水为经沉淀过滤后的自然海水, 水深14cm, 水温26±2℃, pH 8.6±0.2, 连续增氧, 确保DO > 5mg/L。每日下午17:00投喂称量好的配合饲料(宁波天邦饲料有限公司生产), 每次均过量投喂, 并且在2h后收集未摄食完的残饵和粪便, 换水1/3。每日观察幼蟹的死亡和蜕壳情况, 记录每只蟹的蜕壳时间, 并且在蜕壳后的24h(幼蟹甲壳硬化)对其进行称重, 将旧壳与活体幼蟹一并在–20℃条件下冷冻保存。以所有幼蟹完成1次蜕壳时为实验结束时间。
1.3 数据采集 1.3.1 摄食、生长和蜕壳分别计算蜕壳周期内的增重率(WGR)、特殊生长率(SGR)、摄食率(FR)和食物转化率(FCE), 计算公式如下:
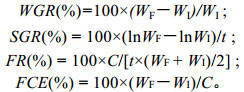
式中, WF为蜕壳结束后幼蟹的平均体重, WI为蜕壳前幼蟹的平均体重, C为蜕壳周期内总摄入的饲料量, t为蜕壳周期。
1.3.2 能量收支根据虾蟹类体内能量流动和转换模型, 利用C = G + F + U + E + R的能量收支关系计算梭子蟹的能量分配方法, 其中C为摄入的饲料能量, G为生长能, F为粪能, U为排泄能, E为蜕壳能, R为呼吸能。C、G、F、E的能值分别由饲料、幼蟹、粪便、蟹壳于70℃下烘干至恒重后使用ZDHW-2全自动量热仪直接测定, 而排泄能的计算参考Levine等(1979)和路允良等(2012)的方法, 即U = UN ×24830 = (CN-GN-FN-EN)×24830, 其中UN为排泄掉的氮, CN为摄取饲料中的氮, GN为蟹体内积累的氮, FN为粪便中损失的氮, EN为蟹蜕壳损失的氮, 系数24830为每克氨氮的能值(J/g), 使用德国VARIO EL Ⅲ元素分析仪测定样品含氮量, 呼吸能由下列公式推算:
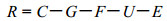
以能量形式计算同化效率(assimilation efficiency, K1)和净生长效率(net growth efficiency, K2)的公式如下:
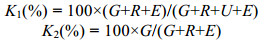
各实验数据均用平均值±标准差(Χ±S.D)表示, 不同试验组数据间采用单因素方差分析, 对检测达到显著的平均值用Duncan检验, 方差分析和多重比较用SPSS 11.5进行, 在Sigmaplot 10.0下绘制相关图表。
2 结果 2.1 自切附肢对幼蟹生长和存活的影响自切附肢后的幼蟹仍能正常的摄食和活动, 实验开始后的4—5d内, 自切附肢后的幼蟹(图 1a)便在原自切位置生长出新的肉芽(图 1b), 并且随着时间的延长, 肉芽逐渐逐渐变大, 经蜕壳后, 从肉芽中长出新的附肢, 形态上与正常附肢相近, 但较小于正常附肢(图 1c)。
 |
| 图 1 三疣梭子蟹幼蟹断肢再生过程形态变化 Fig. 1 The process of limb regeneration in juvenile swimming crabs |
自切附肢对幼蟹的蜕壳周期产生了明显的影响(图 2), 除A1幼蟹的蜕壳周期与A0组相近外, 其余各组的蜕壳周期均显著短于对照组(P < 0.05), 而且, 蜕壳周期与自切附肢的数目呈显著的负相关关系, 断肢越多, 蜕壳周期越短, 整体上, 每多自切1条附肢, 蜕壳周期将缩短1—1.5d。
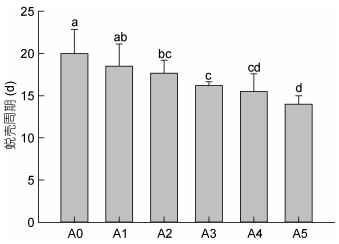 |
| 图 2 自切不同数量附肢后三疣梭子蟹幼蟹的蜕壳周期 Fig. 2 Molt cycle of juvenile swimming crabs with autotomized different quantity limbs 注:柱上不同字母表示各组间差异显著(P < 0.05), 下同 |
较实验初始时, 蜕壳后幼蟹体重明显增加, 但增重率随自切附肢数的增加而逐渐降低(表 1), 经统计学分析A2、A3、A4、A5组幼蟹的增重率均显著低于A0组(P < 0.05), 其中A5组幼蟹在整个蜕壳周期内的增重率仅有100.98%, 远低于A0组的142.87%;与增重率相比, 幼蟹在整个蜕壳周期内的特定生长率与自切附肢数呈正相关, 自切附肢数越多, 幼蟹的特定生长率越高, 其中A3、A4、A5组幼蟹的特定生长率显著高于对照组(P < 0.05), 尤其是A5组幼蟹的特定生长率高于A0组20%以上。
| 组别 | W(g) | WI(g) | WF(g) | WGR(%) | SGR(%) |
| A0 | 2.33±0.28a | 2.33±0.28a | 5.23±0.23a | 142.87±12.09a | 4.33±0.38a |
| A1 | 2.37±0.28a | 2.28±0.21a | 5.04±0.53ab | 136.53±10.03a | 4.51±0.49ab |
| A2 | 2.35±0.23a | 2.15±0.21ab | 4.83±0.25b | 123.83±9.15b | 4.69±0.42abc |
| A3 | 2.40±0.19a | 2.10±0.19ab | 4.47±0.32c | 113.38±8.68bc | 4.71±0.27bc |
| A4 | 2.38±0.10a | 2.02±0.13b | 4.15±0.30cd | 105.23±9.00cd | 5.08±0.39cd |
| A5 | 2.30±0.14a | 1.99±0.13b | 3.98±0.22d | 100.98±7.59d | 5.26±0.35d |
| 注:同一列不同字母表示相互之间差异显著(P < 0.05)。下同 | |||||
图 3所示自切附肢还显著影响了幼蟹的成活率, 整体上自切附肢数越多, 成活率越低, 其中A4、A5组幼蟹的成活率仅为60%左右, 远低于A0组的93.3%。而在实验中发现, 幼蟹发生死亡主要发生于养殖中后期, 近一半个体是因蜕壳不遂死亡。
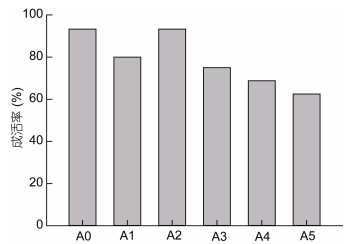 |
| 图 3 自切不同数量附肢后三疣梭子蟹幼蟹的成活率 Fig. 3 Survival rate of juvenile swimming crabs with autotomized different quantity limbs |
由图 4可见, 与正常幼蟹相比, 自切附肢后幼蟹的摄食率略有降低, 并且自切附肢数越多, 摄食率越低, 但仅有A5组幼蟹的摄食率显著低于A0组(P < 0.05), 其余各组与A0组差异并不显著(P > 0.05);然而, 自切附肢后幼蟹的饲料转化率较高于正常幼蟹(图 5), 并且自切附肢数越多, 饲料转化率越高, 其中A4、A5组幼蟹的饲料转化率显著高于A0组(P < 0.05)。
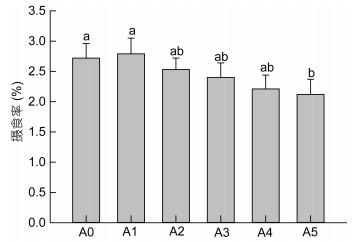 |
| 图 4 自切不同数量附肢后三疣梭子蟹幼蟹的摄食率 Fig. 4 Feeding rate of juvenile swimming crabs with autotomized different quantity limbs |
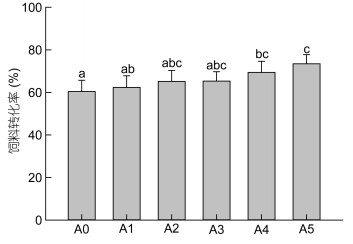 |
| 图 5 自切不同数量附肢后三疣梭子蟹幼蟹的饲料转化率 Fig. 5 Food conversion efficiency of juvenile swimming crabs with autotomized different quantity limbs |
自切不同数量附肢幼蟹的能量分配见图 6。可以看出, 各组幼蟹在能量分配上呈现统一的规律, 即耗能比例为R/C > G/C > U/C > E/C > F/C, 其中呼吸的能量(R)和生长的能量(G)共占据摄入总能量的90%左右, 而粪便能比例最低, 不足1%。从各实验组比较来看, 自切附肢改变了幼蟹的能量分配比例, 随着附肢自切数量的增加, 用于呼吸的能量比例(R/C)逐渐降低, 而用于生长的能量比例(G/C)逐渐升高, 尤其是A4与A5组幼蟹与A0组存在显著差异(P < 0.05), 而不同实验组幼蟹用于排泄的能量(U/C)、蜕壳的能量(E/C)以及粪便中的能量(F/C)差异并不明显(P > 0.05)。
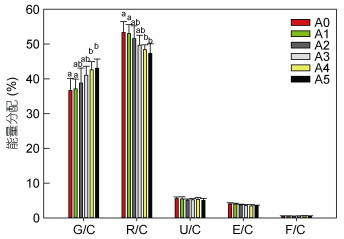 |
| 图 6 自切不同数量附肢后三疣梭子蟹幼蟹的能量分配 Fig. 6 Allocation of consumed energy in juvenile swimming crabs with autotomized different quantity limbs |
从表 2可见, 自切不同数量附肢幼蟹的能量同化效率(K1)相近, 均在94%—95%之间, 组间无显著差异(P > 0.05);而随着自切附肢数量的增加而净生长效率(K2)逐渐升高, 其中A4和A5组幼蟹的净生长效率分别达45.56%和46.41%, 显著高于A0组(39.46%) (P < 0.05)。
| 组别 | K1 | K2 |
| A0 | 94.38±0.52a | 39.46±4.03a |
| A1 | 94.45±0.63a | 39.92±3.31a |
| A2 | 94.83±0.38a | 41.71±4.82ab |
| A3 | 94.72±0.31a | 43.98±3.08ab |
| A4 | 94.60±0.61a | 45.56±2.06b |
| A5 | 94.86±0.56a | 46.41±3.11b |
众所周知, 虾蟹类甲壳动物是依靠蜕壳实现体型的增大和体重的增加。然而, 蜕壳期间是甲壳动物生命过程中最为脆弱的时期, 蜕壳后不久的软壳阶段极易遭受敌害生物和同类的侵袭(王武等, 2013)。作者先前的研究发现, 梭子蟹在硬壳状态时的种内自残率极低, 而正在蜕壳或刚蜕壳后的软壳蟹被同类捕食或残杀的概率极高, 大量的幼蟹在蜕壳后不久的避敌过程中发生自切附肢现象; 另外, 作者还在野外调查中发现, 池塘养殖梭子蟹自切附肢数位1—5条不等(He et al, 2016b)。鉴于以上实际情况, 本研究以处于蜕壳后期(刚完成蜕壳)的幼蟹作为研究材料, 并对其进行自切1—5条附肢的实验处理, 探讨自切附肢对梭子蟹存活、生长及能量收支的影响, 更具有产业实际指导意义。
与其他甲壳动物一样, 梭子蟹幼蟹在自切附肢后将于原部位自发的重新生长出与原来形态功能相近的结构组织, 并且依靠蜕壳动作得以实现, 其再生过程包括伤口愈合、肉芽生长和蜕壳后附肢长出三个阶段(Passano et al, 1963; Adiyodi, 1972)。尽管, 附肢再生对甲壳动蜕壳生长的影响研究已在多个品种中展开, 但结果却不尽相同, 其中在长足龙虾(Panulirus longipes)、非洲龙虾(Jasus lalandii)、中华绒螯蟹(Eriocheir sinensis)中发现自切附肢将缩短蜕壳周期(Chittleborough, 1975; Brouwer et al, 2006; He et al, 2016a); 而在眼斑龙虾(Panulirus argus)、锯缘青蟹(Scylla serrata)中却发现自切附肢延长了它们的蜕壳周期(Davis, 1981; Quinitio et al, 2011), 作者认为, 造成这种结果差异并非与物种种类有关, 而是与实验动物自切附肢时所处的蜕壳时期有关(甲壳动物的蜕壳可以分为蜕壳后期、蜕壳间期、蜕壳前期、蜕壳期等4个时期)。本研究发现自切附肢后梭子蟹幼蟹的蜕壳周期明显缩短, 而且自切数越多, 蜕壳周期越短, 作者推断这与实验幼蟹处于蜕壳后期有关, 蜕壳后期的幼蟹距下次蜕壳的时间较长, 为了能尽快摆脱身体残缺的现状, 幼蟹通过缩短蜕壳周期的生理生态调节策略来加速附肢的再生; 而上述提及的自切附肢延长了部分甲壳动物的蜕壳周期, 很可能是这些研究中的实验动物处于蜕壳间期和蜕壳前期, 距下次蜕壳的时间较短, 其需要延长蜕壳周期, 从而为附肢再生争取更多的时间。至于梭子蟹幼蟹蜕壳后的增重率随自切附肢数的增加而降低, 一方面可能是由于蜕壳周期缩短导致幼蟹的营养积累不够, 另一方面可能是由于自切附肢后的幼蟹将更多的能量用于再生附肢, 即“再生负荷”影响了体型和体重的增长率(Quinitio et al, 2011)。
本研究中采用的是单个体隔离养殖的方法, 饲养期间饵料充足, 水质优良, 梭子蟹幼蟹无需面临食物缺乏、领域争夺、疾病传播以及种内残杀等众多外界环境的压力, 使得仅自切1—2条附肢的幼蟹成活率未受影响, 但自切附肢数较多(自切4—5条附肢)的幼蟹的成活率仍显著降低, 这除了与自切附肢将引发幼蟹免疫力下降、易受病菌的感染的原因外(Slos et al, 2011), 可能还与自切附肢后幼蟹生长营养积累不够, 导致幼蟹蜕壳期间旧壳无法完全分离而死亡, 即出现蜕壳死亡综合症(MDS)有关。然而, 先前研究已表明, 自切附肢将直接影响甲壳动物的种内竞食能力和避敌能力(Juanes et al, 1995; 何杰等, 2017), 因此可以联想到, 在群体养殖条件下, 自切附肢后梭子蟹幼蟹的成活率将受到更大的影响, 这也可能正是作者在调查养殖池塘梭子蟹幼蟹自切规律时发现幼蟹存活个体中附肢自切数最多为5条, 自切数超过5条的幼蟹均无法存活的的真正原因(He et al, 2016b)。
自切附肢后梭子蟹幼蟹的食欲下降, 摄食率降低, 但其食物转化率明显提高, 究其原因, 可能是自切附肢后幼蟹活动能力减弱, 代谢水平降低, 代谢耗能的降低使幼蟹摄入同样的净能用于生长的比例增大, 从而提高了饲料效率, 这与能量收支比较中, 自切附肢降低了幼蟹的呼吸耗能, 而增加了生长耗能的结果相吻合。另外, Hopkins(1993)研究发现招潮蟹(Uca pugilator)在再生附肢期间可增加肌肉蛋白合成能力; Gong等(2015)发现锯缘青蟹附肢再生期间与生长相关的EcR mRNA的表达水平显著升高; 岳武成等(2016)发现中华绒螯蟹断肢再生期间肌肉生长抑制基因MSTN表达下调显著, 使再生肢芽呈现出爆发式的生长现象, 这些结果均表明自切附肢后的幼蟹将表现出一定的补偿生长策略, 符合动物的行为及生理进化理论。
4 结论综上所述, 梭子蟹幼蟹可通过自身的生理生态调节策略应对自切附肢带来的生态后果, 但不容忽视的是自切附肢不仅直接降低幼蟹的成活率, 同时还对蜕壳周期及蜕壳后的增重率均产生不同程度的影响, 使自切附肢成为加剧梭子蟹池塘养殖后期群体规格分化的重要因素之一。而在其他甲壳动物中已证实:群体蜕壳不同步, 规格发生分化, 将加剧种内竞争和残杀, 出现强食弱、大欺小的种群生态现象, 恶性循环发展, 最终导致养殖对象产量严重降低(Gebauer et al, 2003)。然而, 种内自相残杀是引发蟹类自切附肢的首要原因, 影响蟹类同类相残的因素除养殖密度、饵料丰度、水质以及自身性别、蜕壳期和个体大小悬殊等因素外(李玉全等, 2013), 隐蔽物的存在与否也一直被认为是影响蟹类自相残杀的关键因素(Marshall et al, 2005)。目前民间的养殖户也尝试在梭子蟹养殖池塘内投放各种树枝、瓦罐和水管等, 表明这些传统的隐蔽物在提高梭子蟹产量上确实能起到一定作用(刘勇克, 2009), 但是这些隐蔽物的材质和形式多样, 养殖效果参差不齐, 在生产中仍未得到很好的推广和应用。今后的研究不仅需要进一步优化梭子蟹放养密度、饵料投喂和水质管理技术, 还有必要开发一种结构稳固、操作简单并行之有效的隐蔽物, 全方面综合性的减少种内相残和附肢自切的发生率, 切实提高梭子蟹池塘养殖成活率和单位面积产量。
| 王武, 王成辉, 马旭洲, 2013. 河蟹生态养殖. 2版. 北京: 中国农业出版社, |
| 刘勇克, 2009. 沙底质和隐蔽物对三疣梭子蟹(Portunus trituberculatus)行为习性、成活率和生长影响的初步研究. 青岛: 中国海洋大学博士学位论文 |
| 何杰, 王绪杰, 余方平, 等, 2017. 食物资源不足条件下螯足数量对三疣梭子蟹(Portunus trituberculatus)摄食行为和种内竞食能力的影响. 海洋与湖沼, 48(3): 609–616 |
| 李玉全, 孙霞, 2013. 水生动物的争胜行为. 动物学研究, 34(3): 214–220 |
| 沈洁, 朱冬发, 胡则辉, 等, 2011. 三疣梭子蟹蜕皮周期的分期. 水产学报, 35(10): 1481–1487 |
| 岳武成, 陈娇, 慈元吉, 等, 2016. 断肢再生对中华绒螯蟹蜕壳、生长及相关基因表达的影响. 浙江大学学报(农业与生命科学版), 42(4): 502–508 DOI:10.3785/j.issn.1008-9209.2015.09.102 |
| 路允良, 王芳, 赵卓英, 等, 2012. 盐度对三疣梭子蟹生长、蜕壳及能量利用的影响. 中国水产科学, 19(2): 237–245 |
| Adiyodi R G, 1972. Wound healing and regeneration in the crab, Paratelphusa hydrodromous. International Review of Cytology, 32: 257–289 DOI:10.1016/S0074-7696(08)60342-3 |
| Brouwer S L, Groeneveld J C, Blows B, 2006. The effects of appendage loss on growth of South African west coast rock lobster Jasus lalandii. Fisheries Research, 78(2-3): 236–242 DOI:10.1016/j.fishres.2005.11.017 |
| Chittleborough R G, 1975. Environmental factors affecting growth and survival of juvenile western rock lobsters Panulirus longipes (Milne-Edwards). Marine and Freshwater Research, 26(2): 177–196 DOI:10.1071/MF9750177 |
| Davis G E, 1981. Effects of injuries on spiny lobster, Panulirus argus, and implications for fishery management. Fishery Bulletin, 78(4): 979–984 |
| Fleming P A, Saccaggi D, Bateman P W, 2007. Leave it all behind:an evolutionary and taxonomic perspective of autotomy in invertebrates. Biology Review, 82(3): 481–510 DOI:10.1111/brv.2007.82.issue-3 |
| Frisch A J, Hobbs J P A, 2011. Effects of autotomy on long-term survival and growth of painted spiny lobster (Panulirus versicolor) on the great barrier reef, Australia. Marine Biology, 158(7): 1645–1652 DOI:10.1007/s00227-011-1678-7 |
| Gebauer P, Paschke K, Anger K, 2003. Delayed metamorphosis in decapod crustaceans:Evidence and consequences. Revista Chilena de Historia Natural, 76(2): 169–175 |
| Gong J, Yu K, Shu L, et al, 2015. Evaluating the effects of temperature, salinity, starvation and autotomy on molting success, molting interval and expression of ecdysone receptor in early juvenile mud crabs, Scylla paramamosain. Journal of Experimental Marine Biology and Ecology, 464: 11–17 DOI:10.1016/j.jembe.2014.12.008 |
| He J, Wu X G, Cheng Y X, 2016a. Effects of limb autotomy on growth, feeding and regeneration in the juvenile Eriocheir sinensis. Aquaculture, 457: 79–84 DOI:10.1016/j.aquaculture.2016.02.004 |
| He J, Gao Y, Wang W, et al, 2016b. Limb autotomy patterns in the juvenile swimming crab (Portunus trituberculatus) in earth ponds. Aquaculture, 463: 189–192 DOI:10.1016/j.aquaculture.2016.05.043 |
| Hopkins P M, 1993. Regeneration of walking legs in the fiddler crab, Uca pugilator. American Zoologist, 33(3): 348–356 DOI:10.1093/icb/33.3.348 |
| Juanes F, Smith L D, 1995. The ecological consequences of limb damage and loss in decapod crustaceans:a review and prospectus. Journal of Experimental Marine and Biology Ecology, 193(1-2): 197–223 DOI:10.1016/0022-0981(95)00118-2 |
| Levine D M, Sulkin S D, 1979. Partitioning and utilization of energy during the larval development of the xanthid crab, Rhithropanopeus harrisii (Gould). Journal of Experimental Marine Biology and Ecology, 40(3): 247–257 DOI:10.1016/0022-0981(79)90054-6 |
| Maginnis T L, 2006. The costs of autotomy and regeneration in animals:a review and framework for future research. Behavior Ecology, 17(5): 857–872 DOI:10.1093/beheco/arl010 |
| Marshall S, Warburton K, Paterson B, et al, 2005. Cannibalism in juvenile blue-swimmer crabs Portunus pelagicus (Linnaeus.. 1766):effects of body size, moult stage and refuge availability. Applied Animal Behaviour Science, 90(1): 65–82 |
| Passano L M, Jyssum S, 1963. The role of the Y-organ in crab proecdysis and limb regeneration. Comparative Biochemistry and Physiology, 9(3): 195–213 DOI:10.1016/0010-406X(63)90044-6 |
| Quinitio E T, Estepa F D P, 2011. Survival and growth of mud crab, Scylla serrata, juveniles subjected to removal or trimming of chelipeds. Aquaculture, 318(1-2): 229–234 DOI:10.1016/j.aquaculture.2011.05.034 |
| Ramsay K, Bergmann M, Veale L O, et al, 2001. Damage, autotomy and arm regeneration in star fish caught by towed demersal fishing gears. Marine Biology, 138(3): 527–536 DOI:10.1007/s002270000487 |
| Slos S, De Block M, Stocks R, 2011. Autotomy reduces immune function and antioxidant defence. Biology Letters, 5(1): 90–92 |
 2018, Vol. 49
2018, Vol. 49


