中国海洋湖沼学会主办。
文章信息
- 黄冰心, 丁兰平, 秦松, 付晚涛, 陆勤勤, 刘正一, 庞云龙, 李晓丽, 孙忠民. 2018.
- HUANG Bing-Xin, DING Lan-Ping, QIN Song, FU Wan-Tao, LU Qin-Qin, LIU Zheng-Yi, PANG Yun-Long, LI Xiao-Li, SUN Zhong-Min. 2018.
- 铜藻的分类地位、生物地理分布以及2016年底黄海漂浮铜藻源头的初步分析
- THE TAXONOMICAL STATUS AND BIOGEOGRAPHICAL DISTRIBUTION OF SARGASSUM HORNERI WITH THE ORIGIN ANALYSIS OF ITS DRIFTING POPULATION IN THE END OF 2016 AT THE WESTERN YELLOW SEA
- 海洋与湖沼, 49(1): 214-223
- Oceanologia et Limnologia Sinica, 49(1): 214-223.
- http://dx.doi.org/10.11693/hyhz20170900245
-
文章历史
- 收稿日期:2017-09-28
- 收修改稿日期:2017-11-09
2. 中国科学院烟台海岸带研究所 烟台 264003;
3. 大连海洋大学海洋科技与环境学院 大连 116023;
4. 江苏省海洋水产研究所 南通 226007;
5. 大连海洋大学水产与生命学院 大连 116023;
6. 中国科学院海洋研究所 青岛 266071
2. Yantai Institute of Coastal Zone Research, Chinese Academy of Sciences, Yantai 264003, China;
3. Collage of Marine Science-Technology and Environment, Dalian Ocean University, Dalian 116023, China;
4. Marine Fisheries Research Institute of Jiangsu, Nantong 226007, China;
5. Collage of Fisheries and Life, Dalian Ocean University, Dalian 116023, China;
6. Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China
漂浮海藻在太平洋、印度洋、大西洋和红海等地都有发生(Markkaveeva, 1965; Edgar, 1987; Safran et al, 1990; Hirata et al, 2001, 2003; Stewart, 2006)。Murray等(1912)最早研究了大西洋马尾藻海的漂浮马尾藻群落与其共栖鱼类间的相互关系。Parr(1939)介绍了某些马尾藻属种类通过无性繁殖持续产生漂浮的可能性。日本学者自20世纪50年代以来开展了大量的漂浮海藻研究工作, 涉及区系、季节变化、漂浮团块形成过程、漂浮以及繁殖状态等(Segawa et al, 1959a, b, 1961, 1964; Yoshida, 1963; Hirata et al, 2001; Hirata et al, 2003)。马尾藻的漂浮植株可在海上漂浮1—5个月, 可超过沿海自然分布区数百公里(Yoshida, 1963; Okuda, 1977)。
铜藻(Sargassum horneri)属于褐藻门墨角藻目马尾藻科马尾藻属的大型海藻, 是马尾藻属中一种个体比较大的经济褐藻, 长度可达2—7m (Tseng et al, 1983; 曾呈奎等, 2000; 孙建璋等, 2008a, 2010; Pang et al, 2009), 是在北太平洋西部构成海底森林(或海藻床)的主要底栖褐藻类群之一(章守宇等, 2013; 张鹏等, 2014), 且在我国有栽培应用研究(孙建璋等, 2008b, 2009a, b, 2010; Pang et al, 2009)。
在北太平洋西部水域, 铜藻已成为主要的漂浮马尾藻种类, 引起了广泛的关注(Hirata et al, 2001; Hirata et al, 2003; 蔡永超等, 2014)。大量漂浮铜藻通过对马暖流从日本海漂浮到日本北太平洋(Yoshida, 1963)。也有报道称, 东中国海东部的铜藻通过海流漂浮到日本海或日本太平洋沿岸(Komatsu et al, 2007)。
近年来, 我国北部沿海水域除了漂浮绿藻——浒苔外, 漂浮褐藻——铜藻在海面上也常见发生, 但受关注较少。然而2016年底, 黄海西南部沿海大范围暴发的漂浮铜藻种群, 造成了江苏沿海紫菜(Porphyra yezoensis)栽培产业的巨大损失(图 1)。
 |
| 图 1 2016年底江苏南部沿海紫菜栽培筏架的漂浮铜藻 Fig. 1 The drifting thalli ofS. horneri twined to the raft of cultured P. yezoensis at the coast of southern Jiangsu Province in the end of 2016 |
针对铜藻大生物量暴发问题, 本文尝试从其分类地位、地理分布及生长习性等方面介绍和分析我国2016年底黄海漂浮铜藻暴发的可能源头, 以期为后续的防控和资源利用等提供基础科技支撑。
1 铜藻分类地位的历史演变铜藻最早由Turner(1808)报道产于“In the Straits of Corea”, 即现在的韩国与日本间的海峡地区, 原种名为Fucus horneri Turner。1820年, C. Agardh变更其拉丁种名为Sargassum horneri (Turner) C. Agardh, 即现在国际上普遍接受的铜藻拉丁种名; 同时, C. Agardh建立了一个变种Sargassum horneri var. densum C. Agardh。1843年, Kützing变更Turner的铜藻拉丁名为Spongocarpus horneri (Turner) Kützing。1860年, Harvey根据日本东部沿海的样品, 报道了线形马尾藻Sargassum filicinum Harvey, 其在形态特征上与已报道的铜藻非常相似。1880年, Kuntze报道了Sargassum horneri(日本、中国、Cochinchina(越南南部))、Sargassum horneri var. densum(日本)和Sargassum horneri f. furcatodentatum Kuntze(日本)。1889年, J.Agardh(1889)报道了日本及北部沿海几个比较相似的种, 即Sargassum horneri(日本)、S. fengeri J. Agardh (Insulam Sachalin)、Sargassum filicinum(日本)、Sargassum spathulatum J. Agardh (包含在Sargassum horneri的描述之中)。1902年, Okamura(1902)认为Sargassum spathulatum J. Agardh应该是Sargassum horneri var. spathulatum (J. Agardh) Okamura(日本)的同物异名。1998年, Yoshida等(1998)认为S. fengeri为Sargassum filicinum的同物异名, Sargassum horneri var. densum、Sargassum horneri f. furcatodentatum和Sargassum spathulatum皆为铜藻Sargassum horneri的同物异名。2010年, Oak(2010)认为Sargassum horneri var. spathulatum (J. Agardh) Okamura为Sargassum horneri的同物异名。
因此, 以形态特征为基础且与铜藻比较相似的物种有两个, 即铜藻Sargassum horneri(狭义)和线形马尾藻Sargassum filicinum。其差异主要为气囊形状和有性生殖等方面。铜藻的气囊为圆柱状, 而线形马尾藻的为短椭圆形至球形。在有性生殖方面, 铜藻为雌雄异体的生殖托, 而线形马尾藻为雌雄同体但异生殖窝的生殖托(Okuda, 1977; Yoshida, 1983)。这两个种的生殖高峰也相差大约1个月(Sawada, 1955)。
2009年, Uwai等(2009)利用线粒体cox3序列对日本的Sargassum horneri/filicinum复合体进行了系统分析, 认为该复合体应合并为铜藻Sargassum horneri (广义)。但也有作者仍然使用线形马尾藻Sargassum filicinum作为合法的种名(Riosmena-Rodrríguez et al, 2012; Cho et al, 2012)。
基于上述结果, 目前广义铜藻的分类地位可总结如下:
铜藻Sargassum horneri (Turner) C. Agardh 1820
异名: Fucus horneri Turner 1808
Spongocarpus horneri (Turner) Kützing 1843
Sargassum horneri var. densum C. Agardh 1820
Sargassum filicinum Harvey 1860
Sargassum horneri f. furcatodentatum Kuntze 1880
Sargassum fengeri J. Agardh 1889
Sargassum spathulatum J. Agardh 1889
Sargassum horneri var. spathulatum (J. Agardh) Okamura 1902
2 铜藻的地理分布特征 2.1 狭义铜藻的地理分布铜藻最早在朝鲜海峡地区被报道(Turner, 1807— 1808), 之后有多位作者对分布于模式标本地区及邻近海域(韩国、日本、俄罗斯远东地区)铜藻或变种做过描述或介绍(Agardh, 1820, 1889; KüKützing, 1843; Kuntze, 1880; Okamura, 1902; Lee et al, 1992; Phillips, 1995; Tseng et al, 1985; Kloczcova, 1996; Yoshida et al, 1998, 2004; Stiger et al, 2003; Oak, 2010; Cho et al, 2012)。除了模式地区及邻近海域外, 我国沿海(Kuntze, 1880; Cotton, 1915; Setchell, 1931; Tseng, 1983; Tseng et al, 1985; Lewis et al, 1987; 刘瑞玉, 2008; 丁兰平, 2009; 丁兰平等, 2011; 王铁干, 2012; 黄冰心等, 2013, 2015; Titlyanov et al, 2012, 2014, 2015; Xie et al, 2014)和越南(Kuntze, 1880; Pham-Hoàng, 1969; Yoshida et al, 2001)有报道。
其曾一度被认为是北太平洋西部(俄罗斯远东地区、日本、朝鲜和我国)特有的暖温带性海藻(曾呈奎等, 2000)。
2.2 线形马尾藻的地理分布线形马尾藻Sargassum filicinum是Harvey(1860)以日本东部沿海样品为模式建立的, 有记录的分布地区包括日本(Yoshida et al, 1998; Stiger et al, 2003)、韩国(Lee et al, 1992; Phillips, 1995; Oak, 2010; Riosmena-Rodríguez et al, 2012; Cho et al, 2012)、菲律宾(Silva et al, 1987; Phillips, 1995)、墨西哥(太平洋) (Pedroche et al, 2008; Riosmena-Rodríguez et al, 2012)、美国加利福尼亚(Miller et al, 2007)等地区。
2.3 广义铜藻的地理分布由于狭义铜藻和线形马尾藻的合并成广义铜藻(Uwai et al, 2009), 早先报道线形马尾藻在菲律宾、墨西哥(太平洋)、美国加利福尼亚等地分布的资料仅为种名的更新(Almeida et al, 2012; Miller, 2012; Ang et al, 2014)。因此, 广义铜藻的生物地理分布区域仍为狭义铜藻和线形马尾藻分布区的叠加, 即北太平洋西部的广大地区和东部的有限地区。而在北太平洋西部则横跨冷温带、暖温带、亚热带甚至热带海区, 表现出了非常强的“海水温度性质”适应能力, 但暖温带性质占明显优势。
3 铜藻生活周期的季节变化特点铜藻是一年生植物(少数可利用残留基部进行营养繁殖), 在生长和成熟方面具有明显的季节性(Marui et al, 1981; Umezaki, 1984; Terawaki, 1986; Taniguchi et al, 1988; Yoshida et al, 1998; Yoshida et al, 2001)。有性生殖的大致过程如下:植株成熟后产生生殖托, 卵和配子释放结束之后植株迅速腐烂, 直到子一代的出现(Marui et al, 1981; Umezaki, 1984; Terawaki, 1986; Taniguchi et al, 1988; Yoshida et al, 1998, 2001)。其成熟发生在生长季之后, 此时植物长度达到一年中的最大值。
据报道, 铜藻可分为“春季成熟型”和“秋季成熟型”两个种群(Okuda, 1987; Okuda et al, 1989; Uchida et al, 1993), 受基因型调控(Yoshida et al, 2004), 与生境类型和环境条件变化相关(Yoshida et al, 2001)。“春季成熟型”更常见, “秋季成熟型”也具有该种的基本形态学特征(Okuda, 1987), 但也包含部分“春季成熟型”的特征(Uchida et al, 1993)。
“秋季成熟型”铜藻种群的周年生活史可划分为4个阶段: (1)幼年期, 12—5月份(长度增加 < 0.1mm/d); (2)青年期, 5—9月(= 0.3—1.0mm/d); (3)成年期, 9—12月份(> 10mm/d); (4)老年期, 12—3月份。成年期的藻体生长速率最大, 生殖托形成在11月份, 配子释放在11—2月份。而“春季成熟型”的生殖托形成开始于2月份, 配子释放直到4—5月份才观察到。铜藻两种成熟型的生活史差异表现在越冬时期, “秋季成熟型”以幼苗或生长缓慢的幼植株渡过冬季, 而“春季成熟型”以成熟藻体越冬(Yoshida et al, 1998)。
4 我国铜藻自然生境及分布区系 4.1 铜藻的自然生境一般情况下, 铜藻主要分布于潮下带, 在浅水区(0—2m水深)占优势(Terawaki et al, 2001)。属阴生海藻, 单株鲜重可达3kg以上, 繁茂生长在潮流通畅、风浪较为平静海湾的大干潮线以下至-4—5m浅海岩礁上, 生长密度可达200株/m; 浅海区铜藻是种群繁衍的主体, 以有性生殖为主, 残枝营养繁殖为辅, 共同维系种群繁茂(孙建璋等, 2009a)。
4.2 我国铜藻的自然分布区系根据文献报道, 我国铜藻的自然分布区从广东海丰以北至辽东半岛一线(曾呈奎等, 2000)。曾在香港、澳门地区有过报道(Setchell, 1931), 但未被证实(曾呈奎等, 2000)。近年来有学者以名录的方式报道了我国海南岛的铜藻(Titlyanov et al, 2014, 2015), 其真实性还有待考证, 也有文献证实越南的铜藻非底栖而是漂来的(Yoshida et al, 2001)。
与自然生境的浒苔潮间带中上部及漂浮养殖筏架等硬基质的生境不同, 铜藻的自然生境类型主要为潮下带岩礁或覆沙岩石底质和沉箱养殖所提供的直接或间接硬基质。因此, 在我国有记录的分布区内, 适合铜藻自然种群丰富分布的地区主要有三个: (1)广东东北至浙江东南沿海(含台湾), (2)山东半岛, (3)辽东半岛及邻近水域等地。其分布区系横跨南海南区、南海北区、东海西区和黄海西区(曾呈奎等, 1959; 黄冰心等, 2013)。
5 2016年底黄海漂浮铜藻源头分析 5.1 我国铜藻种群的可能类型划分孙建璋等(2009a)报道浙江沿海铜藻的生长和繁殖适温11—16℃, 3—4月为快速生长期, 繁殖盛期水温16—20℃, 3月份生殖托大量产生, 配子(精卵)释放高峰出现在4月底至5月中旬。这些生长发育特性与Yoshida等(1998)报道的“春季成熟型”的铜藻基本一致, 可以确认我国浙江沿海的有性生殖铜藻应该属于典型的“春季成熟型”种群。但该“春季成熟型”腐烂后的残留基部枝可营养繁殖, 其藻株占种群总数可达5%左右(孙建璋等, 2009a), 故该水域底栖铜藻周年可见, 但不同季节的生物量存在差异。
根据作者的调查, 辽东地区沿海底栖铜藻周年可见, 9—12月份可见2—5cm幼苗, 有性生殖季节在5—8月份, 12月份时也可见仅剩余具生殖托的个体。2017年7月份在辽东沿海出现大生物量的漂浮铜藻种群, 我们于8月上旬和下旬均在该地区采集到自然底栖的铜藻幼藻体(图 2), 短的仅为1cm, 长的超过10cm, 也仍能见到残留的老枝(颜色差异明显), 但较大的成年藻体仅见漂浮的。其生长的季节性明显界于“春季成熟型”和“秋季成熟型”之间, 或可考虑称为“夏季成熟型”。
 |
| 图 2 2017年夏季辽东半岛的底栖铜藻幼苗 Fig. 2 The benthic young seedlings of S. horneri at the coast of Liaodong Peninsula in the summer, 2017 |
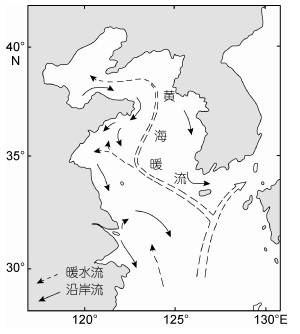
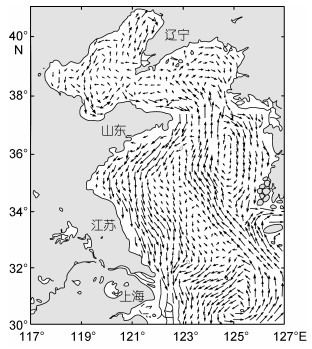
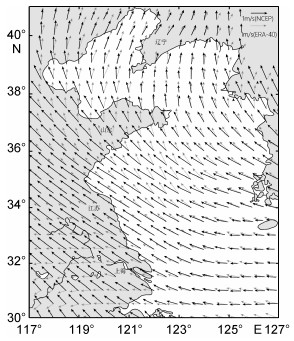
黄海海域主要受黄海暖流(系黑潮暖流的北向分支)及黄海沿岸流影响(图 3, 图 4)。沿岸流系的季节变化除受大陆径流变化的影响外, 还受季风变化的影响, 且与季风变化相一致。从11月至翌年2月, 在强烈的北向冬季季风的作用下, 由北向南的沿岸流系最强, 扩展范围最大。黄海沿岸流系自北向南主要有辽南沿岸流、辽东沿岸流、渤海沿岸流、苏北沿岸流。另外, 黄海沿岸也受冬季风的影响, 其风向为东向偏北(图 5)。
日本及太平洋海流分布情况图 6、图 7、图 8。由图可见, 除了黑潮暖流及分支外, 我国黄海沿岸未受源于日本及近海的海流影响。
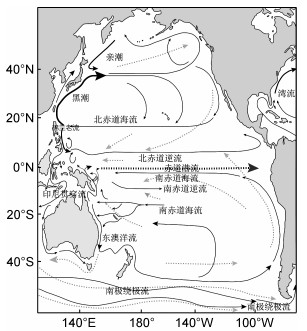 |
| 图 6 东亚及太平洋海流(Hu et al, 2015) Fig. 6 The ocean current of the East Asia and Pacific Ocean |
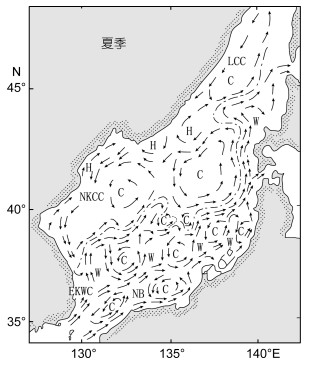 |
| 图 7 日本海夏季海流(Naganuma, 1977) Fig. 7 The ocean current located to the Sea of Japan at the Summer (Naganuma, 1977) |
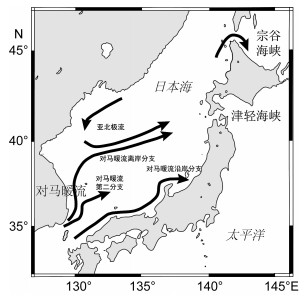 |
| 图 8 日本海的对马暖流分支(Inoue et al, 2017) Fig. 8 The branch of the Tsushima Warming Current located to the Sea of Japan (Inoue et al, 2017) |
关于黄海漂浮铜藻, 虽然在海面常见发生, 但过去人们关注较少。2015年6—7月, 在大连海域首次发现斑块状漂浮铜藻群落, 漂流海域为渤海海峡区辽东半岛一侧(图 9)。近5年来, 渤海海峡区山东半岛一侧海域连续出现大量漂浮铜藻群落(图 10)。2016年末—2017年初, 在江苏南部沿岸海域也出现大生物量的漂浮铜藻群落(图 1), 造成了江苏沿海紫菜栽培产业的巨大损失。
 |
| 图 9 2015年辽东半岛的漂浮铜藻 Fig. 9 The drifting thalli of S. horneri at the coast of the Liaodong Peninsula in 2015 |
 |
| 图 10 山东半岛的漂浮铜藻 Fig. 10 The drifting thalli of S. horneri twined to rope anchored for aquatic culture at the nearshore of the Shandong Peninsula |
江苏沿海岸主要由泥沙质滩涂湿地组成, 海水透明度低, 除其北部沿海的几个离岛外, 缺少自然底栖铜藻种群的合适生境环境, 无法形成大生物量的自然底栖种群。那么2016年底在该水域如此大生物量暴发的漂浮铜藻种群来自哪里, 是值得深入探讨的问题。
根据东亚铜藻的地理分布特点, 我们认为影响苏南漂浮铜藻暴发的可能源头有3个:渤海海峡及邻近海域、长江口以南的浙江至福建沿海、日本与韩国相邻海域。基于铜藻的生长习性、黄海沿岸秋冬季节海流、风向等内外促使漂浮暴发的主要因素, 我们对本次漂浮铜藻暴发的源头分析如下:
(1) 2016年底苏南暴发的漂浮铜藻种群, 不应源自于当地自然种群。如上所述, 苏南地区海岸底质主要为泥沙质, 无法形成大生物量的自然底栖种群或短期内底栖种群无法转变为大生物量的漂浮种群。
(2) 在长江口以南的浙江至福建沿海, 浙江离岸岛屿众多, 但浙江北部沿海受长江和钱塘江的影响, 海水透明度低, 可能仅有离岸较远的岛屿外适合自然底栖铜藻的生长繁殖, 而浙江南部及以南的沿海(包括台湾)为底栖铜藻的主要分布区, 自然底栖铜藻主要为“春季成熟型”种群, 这类似于日本南部的铜藻种群(春季成熟)(Yoshida et al, 1998)。其营养生长盛期约在12—3月份之间, 3月份台湾暖流开始影响其生殖托大量发生, 4—5月份生殖, 之后藻体腐烂, 仅5%左右的藻株残留基部枝可营养繁殖(孙建璋等, 2009a), 但该水域成年底栖种群不能完成大生物量渡夏, 我们多次在浙江南麂列岛调查也都未在夏季发现成年的底栖种群。受环境影响, 近年来更有报道浙江铜藻种群不断在衰退(孙建璋等, 2008a)且有“上岸”趋势(由潮下带较深水底向浅水区分布的趋势)(毕远新等, 2013)。多年以来, 虽然在养殖筏架等水体固着物上漂浮种群时有发生, 但在夏、秋、冬季节, 东海大陆沿岸大生物量的漂浮种群并未发现。据报道, 东海东部铜藻漂浮季节大约在3—5月份(Komatsu et al, 2008)。另外, 夏季东海由南向北的近岸海流主要受长江径流的影响, 其最北端为杭州湾附近, 而冬季的沿岸流方向为北向南; 在黄海沿岸冬季节由北向南的沿岸流及主要为东北风的影响下, 冬季暴发的铜藻种群基本上不可能由浙江及以南地区向北漂移至苏南沿海。
(3) 根据报道, 铜藻在日本和韩国都有广泛分布(Yoshida et al, 1998, 2004; Stiger et al, 2003; Oak, 2010; Cho et al, 2012)并形成漂浮种群(Segawa et al, 1959c; Cho et al, 2011)。然而, 根据冬季黑潮暖流的黄海分支、韩国海峡分支及日本太平洋分支海流(图 3, 图 4, 图 6, 图 7, 图 8)和主要为北向冬季季风初步分析, 2016年底苏南漂浮铜藻种群来源于日本的可能性极低, 但存在来自于韩国西南沿海的可能性。韩国西南岸岛屿众多, 适于铜藻的生长(Cho et al, 2012), 可能形成海底铜藻床。在正常情况下, 韩国西岸的环流区适宜漂浮种群的生长增殖, 但在受强冬季风(图 4)影响的异常年份将有可能越过黄海进入我国江苏沿海。
(4) 排除异常气候条件下, 2016年底苏南沿海大范围暴发的漂浮铜藻种群最可能的源头为渤海海峡区及其邻近水域。
通过多年的调查, 作者在渤海海峡区的山东半岛和辽东半岛发现了自然底栖铜藻种群, 特别是辽东半岛地区生物量更为丰富, 这与历史报道相吻合(曾呈奎等, 2000)。同时, 作者连续多年在辽东半岛近海岸水域发现了大量的漂浮铜藻种群(图 9, 图 11), 这为探讨黄渤海漂浮铜藻问题提供了有益的第一手资料。
 |
| 图 11 2017年辽东半岛的漂浮铜藻 Fig. 11 The drifting thalli of S. horneri twined to rope anchored for aquatic culture at the nearshore of the Liaodong Peninsula in 2017 |
从2016年底苏南暴发的漂浮铜藻藻体生长发育及大生物量暴发情况看, 其应处于“成年期”(快速生长时期), 结合发生季节, 比较符合“秋季成熟型”种群的基本特征(Yoshida et al, 1998)。有报道称马尾藻漂浮植株可漂浮存活1—5个月, 距离可达其底栖种群数百公里(Yoshida, 1963), 因此黄海北部“夏季成熟型”也有可能贡献了此次暴发的生物量。
根据冬季黄海表层沿岸流(图 3, 图 4)及风向特点, 2016年底苏南暴发的铜藻种群无疑大部分应由黄海北部漂移而来。而就目前我们由调查所获的不全数据显示, 大生物量的铜藻种群在苏南以北的分布地区主要为渤海海峡区及其邻近水域。
6 结论结合上述多地区的实际情况, 作者认为2016年底苏南沿海漂浮铜藻种群的最可能源头为渤海海峡区及其邻近水域。就目前作者的调查数据来看, 在黄海北部仅有“夏季成熟型”, 由于受冬季水环境条件限制等原因, 仍缺乏该水域秋冬季节底栖铜藻的信息, 目前无法判断是否存在“秋季成熟型”铜藻种群。但从日本濑户内海铜藻存在“春季成熟型”和“秋季成熟型”种群的报道看(Okuda, 1987; Yoshida et al, 2001, 2004), 黄海北部有着存在两个或两个以上种群的可能性。
致谢 承蒙中国科学院海洋研究所蒋富清研究员提供海流资料, 天津师范大学生命科学学院王艺晓、杨楠和陈彦伟同学绘制上墨线图, 谨致谢忱。| 丁兰平, 2009. 大型褐藻. 见: 曾呈奎. 中国黄渤海海藻. 北京: 科学出版社 |
| 丁兰平, 黄冰心, 谢艳齐, 2011. 中国大型海藻的研究现状及其存在的问题. 生物多样性, 19(6): 798–804 |
| 王铁干, 2012. 浙江洞头大型海藻. 北京: 海洋出版社, 1-85 |
| 毕远新, 章守宇, 吴祖立, 2013. 枸杞岛铜藻种群分布的季节变化. 生态学杂志, 32(5): 1255–1259 |
| 刘瑞玉, 2008. 中国海洋生物名录. 北京: 科学出版社, |
| 孙建璋, 陈万东, 庄定根, 等, 2008a. 中国南麂列岛铜藻Sargassum horneri实地生态学的初步研究. 南方水产, 4(3): 58–63 |
| 孙建璋, 庄定根, 陈万东, 等, 2008b. 铜藻Sargassum horneri繁殖生物学及种苗培育研究. 南方水产, 4(2): 6–14 |
| 孙建璋, 庄定根, 王铁干, 等, 2009a. 南麂列岛铜藻的研究. 渔业信息与战略, 24(5): 19–21 |
| 孙建璋, 庄定根, 孙庆海, 等, 2009b. 铜藻人工栽培的初步研究. 南方水产, 5(6): 41–46 |
| 孙建璋, 庄定根, 王铁干, 等, 2010. 南麂列岛铜藻增殖技术的初步研究. 现代渔业信息, 25(1): 23–27 |
| 张鹏, 王铁杆, 谢起浪, 等, 2014. 培养条件对铜藻幼苗生长发育的影响. 上海海洋大学学报, 23(2): 200–207 |
| 黄冰心, 丁兰平, 栾日孝, 等, 2015. 中国海洋褐藻门新分类系统. 广西科学, 22(2): 189–200 |
| 黄冰心, 丁兰平, 谭华强, 等, 2013. 我国沿海马尾藻属(Sargassum)的物种多样性及其区系分布特征. 海洋与湖沼, 44(1): 69–76 DOI:10.11693/hyhz201301011011 |
| 章守宇, 毕远新, 吴祖立, 2013. 枸杞岛铜藻空间分布格局初探. 水产学报, 37(6): 884–893 |
| 塔娜, 方越, 孙双文, 等, 2014. 1951-2000年间冬季黄海暖流变异的数值研究. 海洋科学进展, 32(2): 130–140 |
| 彭承基, 1986. 从卫星红外遥感图象看黄、东海冬季的海流模式. 山东海洋学院学报, 16(3): 41–45 |
| 曾呈奎, 张峻甫, 1959. 北太平洋西部海藻区系的区划问题. 海洋与湖沼, 2(4): 244–265 |
| 曾呈奎, 陆保仁, 2000. 中国海藻志第三卷第二册-褐藻门墨角藻目. 北京: 科学出版社, |
| 蔡永超, 孙彬, 马家海, 等, 2014. 我国南黄海海域漂浮铜藻的分子生物学鉴定. 海洋渔业, 36(2): 102–106 |
| Agardh C A, 1820. Species algarum rite cognitae, cum synonymis, differentiis specificis et descriptionibus succinctis. Volumen primum. Pars prima. Lundae[Lund]:ex officina Berlingiana |
| Agardh J G, 1889. Species Sargassorum Australiae descriptae et dispositae. Kgl. Svenska Vet.-Akad. Handl,: 1–133 |
| Almeida O U H, Beltrones D A S, 2012. Substrate-dependent differences between the structures of epiphytic and epilithic diatom assemblages off the southwestern coast of the Gulf of California. Botanica Marina, 55(2): 149–159 |
| Ang P O Jr, Leung S M, Choi M M, 2014. A Verification of Reports of Marine Algal Species from the Philippines. Philippine Journal of Science, 142(3): 5–49 |
| Cho S H, Myoung J G, Kim J M, et al, 2011. Fish fauna associated with drifting seaweed in the coastal area of Tongyeong, Korea. Transactions of the American Fisheries Society, 130(6): 1190–1202 |
| Cho S M, Lee S M, Ko Y D, et al, 2012. Molecular systematic reassessment of Sargassum (Fucales, Phaeophyceae) in Korea using four gene regions. Botanica Marina, 55(5): 473–484 |
| Cotton A D, 1915. Some Chinese marine algae. Kew. Bulletin of Miscellaneous Information,(3): 107–113 |
| Edgar G J, 1987. Dispersal of faunal and floral propagules associated with drifting Macrocystis pyrifera plants. Marine Biology, 95(4): 599–610 DOI:10.1007/BF00393104 |
| Harvey W H, 1860. Characters of new algae, chiefly from Japan and adjacent regions, collected by Charles Wright in the North Pacific Exploring Expedition under Captain John Rodgers. Proceedings of the American Academy of Arts and Sciences, 4: 327–334 |
| Hirata T, Tanaka J, Iwami T, et al, 2001. Ecological studies on the community of drifting seaweeds in the south-eastern coastal waters of Izu Peninsula, central Japan. I:Seasonal changes of plants in species composition, appearance, number of species and size. Phycological Research, 49(3): 215–229 |
| Hirata T, Tanaka J, Iwami T, et al, 2003. Ecological studies on the community of drifting seaweeds in the south-eastern coastal waters of Izu Peninsula, central Japan. Ⅱ:Seasonal changes in plants showing maximum stipe length in drifting seaweed communities. Phycological Research, 51(3): 186–191 |
| Hu D X, Wu L X, Cai W J, et al, 2015. Pacific western boundary currents and their roles in climate. Nature, 522(7556): 299–308 DOI:10.1038/nature14504 |
| Inoue M, Shirotani Y, Furusawa Y, et al, 2017. Migration area of the Tsushima Warm Current Branches within the Sea of Japan:Implications from transport of 228Ra. Continental Shelf Research, 143: 167–174 DOI:10.1016/j.csr.2016.08.010 |
| Kloczcova N G, 1996. Flora vodoroslei-makrofitov Tatarskogo Proliva (Yaponskoe more) iosobennosti ego formirovanija Vladivostock:Dal'nauka, 1-289 |
| Komatsu T, Matsunaga D, Mikami A, et al, 2008. Abundance of drifting seaweeds in eastern East China Sea. Journal of Applied Phycology, 20(5): 801–809 DOI:10.1007/s10811-007-9302-4 |
| Komatsu T, Tatsukawa K, Filippi J B, et al, 2007. Distribution of drifting seaweeds in eastern East China Sea. Journal of Marine Systems, 67(3-4): 245–252 DOI:10.1016/j.jmarsys.2006.05.018 |
| Kuntze O, 1880. Revision von Sargassum und das sogennante Sargasso-Meer. Botanische Jahrbücher für Systematik, Pflanzengeschichte und Pflanzengeographie, 1: 191–239 |
| Kützing F T, 1843. Ueber die Eigenthümlichkeit der Vegetation in den chinesischen und Japanischen Meeren. Botanische Zeitung, 1: 53–57 |
| Lee K, Yoo S A, 1992. Korean species of Sargassum subgenus Bactrophycus J. Agardh (Sargassaceae, Fucales). In:Abbott I A, ed. Taxonomy of Economic Seaweeds.. La Jolla, California:California Sea Grant College,: 139–147 |
| Lewis J E, Norris J N, 1987. A history and annotated account of the benthic marine algae of Taiwan. Smithsonian Contributions to Marine Sciences, 29: 1–38 |
| Markkaveeva E G, 1965. The Biocenosis of Sargasso Algae in the Red Sea. Kiev:Dumka Nauk,: 81–93 |
| Marui M, Inai S, Yoshida T, 1981. Growth and maturation of six species of Sargassum and Cystoseira (Phaeophyta, Fucales) in Oshoro Bay, Hokkaido, Japan. Japanese Journal of Phycology, 29: 277–281 |
| Miller K A, 2012. Seaweeds of California. Updates of California Seaweed Species List. Berkeley:University of California Jepson Herbarium, 1-59 |
| Miller K A, Engle J M, Uwai S, et al, 2007. First report of the Asian seaweed Sargassum filicinum Harvey (Fucales) in California, USA. Biological Invasions, 9(5): 609–613 DOI:10.1007/s10530-006-9060-2 |
| Murray J, Hjort J, 1912. The depths of the ocean:a general account of the modern science of oceanography based largely on the scientific researches of the Norwegian steamer Michael Sars in the North Atlantic. With contributions from Professor A. Appell f, Professor H. H. Gran and Dr. B. Helland-Hansen.[i]-xx, -821. London:Macmillan and Co., Limited, St Martin's Street |
| Naganuma K, 1977. The oceanographic fluctuations in the Japan Sea. Marine Sciences (Kaiy Kagaku), 9: 137–141 |
| Oak J H, 2010. Fucales. In:Algal flora of Korea. Volume 2, Number 2. Heterokontophyta:Phaeophyceae:Ishigeales, Dictyotales, Desmarestiales, Sphacelariales, Cutleriales, Ralfisales, Laminariales. (Anon. Eds),: 111–172 |
| Okamura K, 1902. Nippon Sorui-meii[Book listing Japanese Algae]. Tokyo:Keigyosha |
| Okuda T, 1977. Sargassum filicinum; its new findings in sexuality and distribution around Japan. Bulletin of the Japanese Society for Phycology, 25(S1): 265–269 |
| Okuda T, 1987. Monoecism and autumn-fruiting of S. horneri. horneri. Japanese Journal of Phycology, 37(4): 279–283 |
| Okuda T, Satoh Y, 1989. Conceptacular development in Sargassum filicinum and autumnal S. horneri (Phaeophyceae). horneri (Phaeophyceae). Japanese Journal of Phycology, 37(4): 279–283 |
| Pang S J, Liu F, Shan T F, et al, 2009. Cultivation of the brown alga Sargassum horneri:sexual reproduction and seedling production in tank culture under reduced solar irradiance in ambient temperature. Journal of Applied Phycology, 21(4): 413–422 DOI:10.1007/s10811-008-9386-5 |
| Parr A E, 1939. Quantitative observations on the pelagic Sargassum vegetation of the Western North Atlantic. Bull Bingham Oceanogr Coll, 6(7): 1–94 |
| Pedroche P F, Silva P C, Aguilar Rosas L E et al, 2008. Catálogo de las algas benthónicas del Pacífico de México Ⅱ. Phaeophycota. pp.[i-viii], i-vi, 15-146. Mexicali & Berkeley:Universidad Autónoma Metropolitana and University of California Berkeley |
| Pham-Hoàng H, 1969. Rong biên Viêtnam. Marine algae of South Vietnam.[i]-vi, 1-558. Saigon |
| Phillips N, 1995. Biogeography of Sargassum (Phaeophyta) in the Pacific basin. In:Abbott I A, Ed. Taxonomy of Economic Seaweeds. La Jolla, California:California Sea Grant College System, 5: 107–145 |
| Riosmena-Rodríguez R, Boo G H, López-Vivas J M, et al, 2012. The invasive seaweed Sargassum filicinum (Fucales, Phaeophyceae) is on the move along the Mexican Pacific coastline. Botanica Marina, 55(5): 547–551 |
| Safran P, Omori M, 1990. Some ecological observations on fishes associated with drifting seaweed off Tohoku Coast, Japan. Marine Biology, 105(3): 395–402 DOI:10.1007/BF01316310 |
| Sawada T, 1955. Some observations on Sargassum filicinum Harvey and its embryo-development. Science bulletin of the Faculty of Agriculture, Kyushu University, 15(4): 451–549 |
| Segawa S, Sawada T, Higaki M, et al, 1959a. Studies on the floating seaweeds (Ⅰ):Annual vicissitude of floating seaweeds in the Tsuyazaki region. Science Bulletin of the Faculty of Agriculture Kyushu University, 17(1): 83–89 |
| Segawa S, Sawada T, Higaki M, et al, 1959b. Studies on the floating seaweeds (Ⅱ):Floating seaweeds found in Iki-Tusima region. Science Bulletin of the Faculty of Agriculture Kyushu University, 17(3): 291–297 |
| Segawa S, Sawada T, Higaki M, et al, 1959c. Studies on the floating seaweeds-Ⅲ Some considerations on the formation of the floating seaweeds. Science Bulletin of the Faculty of Agriculture Kyushu University, 17(3): 299–305 |
| Segawa S, Sawada T, Higaki M, et al, 1961. Studies on the floating seaweeds (Ⅶ):Seasonal changes in the amount of the floating seaweeds found on Iki-and Tusima Passages. Science Bulletin of the Faculty of Agriculture Kyushu University, 19(1): 125–133 |
| Segawa S, Sawada T, Yoshida T, et al, 1964. Studies on the floating seaweeds (Ⅸ):The floating seaweeds found on the sea around Japan. Science Bulletin of the Faculty of Agriculture Kyushu University, 21(1): 111–115 |
| Setchell W A, 1931. Hong Kong seaweeds, Ⅱ. Hong Kong Naturalist, 2: 237–253 |
| Silva P C, Me ez E G, Moe R L, 1987. Catalog of the benthic marine algae of the Philippines. Smithsonian Contributions to Marine Sciences, 27 |
| Stewart H L, 2006. Ontogenetic changes in buoyancy, breaking strength, extensibility and reproductive investment in a drifting macroalga Turbinaria ornata (Phaeophyta). Journal of Phycology, 42(1): 43–50 DOI:10.1111/jpy.2006.42.issue-1 |
| Stiger V, Horiguchi T, Yoshida T, et al, 2003. Phylogenetic relationships within the genus Sargassum (Fucales, Phaeophyceae), inferred from it ITS nrDNA, with an emphasis on the taxonomic revision of the genus. Phycological Research, 51(1): 1–10 DOI:10.1111/pre.2003.51.issue-1 |
| Taniguchi K, Yamada H, 1988. Annual variation and production of the Sargassum horneri population in Matsushima Bay on the Pacific coast of Japan sea. Bulletin of Tohoku Regional Fisheries Research Laboratory, 50: 59–65 |
| Terawaki T, 1986. Growth and maturation of Sargassum horneri in Odawa Bay, Miura Peninsula, Kanagawa prefecture. Aquaculture Science, 33(4): 177–181 |
| Terawaki T, Yoshikawa K, Yoshida G, et al, 2001. . Horizontal and vertical distribution patterns of macro-algae in Hiroshima Bay, western Seto Inland Sea[Japan]. Bulletin of Fisheries & Environment of Inland Sea, |
| Titlyanov E A, Titlyanova T V, 2012. Marine plants of the Asian Pacific Region countries, their use and cultivation.-376, many col. photographs. Vladivostok:Dalnauka & A. V. Zhirmunsky Institute of Marine Biology Far East Branch of the Russian Academy of Sciences |
| Titlyanov E A, Titlyanova T V, Kalita T L, 2014. Marine algal flora of Hainan Island:a comprehensive synthesis. Coastal Ecosystems, 1(1): 28–53 |
| Titlyanov E A, Titlyanova T V, Li X B, et al, 2015. Recent (2008-2012) seaweed flora of Hainan Island, South China Sea. Marine Biology Research, 11(5): 540–550 DOI:10.1080/17451000.2014.955803 |
| Tseng C K, 1983. Common Seaweeds of China. Beijing: Science Press, |
| Tseng C K, Yoshida T, Chiang Y M, 1985. East Asiatic species of Sargassum subgenus Bactrophycus J. Agardh (Sargassaceae, Fucales), with keys to the section and species. In:Abbott I A, Norris J N, eds. Taxonomy of Economic Seaweeds with reference to some Pacific and Caribbean species. California Sea Grant Program,: 1–14 |
| Turner D, 1807-1808. Fuci, sive, plantarum fucorum generi a botanicis ascriptarum icones descriptiones et historia=Fuci, or, colored figures and descriptions of the plants referred by botanists to the genus Fucus. Londini[London]:Typis J. M'Creery, Impensis J. et A. Arch |
| Uchida T, Arima S, 1993. Crossing experiments between autumn and spring fruiting types of Sargassum horneri (Phaeophyta). Nippon Suisan Gakkaishi, 59(10): 1685–1688 DOI:10.2331/suisan.59.1685 |
| Umezaki I, 1984. Ecological studies of Sargassum horneri (Turner) C. Agardh in Obama Bay, Japan Sea. Nippon Suisan Gakkaishi, 50(7): 1193–1200 DOI:10.2331/suisan.50.1193 |
| Uwai S, Kogame K, Yoshida G, et al, 2009. Geographical genetic structure and phylogeography of the Sargassum horneri/filicinum complex in Japan, based on the mitochondrial cox3 haplotype. Marine Biology, 156(5): 901–911 DOI:10.1007/s00227-009-1136-y |
| Xie X J, Wang G C, Pan G H, et al, 2014. Development of oogonia of Sargassum horneri (Fucales, Heterokontophyta) and concomitant variations in PSⅡ photosynthetic activities. Phycologia, 53(1): 10–14 DOI:10.2216/13-161.1 |
| Yoshida G, Arima S, Terawaki T, 1998. Growth and maturation of the 'autumn-fruiting type' of Sargassum horneri, (Fucales, Phaeophyta) and comparisons with the 'spring-fruiting type'. Phycological Research, 46(3): 183–189 DOI:10.1111/pre.1998.46.issue-3 |
| Yoshida G, Murase N, Arai S, et al, 2004. Ecotypic differentiation in maturation seasonality among Sargassum horneri (Fucales, Phaeophyta) populations in Hiroshima Bay, Seto Inland Sea, Japan. Phycologia, 43(6): 703–710 DOI:10.2216/i0031-8884-43-6-703.1 |
| Yoshida G, Yoshikawa K, Terawaki T, 2001. Growth and maturation of two populations of Sargassum horneri (Fucales, Phaeophyta) in Hiroshima Bay, the Seto Inland Sea. Fisheries Science, 67(6): 1023–1029 DOI:10.1046/j.1444-2906.2001.00357.x |
| Yoshida T, 1963. Studies on the distribution and drift of the floating seaweeds. Bull Tohoku Reg Fish Res Lab, 23: 141–186 |
| Yoshida T, 1983. Japanese species of Sargassum subgenus Bactrophycus (Phaeophyta, Fucales). Journal of the Faculty of Science, Hokkaido University, Series V (Botany), 13: 99–246 |
 2018, Vol. 49
2018, Vol. 49