中国海洋湖沼学会主办。
文章信息
- 江玉立, 黄志涛, 宋协法, 陈钊. 2018.
- JIANG Yu-Li, HUANG Zhi-Tao, SONG Xie-Fa, CHEN Zhao. 2018.
- 好氧反硝化反应器中微生物群落的碳代谢特征
- CARBON METABOLISM OF MICROBIAL COMMUNITIES IN AEROBIC DENITRIFICATION REACTOR
- 海洋与湖沼, 49(2): 331-339
- Oceanologia et Limnologia Sinica, 49(2): 331-339.
- http://dx.doi.org/10.11693/hyhz20170600163
-
文章历史
- 收稿日期:2017-06-20
- 收修改稿日期:2017-11-30
近年来, 水产养殖污水排放带来的问题引起了社会的广泛关注。封闭式循环水养殖, 因具有资源节约、高产高效、环境友好等诸多优点(刘长发等, 2002; 刘晃等, 2008), 已成为当今水产养殖业的发展趋势之一(倪琦等, 2010; 宋奔奔等, 2012)。循环水养殖系统利用微生物硝化作用将水中的氨氮去除, 并转化成硝酸盐(NO3--N), 虽然可以有效控制氨氮, 但NO3--N处于持续积累状态。有研究报道, 循环水系统中NO3--N浓度可达400—500mg/L (赖才胜等, 2012)。与氨氮和亚硝酸盐相比, NO3--N-N对养殖对象的毒性相对较低, 但是大量研究表明, 高浓度NO3--N会对养殖对象造成生长速度降低、易患病、成活率降低等不利影响, 即使中等浓度的NO3--N(30—60mg/L)也会对养殖生物造成不利影响, 引起养殖对象体质变弱, 甚至死亡(Good et al, 2017), 因此控制养殖水环境中NO3--N的浓度有其必要性。反硝化是控制NO3--N浓度的有效途径之一, 可以实现养殖水体中氮元素向大气的转移, 从整体上控制水环境中的氮元素水平。传统的反硝化是厌氧过程, 限制了其在循环水养殖系统中的应用。随着近年来好氧反硝化细菌方面的研究(刘晶晶等, 2008; 李慧颖等, 2009)日渐深入, 好氧反硝化生物滤池在循环水养殖中的应用成为可能。
生物滤池内微生物群落结构复杂, 微生物群落功能多样性反映了生物滤池内微生物的群落状态与功能, 对于养殖水体的净化和养殖环境的调节具有决定作用(张志明等, 2012), 也决定了生物滤池的水处理能力。研究生物滤池群落的代谢特征对于了解生物滤池群落结构、探究代谢特征与水处理效果间的关系具有重要意义。此前研究微生物群落和代谢特性的报道多针对市政污水、养殖废水和地下水, 对于循环水养殖尤其是反硝化系统微生物群落和功能的研究鲜有报道。Biolog-ECO微平板技术通过测定微生物对单一碳源的利用程度来反映微生物的代谢特征, 进而反映微生物群落的多样性(吴则焰等, 2013; Grove et al, 2004; Garland et al, 2001), 是研究微生物代谢功能多样性的有效方法之一, 已被广泛应用于鉴定和分析土壤、水体、生物反应器中的微生物群落结构(Borsodi et al, 2003; Graham et al, 2005)。
本研究利用Biolog-ECO微生物自动鉴定技术, 研究好氧反硝化反应器微生物群落的碳源代谢特性和群落代谢功能多样性, 对好氧反硝化反应器不同水力停留时间(hydraulic retention time, HRT)和不同进水NO3--N浓度下滤料表面微生物群落特征进行分析, 以期为好氧反硝化生物反应器在循环水养殖中的应用, 以及提高生物滤池水处理效率提供理论基础。
1 材料与方法 1.1 好氧反硝化系统装置试验反应器装置如图 1所示。反应器有效容积为2.2L的黑色不透明PVC塑料圆桶, 内装有直径1cm、高1cm内十字圆筒结构的K1滤料, 填充率约40%。滤料密度约为0.96g/cm3, 比表面积850m2/m3。进水由蠕动泵驱动从反应器底部持续泵入反硝化反应器。试验用水为青岛近海岸海水配置的模拟养殖污水, 乙酸钠为碳源, 硝酸钾为氮源, C/N摩尔比为6, 反应器持续供氧, 溶解氧保持在6.0mg/L以上, 温度用加热棒调节在(25±1)℃。蠕动泵启动前人工接种一株好氧反硝化细菌Halomonas venusta促进挂膜。系统的流速三个梯度, 分别是4.91mL/min (HRT=7h)、6.06mL/min (HRT=6h)和7.31mL/min (HRT=5h); 进水NO3--N的浓度设三个梯度, 分别是50、100、150mg/L。5-50表示HRT为5h, 进水NO3--N浓度为50mg/L, 以此类推。每隔1日进行水质测定, 直至硝酸盐出水浓度平均差值差异在10%以内, 视为系统稳定。待系统稳定后从各反应器取生物滤料, 进行微生物代谢特征的检测。
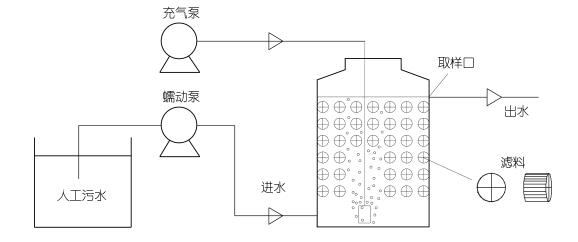 |
| 图 1 试验装置示意图 Fig. 1 Diagram of the experiment setup |
在运行稳定的好氧反硝化反应器中分别取2—3g滤料, 将取出的滤料置于50mL无菌生理盐水中(0.9%的NaCl溶液), 对混合的溶液进行超声波震荡, 使滤料表面的微生物分散到生理盐水中, 形成均匀的微生物悬液, 用无菌生理盐水将微生物悬液稀释至紫外分光光度计600nm下吸光值为0.05, 整个操作过程都在无菌条件下进行。取稀释后的微生物悬液以每孔150μL的量加入到经25℃预热的Biolog-ECO微板中, 加盖并置于25℃恒温培养箱中培养10d, 培养期间每12h用酶标仪测定96个孔在590nm波长下的吸光度, 每个样品3个重复。
1.3 微生物群落多样性计算利用平均颜色变化率(average well color development, AWCD)来评判微生物群落的碳源利用能力, 指示微生物群落的代谢活性。其计算公式为
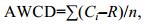 (1)
(1)式中, Ci为所测定的31个碳源孔的吸光值; R为对照孔的吸光值; n为培养基碳源的种类数, ECO板中n为31。
光密度标准化值(RSi)是用来评估微生物对特定碳源的代谢程度。
 (2)
(2)Shannon-Wiener指数(H')能够灵敏反映物种丰富度信息, 其计算公式为
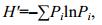 (3)
(3)式中, Pi表示第i个非对照孔中的吸光值与所有非对照孔吸光值之和的比值。即: Pi = (Ci-R)/Σ(Ci-R)。
Simpson指数(D)又称优势度指数, 是多样性方面的集中性度量指数, 其计算公式为
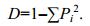 (4)
(4)Pielou指数(Jsw)是群落实测多样性与最大多样性的比率。其计算公式为
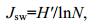 (5)
(5)式中, N为被利用碳源总数目。
McIntosh指数(U)是基于群落物种多维空间上的Euclidian距离的多样性指数, 是反映微生物群落均一性的度量。其计算公式为
 (6)
(6)式中, ni是第i孔的相对吸光值(Ci–R)。
丰富度指数(S)是指被利用碳源的总数目, 为每孔中(Ci-R)的值大于0.25的孔个数。
1.4 数据统计分析采用单因素方差分析(One-way ANOVA)法判断反应器微生物AWCD之间的差异, 用主成分分析(Principal Component Analysis, PCA)法来分析微生物利用碳源的差异, 统计分析通过Excel 2010和SPSS19.0统计软件实现, 差异显著水平为P < 0.05。
2 结果与分析 2.1 好氧反硝化反应器试验期间的水质状况各好氧反硝化反应器在稳定运行后的水质状况见表 1。从表 1可以看出, 在HRT为5h, 进水NO3--N浓度为50、100、150mg/L时, NO3--N的去除率分别为为95.51%、73.74%、60.12%;相同的进水NO3--N浓度下, 硝酸盐去除能力是HRT 7h > 6h > 5h, 说明水力停留时间越长, NO3--N去除能力越强。郭明新等人(1996)的研究表明, 在一定范围内, 随着水力停留时间的延长, 总氮、氨氮的去除效果呈指数提高, 其研究与本研究结果相符。水力停留时间过短时, 水力负荷较高, 污水中的硝酸盐等物质还没来得及降解或者吸附就被冲出系统; 而水力停留时间较长, 污水中的硝酸盐等物质基本被降解。
| 取样点* | T (℃) | pH | 水质指标(mg/L) | 硝酸盐去除率(%) | |||
| DO | NO2–-N | NH4+-N | NO3–-N | ||||
| 5-50 | 20.1 | 8.6 | 6.90 | 1.41 | 0.45 | 2.18 | 95.51 |
| 5-100 | 20.4 | 8.6 | 6.37 | 12.40 | 1.40 | 12.75 | 73.74 |
| 5-150 | 20.3 | 8.6 | 6.97 | 16.28 | 0.68 | 19.35 | 60.12 |
| 6-50 | 20.9 | 8.7 | 6.06 | 1.90 | 0.91 | 1.90 | 98.71 |
| 6-100 | 20.4 | 8.8 | 5.71 | 2.04 | 2.05 | 2.03 | 98.62 |
| 6-150 | 20.7 | 8.7 | 5.09 | 1.91 | 0.54 | 3.38 | 97.70 |
| 7-50 | 20.5 | 8.6 | 6.38 | 1.40 | 0.58 | 1.31 | 98.61 |
| 7-100 | 20.2 | 8.7 | 6.17 | 1.76 | 2.14 | 2.24 | 97.63 |
| 7-150 | 20.3 | 8.7 | 5.47 | 4.42 | 1.56 | 10.47 | 98.90 |
| *本栏中5-50表示HRT为5h, 进水NO3--N浓度为50mg/L, 以此类推。 | |||||||
AWCD值的变化速率以及最终能够到达的值反映了微生物对某种碳源的利用能力, 在一定程度上反映了滤料微生物种群的数量和结构特征(田雅楠等, 2011; 杜毅飞等, 2015)。不同HRT条件和不同进水NO3--N浓度下的滤料微生物AWCD变化曲线如图 2所示。从图中可以看出, AWCD值随着培养时间的延长而升高, 说明不同HRT条件和不同进水NO3--N浓度下微生物的生物活性和碳源利用能力均随培养时间延长而提高。在24h以内, 不同HRT和NO3--N浓度的AWCD差异很小, 说明碳源利用率低, 微生物仍处于适应阶段; 24h以后, AWCD值开始迅速升高, 说明碳源开始被大幅利用, 微生物生长进入指数期; 96h后, 微生物AWCD增长趋势渐缓, 进入微生物生长稳定期, 试验时间内无明显衰亡。从图 2整体来看, 在同一进水NO3--N浓度下, 不同HRT反应器内微生物AWCD值由高到低为7h > 6h > 5h, 说明在进水NO3--N浓度一致的情况下, 水力停留时间对微生物代谢活性有一定影响。在同一HRT下, 不同进水NO3--N浓度反应器内微生物AWCD值由高到低为50mg/L > 150mg/L > 100mg/L (P<0.05), 说明进水NO3--N浓度对微生物代谢活性有一定的影响, 当进水NO3--N浓度为50mg/L时, 其对不同碳源的利用能力最强, 微生物群落对碳源的代谢能力也最强。当HRT为5h, 进水NO3--N浓度为50和100mg/L的AWCD值基本一致。
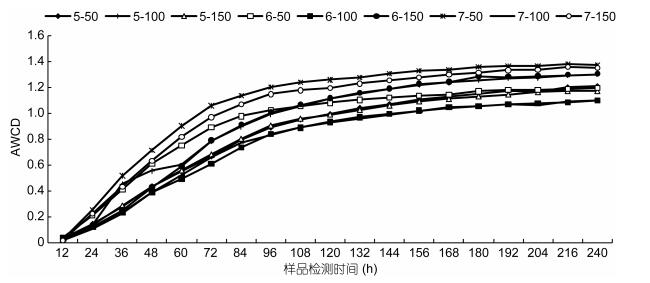 |
| 图 2 不同水力停留时间和进水NO3--N浓度下微生物群落AWCD值随培养时间的变化 Fig. 2 AWCD of microbial communities cultured in different hydraulic retention time and influent NO3--N concentration 注: AWCD: Average Well Color Development, 平均吸光度 |
Biolog的ECO测试板含有31种碳源, 按照化学基团的性质, 将其分为6类:多聚物类4种, 糖类10种, 羧酸类7种, 氨基酸类6种, 胺类2种, 酚类2种(Haack et al, 1995)。不同水力停留时间和不同进水硝酸盐浓度的6大碳源平均吸光值随培养时间的变化见图 3。从图中可以看出, 微生物对不同类型碳源的利用在24—96h很快, 96h后趋于平缓, 说明微生物对碳源的利用主要发生在24—96h。从总体代谢来看, 好氧反硝化反应器中微生物在不同进水浓度和不同水力停留时间对6类碳源的利用由强到弱的顺序为:多聚物 > 氨基类 > 碳水化合物 > 羧酸类 > 胺类 > 酚酸类。7-50 (HRT=7h, NO3--N=50mg/L)对多聚物的利用最好, 对酚酸类的利用最差。不同的HRT和进水NO3--N浓度对羧酸类、碳水化合物、酚酸类的利用率没有显著差别(P > 0.05), 对氨基酸类的利用差异显著(P < 0.05)。总体而言, 微生物对多聚物和氨基酸类有代谢偏好。
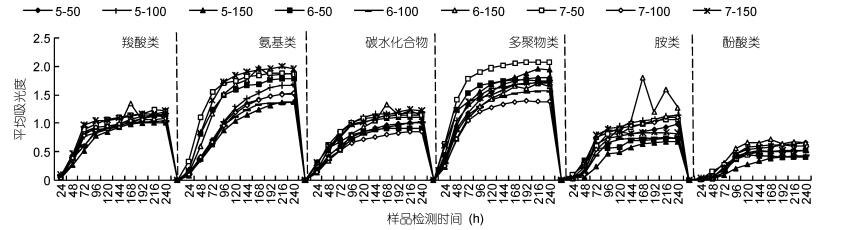 |
| 图 3 不同的水力停留时间和进水硝酸盐浓度下微生物对6类碳源的利用特征 Fig. 3 Metabolic response of micro-organisms for six carbon sourcesin different hydraulic retention time and influent NO3--N concentration |
根据贾夏等人(2013)的研究结果, 选取AWCD曲线达到稳定后(96h)的光密度值计算Shannon-Wiener指数、Simpson指数、Pielou指数、McIntosh指数和丰富度指数, 结果见表 2。从表 2可以看出, 不同的水力停留时间和进水硝酸盐浓度多样性指数除丰富度指数没有显著差异外, Shannon-Wiener指数、Simpson指数、Pielou指数、McIntosh指数相互之间均差异显著(P < 0.05), 其中7-150处理组(HRT=7h, NO3--N=150mg/L)微生物的Shannon-Wiener指数、Simpson指数、Pielou指数最高。同一水力停留时间下, 不同进水硝酸盐浓度反应器的Shannon-Wiener指数、Simpson指数、Pielou指数均表现为150mg/L > 50mg/L > 100mg/L。6-100 (HRT=6h, NO3--N= 100mg/L)和6-150 (HRT=6h, NO3--N=150mg/L)处理组在Shannon-Wiener指数、Simpson指数和Pielou指数的差异不显著, 说明在水力停留时间为6h时, 进水硝酸盐浓度对微生物群落功能多样性无显著影响。
| 取样点 | Shannon-Wiener指数 | Simpson指数 | Pielou指数 | McIntosh指数 | 丰富度指数 |
| 5-50 | 3.173±0.017ab | 0.953±0.002b | 0.924±0.005 ab | 5.957±0.224 c | 23.333±0.577a |
| 5-100 | 3.173±0.029ab | 0.954±0.001 ab | 0.924±0.008 ab | 6.237±0.346 bc | 24.333±2.082 a |
| 5-150 | 3.132±0.031 b | 0.951±0.002 b | 0.912±0.009 b | 6.485±0.232 c | 24.333±0.577a |
| 6-50 | 3.108±0.018 b | 0.950±0.001 b | 0.905±0.005 b | 7.107±0.467 b | 25.333±1.528 a |
| 6-100 | 3.168±0.031 ab | 0.953±0.001 b | 0.923±0.009 ab | 5.663±0.266 c | 22.333±1.528 b |
| 6-150 | 3.182±0.020 ab | 0.954±0.001 b | 0.927±0.006 ab | 6.671±0.245 bc | 26.333±1.528 a |
| 7-50 | 3.162±0.036 b | 0.953±0.002 b | 0.921±0.010 b | 8.068±0.092 a | 23.333±1.155 a |
| 7-100 | 3.118±0.037 b | 0.950±0.002 b | 0.908±0.011 b | 5.787±0.245 c | 24.000±1.000 a |
| 7-150 | 3.245±0.009 a | 0.958±0.001 a | 0.945±0.003 a | 7.332±0.140 ab | 24.333±1.155 a |
| 注:同列数据后不同小写字母表示差异显著(P < 0.05)。 | |||||
为研究不同水力停留时间和不同进水硝酸盐浓度下微生物群落对碳源利用的特点, 选取96h碳源的光密度(Optical Density, OD)值进行主成分分析, 得到大于1的主成分有7个, 前两个主成分贡献率达到50.68%, 提取前两个主成分PC1(30.81%)和PC2(19.87%)作图(图 4), 发现PC1分异的主要碳源有15种, 其中多聚物有3种, 氨基酸类有3种, 碳水化合物有5种, 羧酸类和胺类各有一种, 酚酸类有两种, PC2被利用的碳源有11种, 其中多聚物有1种, 氨基酸类有2种, 碳水化合物有3种, 羧酸类有5种。表 4列出了31种碳源与PC1和PC2之间的相关系数(相关系数绝对值R > 0.5)。根据李志斐等人(2014)的研究结果可知, 相关系数越高意味着样品之间碳源的利用率差异性越高。从表 3可以看出, 造成不同处理组微生物多样性差异的碳源(按贡献大小)为肝糖 > D-苹果酸 > D-甘露醇 > N-乙酰-D-葡萄糖氨 > 吐温80。微生物代谢基质PC1相关系数0.55以上的基质有15种, PC2相关系数0.55以上的基质只有11种, 说明反应器微生物群落结构的差异主要体现在PC1的相关系数较高的基质上。对于PC1而言, 微生物代谢活性的差异大部分集中在碳水化合物类, 而在PC2上的差异大部分是在羧酸类体现出来的。
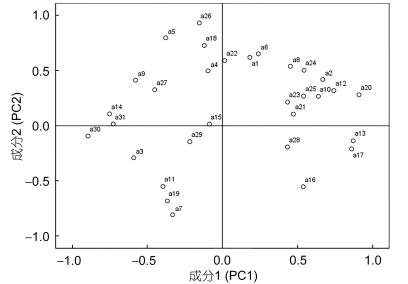 |
| 图 4 不同碳源与前两个主成分的相关系数矩阵(96h) Fig. 4 Correlation coefficients matrix of different carbon sources with the first two principal components (96h) 注: a1: β-甲基-D-葡萄糖苷; a2: D-半乳糖酸-γ-内脂; a3: L-精氨酸; a4:丙酮酸甲酯; a5: D-木糖; a6: D-半乳糖醛酸; a7: L-天门冬酰胺; a8:吐温40; a9: i-赤藓糖醇; a10: 2-羟基苯甲酸; a11: L-苯基丙氨酸; a12:吐温80; a13: D-甘露醇; a14: 4-羟基苯甲酸; a15: L-丝氨酸; a16: α-环式糊精; a17: N-乙酰-D-葡萄糖氨; a18: γ-羟丁酸; a19: L-苏氨酸; a20:肝糖; a21: D-葡糖胺酸; a22:衣康酸; a23:甘氨酰-L-谷氨酸; a24: D-纤维二糖; a25: α-D-葡萄糖-1-磷酸; a26: α-丁酮酸; a27:苯乙胺; a28: α-D-乳糖; a29: D, L-α-磷酸甘油; a30: D-苹果酸; a31:腐胺。 |
| 碳源类型 | R | |
| PC1 | PC2 | |
| 多聚物类 | ||
| 吐温40 | 0.557 | |
| 吐温80 | 0.793 | |
| α-环式糊精 | –0.655 | |
| 肝糖 | 0.948 | |
| 氨基酸类 | ||
| L-精氨酸 | –0.639 | |
| L-苯丙氨酸 | –0.504 | |
| L-天门冬酰 | –0.718 | |
| L-丝氨酸 | ||
| L-苏氨酸 | –0.503 | –0.589 |
| 甘氨酰-L-谷氨酸 | ||
| 碳水化合物类 | ||
| β-甲基-D-葡萄糖苷 | 0.568 | |
| D-半乳糖酸-γ-内脂 | 0.742 | |
| i-赤藓糖醇 | 0.527 | |
| D-甘露醇 | 0.822 | |
| D-纤维二糖 | 0.638 | |
| N-乙酰-D-葡萄糖氨 | 0.796 | |
| α-D-葡萄糖-1-磷酸 | 0.585 | |
| α-D-乳糖 | ||
| D, L-α-磷酸甘油 | ||
| D-木糖 | 0.86 | |
| 羧酸类 | ||
| 衣康酸 | 0.575 | |
| 丙酮酸甲酯 | 0.507 | |
| D-半乳糖醛酸 | 0.587 | |
| γ-羟丁酸 | 0.737 | |
| α-丁酮酸 | 0.944 | |
| D-葡糖胺酸 | ||
| D-苹果酸 | –0.894 | |
| 胺类 | ||
| 苯乙胺 | ||
| 腐胺 | –0.708 | |
| 酚酸类 | ||
| 2-羟基苯甲酸 | 0.681 | |
| 4-羟基苯甲酸 | –0.711 | |
将好氧反硝化反应器内微生物的Biolog ECO板培养96h得到的数据进行水平聚类分析(图 5)。树形聚类分析图谱能够直接显示出不同的水力停留时间和进水硝酸盐浓度下微生物对碳源的利用率(Salomo et al, 2009)。聚类距离越远, 相似性越低(Hadwin et al, 2005)。由图 5可以看出, 当聚合水平≤15时, 整个聚类图谱可以分为4类, 第一类为7-100、6-100、5-50, 第二类为5-150, 第三类为7-150和6-150, 第四类为7-50和6-50。7-100和6-100在较短的距离尺度相聚, 而与其他处理组在较大距离尺度相聚, 说明在这两种水力停留时间和进水NO3--N浓度的反应器内微生物群系相似性更高。
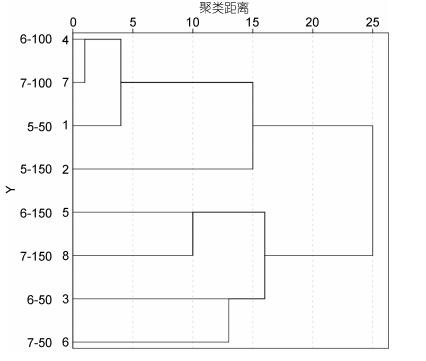 |
| 图 5 不同水力停留时间和进水硝酸盐浓度下微生物群落代谢指纹聚类分析图谱 Fig. 5 Cluster analysis for microbial communities in different hydraulic retention time and different influent NO3--N concentration |
AWCD值反映了微生物群落对不同碳源代谢的总体情况, 其变化速率反映了微生物群落的代谢活性(邓欢欢等, 2007; Haslun et al, 2012)。AWCD值越大, 表明微生物密度越大、活性越高(邓欢欢等, 2007; Xu et al, 2012)。它提供了探究不同微生物群落对同种碳源利用能力差异的可能性(Schveitzer et al, 2013)。在好氧反硝化反应器中, 微生物对碳源的代谢活性(AWCD)在HRT 7h、进水NO3--N浓度50mg/L时最强, HRT 6h、进水NO3--N浓度100mg/L时最弱; 系统运行的水力停留时间越长, 微生物的代谢活动越强, 对碳源的利用率越充分。从整体来看, 尽管微生物的碳源代谢活性在不同水力停留时间的强弱顺序为7h > 6h > 5h, 但变化趋势类似, 这表明生物滤池中微生物群落相似性高, AWCD值的差异反映了两者间微生物数量上的不同(周庆伍等, 2014), 适当延长水力停留时间有利于好氧反硝化反应器的脱氮过程。朱文君等(2013)的研究表明, 在较高的HRT条件下, 会使得有机物负荷和水力以及气流剪切力增加, 使得好氧反硝化菌生长迅速, 生物膜的更新速度加快, 反应器的总微生物量增多。该结论与本研究中较高的水力停留时间下, 微生物对碳源的利用率较高, 微生物的代谢活性高的结论一致。
宋景华等(2014)在循环水养殖池塘微生物群落代谢特性的研究中发现, 池塘微生物群落对6类碳源中的碳水化合物类和羧酸类利用率较高, 对酚类的利用率最差。席劲瑛等(2005)通过研究木屑过滤塔和活性炭过滤塔发现, 过滤塔中的微生物群落更容易利用羧酸类和氨基酸类碳源。朱云昊等(2017)通过研究循环水鳗鲡养殖系统不同生物降解工艺碳源利用发现, 不同工艺下的滤料微生物对多聚物和酚酸类有代谢偏好。但本研究发现在不同的水力停留时间和进水硝酸盐浓度下, 微生物对氨基酸类和多聚物类利用率较高, 对酚酸类的利用最差。随着水力停留时间的加长, 微生物对氨基酸类、碳水化合物类以及多聚物类的代谢也加强。在水环境中, 反硝化作用作为生物脱氮的重要途径, 反硝化的发生是以碳源为电子受体的, 从某种程度上可以说碳源是生物脱氮速率的限制因子(王丽丽等, 2004; Aslan et al, 2005)。本次试验研究了不同的水力停留时间和进水硝酸盐浓度下微生物群落对6类碳源的利用率, 这有助于了解好氧反硝化反应器菌落对营养的需求, 并为微生物定向强化提供可靠依据。
通过对好氧反硝化反应器微生物群落典型代谢类型的分析可以发现, 微生物对碳源的利用主要分为以下三种情况(图 6):一、能够较快地利用碳源, 并且在开始培养时迅速发生显色反应, 达到平衡后对碳源的利用率略微下降, 如N-乙酰-D-葡萄糖氨; 二、对碳源的适用性较第一种弱, 需要较长的时间来适应, 达到平衡的时间也较长, 但达到平衡后对碳源的利用能力超过第一种, 如L-丝氨酸; 三、微生物不能或基本不能利用该碳源, 如2-羟基苯甲酸。李志斐等(2016)发现在草鱼养殖池养生物膜固着的微生物能够很好地利用2-羟基苯甲酸, 但本研究中, 在不同的水力停留时间和进水浓度下均不能利用该碳源, 说明此好氧反硝化反应器中不存在利用该碳源的微生物。在好氧反硝化反应器中, 需要足够的碳源提供电子流以供菌体生长, 碳源不足会限制反硝化效率(王弘宇等, 2007)。Otanni等(2004)的研究发现某些特定的碳源能够促进细菌高效脱氮, 碳源的差异会影响生物膜上反硝化细菌的生长(Salomo et al, 2009), 因此碳源的选择对生物滤池脱氮效果具有重要影响。在好氧反硝化反应器的应用过程中, 可通过Biolog-ECO技术对好氧反硝化反应器中滤料表面微生物群落特征进行分析, 确定微生物群落对不同碳源的利用率, 以便更有针对性地添加碳源, 促进反硝化反应器的脱氮过程。
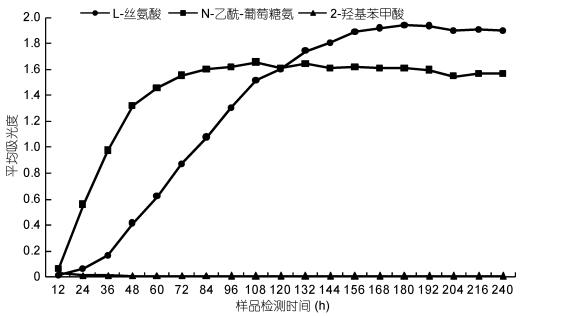 |
| 图 6 微生物的典型代谢类型 Fig. 6 Different types of microbial metabolism on different carbon substrates |
好氧反硝化反应器在同一个进水硝酸盐浓度下, 水力停留时间越长, 微生物的代谢活性越强(P < 0.05)。进水硝酸盐浓度和水力停留时间是影响反应器菌落多样性的重要因素, 其中HRT为7h、NO3--N为150mg/L处理组微生物多样性指数最高。反应器内微生物对不同碳源的代谢利用由强到弱的顺序是:多聚物 > 氨基类 > 碳水化合物 > 羧酸类 > 胺类 > 酚酸类, 对多聚物和氨基类有代谢偏好。碳源是影响反应器菌落代谢特点的重要因素, 其中羧酸类和碳水化合物的作用尤为显著。本研究为好氧反硝化过程中碳源的选择提供了新的思路, 为通过添加碳源提高生物滤池脱氮效率提供了理论基础。
| 王弘宇, 马放, 苏俊峰, 等, 2007. 不同碳源和碳氮比对一株好氧反硝化细菌脱氮性能的影响. 环境科学学报, 27(6): 968–972 |
| 王丽丽, 赵林, 谭欣, 等, 2004. 不同碳源及其碳氮比对反硝化过程的影响. 环境保护科学, 30(1): 15–18 |
| 邓欢欢, 杨长明, 李建华, 等, 2007. 人工湿地基质微生物群落的碳源代谢特性. 中国环境科学, 27(5): 698–702 |
| 田雅楠, 王红旗, 2011. Biolog法在环境微生物功能多样性研究中的应用. 环境科学与技术, 34(3): 50–57 |
| 刘晃, 倪琦, 顾川川, 2008. 海水对虾工厂化循环水养殖系统模式分析. 渔业现代化, 35(1): 15–19 |
| 刘长发, 綦志仁, 何洁, 等, 2002. 环境友好的水产养殖业-零污水排放循环水产养殖系统. 大连水产学院学报, 17(3): 220–226 |
| 刘晶晶, 汪苹, 王欢, 2008. 一株异养硝化-好氧反硝化菌的脱氮性能研究. 环境科学研究, 21(3): 121–125 |
| 朱云昊, 谭洪新, 孙大川, 等, 2017. Biolog-ECO解析循环水鳗鲡养殖系统中不同生物降解工艺下的滤料微生物群落功能多样性特征. 上海海洋大学学报, 26(1): 64–74 DOI:10.12024/jsou.20160401729 |
| 朱文君, 杨扬, 乔永民, 等, 2013. 水力停留时间对自然曝气生物滤床净化效能的影响. 生态科学, 32(2): 224–229 |
| 吴则焰, 林文雄, 陈志芳, 等, 2013. 武夷山国家自然保护区不同植被类型土壤微生物群落特征. 应用生态学报, 24(8): 2301–2309 |
| 宋奔奔, 吴凡, 倪琦, 2012. 国外封闭循环水养殖系统工艺流程设计现状与展望. 渔业现代化, 39(3): 13–18 |
| 宋景华, 李谷, 张世羊, 等, 2013. 循环水养殖池塘微生物群落的碳源代谢特性和功能多样性. 江苏农业科学, 41(9): 305–309 |
| 张志明, 许艳丽, 韩晓增, 等, 2012. 连续施肥对农田黑土微生物功能多样性的影响. 生态学杂志, 31(3): 647–651 |
| 李志斐, 王广军, 谢骏, 等, 2016. 草鱼养殖池塘生物膜固着微生物群落碳代谢Biolog分析. 水产学报, 38(12): 1985–1995 |
| 李志斐, 谢骏, 郁二蒙, 等, 2014. 基于Biolog-ECO技术分析杂交鳢和大口黑鲈高产池塘水体微生物碳代谢特征. 农业环境科学学报, 33(1): 185–192 DOI:10.11654/jaes.2014.01.024 |
| 李慧颖, 黄少斌, 范利荣, 2009. 一株好氧反硝化菌的反硝化性能研究. 环境科学与技术, 32(8): 9–12 |
| 杜毅飞, 方凯凯, 王志康, 等, 2015. 生草果园土壤微生物群落的碳源利用特征. 环境科学, 36(11): 4260–4267 |
| 周庆伍, 李红歌, 李安军, 等, 2014. Biolog ECO解析不同产地大曲微生物群落功能多样性特征. 食品与发酵科技, 50(3): 53–56 |
| 倪琦, 雷霁霖, 张和森, 2010. 我国鲆鲽类循环水养殖系统的研制和运行现状. 渔业现代化, 37(4): 1–9 |
| 席劲瑛, 胡洪营, 姜健, 等, 2005. 生物过滤塔中微生物群落的代谢特性. 环境科学, 26(4): 165–170 |
| 贾夏, 董岁明, 周春娟, 2013. 微生物生态研究中Biolog Eco微平板培养时间对分析结果的影响. 应用基础与工程科学学报, 21(1): 10–19 |
| 郭明新, 李万庆, 1996. 天津市城市污水自由水面构筑物湿地处理系统中污水氮去除规律的研究. 环境化学, 15(6): 516–522 |
| 赖才胜, 王智勇, 许嘉翔, 等, 2012. 循环水养殖系统生物反应器脱氮技术. 黑龙江水产,(3): 3–5 |
| Aslan S, Türkman A, 2005. Combined biological removal of nitrate and pesticides using wheat straw as substrates. Process Biochemistry, 40(2): 935–943 |
| Borsodi A K, Vladár P, Cech G, et al, 2003. Bacterial activities in the sediment of Lake Velencei, Hungary. Hydrobiologia, 506(1-3): 721–728 |
| Garland J L, Mills A L, Young J S, 2001. Relative effectiveness of kinetic analysis vs single point readings for classifying environmental samples based on community-level physiological profiles (CLPP). Soil Biology and Biochemistry, 33(7-8): 1059–1066 DOI:10.1016/S0038-0717(01)00011-6 |
| Good C, Davidson J, Iwanowicz L, et al, 2017. Investigating the influence of nitrate nitrogen on post-smolt Atlantic salmon Salmo salar reproductive physiology in freshwater recirculation aquaculture systems. Aquacultural Engineering, 78: 2–8 DOI:10.1016/j.aquaeng.2016.09.003 |
| Graham M H, Haynes R J, 2005. Catabolic diversity of soil microbial communities under sugarcane and other land uses estimated by Biolog and substrate-induced respiration methods. Applied Soil Ecology, 29(2): 155–164 DOI:10.1016/j.apsoil.2004.11.002 |
| Grove J A, Kautola H, Javadpour S, et al, 2004. Assessment of changes in the microorganism community in a biofilter. Biochemical Engineering Journal, 18(2): 111–114 DOI:10.1016/S1369-703X(03)00182-7 |
| Haack S K, Garchow H, Klug M J, et al, 1995. Analysis of factors affecting the accuracy, reproducibility, and interpretation of microbial community carbon source utilization patterns. Applied and Environmental Microbiology, 61(4): 1458–1468 |
| Haslun J, De Souza Correia E, Strychar K B, et al, 2012. Characterization of bioflocs in a no water exchange super-intensive system for the production of food size pacific white shrimp Litopenaeus vannamei. International Journal of Aquaculture, 2(1): 29–39 |
| Hadwin A K M, Del Rio L F, Pinto L J, et al, 2005. Microbial communities in wetlands of the Athabasca oil sands:genetic and metabolic characterization. FEMS Microbiology Ecology, 55(1): 68–78 |
| Otani Y, Hasegawa K, Hanaki K, 2004. Comparison of aerobic denitrifying activity among three cultural species with various carbon sources. Water Science and Technology, 50(8): 15–22 |
| Salomo S, Münch C, Röske I, 2009. Evaluation of the metabolic diversity of microbial communities in four different filter layers of a constructed wetland with vertical flow by Biolog™ analysis. Water Research, 43(18): 4569–4578 DOI:10.1016/j.watres.2009.08.009 |
| Schveitzer R, Arantes R, Baloi M F, et al, 2013. Use of artificial substrates in the culture of Litopenaeus vannamei (Biofloc System) at different stocking densities:Effects on microbial activity, water quality and production rates. Aquacultural Engineering, 54: 93–103 DOI:10.1016/j.aquaeng.2012.12.003 |
| Xu W J, Pan L Q, 2012. Effects of bioflocs on growth performance, digestive enzyme activity and body composition of juvenile Litopenaeus vannamei in zero-water exchange tanks manipulating C/N ratio in feed. Aquaculture, 356-357: 147–152 DOI:10.1016/j.aquaculture.2012.05.022 |
 2018, Vol. 49
2018, Vol. 49


