
中国海洋湖沼学会主办。
文章信息
- 俞群娣, 王亚军, 余新威, 刘寅政, 李叶, 方力, 陈成吉, 罗红宇. 2018.
- YU Qun-Di, WANG Ya-Jun, YU Xin-Wei, LIU Yin-Zheng, LI Ye, FANG Li, CHEN Cheng-Ji, LUO Hong-Yu. 2018.
- 微小亚历山大藻(Alexandrium minutum)的氮磷吸收、生长、产毒动态变化
- DYNAMICS OF ABSORPTION OF NITROGEN AND PHOSPHORUS, GROWTH AND TOXIN PRODUCTIVITY IN ALEXANDRIUM MINUTUM
- 海洋与湖沼, 49(2): 346-351
- Oceanologia et Limnologia Sinica, 49(2): 346-351.
- http://dx.doi.org/10.11693/hyhz20170400085
-
文章历史
- 收稿日期:2017-04-07
- 收修改稿日期:2017-11-17
2. 浙江省舟山市疾病预防控制中心 舟山 316021
2. Zhoushan Center for Disease Control and Prevention, Zhoushan 316021, China
微小亚历山大藻(Alexandrium minutum)是一种全球分布广泛的单细胞海洋浮游生物, 有害赤潮生物之一。其细胞近似椭圆, 长15—30μm, 宽13—24μm, 能利用光能进行光合作用, 并且产生毒性强烈的膝沟藻毒素(gonyautoxins), 包含GTX1、GTX2、GTX3、GTX4四种毒素。这些毒素给人类、其他哺乳动物、鸟类和鱼类危害造成一定危害(于仁诚等, 1998)。
藻潮的形成通常会伴随着水域中营养物质减少, 这些营养物主要包括氮和磷。氮和磷是亚历山大藻生长和产毒所需的主要营养物质(缪宇平等, 2009)。以往关于氮磷对亚历山大藻生长和产毒的研究多集中于氮磷类型(张清春等, 2005a, b)和培养的初始氮磷浓度(缪宇平等, 2009)对藻的生长和产毒的影响, 对生长过程中氮磷吸收和产毒动态关系的研究较少, 而对生长过程中产毒与氮磷吸收的相关性研究往往更能揭示产毒的本质。
本实验以批次培养方式培养了一株产膝沟藻毒素的微小亚历山大藻, 定期检测氮磷浓度、pH、藻密度、叶绿素含量及产毒量, 观察它们的动态变化特征, 探索赤潮生物种微小亚历山大藻在生长过程中的氮磷吸收特性与其生长产毒关系, 对深入了解产毒机理和赤潮防治有着重要意义。
1 材料与方法 1.1 藻种培养微小亚历山大藻取自暨南大学藻种库, 保种于f/2-Si海水培养基中(Guillard et al, 1962)。海水取自舟山海域, 盐度24±1, 经0.22µm纤维滤膜过滤后, 于121℃高压湿热灭菌25min, 待冷却后使用。培养试验中, 配制成改进的海水培养基, 使磷酸二氢钠最终浓度为18.15μmol/L (f/2-Si海水培养基中磷浓度的一半, 以缩短实验周期), 其他成分浓度按f/2-Si海水培养基中浓度配制。将对数期的藻种接种于1.5L改进培养基中进行培养, 初始密度为1160cell/mL。接种后的藻液置于GMC-350HP-2人工气候培养箱中培养, 昼夜光暗时间比为12h︰12h, 光照强度为125±12.5µmol/ (m2s), 温度25℃。
1.2 藻密度检测及其数据处理在光照开始时采集藻液。计数时, 取1mL摇匀的藻液于微型离心管, 加微量鲁格试剂固定, 涡旋摇匀, 取100μL至浮游植物计数板, 于显微镜下计数。取双份计算出平均藻密度(cell/mL), 绘制藻密度生长曲线。微小亚历山大藻的比增长率按下列公式计算:
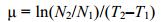
式中, N2、N1表示接种后第T2、T1天的藻密度。
1.3 毒素的检测取5mL摇匀的培养液于离心管中, 5000g离心15min, 上清液8000g再次离心15min, 合并离心所得藻泥, 将其溶解在5mL 0.003mol/L HCl和0.01mol/L CH3COOH组成的混合溶液中, 在冰浴中超声破碎5min, 于4℃、7000g离心10min, 取2—4mL上清液于截留分子量3000的超滤离心管中, 5000g离心15min, 滤液用于毒素检测。
取上述步骤中藻液第二次分离后的上清液(即藻液分离后的培养液)1mL用3mL 0.003mol/L HCl和0.01mol/L CH3COOH的混合溶液定容到4mL, 于超滤离心管中, 5000g离心15min, 滤液用检测小瓶收集, 于–20℃下储存, 用于检测游离于培养液中毒素。
藻细胞提取液和培养液中的膝沟藻毒素用液相色谱串联质谱检测, 参照Watanabe等(2013)的方法。Waters ACQUITY UPLC BEH Amide色谱柱用于毒素分离, TSQ Vantage三重四极杆质谱仪(配有电喷雾离子源)进行毒素分析。膝沟藻毒素标准品(CRM-GTX1 & 4-C; CRM-GTX2 & 3-C), 由加拿大海洋生物研究所提供。甲酸(LC-MS级)、乙腈(色谱纯)购自德国CNW科技公司。超纯水由Mili-Q超纯水系统制得。
1.4 叶绿素a测定取15m摇匀的藻液于离心管中, 于离心管中5000g离心15min, 上清液8000g再次离心15min, 合并两次离心所得藻泥。加5mL 90% (V/V)丙酮的水溶液, 摇荡, 放置冰箱贮存室中14—24h, 提取叶绿素a。测定方法参照Jeffrey等(1975)的分光光度法。
1.5 培养液基质中氮、磷、pH的测定按照1.3和1.4中藻液离心的方法获取上清液, 用于分析其中氮磷含量及pH。取10—12mL上清液, 用PHS-3C精密pH计测其pH。用移液枪准确量取4—10mL上清液, 用超纯水稀释到50mL, 测其总磷含量, 方法参照磷钼蓝分光光度法(Murphy et al, 1962)。取1mL上清液测其硝酸盐含量, 方法参照Wood等(1967)的硝酸盐镉柱还原法。
2 实验结果 2.1 生长参数和产毒量随时间的变化在68天的批量培养过程中, 微小亚历山大藻生长密度和叶绿素a含量随时间变化见图 1A, 根据藻密度的变化趋势, 该藻生长可以分为五个时期:延缓期(1—2d), 第一对数期(3—15d, 比增长率µ=0.20), 第二对数期(17—35d, 比增长率µ=0.04), 稳定期(35—51d)和衰亡期(51d后)。在延缓期和第一对数期, 藻密度与叶绿素a含量呈正相关关系, 拟合的线性方程式为
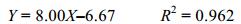
 |
| 图 1 在批量培养中微小亚历山大藻生长和产毒参数的变化 Fig. 1 Changes of indexs of growth and toxin productivity of A. minutum in batch culture |
式中, Y表示细胞密度(103cells/mL), X表示叶绿素a含量(µg/L), 拟合时间范围为1—15d。
在第17天后的生长期, 藻密度与叶绿素a含量随时间延长呈相反的变化趋势, 其中在第17—29d, 线性拟合结果显示, 藻密度与叶绿素a具有负线性相关关系:
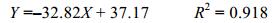
式中, Y表示细胞密度(103cells/mL), X表示叶绿素含量(µg/L), 拟合时间范围为17—29d。在培养至17天时, 细胞密度出现一次急剧减少, 并且观察到有一团微藻沉聚于培养容器底部, 轻轻晃动, 该团菌斑消失。与此同时, pH上升至其最高值9.01, 随着培养进一步进行, pH呈下降趋势(图 1b)。
微小亚历山大藻对磷的吸收非常迅速, 在第9天时, 培养液中已经检测不到其存在(图 1b)。然而, 藻对氮的吸收相对缓慢, 在整个实验过程中, 培养液中氮浓度逐渐减小(图 1c)。
总毒素由胞内毒素和胞外毒素组成, 其随时间的变化见图 1c。经对比发现, 总毒素含量与氮吸收量有一定关联性:当溶液中氮浓度减小时, 总毒素含量升高; 当氮的吸收速度在后期减缓时, 总毒素含量增速也趋缓。
胞内毒素在第60天时具有最大值, 然后下降, 而胞外毒素则从进入稳定期开始才大量出现, 且随着时间的延长, 积累得越来越多(图 1c)。
2.2 产毒过程中毒素组成变化分别对细胞内和细胞外的四种毒素作散点图和进行线性拟合, 结果显示: GTX1与GTX4, GTX2与GTX3呈线性变化(图 2a, b, d, e)。在胞内和胞外的四种毒素中, GTX1和GTX4为主要毒素, 占到总毒素含量的64.1%—97.6%, 其胞外和胞内的线性拟合相关系数高达0.972和0.965, 较GTX2和GTX3拟合的线性相关系数(0.880和0.774)要高。在延缓期和第一对数期中, 细胞内的GTX1/4和GTX2/3呈正线性相关关系, 在随后的生长周期中, 随着胞内的GTX1/4含量增加, GTX2/3含量出现先下降、后保持不变的趋势(图 2c)。胞外的GTX1/4与GTX2/3则呈现一定的线性变化趋势(图 2f)。
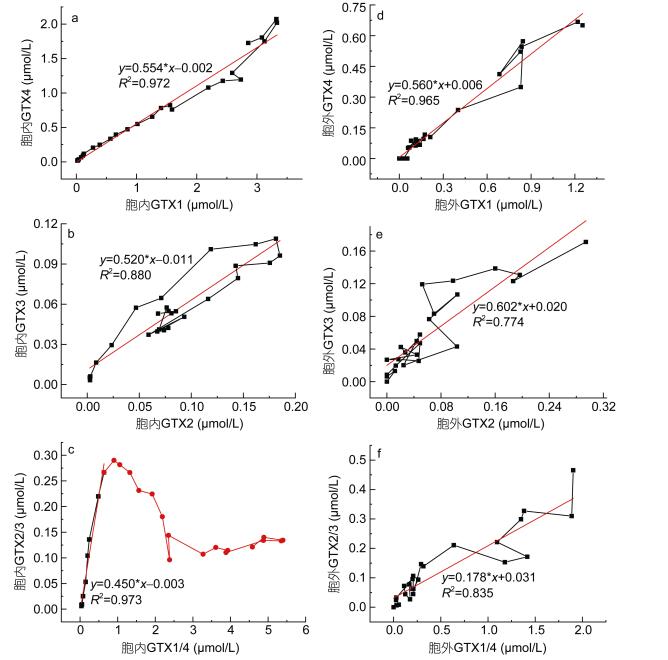 |
| 图 2 藻细胞和培养液中毒素组成变化 Fig. 2 Changes of toxin constitution in algal cell and culture medium |
一般地, 批量培养周期按照藻生长速率可分为延缓期、对数期、稳定期和衰亡期。然而, 在本实验中, 出现了两段对数期。第二对数期生长速率较第一对数期小, 可能是受到某种因子的限制。海洋浮游植物暴发藻潮时, 海水中二氧化碳被生物固定, 通常伴随着海水pH的升高(Hinga, 1992)。相反, 当海水中溶解二氧化碳增多, 可导致pH下降, 即海水酸化现象(石莉等, 2011)。在人工培养条件下, 因受限于无机碳的缺乏, 一些亚历山大藻的生长会出现停滞(Anderson et al, 1990b)。Wang等(2001)在批量培养塔玛亚历山大藻时发现, 培养液pH值随着培养时间的延长出现先升后降的趋势, 本实验结果与其变化趋势一致, 培养液的pH从第5天开始到第17天单调递增, 在第17天达到最大pH 9.01, 随后pH出现下降。培养液正好在第17天进入第二对数期, 因此, 藻进入第二对数期可能是由碳限制造成, 而随后的pH下降可能是由于藻活力减弱而培养液中二氧化碳溶解逐渐增加导致。另外, 在第二对数期, 藻密度与叶绿素含量呈负线相关关系, 也可能是在缺乏碳源的情况下, 叶绿素转换成其他含碳物质, 用作生长所必须的碳源, 以维持继续生长。
利用叶绿素含量判断生物量大小已被很多文献提及(Parkhill et al, 1999; 杜胜蓝等, 2011), 在实验室培养条件下, 叶绿素与生物量一般成正相关关系。Parkhill等(1999)培养的一株塔玛亚历山大藻在对数期内, 藻密度和叶绿素a含量呈正线性相关关系。在本实验中, 微小亚历山大藻在延缓期和第一对数期时, 叶绿素a与藻密度呈现良好的正线性相关关系, 但是在第二对数期, 藻密度与叶绿素含量呈负线相关关系。据此推测, 只有在营养充沛的对数期, 叶绿素a含量才是表征藻密度(生物量)的良好指标。因此, 在用叶绿素判断藻密度的时候, 要特别注意藻所生长的时期或状态。
磷是生物膜、遗传物质的重要组成元素, 是微藻生长和增殖不可或缺的元素。实验中, 虽然从第9天开始, 培养液中的磷已被完全吸收, 但是微小亚历山大藻直到第43天依然能够大量增殖, 说明微小亚历山大藻具有较强的磷储备能力。许多甲藻能将周围环境中的磷迅速吸收和储存于体内, 当胞外磷消耗殆尽, 微藻可利用胞内磷继续分裂增殖(Boyer et al, 1987; 张清春等, 2005b)。因此, 培养液检测不到磷酸盐存在并不能表示微藻处于磷限制状态。微小亚历山大藻的这种“奢侈吸收”特性, 可能有助于其在低磷环境中长时间持续生长(吕颂辉等, 2006)。
当培养液逐渐老化, 部分细胞死亡并且裂解, 会导致毒素释放。实验结果表明, 微小亚历山大藻胞内产生的毒素在进入稳定期后开始向培养液中释放毒素, 使得培养液中的毒素越来越高。塔玛亚历山大藻和链状亚历山大藻培养过程中也观察到类似现象(Prakash, 1967)。因此, 在研究微藻产毒时, 泄露到培养液中的毒素不可忽视。通常认为麻痹性贝类毒素是通过食物链富集, 危害于人类或动物, 本实验则提醒, 毒素还有可能通过海水传播, 造成更大范围的潜在危害。
氮是生命体必须的元素, 它是遗传物质、蛋白质、麻痹性贝类毒素等物质的必备元素。氮的缺乏会造成产麻痹性贝类毒素微藻生长和产毒受限。实验结果显示, 当培养液中的氮被吸收耗尽时, 总毒素的含量亦不再增加。由此可以看出, 毒素的产生需要培养液中含有一定浓度的氮营养素, 当氮耗尽时, 产毒也将停止。
微藻所产麻痹性贝类毒素是以石房蛤毒素为骨架的一系列同系物(Wiese et al, 2010), 一种微藻通常可以产生多种结构相近的麻痹性贝类毒素。微小亚历山大藻中有GTX1、GTX2、GTX3、GTX4四种麻痹性贝类毒素, 与其他文献中报道的微小亚历山大藻所产毒素类似, GTX1/4占有绝对优势, 而GTX2/3所占的比例较低(张清春等, 2005b)。实验中GTX1和GTX4, GTX2和GTX3的含量比值都比较固定, 可能与它们是两对结构极为相似的同分异构体有关, 这两对同分异构体在提取或储藏过程中可发生相互转化而达到一定平衡(Laycock et al, 1994)。有研究观察到不论温度变化或是氮磷营养限制, 毒素的组成比例都很稳定(Boyer et al, 1987), 这种稳定的毒素组成特性也许可以被用作生物化学标记, 应用于生物分类学研究(Franco et al, 1994; Wang et al, 2006)。然而, 本研究表明, 在延缓期和第一对数期, GTX1/4与GTX2/3呈正线性相关关系, 即各毒素组成比例相对恒定。但是在随后的生长时期中, 随着GTX1/4含量进一步增大, GTX2/3含量呈现下降继而不变的趋势, 即毒素组成比例发生变化。这种组成变化也在逐渐老化的原膝沟藻中被发现(Boczar et al, 1988)。除了在批量培养中观察到毒素组成变化, 在半连续和连续的培养中, 同样观察到亚历山大藻毒素的组成会随环境的变化而变化(Anderson et al, 1990a; Han et al, 2016)。所以, 微小亚历山大藻毒素组成恒定这一结论仅在营养充足的延缓期和第一对数期成立, 当微小亚历山大藻生长受到营养盐(如碳)限制时, 毒素的组成比例会发生明显改变。
4 结论氮和磷都是微小亚历山大藻的重要营养因子, 但它们的吸收特性以及在生长和产毒中的作用并不相同。微小亚历山大藻有较强的磷储备能力, 储磷后可以于低磷或无磷环境中生长。氮的吸收相对缓慢, 且与产毒量有着更为直接的关系。产毒过程中毒素组成恒定仅在营养充足的环境下才成立, 用其作为生物标记应当格外注意。微小亚历山大藻从稳定期开始向培养液中释放毒素, 因此当赤潮暴发时, 通过海水传播的毒素应该引起一定警惕。生长过程中pH变化或许可以作为海水(培养基)水质判断的一个重要指标, 且该方法简单易行。用叶绿素含量来表征微小亚历山大藻生物量时也需谨慎, 碳限制条件下并不适用。
| 于仁诚, 周名江, 1998. 麻痹性贝毒研究进展. 海洋与湖沼, 29(3): 330–338 |
| 石莉, 桂静, 吴克勤, 2011. 海洋酸化及国际研究动态. 海洋科学进展, 29(1): 122–128 |
| 吕颂辉, 李英, 2006. 我国东海4种赤潮藻的细胞氮磷营养储存能力对比. 过程工程学报, 6(3): 439–444 |
| 杜胜蓝, 黄岁樑, 臧常娟, 等, 2011. 浮游植物现存量表征指标间相关性研究Ⅰ:叶绿素a与生物量. 水资源与水工程学报, 22(1): 40–44 |
| 张清春, 于仁诚, 周名江, 等, 2005a. 不同氮源对微小亚历山大藻生长和毒素产生的影响. 海洋学报, 27(6): 138–145 |
| 张清春, 于仁诚, 周名江, 等, 2005b. 不同类型含磷营养物质对微小亚历山大藻(Alexandrium minutum)生长和毒素产生的影响. 海洋与湖沼, 36(5): 465–474 |
| 缪宇平, 袁骐, 周宏农, 等, 2009. 环境因子对微小亚历山大藻Amtk-9生长与产毒的综合影响. 海洋渔业, 31(3): 279–287 |
| Anderson D M, Kulis D M, Sullivan J J, et al, 1990a. Toxin composition variations in one isolate of the dinoflagellate Alexandrium fundyense. Toxicon, 28(8): 885–893 DOI:10.1016/0041-0101(90)90018-3 |
| Anderson D M, Kulis D M, Sullivan J J, et al, 1990b. Dynamics and physiology of saxitoxin production by the dinoflagellates Alexandrium spp. Mar Biol, 104(3): 511–524 DOI:10.1007/BF01314358 |
| Boczar B A, Beitler M K, Liston J, et al, 1988. Paralytic shellfish toxins in Protogonyaulax tamarensis and Protogonyaulax catenella in axenic culture. Plant Physiol, 88(4): 1285–1290 DOI:10.1104/pp.88.4.1285 |
| Boyer G L, Sullivan J J, Andersen R J, et al, 1987. Effects of nutrient limitation on toxin production and composition in the marine dinoflagellate Protogonyaulax tamarensis. Mar Biol, 96(1): 123–128 DOI:10.1007/BF00394845 |
| Franco J M, Fernández P, Reguera B, 1994. Toxin profiles of natural populations and cultures of Alexandrium minutum Halim from Galician (Spain) coastal waters. J Appl Phycol, 6(3): 275–279 DOI:10.1007/BF02181938 |
| Guillard R R L, Ryther J H, 1962. Studies of marine planktonic diatoms:Ⅰ. Cyclotella nana Hustedt, and Detonula confervacea (Cleve) Gran. Can J Microbiol, 8(2): 229–239 DOI:10.1139/m62-029 |
| Han M, Lee H, Anderson D M, et al, 2016. Paralytic shellfish toxin production by the dinoflagellate Alexandrium pacificum (Chinhae Bay, Korea) in axenic, nutrient-limited chemostat cultures and nutrient-enriched batch cultures. Mar Pollut Bull, 104(1-2): 34–43 DOI:10.1016/j.marpolbul.2016.01.057 |
| Hinga K R, 1992. Co-occurrence of dinoflagellate blooms and high pH in marine enclosures. Mar Ecol Prog Ser, 86(2): 181–187 |
| Jeffrey S W, Humphrey G F, 1975. New spectrophotometric equations for determining chlorophylls a, b, c1 and c2 in higher plants, algae and natural phytoplankton. Biochem Physiol Pflanz, 167(2): 191–194 DOI:10.1016/S0015-3796(17)30778-3 |
| Laycock M V, Thibault P, Ayer S W, et al, 1994. Isolation and purification procedures for the preparation of paralytic shellfish poisoning toxin standards. Nat Toxins, 2(4): 175–183 DOI:10.1002/(ISSN)1056-9014 |
| Murphy J, Riley J P, 1962. A modified single solution method for the determination of phosphate in natural waters. Anal Chim Acta, 27: 31–36 DOI:10.1016/S0003-2670(00)88444-5 |
| Parkhill J P, Cembella A D, 1999. Effects of salinity, light and inorganic nitrogen on growth and toxigenicity of the marine dinoflagellate Alexandrium tamarense from northeastern Canada. J Plankton Res, 21(5): 939–955 DOI:10.1093/plankt/21.5.939 |
| Prakash A, 1967. Growth and toxicity of a marine dinoflagellate, Gonyaulax tamarensis. J Fish Res Board Can, 24(7): 1589–1606 DOI:10.1139/f67-131 |
| Wang D Z, Hsieh D P H, 2001. Dynamics of C2 toxin and chlorophyll-a formation in the dinoflagellate Alexandrium tamarense during large scale cultivation. Toxicon, 39(10): 1533–1536 DOI:10.1016/S0041-0101(01)00125-8 |
| Wang D Z, Zhang S G, Gu H F, et al, 2006. Paralytic shellfish toxin profiles and toxin variability of the genus Alexandrium (Dinophyceae) isolated from the Southeast China Sea. Toxicon, 48(2): 138–151 DOI:10.1016/j.toxicon.2006.04.002 |
| Watanabe R, Matsushima R, Harada T, et al, 2013. Quantitative determination of paralytic shell fish toxins in cultured toxic algae by LC-MS/MS. Food Addit Contam, 30(8): 1351–1357 DOI:10.1080/19440049.2013.793456 |
| Wiese M, D'Agostino P M, Mihali T K, et al, 2010. Neurotoxic alkaloids:saxitoxin and its analogs. Mar Drugs, 8(7): 2185–2211 |
| Wood E D, Armstrong F A J, Richards F A, 1967. Determination of nitrate in sea water by cadmium-copper reduction to nitrite. J Mar Biol Assoc UK, 47(1): 23–31 DOI:10.1017/S002531540003352X |
 2018, Vol. 49
2018, Vol. 49


