
中国海洋湖沼学会主办。
文章信息
- 盛建海, 韩涛, 王骥腾, 郑普强, 杨敏, 徐含颖. 2018.
- SHENG Jian-Hai, HAN Tao, WANG Ji-Teng, ZHENG Pu-Qiang, YAN Min, XU Han-Ying. 2018.
- 源自生物絮团产絮凝剂的异养硝化-好氧反硝化菌xt1的鉴定及其脱氮特性
- IDENTIFICATION AND NITROGEN REMOVAL CHARACTERISTICS OF A HETEROTROPHIC NITRIFICATION-AEROBIC DENITRIFICATION STRAIN xt1 WITH FLOCCULATION ABILITY ISOLATED FROM BIOFLOC
- 海洋与湖沼, 49(2): 375-383
- Oceanologia et Limnologia Sinica, 49(2): 375-383.
- http://dx.doi.org/10.11693/hyhz20171000251
-
文章历史
- 收稿日期:2017-10-08
- 收修改稿日期:2017-11-10
我国是水产养殖大国, 养殖产量中约41%源于投饲养殖(董双林, 2011)。然而养殖鱼类通常仅能同化约27%的饲料氮, 剩余主要以氨氮、粪便和残饵的形式存在于水体中(Crab et al, 2007)。残饵、粪便经微生物氨化产生氨氮, 氨氮又易在自养硝化中停滞为亚硝氮, 超标亚硝氮与氨氮将毒害养殖动物(余瑞兰等, 1999; 张列宇等, 2010; Avnimelech et al, 2012)。传统方式以换水降低氨氮及亚硝氮含量, 然而养殖水体的肆意排放导致近海水域富营养化日渐突出, 这将引发诸如赤潮等严重的海洋环境问题, 致使养殖水源恶化, 继而加剧养殖自身污染, 制约产业发展(董双林, 2011; 方圣琼等, 2004)。鉴于此, 加强养殖水体脱氮已然是水产养殖业亟待解决的关键问题之一。
生物脱氮法被认为是安全、高效、极具应用前景的养殖水体处理方式, 其通过结合微生物氨化、硝化与反硝化等多重工艺将氮素从水中脱除(张列宇等, 2010; 王骁静等, 2017)。其中, 异养硝化-好氧反硝化(Heterotrophic Nitrification-Aerobic Denitrification, HN-AD)菌因能进行同步硝化反硝化(Simultaneous Nitrification and Denitrification, SND), 无需传统工艺中反硝化所需严格厌氧环境且耐受有机负荷, 是当前水体脱氮领域的热点之一。至今, 研究者已筛选到诸多HN-AD菌, 如醋酸钙不动杆菌(Acinetobacter calcoaceticus)(罗国芝等, 2016)、铜绿假单胞菌(Pseudomonas aeruginosa) (梁贤等, 2015)、粪产碱菌(Alcaligenes faecalis) (方海洋等, 2015)等。然而, 直接向水体投放游离菌株进行脱氮仍存有缺陷, 因单个细菌细胞表面水层易发生分子扩散, 从而导致菌体汲取营养效率受限, 进而影响菌株脱氮效率(Avnimelech et al, 2012; 郝红红等, 2013)。而多个细菌聚集将有益于菌株脱氮。研究发现, 部分菌种能分泌诸如多糖、蛋白质、腐殖质等组成的胞外聚合物(EPS)形成絮凝剂, 可将细菌细胞及环境中微粒聚集构建生物絮团(biofloc)(Avnimelech et al, 2012), 形成的絮团结构疏松多孔, 利于内部物质传输, 从而有助于菌株高效截获水流中碳、氮源, 保障脱氮效率。因此, 筛选、研究具产絮能力的HN-AD菌对于水体高效脱氮具有实际意义。
本研究从形成于凡纳滨对虾(Litopenaeus vannamei)养殖水体的生物絮团中分离到一株具产絮能力的HN-AD菌xt1, 进一步对其进行分子鉴定及生理生化分析, 在此基础上探讨菌株脱氮特性及絮凝能力, 并进行养殖水体脱氮试验, 以期在实践中为高效水体脱氮提供备选菌株。
1 材料与方法 1.1 培养基2216E海水培养基:蛋白胨5g/L, 酵母膏1g/L, 磷酸高铁0.01g/L, 海水1L, 盐度25, 调节pH值7.5。
2216E海水固体培养基: 2216E海水培养基中添加琼脂15—20g/L。
硝化培养基:参考张家顺等(2015)配方, NH4Cl 0.38g/L, 蔗糖4.8g替换原葡萄糖, K2HPO4 1.2g, MgSO4·7H2O 0.5g, 海水1L, 盐度25, 调节pH值7.5。
亚硝氮反硝化培养基:将硝化培养基中NH4Cl替换成NaNO2, 配制NO2–-N=120mg/L。
硝态氮反硝化培养基:将硝化培养基中NH4Cl替换成KNO3, 配制NO3–-N=100mg/L。
上述培养基经高压灭菌后使用。
1.2 菌株来源目的菌株分离自凡纳滨对虾养殖水体中形成的生物絮团。采用2216E海水固体培养基对絮团内细菌进行划线分离, 具体方法参考孙振等(2013), 经多次纯化、筛选到具异养硝化-好氧反硝化兼具絮凝能力的目的菌株xt1。
1.3 菌株鉴定 1.3.1 菌落形态将菌株接种至2216E海水固体培养基上24h后观察菌落特征。
1.3.2 菌株16S rRNA基因测序及系统发育树构建菌株DNA采用酚氯仿法提取, 并以其为模板进行PCR扩增, 扩增上游引物为515F (5'-GTGCCAGCM GCCGCGGTAA-3 ), 下游引物为907R (5'-CCGTCA ATTCCTTTGAGTTT-3 )。PCR反应体系30μL, 包括:模板DNA 0.1μL, 正向和反向引物各0.6μL, dNTP 2μL, rTaq 0.2μL, 10×buffer 3μL, ddH2O 23.5μL。PCR反应条件为: 94℃解链3min; 94℃ 30s, 55℃ 30s和72℃ 1min, 循环30次, 72℃延伸5min。扩增产物经凝胶电泳检测后送至生工生物工程(上海)股份有限公司进行测序。
测序结果在GenBank上进行BLAST比对。下载相似性高于95%的其他序列, 使用MEGA5.0软件中Neighbor-Joining法对其他序列与目标序列构建系统发育树, 进行亲缘关系分析。
1.3.3 菌株生理生化分析菌株生理生化参照《伯杰氏细菌鉴定手册》(Buchanan et al, 1984)和《常见细菌系统鉴定手册》(2001) (东秀珠等, 2001)进行, 分析项目包括革兰氏染色、接触酶、氧化酶、淀粉水解、吲哚试验、硝酸盐还原、耐盐性及生长温度。
1.4 菌株脱氮特性及絮凝能力 1.4.1 碳源、有机氮和无机氮浓度对菌株脱氮能力的影响实验所用培养基以硝化培养基为基础, 调整氮源为氨氮、硝态氮各50mg/L(总无机氮100mg/L)。选取碳源、有机氮浓度、无机氮浓度作为影响因素分别进行研究。碳源分别为蔗糖、葡萄糖、柠檬酸三钠、乙酸钠, 以C/N=20加入培养基中; 有机氮以蛋白胨(总氮 > 14.5%)为氮源, 分别添加0.25%、0.5%、1%、2%于培养基中; 无机氮浓度(氨氮+硝态氮, 氨氮:硝态氮=1:1)设置为20、50、150、200mg/L, 分别替换原无机氮浓度, 其中各组碳源添加量以C/N=20计算。
采用接种环将分离的单菌落接种入2216E海水培养基中, 于摇床30℃、160r/min培养48h后, 使用灭菌海水配制成OD600为0.5的菌液, 将菌液按2%接种入各100mL培养基中, 培养基置于250mL三角烧瓶中, 于摇床30℃、160r/min培养48h后测量氨氮、亚硝氮、硝态氮及OD600。以上每组设置三个平行。
1.4.2 菌株异养硝化-好氧反硝化及絮凝能力将OD600为0.5的菌液按2%接种入各150mL氨氮硝化、亚硝氮反硝化、硝态氮反硝化培养基中, 于摇床30℃、160r/min培养, 每12h测量一次氨氮、亚硝氮、硝态氮、OD600以及絮凝率。以上每组设置三个平行。
1.4.3 添加菌株对养殖水体脱氮效果的影响实验用水为凡纳滨对虾养殖水体, 取自浙江海洋大学水产学院饲料与营养养殖车间。将10L养殖水体注入12L处理桶中, 共6个, 3个实验组, 3个对照组, 每个处理桶添加1个气石充气, 水温(28±1)℃、盐度25。将培养于硝化培养基48h的菌液按2%接种入实验组, 对照组不添加菌液, 实验组、对照组各加入3g蔗糖。每6h测量一次水体氨氮、亚硝氮、硝态氮、pH及絮团沉积量(Floc volume, FV), 实验结束后对实验组形成絮团颗粒进行显微结构观察。
1.4.4 添加菌株对氮源加富的养殖水体脱氮效果的影响实验设置与1.4.3相同, 但人工添加氮源, 调整氨氮、亚硝氮、硝态氮至约10mg/L, 添加饲料氮(40%粗蛋白)30mg/L, 调节C/N=20。每日记录水体氨氮、亚硝氮、硝态氮及絮团沉积量(FV), 每日记录pH, 并采用碳酸氢钠调节至7.5—7.7, 实验结束后对实验组形成絮团颗粒进行显微结构观察。
1.5 主要分析方法氨氮、亚硝氮、硝态氮测定参考《海洋监测规范》(中华人民共和国国家质量监督检验检疫总局等, 2008)。
脱氮率计算方法如下:
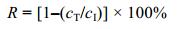
其中, R为氮的去除率, cT为终态氮浓度(mg/L), cI为初始氮浓度(mg/L)。
絮凝率测定采用高岭土法(信欣等, 2014)、FV采用英霍夫锥沉淀30min、pH采用pH计(METTLER TOLEDO型号为FE20K)测量、絮团显微结构采用倒置荧光显微镜(OLYMPUS型号IX53)于200倍下拍摄、OD600在全波长核酸仪(Thermo Scientific型号Multiskan GO) 600nm下测量。实验数据采用Excel(2010)和SPSS 19.0软件进行分析、作图。
2 结果 2.1 菌株鉴定 2.1.1 菌落特征菌株xt1培养至固体培养基24h后, 菌落大小约1.5—2.0mm, 乳黄色, 呈不透明圆形, 表明黏稠, 隆起, 边缘整齐具透明圈。
2.1.2 菌株16S rRNA基因测序及系统发育树通过PCR扩增得到菌株xt1 382bp的16S rRNA基因序列(登录号: FM992193.), 经NCBI网站BLAST比对显示菌株xt1与Bacillus pumilus、Bacillus amyloliquefaciens、Bacillus subtilis、Bacillus licheniformis相似性均达到99%, 初步可确定菌株xt1为芽孢杆菌(Bacillus sp.)。进一步构建系统发育树结果(图 1)显示, 菌株xt1与短小芽孢杆菌(Bacillus pumilus)亲缘关系最近。
 |
| 图 1 菌株xt1的16S rRNA基因序列系统发育树 Fig. 1 Phylogenetic tree of strain xt1 based on the sequence of 16S rRNA gene |
菌株革兰氏染色呈紫色(图 2), 为革兰氏阳性菌, 短杆状, 主要生理生化分析(表 1)显示菌株xt1具氧化酶、接触酶, 盐度耐受范围广, 吲哚试验为阴性, 不能分解淀粉, 这些特征均与Bacillus pumilus一致(吴琦等, 2007)。因此, 结合16S rRNA基因测序及生理生化特征可初步确定菌株xt1为短小芽孢杆菌(Bacillus pumilus)。
 |
| 图 2 菌株xt1的细胞形态(10×20) Fig. 2 Morphology of the strain xt1 (10×20) |
| 项目 | xt1 |
| 革兰氏染色 | + |
| 接触酶 | + |
| 氧化酶 | + |
| 淀粉水解 | – |
| 吲哚试验 | – |
| 硝酸盐还原 | + |
| 0%耐盐性 | + |
| 1%耐盐性 | + |
| 3%耐盐性 | + |
| 4℃生长 | – |
| 30℃生长 | + |
| 37℃生长 | + |
| 注: “+”:阳性; “–”:阴性 | |
如图 3所示, 菌株xt1以蔗糖和葡萄糖为碳源的脱氮效率高于以柠檬酸三钠及乙酸钠为碳源的脱氮效率。其中, 氨氮去除率分别达到69.95%、95.56%、29.48%和13.41%;硝态氮去除率分别达到49.50%、57.40%、32.36%和9.04%。同时, 在蔗糖、葡萄糖及乙酸钠下脱氮均生成亚硝氮, 分别达到2.87、2.78和2.32mg/L。菌株生长量OD600分别为0.403、0.426、0.166和0.119, 生长趋势与脱氮效率相吻合。综合4种碳源下的脱氮效率及生长量, 菌株xt1对于葡萄糖的利用效果最佳, 同时在蔗糖下也具有较高脱氮效率。
 |
| 图 3 碳源对菌株xt1脱氮的影响 Fig. 3 Effect of carbon source on nitrogen removal reaction of strain xt1 |
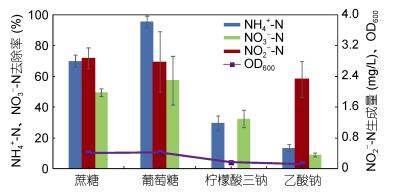
如图 4所示, 添加蛋白胨的条件下对于菌株xt1脱氮均有良好效果, 四种比例下脱氮效率均极高, 其中, 氨氮去除率分别达到93.08%、93.14%、96.79%和96.23%;硝态氮去除率分别达到88.27%、90.50%、92.97%和97.80%。OD600随着添加量增加分别达到0.925、1.034、1.103和1.314。此外, 各组均无亚硝氮累积。
 |
| 图 4 添加蛋白胨对菌株xt1脱氮的影响 Fig. 4 Effect of peptone on nitrogen removal reaction of strain xt1 |
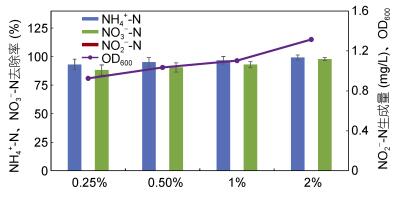
如图 5所示, 菌株xt1在4种无机氮浓度下均体现一定脱氮效率。其中, 氨氮去除率分别达到84.15%、98.66%、31.47%和30.96%;硝态氮去除率分别达到32.09%、63.50%、36.13%和32.06%。此外, 在140和200mg/L下亚硝氮有所累积, 分别达到3.32和2.78mg/L。OD600分别达到0.359、0.531、0.363和0.320, 菌株生长在高浓度无机氮下稍有抑制。
 |
| 图 5 无机氮浓度对菌株xt1脱氮的影响 Fig. 5 Effect of inorganic nitrogen concentration on nitrogen removal reaction of strain xt1 |
如图 6所示, 菌株xt1以氨氮为唯一氮源时体现高效脱氮效率, 前24h具较快去除率, 氨氮从95.54mg/L下降至25.83mg/L, 此阶段平均去除率达2.90mg/(L h), 之后去除率减缓, 至84h, 氨氮下降至5.58mg/L, 去除率达到94.16%。OD600伴随氨氮去除逐渐升高, 至84h达到0.689。整个氨氮硝化过程中, 无明显亚硝氮、硝态氮累积。
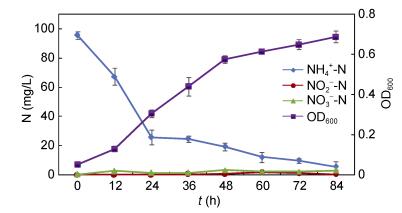 |
| 图 6 菌株xt1的异养硝化过程 Fig. 6 Process of heterotrophic nitrification of strain xt1 |
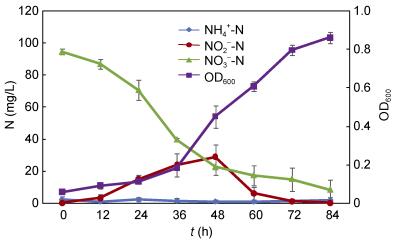
如图 7所示, 菌株xt1对于高达120.09mg/L的亚硝氮具一定去除效率。初始24h内, 菌株处于适应期, OD600缓慢增加, 24h后菌株处于快速生长阶段, 伴随菌株生长, 亚硝氮逐步下降。至84h, OD600达到0.324, 亚硝氮降至62.93mg/L, 去除率达47.60%。整个亚硝氮反硝化过程中, 无明显氨氮、硝态氮累积。
 |
| 图 7 菌株xt1亚硝氮反硝化过程 Fig. 7 Process of nitrite denitrification of strain xt1 |
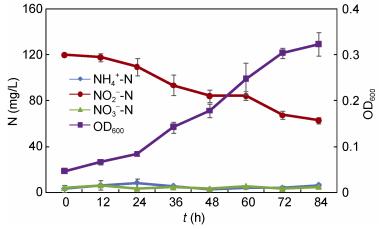
如图 8所示, 菌株xt1对于硝态氮具较高去除能力, 接种后24h, 菌株进入对数生长期, 此时硝态氮去除率最高, 24—48h的平均去除率达2.00mg/(L h), 之后去除率减缓, 至84h, 整体硝态氮去除率达91.17%, OD600达到0.862。此外, 硝态氮反硝化过程中, 亚硝氮逐步累积, 至48h达到最大值28.95mg/L, 之后逐渐下降至0.34mg/L, 而氨氮在整个反硝化过程未有明显累积。
 |
| 图 8 菌株xt1硝态氮反硝化过程 Fig. 8 Process of nitrate denitrification of strain xt1 |
菌株xt1在氨氮硝化、亚硝氮反硝化、硝态氮反硝化过程中均产生絮凝能力, 其絮凝率变化如图 9所示。三种脱氮过程中, 菌株絮凝率均先随培养时间延长而增加, 至最大值后絮凝率有不同程度下降。其中, 硝化过程中, 絮凝率至60h达到最大值82.28%。亚硝氮反硝化过程中, 絮凝率至48h达最大值73.15%。硝态氮反硝化过程中, 絮凝率至48h达到最大值75.60%。
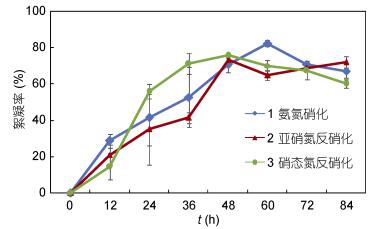 |
| 图 9 菌株xt1在3种脱氮过程中的絮凝率变化 Fig. 9 The change of flocculation rate of strain xt1 in 3 nitrogen removal processes |
添加菌株xt1对养殖水体的脱氮效果及对照组脱氮效果如图 10所示。以亚硝氮为主的养殖水体中, 添加菌株xt1对比对照组对亚硝氮的去除效果更佳, 经12h适应期后, 实验组、对照组均开始去除亚硝氮, 至30h, 实验组亚硝氮去除率达到82.18%, 高于对照组31.48%, 而至42h, 实验组亚硝氮基本去除, 而对照组仍残余0.17mg/L。脱氮过程中, 实验组及对照组氨氮及硝态氮含量于低浓度内波动, pH均有所升高, 分别从7.70、7.78升高至8.03、8.06。此外, 随着脱氮时间延长, 实验组中FV逐渐累积至0.7, 形成较多生物絮团, 絮团结构如图 11, 而对照组FV累积至0.1左右, 低于实验组。
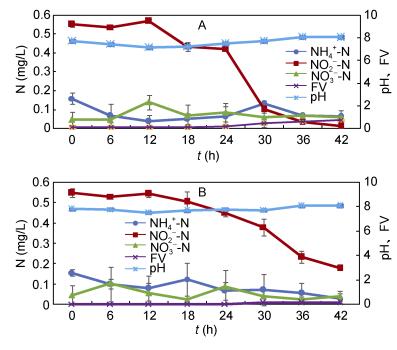 |
| 图 10 添加菌株xt1对养殖水体的脱氮效果 Fig. 10 The effect of adding strain xt1 on the removal of nitrogen from aquaculture wastewater 注: A.实验组; B.对照组 |
 |
| 图 11 添加菌株xt1形成的生物絮团 Fig. 11 The biofloc formed by adding strain xt1 |
如图 12所示, 实验组与对照组对于氮源加富且富含有机氮源的养殖水体体现出相似的脱氮轨迹。其中, 实验组硝态氮初期呈现升高趋势, 后与氨氮、亚硝氮一同被快速去除, 至处理6—7d后, 无机三态氮处于低浓度范围内波动。对照组初始无机三态氮未有升高趋势, 处理7—8d后, 氨氮、亚硝氮于低浓度范围内波动, 处理8d后, 硝态氮于低浓度范围内波动。而至于FV, 初始添加xt1加速了生物絮团形成(絮团结构见图 13), 实验组前4天沉积量高于对照组, 至第4天, 实验组FV达到最高值4.2, 后FV沉积量减少, 至第7天降低至0.4左右; 而对照组FV沉积量至第6天达到最大值5.7, 之后减少, 至第9天减少至0.3。在实验组生物絮团快速形成前4d, 亚硝氮去除率相较对照组更高, 至第4天分别为70.53%、42.92%。此外, 实验组、对照组脱氮过程中pH均下降, 调节后每日降低约0.5—1个单位。
 |
| 图 12 添加菌株xt1对氮源加富养殖水体的脱氮效果 Fig. 12 Effect of adding strain xt1 on nitrogen removal from nitrogen enriched aquaculture wastewater 注: A.实验组; B.对照组 |
 |
| 图 13 添加菌株xt1形成的生物絮团 Fig. 13 The biofloc formed by adding strain xt1 |
迄今为止, 已筛选出的异养硝化-好氧反硝化(HN-AD)菌主要集中于副球菌属(Paracoccus)、假单胞菌属(Pseudomonas sp.)、不动杆菌属(Acinetobacter sp.)与芽孢杆菌属(Bacillus sp.)等(孙庆花等, 2016b)。其中芽孢杆菌属内多个菌种已被证实具HN-AD能力, 包括枯草芽孢杆菌(Bacillus subtilis) (Yang et al, 2011)、解淀粉芽胞杆菌(Bacillus amyloliquefaciens) (谢凤行等, 2012)、地衣芽孢杆菌(Bacillus licheniformis) (张庆华等, 2011)。本文从生物絮团中分离的菌株xt1, 经16S rRNA基因测序鉴定为短小芽孢杆菌, 其与上述芽孢杆菌一致, 均具HN-AD能力。而以往关于短小芽孢杆菌的研究多围绕其抑菌特性展开, 鲜有其脱氮能力报道, 因此本研究进一步丰富了对该菌功能的认知。
菌株HN-AD过程需有机碳源提供电子和能量, 而不同碳源因其结构和分子量的差异对菌株生长和脱氮的影响亦不同。孙庆花等(2016a)筛选的HN-AD菌y5利用柠檬酸三钠时脱氮率最高, 而利用蔗糖、葡萄糖时氨氮去除率不足40%。宋宇杰等(2013)分离的菌株Y1以柠檬酸钠和乙酸钠为碳源时氨氮去除率最高, 而利用葡萄糖、蔗糖时氨氮去除率仅13.92、14.06%。而本文筛选的HN-AD菌xt1以葡萄糖和蔗糖为碳源相比柠檬酸三钠、乙酸钠时脱氮率更高, 其中蔗糖下对50mg/L的氨氮去除率达69.95%, 葡萄糖下高达95.56%。相较上述HN-AD菌y5、Y1, 菌株xt1更倾向于利用蔗糖、葡萄糖, 其原因或与芽孢杆菌富含葡萄糖脱氢酶参与葡萄糖代谢相关(杜怡青等, 2011), 而蔗糖水解生成一分子葡萄糖, 故菌株xt1代谢蔗糖亦具较高脱氮率。除脱氮率外, 价格亦是选择碳源需考虑的因素, 在满足足够脱氮率下选择低价碳源是必然选择。而蔗糖广泛存在于低价糖蜜、红糖中, 对于菌株xt1脱氮而言是一种经济、高效的碳源。
水产养殖水体中无机氮浓度涵盖范围广且常富含残饵、粪便等有机氮, 有机氮存在会因细菌氨化影响菌株脱氮效果(蒋鹏等, 2014), 但有机氮存在又利于异养细菌生长, 当有足够碳源支持下, 有机氮能提高脱氮效率。吴建江等(2013)研究中设置C/N比约16, 其筛选的菌株XS76在有机氮源比无机氮源环境中更易生长, 生长稳定期时氨氮去除率明显增强。何霞等(2007)筛选的菌株LY在反应体系C/N=20且有机氮浓度达800mg/L时氨氮去除率显著提高至100%。但上述作者均未报道对反硝化能力的影响。本研究C/N设置为20, 添加0.25%、0.5%、1%和2%的蛋白胨促进菌株xt1生长(OD600)分别至0.925、1.034、1.103和1.314, 均远高于对照生长量0.403, 氨氮去除率均超过90%, 且硝态氮去除率均超过88%。此外, 菌株xt1能适应20—200mg/L的无机氮浓度, 若能结合水体中有机氮促进生长并提供其足够碳源脱氮, 则菌株xt1有望高效处理不同氮浓度的养殖水体。
一般认可的异养硝化途径主要有两种, 一是菌株利用氨单加氧酶(AMO)与羟胺氧化酶(HAO)将氨氧化至羟氨再催化为亚硝氮、硝态氮, 即NH4+→ NH2OH→NO2–→NO3–; 另一种是菌株将氨氧化至羟氨后直接催化至气态氮, 即NH4+→NH2OH→N2O、N2 (Richardson et al, 1998)。本研究中, 菌株xt1以氨氮为唯一氮源时体现高效硝化能力, 硝化过程中亚硝氮、硝态氮几乎无累积, 因此推测其硝化途径为第二种, 该硝化过程与菌株y5 (孙庆花等, 2016a)、y6 (王骁静等, 2017)相似。而以硝态氮、亚硝氮为唯一氮源时, 菌株xt1均能进行好氧反硝化, 这表明菌株xt1存在周质硝酸盐还原酶(NAP), 故可同时利用硝态氮与氧气作为电子受体进行协同呼吸, 无机氮最终以气体脱除(罗国芝等, 2016)。其中硝态氮反硝化时, 亚硝氮逐渐累积, 随后分解, 说明硝态氮先被还原至亚硝氮, 再以气态氮脱除, 此反硝化过程又与菌株y5 (孙庆花等, 2016a)、Y-10(何腾霞等, 2016)、YF-14 (辛玉峰等, 2011)相似。此外, 菌株xt1在NH4+-N、NO2–-N、NO3–-N脱氮时体现絮凝特性, 絮凝率最高分别达82.28%、73.15%、75.60%。这表明菌株xt1在脱氮同时可发生生物絮凝参与构建生物絮团, 以此可抵御水流冲刷使高效脱氮成为可能。
生物絮团是以异养微生物为主体, 经生物絮凝作用结合水中有机颗粒、原生动物和藻类形成的絮状物(Avnimelech et al, 1999; Hargreaves et al, 2006), 因其疏松多孔结构利于内部物质传输而有助于微生物脱氮。异养微生物中芽孢杆菌多能分泌高活性胞外产物(EPS)(郭婧等, 2013), 因而利于生物絮凝。Lu等(2012)研究显示, 添加枯草芽孢杆菌能提高序批式生物反应器(SBR)中EPS含量、强化生物絮团沉降性能, 且脱氮率达0.41mg/(L d)是对照组1.17倍。杨章武等(2015)添加地衣芽孢杆菌促进了凡纳滨对虾育苗中生物絮团形成。而Zhao等(2012)发现日本囊对虾(Marsupenaeus japonicus)养殖中形成的生物絮团内主要菌群亦是芽孢杆菌。本文添加短小芽孢杆菌xt1同样加速了养殖水体中生物絮团形成, 脱氮结束时添加组FV达0.7ml/L高于对照组0.1ml/L, 同时对水体主要亚硝氮反硝化率更高, 至42h基本去除, 而对照组仍残余0.17mg/L。此外, 菌株xt1反硝化时系统pH略升高, 这一特性将有助于缓解因硝化消耗碱度而引起的pH变动。而添加菌株至高浓度水体脱氮时, 至第4天FV达到最高4.2mL/L, 而同时期对照只达2.5mL/L, 此阶段亚硝氮反硝化速率亦优于对照组。但4d后添加组FV减少, 其与添加的菌株快速繁殖产生大量EPS相关, 过高EPS导致絮团表面电负性增大, 致使絮团不易沉降(Forster et al, 1980), 对照组6d后出现相同现象。总体而言, 添加菌株xt1可加速水体脱氮进程, 且经生物絮凝后具澄清水质效果, 因而有望使养殖水体得到二次应用。
4 结论(1) 从形成于凡纳滨对虾(Litopenaeus vannamei)养殖水体的生物絮团中分离到一株具产絮能力的HN-AD菌xt1, 经16S rRNA测序与生理生化分析确定为短小芽孢杆菌(Bacillus pumilus)。
(2) 菌株xt1能利用葡萄糖高效脱氮, 在蔗糖下亦具较高脱氮率, 且能有效利用0.25%—2%蛋白胨加速生长, 强化脱氮率, 同时能适应20—200mg/L无机氮浓度。
(3) 菌株xt1氨氮硝化率达94.16%、亚硝氮反硝化率达47.60%、硝态氮反硝化率达91.17%, 且添加菌株xt1能加速水体生物絮团形成, 相较对照组提高脱氮效率。总体而言菌株xt1可作为高效养殖水体脱氮的备选菌株。
| 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会, 2008. GB17378. 4-2007海洋监测规范第4部分:海水分析. 北京: 中国标准出版社, |
| 方圣琼, 胡雪峰, 巫和昕, 2004. 水产养殖废水处理技术及应用. 环境污染治理技术与设备, 5(9): 51–55 |
| 方海洋, 王智, 李建华, 等, 2015. 异养硝化-好氧反硝化菌粪产碱杆菌的脱氮特性. 环境工程学报, 9(2): 983–988 DOI:10.12030/j.cjee.20150279 |
| 王骁静, 于德爽, 李津, 等, 2017. 海洋异养硝化-好氧反硝化菌y6同步脱氮除碳特性. 中国环境科学, 37(2): 686–695 |
| 东秀珠, 蔡妙英, 2001. 常见细菌系统鉴定手册. 北京: 科学出版社, 409-412 |
| 孙振, 王秀华, 黄倢, 2013. 一种微生物絮团的生化分析及其对凡纳滨对虾免疫力的影响. 水产学报, 37(3): 473–480 |
| 孙庆花, 于德爽, 张培玉, 等, 2016a. 1株海洋异养硝化-好氧反硝化菌的分离鉴定及其脱氮特性. 环境科学, 37(2): 647–654 |
| 孙庆花, 于德爽, 张培玉, 等, 2016b. 海洋菌株y3的分离鉴定及其异养硝化-好氧反硝化特性. 环境科学, 37(3): 1089–1097 |
| 何霞, 赵彬, 吕剑, 等, 2007. 异养硝化细菌Bacillus sp. LY脱氮性能研究. 环境科学, 28(6): 1404–1408 |
| 何腾霞, 倪九派, 李振轮, 等, 2016. 1株Arthrobacter arilaitensis菌的耐冷异养硝化和好氧反硝化作用. 环境科学, 37(3): 1082–1088 |
| 余瑞兰, 聂湘平, 魏泰莉, 等, 1999. 分子氨和亚硝酸盐对鱼类的危害及其对策. 中国水产科学, 6(3): 73–77 |
| 吴琦, 李军, 李陈, 等, 2007. 一株产胶原蛋白酶短小芽孢杆菌的分离与鉴定. 中国皮革, 36(17): 16–19 |
| 吴建江, 王兆阳, 许培雅, 2013. 一株高效异养硝化菌的分离、鉴定及其氨氮去除特性. 中国环境科学, 33(7): 1309–1315 |
| 宋宇杰, 李屹, 刘玉香, 等, 2013. 碳源和氮源对异养硝化好氧反硝化菌株Y1脱氮性能的影响. 环境科学学报, 33(9): 2491–2497 |
| 张列宇, 饶本强, 熊瑛, 等, 2010. 人工湿地黑臭水体处理系统微生物脱氮机理研究. 水生生物学报, 34(2): 256–261 |
| 张庆华, 封永辉, 王娟, 等, 2011. 地衣芽孢杆菌对养殖水体氨氮、残饵降解特性研究. 水生生物学报, 35(3): 498–503 |
| 张家顺, 苏真真, 薛菲菲, 等, 2015. 2株氨氮去除菌的分离鉴定及去除率影响因素分析. 水产学报, 39(10): 1549–1557 |
| 杜怡青, 丁海涛, 赵宇华, 2011. 芽孢杆菌葡萄糖脱氢酶结构与功能研究进展. 科技通报, 27(1): 50–56 |
| 杨章武, 杨铿, 张哲, 等, 2015. 基于宏基因组测序技术分析凡纳滨对虾育苗中生物絮团细菌群落结构. 福建水产, 37(2): 91–97 |
| 辛玉峰, 曲晓华, 袁梦冬, 等, 2011. 一株异养硝化-反硝化不动杆菌的分离鉴定及脱氮活性. 微生物学报, 51(12): 1646–1654 |
| 罗国芝, 陈家捷, 于文杰, 等, 2016. 一株新型异养硝化细菌处理养殖水的效果. 环境工程学报, 10(8): 4206–4212 DOI:10.12030/j.cjee.201503070 |
| 信欣, 姚力, 鲁磊, 等, 2014. 耐高氨氮异养硝化-好氧反硝化菌TN-14的鉴定及其脱氮性能. 环境科学,(10): 3926–3932 |
| 郝红红, 陈浚, 程鳌, 等, 2013. 一株好氧反硝化菌的筛选鉴定及固定化研究. 环境科学学报, 33(11): 3017–3024 |
| 郭婧, 王娟, 宋增福, 等, 2013. 短小芽孢杆菌X93及胞外产物抑菌活性的研究. 水产学报, 37(10): 1564–1571 |
| 梁贤, 任勇翔, 杨垒, 等, 2015. 异养硝化-好氧反硝化菌YL的脱氮特性. 环境科学, 36(5): 1749–1756 |
| 董双林, 2011. 高效低碳——中国水产养殖业发展的必由之路. 水产学报, 35(10): 1595–1600 |
| 蒋鹏, 赵春贵, 杨素萍, 2014. 小分子有机碳、氮源对海洋着色菌(Marichromatium gracile)生长和去除高浓度无机三态氮的影响. 海洋与湖沼, 45(6): 1218–1224 |
| 谢凤行, 张峰峰, 周可, 等, 2012. 一株解淀粉芽胞杆菌的分离鉴定及水质净化效果的研究. 环境科学学报, 32(11): 2781–2788 |
| Buchanan R E, Gibbons N E, 1984. 伯杰细菌鉴定手册. 中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组译. 北京: 科学出版社 |
| Avnimelech Y, 1999. Carbon/nitrogen ratio as a control element in aquaculture systems. Aquaculture, 176(3-4): 227–235 DOI:10.1016/S0044-8486(99)00085-X |
| Avnimelech Y, Schryver P D, Emmereciano M et al, 2012. Biofloc Technology. Baton Rouge: The World Aquaculture Society, 37, 50, 146, 201 |
| Crab R, Avnimelech Y, Deeoirdt T, et al, 2007. Nitrogen removal techniques in aquaculture fora sustainable production. Aquaculture, 270(1-4): 1–14 DOI:10.1016/j.aquaculture.2007.05.006 |
| Forster C F, Dallas Newton J, 1980. Activated sludge on settlement some suppositions and suggestion. Water Pollution Control, 79(3): 338–351 |
| Hargreaves J A, 2006. Photosynthetic suspended-growth systems in aquaculture. Aquaculture Engineering, 34(3): 344–363 DOI:10.1016/j.aquaeng.2005.08.009 |
| Lu Lu, Tan H X, Luo G Z, et al, 2012. The effects of Bacillus subtilis on nitrogen recycling from aquaculture solid waste using heterotrophic nitrogen as simulation in sequencing batch reactors. Bioresource Technology, 124: 180–185 DOI:10.1016/j.biortech.2012.07.084 |
| Richardson D J, Wehrfritz J M, Keech A, et al, 1998. The diversity of redox proteins involved in bacterial heterotrophic nitrification andaerobic denitrification. Biochemical Society Transactions, 26(3): 401–408 DOI:10.1042/bst0260401 |
| Yang X P, Wang S M, Zhang D W, et al, 2011. Isolation and nitrogen removal characteristics of an aerobic heterotrophic nitrifying-denitrifying bacterium, Bacillus subtilis A1. Bioresource Technology, 102(2): 854–862 DOI:10.1016/j.biortech.2010.09.007 |
| Zhao P, Huang J, Wang X H, et al, 2012. The application of bioflocs technology in high-intensive, zero exchange farming systems of Marsupenaeus japonicus. Aquaculture, 354-355: 97–106 DOI:10.1016/j.aquaculture.2012.03.034 |
 2018, Vol. 49
2018, Vol. 49


