
中国海洋湖沼学会主办。
文章信息
- 叶容晖, 王春琳, 郑荣泉. 2018.
- YE Rong-Hui, WANG Chun-Lin, ZHENG Rong-Quan. 2018.
- 中华鲟(Acipenser sinensis)脑垂体的形态和ACTH细胞定位
- THE ACIPENSER SINENSIS PITUITARY: MORPHOLOGY AND ACTH CELL LOCATION
- 海洋与湖沼, 49(2): 395-402
- Oceanologia et Limnologia Sinica, 49(2): 395-402.
- http://dx.doi.org/10.11693/hyhz20171000263
-
文章历史
- 收稿日期:2017-10-15
- 收修改稿日期:2017-11-19
2. 金华职业技术学院 金华 321007;
3. 浙江师范大学 金华 321004
2. Jinhua Polytechnic, Jinhua 321007, China;
3. Zhejiang Normal University, Jinhua 321004, China
脊椎动物脑垂体位于下丘脑的底部, 形成一个突起。垂体位于颅窝中央的垂体窝, 通过一个小柄和下丘脑联系, 由脑膜覆盖, 是脊椎动物内分泌系统的核心。人脑垂体分为腺垂体和神经垂体, 二者发育上具有双重来源。脑垂体分泌的激素有助于控制生长、血压、生殖器官的发育、甲状腺和新陈代谢, 以及盐度、体温调节和止痛等方面的功能(Gorbman, 1995)。
尽管脑垂体结构和功能保守, 但是不同动物脑垂体的形态有一定的差别, 从哺乳动物, 鸟, 爬行动物, 两栖动物到鱼类各具特色。鱼类种类占了脊椎动物60%以上, 垂体的形态变化较大, 其结构和功能研究对探索脊椎动物的进化有一定的参考价值, 鱼类脑垂体能分泌多种激素, 各种内分泌细胞的组织分布也和垂体的结构对应(Ferrandino et al, 2000)。其中Pro-opiomelanocortin (POMC)基因在进化早期的脊椎动物中就出现了。POMC基因的一个共同特征是, 有一个MSH或ACTH序列位于前体的中央, 而在前体的C末端处有一个β-endorphin序列。除此以外, POMC能产生几种肽激素。每一种多肽都被包装在细胞的囊泡中, 再形成分泌小泡, 分泌到细胞外, 以应对适当的环境刺激(Harris et al, 2014)。
中华鲟(Acipenser sinensis)是我国的一级保护动物, 属于硬骨鱼纲, 软骨硬鳞亚纲, 进化上处在硬骨鱼类的早期, 在鱼类分类学和进化生物学上占有极其重要的位置。由于长江水质变化, 水利工程修建等人类活动影响, 中华鲟数量越来越少(张涛等, 2011; 班璇等, 2014)。本文以中华鲟为研究材料, 首次报道了其脑垂体的组织形态和细胞分布规律, 分析了ACTH细胞在脑垂体中的分布, 探讨了ACTH前体基因POMC的序列特征和体外表达情况, 为更好地研究和保护这一古老的珍稀物种提供基础资料。
1 材料与方法 1.1 实验动物和取材中华鲟幼鱼标本来自长江口, 体重100g左右, 打开颅腔在蝶鞍窝内取出脑垂体, 固定于不含冰醋酸的Bouin氏液, 常规石蜡包埋, 连续切片。同时取鳃、肝、中肾、肠、脾、肌肉组织, 总RNA提取按照上海生工生物工程有限公司动物组织总RNA提取试剂盒的方法进行。总RNA然后通过琼脂糖凝胶电泳检测完整性, 分光光度计测定OD260/OD280比值。
1.2 组织切片的制备和染色脑垂体组织块固定于不含冰醋酸的Bouin氏液中24h后转入70%的酒精保存。然后经85%—95%— 100%的酒精脱水, 二甲苯透明, 浸蜡2.5h, 石蜡包埋, 切片厚6μm, 用苏木精和伊红染色(HE)染色和免疫组织化学染色, H.E染色按照常规方法。ACTH抗体, SP检测试剂盒和DAB显色试剂盒均购自北京中杉金桥生物技术有限公司, 方法参考文献(陈晓武等, 2010)。简述如下, 切片脱蜡至水后以3%的H2O2灭活内源性过氧化物酶10min, 洗净后在室温下与山羊抗血清孵育10min, 再进入一抗37℃中孵育2h, 又在生物素化二抗和辣根酶标记链霉卵白素工作液中37℃下孵育30min, 最后以DAB显色, 全部过程均在pH 7.3环境和湿盒中进行, 阴性对照除一抗以PBS替代一抗, 其余步骤均同实验。蔡司Axio Imager A2m显微镜观察拍照。
1.3 ACTH前体基因的克隆和载体构建RNA反转录采用Prime Script 1st strand cDNA synthesis试剂盒(TaKaRa)的方法进行, 具体如下, 取2μg总RNA, 1μL dNTP Mixture (10mmol/L each) 1μL Oligo dT Primer (50μmol/L), 加入无RNase离心管中, 补充RNase free dH2O至10μL, PCR反应65℃ 5 min, 冰上急冷后加入以下试剂: 5×PrimeScript Buffer 4μL, RNase Inhibitor (40U/μL) 0.5μL, PrimeScript RTase (200U/μL) 1μL, 补充RNase free dH2O至20μL; 然后在PCR仪上进行反转录, 反应条件为: 42℃ 60min, 70℃ 15s, 然后冰上放置2min, –20℃保存获得的cDNA。
根据GenBank数据POMC基因序列(登录号: EU346739), 设计引物5'-ATGCTGCGTCCAGTTTGGGGC-3'和5'-TTACTGGCCCTTTTTCTCATG-3',取中华鲟垂等7个组织cDNA进行RT-PCR分析。β-actin作为参考基因, 引物参考文献为5'-TCCGTGACATC AAGGAGAAGC-3'和5'-TACCGCAGATTCCATACC C-3' (刘婷等, 2011)。获得POMC基因组织表达谱, 长度正确的PCR产物经1.5%琼脂糖凝胶电泳分离后, 切胶回收, 并将其连接到pMD19-T载体上, 测序鉴定。以验证正确的载体DNA为PCR模板, 设计引物5'-ACTCTAGAATGCTGCGTCCAGTTTG-3'和5'-GGCCTAGGTTACTGGCCCTTTTTC-3'进行过扩增, 得到添加两端有XblI和BamHI内切酶位点的编码序列, 包含了信号肽区。再使用引物5'-ACTCTAGATGTTG GGAGCATAGT-3'和5'-GGCCTAGGTTACTGGCCCT TTTTC-3'扩增出不含信号肽的编码区。经过克隆连接到pMD19-T载体。分别采用XblI和BamHI双酶切, 将酶切产物和同样双酶切的p3XFLAG-CMV-10载体分别进行连接, 克隆验证, 获得包含信号肽区spomc-p3XFLAG和不含信号肽区的nspomc-p3XFLAG的POMC表达载体。信号肽预测使用在线分析服务器SignalP 4.1 (http://www.cbs.dtu.dk/services/SignalP/)。
1.4 表达载体构建和细胞培养HeLa细胞利用DMEM培养基保持在37℃, 5% CO2培养箱进行培育, 加10% FBS及双抗[penicillin (100U/mL), and streptomycin (100μg/mL)]。spomc- p3XFLAG和nspomc- p3XFLAG的质粒转染根据说明采用Liopofectamine 2000试剂(Thermo Fisher Scientific公司)。免疫荧光染色如下, pcmv3-flag- POMC转染HeLa细胞。48h后转染的细胞被固定为3% (V/V)为10min, 甲醛和PBS Tritonx-100 0.2%, 持续15min。固定细胞被5% (V/V)山羊血清在37℃ 1h, 孵化与兔anti-FLAG抗体在37℃ 1h, 然后与FITC-labeled山羊anti-rabbit免疫球蛋白二次抗体在37℃ 1h。此外, 与DAPI染色的细胞(核标记)1min, 然后在荧光显微镜下拍照。
2 结果 2.1 脑垂体组织结构体重在100g左右的鲟垂体前后直径约5mm, 雌雄的未见明显的区别。刚取出的垂体为半透明状小体, 和间脑有一长的小柄联系。鲟脑垂体前后较长, 神经垂体呈指状突起, 插入后腺垂体中。除后腺垂体外, 还可将腺垂体分为前腺垂体和中腺垂体。中华鲟腺垂体内有纵横的垂体裂。
H.E染色显示神经垂体着色浅, 其中主要是神经纤维, 仅少量的垂体细胞, 胞核呈红色或棕红色, 直径约10μm, 少量赫令氏体呈鲜红色圆形的小体, 与垂体细胞核之间的区别在于它无细胞核。腺垂体细胞间可见丰富的毛细血管。前腺垂体位于垂体前侧, 约占总面积的1/4, 细胞间隙大, 细胞分散呈窦状, 细胞小, 分散, 嗜碱性, 着色深, 毛细血管丰富。中腺垂体细胞间隙小, 细胞密集呈条索状, 嗜酸性细胞和嗜碱性细胞区分明显。后腺垂体包围在神经垂体周围, 细胞排列比较稀疏。腺垂体中有长且分支的垂体裂, 腺垂体形成许多突起深入其中, 垂体裂周围的细胞密集, 染色深, 排列成类似上皮组织的形态(图 1a)。
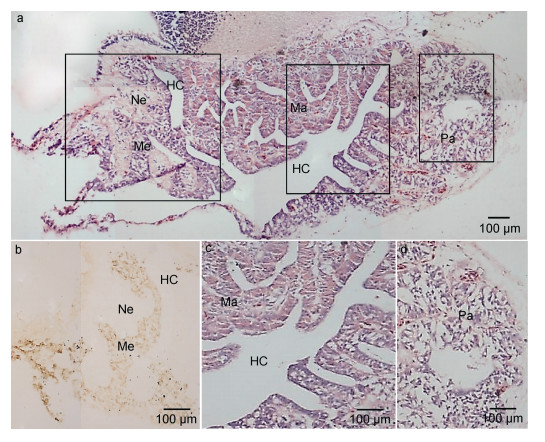 |
| 图 1 中华鲟脑垂体结构及ACTH细胞的分布 Fig. 1 The structure of pituitary from A. sinensis and cellular localization of ACTH cells 注: a.脑垂体H.E染色; b. ACTH细胞免疫组化染色; c.图a中腺垂体部分放大; d.图a中前腺垂体放大。Pa:前腺垂体; Ma:中腺垂体; Me:后腺垂体; Ne:神经垂体; HC:垂体裂 |
按照不同的染色方法可将垂体中的细胞分为三种:嗜酸性细胞、嗜碱性细胞和嫌色细胞。嗜酸性细胞主要分布在中腺垂体。H.E染色胞质为红色, 多成块分布。这些细胞比周边的细胞小, 核圆, 靠边。
嗜碱性细胞主要分布在前腺垂体和后腺垂体。分布的区域很广数量多。H.E染色时细胞质呈蓝色、核着色深、多位于细胞中央。免疫组化染色表明ACTH细胞数量不多, 分布集中, 核位于细胞中央, 这些细胞聚集在一起, 呈条索状聚集, 并且常围绕在一些毛细血管周围, 集中在后腺垂体(图 1b)。嫌色细胞所占的区域很小, 零星分布在各部分。H.E染色很浅几乎不着色, 细胞内部结构也不清晰。
2.3 中华鲟POMC序列分析和细胞定位中华鲟POMC蛋白由264个氨基酸组成, 与人、鸡、蜥蜴和斑马鱼相比较, 其中138—181区域最为保守, 为ACTH结构域。这些同源基因均有信号肽, 预测中华鲟信号肽序列为1—26氨基酸序列。另外还有2个相对保守区域(24—101和214—262)位于蛋白的氨基酸和羧基端(图 2)。
 |
| 图 2 5种脊椎动物POMC基因序列比较 Fig. 2 The alignment of 5 homologs of POMC 注:红线表示信号肽, 方框表达ACTH剪切区。双下划线表示保守区 |
RT-PCR结果表明中华鲟POMC基因主要在脑垂体中表达, 其他6种组织没有检测到(图 3a)。缺失信号肽的POMC基因主要在HeLa细胞质中表达(图 3b, 图 3c), 而带有信号肽的POMC在细胞质中很少(图 3d)。
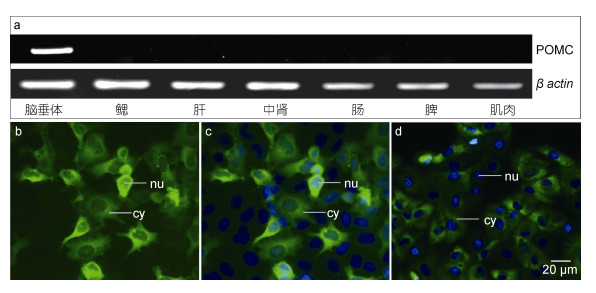 |
| 图 3 POMC基因组织表达和细胞定位 Fig. 3 The tissue expression and cellular location of POMC 注: a. POMC基因组织表达谱, 上图为795bp的中华鲟POMC基因全长, 以129bp的β-actin基因作为内标; b.不带信号肽的POMC在细胞中表达的荧光照片; c.图b经过DAPI复染; d.具有信号肽的POMC细胞表达 |
人的脑垂体由腺垂体和神经垂体两大部分组成。腺垂体又可分为远侧部、中间部和结节部, 其中远侧部和结节部合称为前叶。远侧部和中间部之间还有垂体裂。神经垂体包括漏斗(由正中隆起和漏斗柄组成)和神经部。中间部和神经部紧密联系形成后叶(陈秋生, 2002)。一般认为脑垂体仅在脊椎动物中发现, 无脊椎动物没有相应器官, 脑垂体的比较研究对了解脊椎动物的进化史有重要的价值。已经有很多动物脑垂体的研究报道, 涵盖了哺乳动物、两栖类、龟鳖类、鱼类、文昌鱼等生物(Howe, 1973; 陈秋生, 2002; 陈晓武等, 2010; Prakash, 2015)。鱼类神经垂体多与中间部混杂在一起。脑垂体由神经垂体和腺垂体组成, 腺垂体又可分为前腺垂体、中腺垂体和后腺垂体。在此基础上, 有学者将硬骨鱼类脑垂体归纳为两种类型:扁平型和细长型(Goos, 1982)。国内也有学者将鱼类脑垂体分为前后型和背腹型两类(楼允东, 1980)。各种硬骨鱼类脑垂体的组织学研究已经有较多的报道。比较七鳃鳗、鲨、河鲈、鳗鲡、鲤鱼、西伯利亚鲟(Pelissero et al, 1988)和中华鲟, 结果表明从原口纲到硬骨鱼脑垂体基本组成类似, 但是各部分的位置和形态差别较大。七鳃鳗神经垂体和腺垂体相对独立, 神经垂体和腺垂体均细长。而鱼类, 包括中华鲟的腺垂体和神经垂体结合紧密, 神经垂体一般都交错插入腺垂体, 形成指状凸起。七鳃鳗和鲨鱼神经垂体体积相对比较小, 垂体腔明显, 而多数硬骨鱼垂体腔不明显。可见, 垂体的形状不仅和物种相关, 也与动物体型有关系, 如鳗鲡垂体细长, 其他鱼则比较圆。鱼类神经垂体相对高等动物比例较小。西伯利亚鲟和中华鲟脑垂体形状最接近, 前者其分部采用类似人脑垂体的结构命名方法(Pelissero et al, 1988)。我们发现中华鲟的腺垂体可以比较明显地分为前、中和后腺垂体三部分。因此我们按照其他鱼类脑垂体的划分方法进行命名, 可能更符合实际情况(图 4)。
 |
| 图 4 脑垂体形态比较 Fig. 4 The pituitary of fishes a.人; b.鳖; c.七鳃鳗; d.鲨; e.河鲈; f.鳗鲡; g.香鱼; h.黄狮鱼; i.西伯利亚鲟; j.中华鲟。Pd:远侧部; Pt:中间部; Pt:结节部; Ic:垂体裂; Hl:垂体腔; In:漏斗; Ma:中腺垂体; Me:后腺垂体; Ne:神经垂体; Pa:前腺垂体; Vl:腹叶; Pi:中间部 |
脑垂体作为内分泌系统的核心, 其内分泌细胞中激素可分为四类, 每一类在分子结构上都相关并且可能是有同一祖先通过基因复制和分化而来。第一类是来自神经垂体的催产素和加压素, 属于肽类激素。第二类包括促肾上腺激素和黑色素细胞刺激素。第三类包括生长激素和催乳激素, 以及人的胎盘型催乳素。第四类包括黄体生成素和卵泡生成素, 两者都属于糖蛋白家族(Wallis, 1975; Kawauchi, 1989)。
鱼类POMC基因序列的研究工作最早是在大马哈鱼(Oncorhynchus keta)中报道(Kitahara et al, 1988)。近年来又有一些鱼类的POMC基因的序列报道, 如海七鳃鳗(Petromyzon marinus) (Heinig et al, 1995)、鲤鱼(Cyprinus carpio) (Arends et al, 1998)、白斑角鲨(Squalus acanthias) (Amemiya et al, 1999)、三文鱼(Vallarino et al, 1989)、河鲈(Follenius et al, 1976)、虹鳟(Suzuki et al, 1997)、莫桑比克罗非鱼(Oreochromis mossambicus) (Lee et al, 1999)、美洲鳗(Anguilla rostrata) (Alrubaian et al, 2003)、欧洲鲈(Dicentrarchus labrax) (Varsamos et al, 2003)等。在鲟鱼中, 匙吻鲟(Polyodon spathula) (Danielson et al, 1999), 高首鲟(Acipenser transmontanus) (Alrubaian et al, 1999)的POMC的研究工作亦有报道。在多数鱼类中发现POMCa和POMCb两个亚型, 推测这可能与鱼类染色体进化过程中出现了基因组加倍有关, 而在真骨鱼类中, 鲤鱼、大西洋鲑及褐牙鲆也都有2种亚型的POMC基因, 这些不同亚型的POMC基因在功能上是否存在明确分工, 值得在今后工作中更进一步探讨(曹宏等, 2011)。不同物种的POMCa的同源性要高于和POMCb的同源性, 本研究以中华鲟POMCa为研究对象, 表明POMC在脑组织的表达量最高, 脑组织是该基因发挥功能的重要区域, 该结果与其他鱼类的结果相一致(Pritchard et al, 2002)。
信号肽也称为信号序列、靶信号、定位信号和引导肽等。一般包括16—30个氨基酸的短序列, 一般位于蛋白的氨基端, 用于决定蛋白的分泌途径。信号肽核心序列包括一个5—16个氨基酸的疏水区, 可以形成一个alpha-helix结构, 称为H区(h-region)。信号肽具有很大的多样性, 但是许多原核和真核细胞中不同物种的信号肽能进行互换使用, 尽管其效率可能不同, 说明信号肽的功能还是具有保守性, 信号肽序列能被信号识别颗粒(SRP)所识别, 信号识别颗粒将核糖体携带至内质网上, 蛋白质再开始合成。在信号肽的引导下, 新合成的蛋白质进入内质网腔, 最终分泌到细胞外, 而信号肽序列则在信号肽酶的作用下被切除(Kuhnen et al, 2016; Raffan et al, 2016)。在人体内, POMC信号肽区一个arginine被glycine和2型糖尿病、高血压和冠心病密切相关。原因是信号肽突变的POMC在一些脑细胞中缺失(Mencarelli et al, 2012)。信号肽的突变还会导致POMC不能定位到内质网上, 导致肥胖(Miraglia et al, 2001)。可见, 信号肽不仅起定位作用, 同时还影响基因的表达和功能。本文通过体外实验也证明信号肽对POMC的表达和有显著影响, 提示可以利用信号肽对POMC基因的表达和定位进行调节, 从而调节机体的生理状态。但是对中华鲟POMC信号肽还有更多工作可以开展, 包括氨基酸位点变异、核心区域的分析及活体内功能等。
4 结论中华鲟是我国的一级保护动物, 在进化上处在硬骨鱼类的早期, 在鱼类分类学和进化生物学上占有极其重要的位置。如今由于长江环境变化导致中华鲟数量越来越少。脑垂体是脊椎动物内分泌的核心器官, 对动物生理活动起核心作用, 其结构和功能研究对探索脊椎动物的进化有重要参考价值。组织学研究表明, 中华鲟的神经垂体较小, 腺垂体可分为前、中和后腺垂体三部分, 神经垂体形成分支插入后腺垂体。中华鲟垂体还有一个特点是有分支的垂体裂。围绕垂体裂的细胞呈上皮状。以垂体内特异表达的POMC基因为代表, 采用分子和细胞学技术证明, 中华鲟脑垂体ACTH细胞主要分布于后腺垂体, 与西伯利亚鲟有一定区别。POMC基因通过剪切形成不同类型的短肽激素, 包括ACTH。其中信号肽对POMC的表达和成熟非常重要, 缺失信号肽的POMC聚集在细胞质中。
| 刘婷, 章龙珍, 张涛, 等, 2011. 中华鲟神经内分泌多肽7B2基因克隆及组织特异性表达. 海洋渔业, 33(2): 121–130 |
| 张涛, 庄平, 章龙珍, 等, 2011. 长江口中华鲟自然保护区底层鱼类的群落结构特征. 生态学报, 31(6): 1687–1694 |
| 陈秋生, 2002. 兽医比较组织学. |
| 陈晓武, 刘仪, 毕燕会, 等, 2010. 中华鳖脑垂体的显微与超微结构观察. 水产学报, 34(8): 1210–1218 |
| 班璇, 肖飞., 2014. 葛洲坝下游河势调整工程对中华鲟产卵场的影响. 水利学报, 45(1): 58–64 |
| 曹宏, 李创举, 危起伟, 等, 2011. 中华鲟阿黑皮素原cDNA序列克隆及其序列分析. 水生生物学报, 35(5): 776–782 |
| 楼允东, 1980. 组织胚胎学. 2版. 北京: 中国农业出版社, |
| Alrubaian J, Danielson P, Fitzpatrick M, et al, 1999. Cloning of a second proopiomelanocortin cDNA from the pituitary of the sturgeon, Acipenser transmontanus. Peptides, 20(4): 431–436 DOI:10.1016/S0196-9781(99)00021-2 |
| Alrubaian J, Sollars C, Danielson P B, et al, 2003. Evaluating the radiation of the POMC gene in teleosts:characterization of American eel POMC. General and Comparative Endocrinology, 132(3): 384–390 DOI:10.1016/S0016-6480(03)00119-9 |
| Amemiya Y, Takahashi A, Suzuki N, et al, 1999. A newly characterized melanotropin in proopiomelanocortin in pituitaries of an elasmobranch, Squalus acanthias. General and Comparative Endocrinology, 114(3): 387–395 DOI:10.1006/gcen.1999.7256 |
| Arends R J, Vermeer H, Martens G J, et al, 1998. Cloning and expression of two proopiomelanocortin mRNAs in the common carp (Cyprinus carpio L. ). Molecular and Cellular Endocrinology, 143(1-2): 23–31 DOI:10.1016/S0303-7207(98)00139-7 |
| Danielson P B, Alrubaian J, Muller M, et al, 1999. Duplication of the POMC gene in the paddlefish (Polyodon spathula):analysis of gamma-MSH, ACTH, and beta-endorphin regions of ray-finned fish POMC. General and Comparative Endocrinology, 116(2): 164–177 DOI:10.1006/gcen.1999.7353 |
| Ferrandino I, Pica A, Grimaldi M C., 2000. Immunohistochemical detection of ACTH and MSH cells in the hypophysis of the hermaphroditic teleost, Diplodus sargus. European Journal of Histochemistry Ejh, 44(4): 397–406 |
| Follenius E, Dubois M P., 1976. Cytology and immunocytology of the organization of the intermediate lobe of the perch (Perca fluviatilis L.) pituitary. General & Comparative Endocrinology, 30(4): 462–471 |
| Goos Th H J, 1982. Proceedings of the International Symposium on Reproductive Physiology of Fish. Wageningen: Centre for Agricultural Pub. and Documentation |
| Gorbman A., 1995. Olfactory origins and evolution of the brain-pituitary endocrine system:facts and speculation. General and Comparative Endocrinology, 97(2): 171–178 DOI:10.1006/gcen.1995.1016 |
| Harris R M, Dijkstra P D, Hofmann H A., 2014. Complex structural and regulatory evolution of the pro-opiomelanocortin gene family. General and Comparative Endocrinology, 195: 107–115 DOI:10.1016/j.ygcen.2013.10.007 |
| Heinig J A, Keeley F W, Robson P, et al, 1995. The appearance of proopiomelanocortin early in vertebrate evolution:cloning and sequencing of POMC from a Lamprey pituitary cDNA library. General and Comparative Endocrinology, 99(2): 137–144 DOI:10.1006/gcen.1995.1094 |
| Howe A., 1973. The mammalian pars intermedia:a review of its structure and function. Journal of Endocrinology, 59(2): 385–409 DOI:10.1677/joe.0.0590385 |
| Kawauchi H., 1989. Evolutionary aspects of pituitary hormones. Kitasato Archives of Experimental Medicine, 62(4): 139–155 |
| Kitahara N, Nishizawa T, Iida K, et al, 1988. Absence of a γ-melanocyte-stimulating hormone sequence in proopiomelanocortin mRNA of chum salmon Oncorhynchus keta. Comparative Biochemistry and Physiology Part B:Comparative Biochemistry, 91(2): 365–370 DOI:10.1016/0305-0491(88)90155-1 |
| Kuhnen P, Clément K, Wiegand S, et al, 2016. Proopiomelanocortin deficiency treated with a melanocortin-4 receptor agonist. New England Journal of Medicine, 375(3): 240–246 DOI:10.1056/NEJMoa1512693 |
| Lee J, Danielson P, Sollars C, et al, 1999. Cloning of a neoteleost (Oreochromis mossambicus) pro-opiomelanocortin (POMC) cDNA reveals a deletion of the gamma-melanotropin region and most of the joining peptide region:implications for POMC processing. Peptides, 20(12): 1391–1399 DOI:10.1016/S0196-9781(99)00148-5 |
| Mencarelli M, Zulian A, Cancello R, et al, 2012. A novel missense mutation in the signal peptide of the human POMC gene:a possible additional link between early-onset type 2 diabetes and obesity. European Journal of Human Genetics, 20(12): 1290–1294 DOI:10.1038/ejhg.2012.103 |
| Miraglia D G E, Cirillo G, Santoro N, et al, 2001. Molecular screening of the proopiomelanocortin (POMC) gene in Italian obese children:report of three new mutations. International Journal of Obesity, 25(1): 61–67 DOI:10.1038/sj.ijo.0801485 |
| Pelissero C, Nunez-Rodriguez J, Le Menn F, et al, 1988. Immunohistochemical investigation of the pituitary of the sturgeon (Acipenser baeri, Chondrostei). Fish Physiology and Biochemistry, 5(3): 109–119 DOI:10.1007/BF01875699 |
| Prakash A., 2015. Studies on the functional morphology of the endocrine glands in some fresh water fishes. Cybernetics & Systems, 38(7): 667–693 |
| Pritchard L E, Turnbull A V, White A., 2002. Pro-opiomelanocortin processing in the hypothalamus:impact on melanocortin signalling and obesity. Journal of Endocrinology, 172(3): 411–421 DOI:10.1677/joe.0.1720411 |
| Raffan E, Dennis R J, O'Donovan C J, et al, 2016. A deletion in the canine POMC gene is associated with weight and appetite in obesity-prone Labrador retriever dogs. Cell Metabolism, 23(5): 893–900 DOI:10.1016/j.cmet.2016.04.012 |
| Suzuki M, Bennett P, Levy A, et al, 1997. Expression of MCH and POMC genes in rainbow trout (Oncorhynchus mykiss) during ontogeny and in response to early physiological challenges. General and Comparative Endocrinology, 107(3): 341–350 DOI:10.1006/gcen.1997.6936 |
| Vallarino M, Delbende C, Bunel D T, et al, 1989. Proopiomelanocortin (POMC)-related peptides in the brain of the rainbow trout, Salmo gairdneri. Peptides, 10(6): 1223–1230 DOI:10.1016/0196-9781(89)90016-8 |
| Varsamos S, Bonga B S W, Flik G, et al, 2003. Cloning of a proopiomelanocortin cDNA from the pituitary gland of the sea bass (Dicentrarchus labrax) and assessment of mRNA expression in different tissues by means of real-time PCR. Journal of Endocrinology, 176(3): 405–414 DOI:10.1677/joe.0.1760405 |
| Wallis M., 1975. The molecular evolution of pituitary hormones. Biological Reviews, 50(1): 35–98 DOI:10.1111/brv.1975.50.issue-1 |
 2018, Vol. 49
2018, Vol. 49


