
中国海洋湖沼学会主办。
文章信息
- 梁亚芳, 史雨红, 苗亮, 陈炯. 2018.
- LIANG Ya-Fang, SHI Yu-Hong, MIAO Liang, CHEN Jiong. 2018.
- 大弹涂鱼(Boleophthalmus pectinirostris) Gal-8L基因序列及其细菌凝集活性的鉴定
- Gal-8L OF MUDSKIPPER BOLEOPHTHALMUS PECTINIROSTRIS: CHARACTERIZATION OF THE SEQUENCE AND BACTERIAL AGGLUTINATION ACTIVITY
- 海洋与湖沼, 49(2): 413-421
- Oceanologia et Limnologia Sinica, 49(2): 413-421.
- http://dx.doi.org/10.11693/hyhz20171000278
-
文章历史
- 收稿日期:2017-10-31
- 收修改稿日期:2017-11-26
凝集素(lectin)可特异识别并结合蛋白或脂质上糖复合物的蛋白质或糖蛋白, 包括C型凝集素、P型凝集素、I型凝集素、五聚体凝集素和半乳糖凝集素(Galectin, Gal)(原称作S型凝集素)五个家族(Kaltner et al, 2001)。半乳糖凝集素为可溶性非阳离子依赖型凝集素, 存在于胞内、细胞核内或分泌于胞外(Unajak et al, 2015)。这类凝集素进化保守, 组织分布广, 具有显著的发育调节性, 并且在特定组织中含量丰富。其参与细胞粘附、生长、凋亡及免疫反应等多种生物学过程(Chen et al, 2014)。尤其是在动物免疫组织中作为模式识别受体(pattern recognition receptor, PRR), 能识别潜在致病菌表面的病原体相关分子模式(pathogen-associated molecular patterns, PAMPs), 从而调控诱发先天免疫反应的作用(Cerliani et al, 2011)。半乳糖凝集素含有由130—150个氨基酸残基组成的高度保守的糖识别结构域(carbohydrate recognition domain, CRD), 其中具有两个保守的基序能特异性识别并结合β-半乳糖苷糖类(Hirabayashi et al, 1992)。根据CRD区的组成可将其分为原型、嵌合型和串联重复型3类。半乳糖凝集素-8(Galectin-8, Gal-8)属于串联重复型, 包括两个约140个氨基酸组成的CRD区, 该结构中包括两个保守基序HXNPR和WGXEE(X代表任意氨基酸)。两个CRD区之间通过一个长度不等的连接肽连接, 其长度影响Gal-8与糖基配体的结合(Zick et al, 2002)。Gal-8没有信号肽, 但属于分泌型蛋白, 甚至存在于一些细胞表面, 目前其分泌途径尚未明确(Zick et al, 2002)。
研究表明, 哺乳动物Gal-8通过和糖基结合参与细胞和细胞以及细胞与胞外基质之间的相互识别, 从而调节细胞的黏附、生长和凋亡(Hadari et al, 2000; Zick et al, 2002; Cueni et al, 2009)。此外, Gal-8可通过破坏细胞膜的完整性杀死具有特定血清型抗原特征的细菌(Stowell et al, 2010)。也可以通过招募含有鼠伤寒沙门氏菌(Salmonella typhimurium)、单核细胞增生李斯特氏菌(Listeria monocytogenes)或福氏志贺氏菌(Shigella flexneri)的囊泡, 从而引导自噬过程, 最终限制病原菌在宿主体内增殖(Thurston et al, 2012; Chen et al, 2014)。目前哺乳动物Gal-8已有较系统的研究, 而鱼类中Gal-8的功能及作用机制鲜见研究报道。
大弹涂鱼(Boleophthalmus pectinirostris)属鲈形目、弹涂鱼科、大弹涂鱼属。为暖水广温广盐性的两栖鱼类, 是一种具有广阔市场前景的滩涂养殖经济鱼类(You et al, 2014)。大弹涂鱼栖息在富含多样微生物种群的潮间带泥滩, 但其却很少感染严重的细菌性疾病。因此, 对大弹涂鱼免疫相关基因进行研究十分必要, 可为其抗病品种选育奠定理论基础。本研究旨在确定大弹涂鱼Gal-8样基因(BpGal-8L)序列特征; 分析其mRNA组织表达情况以及与迟缓爱德华氏菌(Edwardsiella tarda)感染相关性; 采用原核表达获得BpGal-8L蛋白N端和C端CRD区重组蛋白(BpGal-8L-N和BpGal-8L-C), 进一步鉴定其细菌凝集活性和糖基结合特异性, 为BpGal-8L基因后续功能研究奠定基础。
1 材料与方法 1.1 实验材料与试剂健康大弹涂鱼购自浙江省宁波市路林海产品市场。大肠杆菌(Escherichia coli)TG1和BL21 pLys E菌株、原核表达载体pET-28a和pET-30a等由实验室保存。RNAiso Reagent、pMD19-T Simple Vector、AMV逆转录酶、Ex Taq DNA聚合酶、限制性内切酶EcoR I、Xho I和SYBR Premix Ex Taq试剂盒等购自大连TaKaRa公司; DNA分子量标准GeneRulerTM 1kb DNA Marker、卡那霉素(kanamycin)、异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside, IPTG)、低分子量蛋白Marker、半乳糖、葡萄糖、甘露糖、岩藻糖、乙酰氨基葡糖、乳糖和脂多糖购自生工生物工程股份有限公司(上海); 肽聚糖购自Sigma公司; Gel ExtractionKit购自Omega公司。HisTrapTM FF购自GE公司; Bio-Gel P6购自Bio-rad公司。引物合成及序列测序工作由华大基因公司完成。
1.2 实验方法 1.2.1 序列获得及分析采用Illumina HiSeq 2000测序平台对大弹涂鱼单核巨噬细胞进行转录组测序, 从中获得BpGal-8L序列, 并采用常规PCR方法进行扩增和测序验证。采用SignalP 4.1在线程序(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽序列; 采用SMART软件(http://smart.embl-heidelberg.de/)预测蛋白结构; 采用ClustalW在线程序(http://clustalw.ddbj.nig.ac.jp/)进行多重序列比对; 采用MEGA6.0软件构建系统进化树(Tamura et al, 2013)。多序列比对和系统进化树构建所用序列见表 1。
| 登录号 | 物种 | 蛋白 | |
| 拉丁名 | 英文名 | ||
| MF461413 | Boleophthalmus pectinirostris | mudskipper | Gal-8L |
| XM_008305263 | Stegastes partitus | bicolor damselfish | Gal-8L |
| XM_004566490 | Maylandia zebra | zebra mbuna | Gal-8L |
| XM_006800615 | Neolamprologus brichardi | cichlid | Gal-8L |
| XM_005922397 | Haplochromis burtoni | African cichlid | Gal-8L |
| XM_010738049 | Larimichthys crocea | large yellow croaker | Gal-8L |
| XM_003446206 | Oreochromis niloticus | Nile tilapia | Gal-8L |
| XM_005815106 | Xiphophorus maculatus | platyfish | Gal-8L |
| XM_020700761 | Oryzias latipes | Japanese ricefish | Gal-8L |
| XM_014151154 | Salmo salar | Atlantic salmon | Gal-8L |
| XM_002665254 | Danio rerio | zebrafish | Gal-8L |
| XM_014011381 | Austrofundulus limnaeus | killifish | Gal-8L |
| KP663372 | Oreochromis niloticus | Nile tilapia | Gal-8 |
| XM_004084834 | Oryzias latipes | Japanese ricefish | Gal-8 |
| XM_003977467 | Takifugu rubripes | tiger pufferfish | Gal-8 |
| JT412922 | Ictalurus punctatus | catfish | Gal-8 |
| XM_003200667 | Danio rerio | zebrafish | Gal-8 |
| XM_019064425 | Cyprinus carpio | common carp | Gal-8 |
| NM_001140306 | Salmo salar | Atlantic salmon | Gal-8 |
| NM_201545 | Homo sapiens | human | Gal-8 |
| NM_001291055 | Mus musculus | mouse | Gal-8 |
| NM_001010843 | Gallus gallus | chicken | Gal-8 |
| KB375612 | Columba livia | pigeon | Gal-8 |
| NM_001266745 | Macaca mulatta | rhesus monkey | Gal-8 |
| NM_001142086 | Xenopus tropicalis | African clawed frog | Gal-8 |
| XM_006258187 | Alligator mississippiensis | American alligator | Gal-8 |
| GAEP01000629 | Micrurus fulvius | eastern coral snake | Gal-8 |
| AZIM01000769 | Ophiophagus hannah | king cobra | Gal-8 |
| NM001142535 | Homo sapiens | human | Gal-12 |
定量PCR方法参考文献(Chen et al, 2016)。简述如下:大弹涂鱼在实验室进行适应性养殖, 水温维持在24—26℃, 静脉采血处理。取健康大弹涂鱼肝、脾、肾、鳃、肠、肌肉和皮肤组织进行qPCR的检测。大弹涂鱼各组织总RNA抽提采用RNAiso试剂, 经过DNase I (RNase-free)处理后, 取1μg处理后的RNA作为模板, 以Random primers (N)6为引物, 采用RNA PCR kit (AMV) Ver.3.0 (TaKaRa)合成第一链cDNA。根据已获得的BpGal-8L基因cDNA序列设计检测引物BpGal-8L (+): 5′-CCCTCGCATAAAGTCAACC G-3′和BpGal-8L (-): 5′-ACCCATTCACTGCCACCT TA-3′; 选择大弹涂鱼看家基因18S rRNA作为内参, 根据其cDNA序列设计引物Bp18S rRNA (+): 5′-GGCCGTTCTT AGTTGGTGGA-3′和Bp18S rRNA (-): 5′-CCCGGACATCTAAGGGCA TC-3′。
把迟缓爱德华氏菌接种到普通营养肉汤培养基中, 37℃恒温摇床过夜培养, 按照1︰100比例继续扩大培养, 收集菌体, 洗涤、计数并用生理盐水将菌体稀释至1.0×105 cfu/mL的终浓度。随机选取健康大弹涂鱼分成实验组和对照组, 各20尾, 实验组大弹涂鱼腹腔注射菌悬液0.1mL/尾, 对照组注射等量无菌生理盐水。注射后分别在4、8、12、24hpi (hours post infection)时收集肝、脾组织。实验结果采用SPSS单因素方差分析(One-way ANOVA)进行统计, P < 0.05为显著差异。
1.2.3 BpGal-8L-N和BpGal-8L-C的原核表达、纯化及复性根据BpGal-8L基因cDNA序列设计N端CRD区原核表达引物Bp-Gal-8L-N(+) (5′-CGAATTC TCTGTAGCCAATGCG AAACAC-3′)和Bp-Gal8L-N(-) (5′-CCTCGAGACCTGATTCTGAGTATATTGCT-3′)以及C端CRD区原核表达引物Bp-Gal-8L-C(+) (5′-CG AATTCTCTGTAGCCAATGCGAAACAC-3′)和Bp- Gal8L-C(-) (5′-CCTCGAGTCACCACACTTTGACAT CGATG-3′), 其中下划线表示限制性内切酶EcoR I和Xho I的酶切位点, 斜体字母为保护碱基。PCR扩增产物经EcoR I和Xho I双酶切后, 插入到经相同内切酶酶切的原核表达载体pET28a或pET30a中, 获得重组质粒pET28a-BpGal-8L-N和pET30a-BpGal-8L-C。重组质粒经测序验证无误后转化大肠杆菌BL21 pLys E菌株, 经IPTG诱导表达, 12% SDS-PAGE检测, 观察目的蛋白表达情况。
大量诱导获得的菌体进行超声波破碎, 随后采用不同缓冲液进行洗涤, 最大可能洗涤包涵体。再用重溶缓冲液(0.1mol/L Tris-HCl, 0.5mol/L NaCl, 10mmol/L imidazole and 8mol/L urea, pH 7.5)溶解包涵体, 随后采用HisTrapTM FF进行纯化。纯化后采用分子筛尿素梯度复性。最后用Bio-Gel P-6层析柱脱盐后, 冷冻干燥备用(Zhang et al, 2015)。
1.2.4 细菌凝集实验采用玻片凝集法测定BpGal-8L-N和BpGal-8L-C重组蛋白凝集细菌的活性(Zhang et al, 2009; Zhang et al, 2015)。5种革兰氏阴性菌:嗜水气单胞菌(Aeromonas hydrophila)、大肠杆菌(E. coli)、鳗弧菌(Vibrio anguillarum)、副溶血弧菌(V. parahaemolyticus)和迟缓爱德华氏菌以及2种革兰氏阳性菌单核细胞增生李斯特氏菌(L. monocytogenes)和金黄色葡萄球菌(Staphylococcus aureus)培养过夜。6000×g, 5min, 离心收集对数期细菌, 取细菌(2×108 cell/mL) 25μL与重组蛋白(200μg/mL) 25μL在洁净的载玻片上孵育1h。用TBS (10mmol/L Tris-HCl, pH 7.5; 150mmol/L NaCl)缓冲液, 牛血清白蛋白(Bovine serum albumin, BSA)作为对照。用Olympus BH-2显微镜分析细菌的凝集现象。重组蛋白梯度稀释(50—200μg/mL)后分别与细菌孵育观察凝集现象确定最小凝集浓度。
1.2.5 通过抑制凝集实验测定糖结合特性分别选取5种单糖(D-葡萄糖、D-半乳糖、D-甘露糖、L-岩藻糖、N-乙酰葡糖胺)、双糖(乳糖)以及2种多糖(肽聚糖、脂多糖)梯度稀释, 各取25μL分别与重组蛋白BpGal-8L-C (100μg/mL, 25μL)在室温下孵育1h。显微镜分析细菌的凝集现象是否被抑制, 从而确定糖的最小抑制凝集浓度。
2 结果 2.1 BpGal-8L基因cDNA序列分析BpGal-8L基因cDNA序列共由1578个核苷酸组成, 包括一个由891个核苷酸组成的完整开放阅读框(ORF), 编码一个由297个氨基酸组成的蛋白, 其分子量约为36.8kDa, 等电点为6.83。BpGal-8L无信号肽序列。通常Gal的CRD区具有典型β-半乳糖苷糖类结合基序(HXNPR和WGXEE, X代表任意氨基酸)。多重序列比对显示, BpGal-8L具有串联重复型半乳糖凝集素类似的典型结构特征, N端和C端两个CRD区之间同一性为37.9%, C端CRD区具有两个典型的β-半乳糖苷糖类结合基序, 但N端CRD区不具有“ HXNPR”基序(图 1)。两个CRD之间的连接肽序列长14aa, 是Gal-8蛋白连接肽中较短的一类(图 1)。
 |
| 图 1 大弹涂鱼和其他动物Gal-8和Gal-8L氨基酸序列多重比对 Fig. 1 Multiple alignment of Gal-8 and Gal-8L amino acid sequences of mudskipper and other animals 注: BpGal-8L: Boleophthalmus pectinirostris Gal-8L, OnGal-8L: Oreochromis niloticus Gal-8L, DrGal-8L: Danio rerio Gal-8L, SsGal-8L: Salmo salar Gal-8, OnGal-8: Oreochromis niloticus Gal-8, DrGal-8: Danio rerio Gal-8, SsGal-8: Salmo salar Gal-8, HsGal-8: Homo sapiens Gal-8;序列上方标示的CRD1和CRD2为Gal-8蛋白两个串联的糖识别结构域, 其中多序列比对下方的“#”表示“HXNPR”, “+”表示“WGXEE”, 均为保守的β-半乳糖苷糖类结合基序 |
系统进化树分析表明, Gal-8分子进化与物种进化相一致。鱼类Gal-8这一簇产生两个分支: Gal-8和Gal-8L, BpGal-8L归属于鱼类Gal-8L这一簇(图 2)。上述表明, BpGal-8L可能为Gal8的一种亚型。
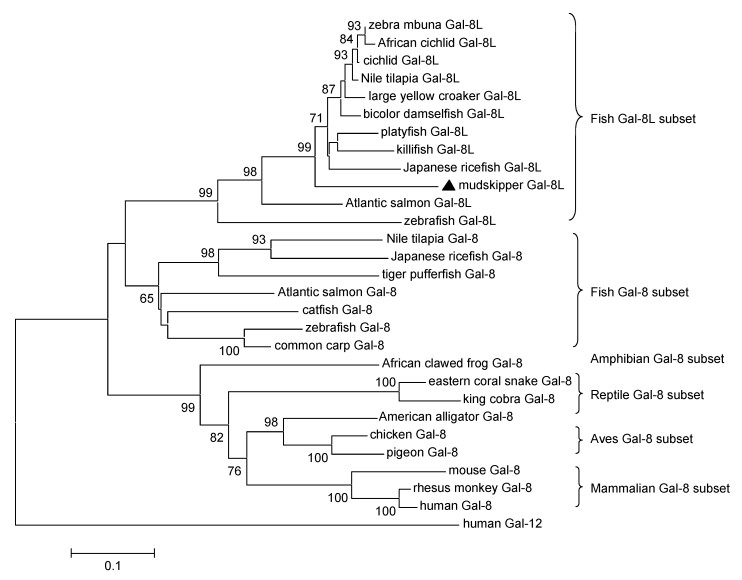 |
| 图 2 基于NJ法构建的大弹涂鱼和其他物种Gal-8系统进化树 Fig. 2 Phylogenetic tree of amino acid sequences of Gal-8 and other animals using neighbor-joining method |
经qPCR分析表明所检测的健康组织肝、脾、肾、鳃、肠、肌肉和皮肤中, BpGal-8L基因mRNA均有表达, 其中肾中表达量最高, 鳃和脾组织中表达次之(图 3)。
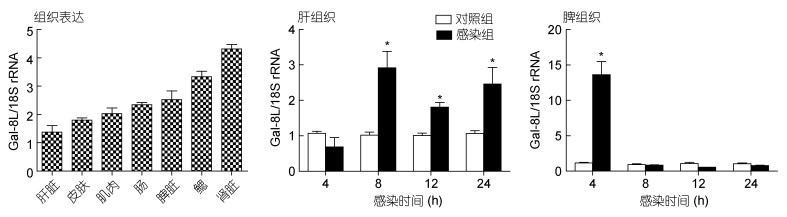 |
| 图 3 qPCR分析BpGal-8L基因mRNA在健康组织及迟缓爱德华氏菌感染后肝和脾组织中的表达特征 Fig. 3 qPCR analysis of BpGal-8L mRNA expression patterns of healthy and E. tarda-infected livers and spleens 注: n=4; *: P < 0.05 |
qPCR分析迟缓爱德华氏菌感染大弹涂鱼后BpGal-8L基因mRNA表达变化。结果显示, 肝组织中, 感染8hpi时BpGal-8L基因mRNA表达量为对照组的2.9倍, 并达到峰值, 随后表达量仍趋于上调, 感染12和24hpi时, 其表达量分别为对照组1.7倍和2.3倍(图 3)。脾组织中, 感染4hpi时BpGal-8L基因mRNA表达量急剧上调(为对照组11.7倍), 随后下降至对照组中该基因的表达水平(图 3)。
2.3 BpGal-8L-N和BpGal-8L-C重组蛋白的原核表达及纯化重组质粒pET28a-BpGal-8L-N和pET30a-BpGal- 8L-C经测序验证无误后转至大肠杆菌BL21 pLys E, 加入诱导剂IPTG后高效表达。菌体总蛋白经SDS-PAGE分离后, 检测分别出现一条高表达蛋白条带, BpGal-8L-N重组蛋白的分子量约为25.5kDa, 而预测理论重组蛋白分子量22.1kDa (BpGal-8L-N 17.2kDa +4.9kDa His-tag融合蛋白)。BpGal-8L-C重组蛋白的分子量约为24kDa, 而理论重组蛋白分子量为21.5kDa (BpGal-8L-C 15.8kDa + His-tag融合蛋白5.7kDa) (图 4)。这种偏差可能是由于His-tag中的碱性氨基酸的作用造成蛋白在SDS-PAGE中迁移变慢(唐威华等, 2000)。经过纯化和复性后BpGal-8L-N和BpGal-8L-C重组蛋白的纯度分别为 > 95%和 > 90%, 可用于后续实验。
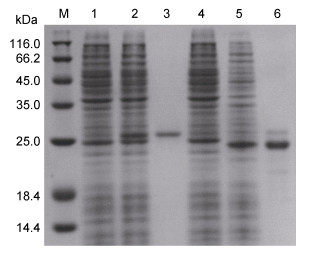 |
| 图 4 BpGal-8L-N和BpGal-8L-C重组蛋白的原核表达及纯化 Fig. 4 Prokaryotic expressions and purifications of BpGal-8L-N and BpGal-8LC recombinant proteins |
本研究检测了BpGal-8L-N和BpGal-8L-C重组蛋白对嗜水气单胞菌、大肠杆菌、鳗弧菌、副溶血弧菌、迟缓爱德华氏菌、单核细胞增生李斯特氏菌和金黄色葡萄球菌的凝集活性。实验结果显示BpGal-8L-N对7种细菌均无凝集作用, 而BpGal-8L-C对7种细菌均有凝集作用(图 5)。BpGal-8L-C重组蛋白最小凝集浓度分别为120μg/mL (嗜水气单胞菌, 大肠杆菌, 鳗弧菌和副溶血弧菌)以及100μg/mL (迟缓爱德华氏菌, 单核细胞增生李斯特氏菌和金黄色葡萄球菌)。糖抑制凝集实验中, 5种单糖及肽聚糖均不能抑制迟缓爱德华氏菌和金黄色葡萄球菌的凝集, 而乳糖和脂多糖则能抑制其凝集, 其最小抑制凝集浓度结果如表 2。
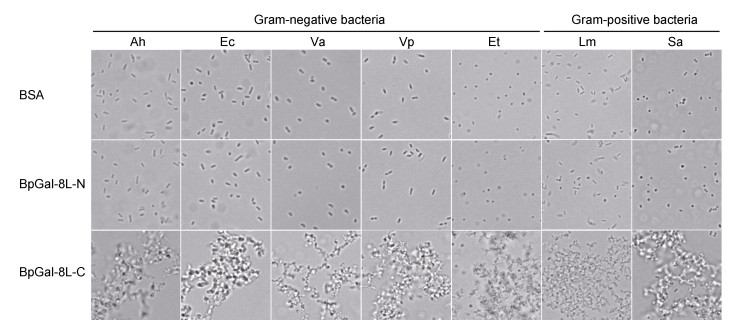 |
| 图 5 BpGal-8L-N和BpGal-8L-C重组蛋白的细菌凝集活性 Fig. 5 The agglutinating activity of BpGal-8L-N and BpGal-8L-C recombinant proteins against bacteria 注: Ah:嗜水气单胞菌, Ec:大肠杆菌, Va:鳗弧菌, Vp:副溶血弧菌, Et:迟缓爱德华氏菌, Lm:单核细胞增生李斯特氏菌, Sa:金黄色葡萄球菌 |
| 糖类 | 最小抑制凝集浓度(mg/mL) | |
| 迟缓爱德华氏菌 E. tarda |
金黄色葡萄球菌 S. aureus |
|
| D-葡萄糖 | NIa | NIa |
| D-半乳糖 | NIa | NIa |
| D-甘露糖 | NIa | NIa |
| L-岩藻糖 | NIa | NIa |
| N-乙酰葡糖氨 | NIa | NIa |
| 乳糖 | 6.25 | 12.5 |
| 脂多糖 | 1.25 | 2.5 |
| 肽聚糖 | NIb | Nib |
| 注: NIa:测试的最高浓度为100mg/mL时, 不抑制细菌凝集; Nib:测试的最高浓度为8mg/mL时, 不抑制细菌凝集 | ||
本研究从大弹涂鱼单核/巨噬细胞转录组测序结果中获得BpGal-8L基因的cDNA序列。多重序列比对分析表明, BpGal-8L具有串联重复型半乳糖凝集素类似的典型结构特征, 即N端和C端各有一个CRD保守结构域, 并通过短肽连接。但其中只有C端具有典型的β-半乳糖苷结合保守基序。系统进化树分析显示鱼类Gal-8基因内部分成两簇, 一簇为与其他物种亲缘关系较近的Gal-8基因, 另一簇为与其他物种亲缘关系较远的Gal-8L基因。BpGal-8L属于鱼类Gal-8L基因簇。
Hadari等(1995)首次从大鼠肝脏cDNA文库中获得Gal-8基因。研究表明大鼠Gal-8基因mRNA在健
康组织中普遍表达, 其中在肺中表达量最高, 肝、心脏、肌肉、脾、后肢肌肉中表达量次之, 在脑和胚胎中最少(Hadari et al, 1995)。随后在人前列腺癌cDNA表达文库和肺cDNA表达文库中相继分离出Gal-8基因, 研究显示人Gal-8基因mRNA在脑、胸腺、结肠、视网膜、胰腺、胎盘、脾、睾丸、子宫、血管、食道和心脏中普遍表达(Bidon-Wagner et al, 2002)。在仅有的鱼类相关文献中, 罗非鱼Gal-8基因mRNA在皮肤、肠、脑中表达量最高, 在头肾、体肾、肝、鳃、肌肉、性腺、心脏和外周血白细胞中表达量次之, 脾中表达量最少。无乳链球菌(Streptococcus agalactiae)感染罗非鱼4d时, 脾中Gal-8基因mRNA表达量开始上调, 感染5d时, 表达量达到峰值, 为对照的30倍。虽然皮肤中Gal-8基因mRNA表达量最大, 但感
染后却无显著变化(Unajaket al, 2015)。目前, Gal-8L基因mRNA表达与病原菌感染的相关性鲜少报道。本研究中, BpGal-8L基因mRNA在健康大弹涂鱼的7个组织中均有表达, 其中肾中表达量最高, 鳃和脾中表达次之, 其普遍组织表达特征与文献报道一致。此外, 迟缓爱德华氏菌感染后肝和脾组织BpGal-8L基因mRNA表达量呈现上调趋势。本研究与罗非鱼中该基因表达模式不同之处在于罗非鱼响应细菌感染时间较长(4d), 而大弹涂鱼中感染4h即出现基因表达量上调。这可能与BpGal-8L和罗非鱼Gal-8属于鱼类不同亚型有关。
据报道, 大鼠Gal-8可采用lactosyl-sepharose层析柱进行重组蛋白纯化(Hadari et al, 1995)。人Gal-8可凝集红细胞, 而且这种凝集可被多种含半乳糖的糖类所抑制, 其中乳糖最小抑制凝集浓度为6.0mmol/L, 岩藻糖、葡萄糖、甘露糖、Me-α-Gal和Me-α-Gal无抑制凝集作用(Hadari et al, 2000)。海胆Gal-8也可以凝集红细胞, 其最小凝集浓度为0.25μmol/L。乳糖可以抑制红细胞凝集, 最小抑制凝集浓度为1mmol/L (Karakostis et al, 2015)。未见有Gal-8蛋白凝集细菌的报道, 但有文献表明, 在采用糖基芯片的方法中, 确定了多种细菌表面LPS的多聚糖, Gal-8蛋白能结合细菌表面含有半乳糖苷的多聚糖类, 也能结合含鼠李糖的多聚糖类(Knirel et al, 2014)。而这种作用可能介导通过细胞膜的完整性促进杀死B型抗原的大肠杆菌, 但对不具有这种B型抗原的其他细菌无作用(Stowell et al, 2010; Chenet al, 2014)。本研究中BpGal-8L-C对革兰氏阴性菌和革兰氏阳性菌均具有凝集作用, 这种凝集活性在大弹涂鱼抗病原菌感染的防御过程中如何发挥作用还需进一步验证。
大量文献表明, Gal-8蛋白为串联重复型半乳糖凝集素, 具有2个保守的CRD区域, 脊椎动物中两个CRD区糖基结合保守氨基酸残基略有不同, 在低等动物海胆Gal-8两个CRD区相似程度较高(同一性为62.8%) (Karakostis et al, 2015), 鱼类及更高等动物中氨基酸序列同一性约35%—38% (Hadari et al, 1995)。预示着N端和C端CRD区可能具有不同的糖基结合能力及作用。有文献表明, Gal-8蛋白N端CRD区对3'-O-硫酸化或唾液酸化的乳糖或是含路易斯X的多糖亲和性大于末端为Galβ 1→3/4GlcNAc的寡糖(Ideo et al, 2003), N端区还可以结合鞘糖脂(Stowell et al, 2008; Bohari et al, 2016)。而C端CRD区对多聚N-乙酰乳糖亲和力更高。因此, 将HL60细胞去唾液酸化, 将减弱N端CRD区的结合, 而增强C端CRD区的结合。当HL60细胞表面去除多聚N-乙酰乳糖则将改变C端CRD区结合特性。因此, N端和C端CRD区具有不同的糖基结合特异性。同时, 研究发现人Gal-8通过N端CRD区形成二聚体结合于HL60细胞表面, 而细胞信号转导功能则是C端CRD区的功能(Stowell et al, 2008)。此外, Gal-8的C端CRD区还具有杀菌作用(Stowell et al, 2010)。
4 结论本研究中BpGal-8L具有两个串联的CRD区, 但只有C端CRD区具有典型的β-半乳糖苷糖类结合保守基序。研究表明BpGal-8L-C具有细菌凝集活性, 且能结合乳糖和脂多糖。上述结果表明, 如文献报道BpGal-8L蛋白N端和C端CRD区可能存在不同的生物学活性。综上所述, BpGal-8L蛋白具有细菌凝集活性, 这预示BpGal-8L可能参与大弹涂鱼抗细菌免疫作用, 并且N端和C端CRD区发挥的作用不同。
| 唐威华, 张景六, 王宗阳, 等, 2000. SDS-PAPGE法测定His-tag融合蛋白分子量产生偏差的原因. 植物生理学报, 26(1): 64–68 |
| Bidon-Wagner N, Le Pennec J P., 2002. Human galectin-8 isoforms and cancer. Glycoconjugate Journal, 19(7-9): 557–563 DOI:10.1023/B:GLYC.0000014086.38343.98 |
| Bohari M H, Yu X, Zick Y, et al, 2016. Structure-based rationale for differential recognition of lacto-and neolacto-series glycosphingolipids by the N-terminal domain of human galectin-8. Scientific Reports, 6(1): 39556–39556 DOI:10.1038/srep39556 |
| Cerliani J P, Stowell S R, Mascanfroni I D, et al, 2011. Expanding the Universe of Cytokines and Pattern Recognition Receptors:Galectins and Glycans in Innate Immunity. Journal of Clinical Immunology, 31(1): 10–21 DOI:10.1007/s10875-010-9494-2 |
| Chen H Y, Weng I C, Hong M H, et al, 2014. Galectins as bacterial sensors in the host innate response. Current Opinion in Microbiology, 17: 75–81 DOI:10.1016/j.mib.2013.11.006 |
| Chen J, Chen Q, Lu X J, et al, 2016. The protection effect of LEAP-2 on the mudskipper (Boleophthalmus pectinirostris) against Edwardsiella tarda infection is associated with its immunomodulatory activity on monocytes/macrophages. Fish & Shellfish Immunology, 59: 66–76 |
| Cueni L N, Detmar M., 2009. Galectin-8 interacts with podoplanin and modulates lymphatic endothelial cell functions. Experimental Cell Research, 315(10): 1715–1723 DOI:10.1016/j.yexcr.2009.02.021 |
| Hadari Y R, Paz K, Dekel R, et al, 1995. Galectin-8 a new rat lectin, related to galectin-4. Journal of Biological Chemistry, 270(7): 3447–3453 DOI:10.1074/jbc.270.7.3447 |
| Hadari Y R, Arbe-Lgoren R, Levy Y, et al, 2000. Galectin-8 binding to integrins inhibits cell adhesion and induces apoptosis. Journal of Cell Science, 113(13): 2385–2397 |
| Hirabayashi J, Satoh M, Kasai K., 1992. Evidence that Caenorhabditis elegans 32-kDa beta-galactoside-binding protein is homologous to vertebrate beta-galactoside-binding lectins. cDNA cloning and deduced amino acid sequence. Journal of Biological Chemistry, 267(22): 15485–15490 |
| Ideo H, Seko A, Ishizuka I, et al, 2003. The N-terminal carbohydrate recognition domain of galectin-8 recognizes specific glycosphingolipids with high affinity. Glycobiology, 13(10): 713–723 DOI:10.1093/glycob/cwg094 |
| Kaltner H, Gabius H J., 2001. Animal lectins:from initial description to elaborated structural and functional classification. Advances in Experimental Medicine and Biology, 491: 79–94 DOI:10.1007/978-1-4615-1267-7 |
| Karakostis K, Costa C, Zito F, et al, 2015. Heterologous expression of newly identified galectin-8 from sea urchin embryos produces recombinant protein with lactose binding specificity and anti-adhesive activity. Scientific Reports, 5: 17665 |
| Knirel Y A, Gabius H J, Blixt O, et al, 2014. Human tandem-repeat-type galectins bind bacterial non-βGal polysaccharides. Glycoconjugate Journal, 31(1): 7–12 DOI:10.1007/s10719-013-9497-3 |
| Stowell S R, Arthur C M, Dias-Baruffi M, et al, 2010. Innate immune lectins kill bacteria expressing blood group antigen. Nature Medicine, 16(3): 295–301 DOI:10.1038/nm.2103 |
| Stowell S R, Arthur C M, Slanina K A, et al, 2008. Dimeric Galectin-8 induces phosphatidylserine exposure in leukocytes through polylactosamine recognition by the C-terminal domain. Journal of Biological Chemistry, 283(29): 20547–20559 DOI:10.1074/jbc.M802495200 |
| Tamura K, Stecher G, Peterson D, et al, 2013. MEGA6:molecular evolutionary genetics analysis version 6. 0. Molecular biology and evolution, 30(12): 2725–2729 DOI:10.1093/molbev/mst197 |
| Thurston T L M, Wandel M P, Von Muhlinen N, et al, 2012. Galectin 8 targets damaged vesicles for autophagy to defend cells against bacterial invasion. Nature, 482(7385): 414–418 DOI:10.1038/nature10744 |
| Unajak S, Pholmanee N, Songtawee N, et al, 2015. Molecular characterization of Galectin-8 from Nile tilapia (Oreochromis niloticus Linn.) and its response to bacterial infection. Molecular Immunology, 68(2): 585–596 |
| You X X, Bian C, Zan Q J, et al, 2014. Mudskipper genomes provide insights into the terrestrial adaptation of amphibious fishes. Nature Communications, 5: 5594 DOI:10.1038/ncomms6594 |
| Zhang X H, Shi Y H, Chen J., 2015. Molecular characterization of a transmembrane C-type lectin receptor gene from ayu (Plecoglossus altivelis) and its effect on the recognition of different bacteria by monocytes/macrophages. Molecular Immunology, 66(2): 439–450 DOI:10.1016/j.molimm.2015.05.009 |
| Zhang X W, Xu W T, Wang X W, et al, 2009. A novel C-type lectin with two CRD domains from Chinese shrimp Fenneropenaeus chinensis functions as a pattern recognition protein. Molecular Immunology, 46(8-9): 1626–1637 DOI:10.1016/j.molimm.2009.02.029 |
| Zick Y, Eisenstein M, Goren R A, et al, 2002. Role of galectin-8 as a modulator of cell adhesion and cell growth. Glycoconjugate Journal, 19(7-9): 517–526 DOI:10.1023/B:GLYC.0000014081.55445.af |
 2018, Vol. 49
2018, Vol. 49


