中国海洋湖沼学会主办。
文章信息
- 管峰, 李长红, 聂力, 苗亮, 陈炯. 2018.
- GUAN Feng, LI Chang-Hong, NIE Li, MIAO Liang, CHEN Jiong. 2018.
- 大弹涂鱼(Boleophthalmus pectinirostris) piscidin 1的分子特征及功能分析
- PISCIDIN 1 OF MUDSKIPPER BOLEOPHTHALMUS PECTINIROSTRIS: MOLECULAR CHARACTERIZATION AND FUNCTIONAL ANALYSIS
- 海洋与湖沼, 49(2): 422-431
- Oceanologia et Limnologia Sinica, 49(2): 422-431.
- http://dx.doi.org/10.11693/hyhz20171100297
-
文章历史
- 收稿日期:2017-11-26
- 收修改稿日期:2017-12-30
2. 浙江万里学院生物与环境学院 宁波 315100
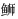 (Seriola lalandi)piscidin同源性最高,为40.8%;系统进化树分析表明,Bppis1属于piscidin 1类,与黄条
(Seriola lalandi)piscidin同源性最高,为40.8%;系统进化树分析表明,Bppis1属于piscidin 1类,与黄条 piscidin进化相关性最高。实时荧光定量PCR(quantitative real-time PCR,RT-qPCR)结果显示,Bppis1 mRNA在健康鱼鳃中表达量最高;迟缓爱德华氏菌(Edwardsiella tarda)感染后,大弹涂鱼肝、脾、肾、鳃和皮肤中Bppis1 mRNA表达量显著上调。体外抑菌实验结果表明,人工合成的Bppis1成熟肽抑菌活性较广泛,但对迟缓爱德华氏菌和3株革兰氏阳性菌无抑菌活性。大弹涂鱼MO/MΦ经1.0μg/mL Bppis1成熟肽处理后,对FITC标记的创伤弧菌(Vibrio vulnificus)的吞噬活性显著增加。综上,Bppis1在大弹涂鱼先天免疫中发挥重要作用,可能作为抵抗病原体入侵的潜在治疗药物。
piscidin进化相关性最高。实时荧光定量PCR(quantitative real-time PCR,RT-qPCR)结果显示,Bppis1 mRNA在健康鱼鳃中表达量最高;迟缓爱德华氏菌(Edwardsiella tarda)感染后,大弹涂鱼肝、脾、肾、鳃和皮肤中Bppis1 mRNA表达量显著上调。体外抑菌实验结果表明,人工合成的Bppis1成熟肽抑菌活性较广泛,但对迟缓爱德华氏菌和3株革兰氏阳性菌无抑菌活性。大弹涂鱼MO/MΦ经1.0μg/mL Bppis1成熟肽处理后,对FITC标记的创伤弧菌(Vibrio vulnificus)的吞噬活性显著增加。综上,Bppis1在大弹涂鱼先天免疫中发挥重要作用,可能作为抵抗病原体入侵的潜在治疗药物。2. Zhejiang Wanli University, Ningbo 315100, China
抗菌肽(antimicrobial peptides, AMPs)是动物先天免疫系统的重要组分之一, 在机体抵抗病原入侵时发挥重要作用。AMPs多是小分子量的短肽, 抗菌谱广, 主要通过形成离子通道直接破坏细胞膜以杀灭病原菌, 病原菌很难对其产生抗性(Brogden, 2005; Lai et al, 2009)。研究表明, AMPs除对细菌、真菌、病毒、原生动物和癌细胞等有良好的直接抑制或杀伤作用外, 还参与免疫激活、免疫调节、抗炎和免疫抑制等免疫过程(Lai et al, 2009; Choi et al, 2012; Hilchie et al, 2013; Wan et al, 2014; Hancock et al, 2016)。近年来, 国内外学者已从水产动物中分离鉴定了豹鳎毒素(pardaxin) (Lazarovici et al, 1986)、毒鱼豆素(piscidin) (Silphaduang et al, 2001)、cathelicidin (Lu et al, 2011)、肝脏表达抗菌肽-1 (liver express antimicrobial peptide 1, LEAP-1/hepcidin) (陈梅珍等, 2010; 王克坚, 2011)、肝脏表达抗菌肽-2 (liver express antimicrobial peptide 2, LEAP-2) (Li et al, 2014)、防御素(defensin) (Zhu et al, 2017)、epinecidin-1 (Pan et al, 2007)和scygonadin (王克坚, 2011)等多种AMPs。
Piscidin是一类广泛存在于鱼类中的AMP之一, 最早从杂交斑纹鲈鱼(Morone chrysops × Morone saxatilis)的肥大细胞中分离(Silphaduang et al, 2001)。此后, 在鳜鱼(Siniperca chuatsi) (Sun et al, 2007)、大西洋鳕(Gadus morhua L.) (Fernandes et al, 2010; Ruangsri et al, 2012)、南极独角雪冰鱼(Chionodraco hamatus) (Buonocore et al, 2012)、罗非鱼(Oreochromis niloticus) (Peng et al, 2012)、大黄鱼(Larimichthys crocea) (Niu et al, 2013; Zhou et al, 2014; Yang et al, 2016)、条石鲷(Oplegnathus fasciatus) (Umasuthan et al, 2016)和斜带石斑鱼(Epinephelus coioides) (Zhuang et al, 2017)等数种鱼类中均发现它的存在。已有的研究发现, piscidin通过破坏细菌、真菌和寄生虫的细胞膜发挥直接的抑制活性(Campagna et al, 2007; Sung et al, 2008; Hayden et al, 2015; Li et al, 2016; Umasuthan et al, 2016; Pan et al, 2017)。除具有直接的抗病原活性外, piscidin还能通过免疫调节功能参与机体内病原诱导的免疫应答(Huang et al, 2015; Lin et al, 2016; Pan et al, 2017)。由于与piscidin具有相似的初级或二级多肽结构以及基因结构, 从其他鱼类中鉴定的拟鲽毒素(pleurocidin) (Cole et al, 1997)、moronecidin (Lauth et al, 2002; Bae et al, 2014)、chrysophsin(Iijima et al, 2003)、dicentracin(Salerno et al, 2007?)、epinecidin (Yin et al, 2006; Pan et al, 2007)、myxinidin (Subramanian et al, 2009)和gaduscidin (Browne et al, 2011)等抗菌肽被建议归为piscidin家族。
大弹涂鱼(Boleophthalmus pectinirostris)是弹涂鱼的一种, 主要分布在中国、韩国和日本等地, 在我国主要盛产于东南沿海和台湾。它是一种能够适应不同盐度的两栖鱼类, 喜栖息于港湾和河口潮间带淤泥滩涂上, 摄食有机碎屑、底藻和小型底栖动物等, 营掘洞穴居生活, 具有较高的食用与药用价值。尽管大弹涂鱼生活的滩涂环境含有种类繁多、数量巨大的微生物群落, 但它们很少感染严重的细菌性疾病, 因此研究大弹涂鱼抗感染应答的免疫机制显得尤为重要。鉴于piscidin在动物抗感染免疫应答中的重要作用, 本研究初步研究大弹涂鱼(B. pectinirostris)的piscidin 1(Bppis1), 测得Bppis1基因的cDNA序列, 确定该基因结构特点、分析其氨基酸系统进化关系并确定mRNA在正常组织中表达情况, 研究迟缓爱德华氏菌(Edwardsiella tarda)感染后其组织中Bppis1 mRNA的表达变化; 人工合成Bppis1成熟肽, 分析其体外抑菌活性以及对大弹涂鱼单核/巨噬细胞(monocytes/ macrophages, MO/MΦ)功能的影响, 为进一步深入探讨piscidin对鱼类抵抗细菌感染的免疫作用提供依据。
1 材料与方法 1.1 实验材料与实验试剂30—40g健康大弹涂鱼(Boleophthalmus pectinirostris)购自浙江省宁波市路林市场, 规格均一、无病症。大弹涂鱼充气运回实验室, 在充分曝气、盐度为10‰、温度为24—26℃水环境中暂养以适应实验室环境。适应期间连续充气, 早晚换水各一次。
迟缓爱德华氏菌(Edwardsiella tarda)Et-CD由浙江省海水养殖研究所惠赠, 其他细菌菌株由本实验保存。RNAiso试剂、AMV逆转录酶、SYBR Premix Ex Taq试剂盒等购自TaKaRa公司(中国)。Ficoll购自Invitrogen公司(中国)。RPMI 1640培养基和胎牛血清购自Gibco公司(美国)。Bppis1成熟肽由吉尔生化(上海)有限公司合成, 纯度 > 95%。引物合成和序列测定由生工生物工程(上海)股份有限公司完成。
1.2 大弹涂鱼肾源MO/MΦ的分离培养大弹涂鱼肾源MO/MΦ的分离培养过程参考Chen等(2016)的方法, 具体步骤如下:用0.1% (V/V)的间氨基苯甲酸乙酯甲磺酸盐(MS-222)麻醉大弹涂鱼, 在无菌环境中抽血并迅速取出体肾, 放入无菌过滤筛网中, 再用1mL RPMI 1640培养基润湿体肾, 注射器活塞按压体肾碎片, 收集分离细胞。采用Ficoll密度梯度离心方法继续分离细胞, 获得含有MO/MΦ的白色细胞混悬层, 收集混悬细胞后用含2%胎牛血清的RPMI 1640培养基洗涤2次, 离心, 重复2次, 再用同样浓度胎牛血清的RPMI 1640培养基重新混悬细胞。使用血球计数板对分离细胞进行计数, 将MO/MΦ的浓度调至2.0×107 cells/mL, 每个35mm细胞培养皿加入2mL细胞, 置于5% CO2、24℃细胞培养箱中培养24h, 然后用RPMI 1640培养基除去未贴壁细胞, 重复2次, 用含10%胎牛血清的RPMI 1640培养基继续培养贴壁细胞。用Giemsa′s染液对贴壁细胞染色并镜检细胞的形态特征, 最终确认细胞培养皿中超过95%贴壁细胞属于MO/MΦ。
1.3 Bppis1 cDNA序列获得及分析应用Illumina二代测序平台构建正常无病症大弹涂鱼的MO/MΦ转录组数据库, 筛选取得Bppis1 cDNA序列。根据说明书, 从大弹涂鱼MO/MΦ中提取总RNA, 经AMV逆转录酶合成互补cDNA链, 通过特异性引物对PCR进行扩增并将扩增产物测序检验。使用SignalP 4.0软件(http://www.cbs.dtu.dk/services/SignalP-4.0/)对开放阅读框编码多肽的信号肽序列进行预测; 采用pI/Mw程序(http://web.expasy.org/compute_pi/)对基因编码多肽的分子量和等电点进行预测; 应用ClustalW程序(http://clustalw.ddbj.nig.ac.jp/)多重比对piscidin氨基酸序列; 使用MEGA 5.0软件构建piscidin氨基酸的系统进化树(Tamura et al, 2011)。构建系统发育进化树及比对多重序列所用piscidin的氨基酸序列详见表 1。
| NCBI登录号 | 基因名称 | 物种 | ||
| 拉丁名 | 英文名 | 中文名 | ||
| MF459711 | piscidin 1 | Boleophthalmus pectinirostris | Mudskipper | 大弹涂鱼 |
| AB703274 | piscidin | Oplegnathus fasciatus | Rock bream | 条石鲷 |
| EU741827 | piscidin l | Larimichthys crocea | Large yellow croaker | 大黄鱼 |
| JX412481 | piscidin 1 | Epinephelus malabaricus | Malabar grouper | 玛拉巴石斑鱼 |
| JQ823163 | piscidin l | Epinephelus coioides | Orange-spotted grouper | 斜带石斑鱼 |
| EU741828 | piscidin l | Epinephelus akaara | Red spotted grouper | 赤点石斑鱼 |
| GU592793 | piscidin l | Epinephelus fuscoguttatus | Brown marbled grouper | 褐点石斑鱼 |
| HQ437912 | piscidin l | Epinephelus bleekeri | Duskytail grouper | 布氏石斑鱼 |
| JN216987 | piscidin l | Epinephelus bruneus | Longtooth grouper | 褐石斑鱼 |
| FJ917596 | piscidin 1 | Gadus morhua L. | Atlantic cod | 大西洋鳕 |
| KY548530 | piscidin | Seriola lalandi | Yellowtail amberjack | 黄条
|
| HQ437913 | piscidin 2 | Epinephelus coioides | Orange-spotted grouper | 斜带石斑鱼 |
| JX412480 | piscidin 2 | Epinephelus malabaricus | Malabar grouper | 玛拉巴石斑鱼 |
| HQ184323 | piscidin 2β | Gadus morhua L. | Atlantic cod | 大西洋鳕 |
| HQ184322 | piscidin 2 | Gadus morhua L. | Atlantic cod | 大西洋鳕 |
| KX231319 | piscidin 3 | Morone chrysops | White bass | 白鲈 |
| KX231323 | piscidin 3 | Morone saxatilis | Striped bass | 条纹鲈 |
| KX231324 | piscidin 4 | Morone chrysops | White bass | 白鲈 |
| KX231320 | piscidin 4 | Morone saxatilis | Striped bass | 条纹鲈 |
| HM596029 | piscidin 4 | Morone chrysops ×Morone saxatilis | Hybrid striped bass | 杂交斑纹鲈鱼 |
| HM596030 | piscidin 5 | Morone chrysops ×Morone saxatilis | Hybrid striped bass | 杂交斑纹鲈鱼 |
| KX870851 | piscidin 5lt3 | Larimichthys crocea | Large yellow croaker | 大黄鱼 |
| KJ879923 | piscidin 5lt2 | Larimichthys crocea | Large yellow croaker | 大黄鱼 |
| KJ879922 | piscidin 5l | Larimichthys crocea | Large yellow croaker | 大黄鱼 |
| KX231326 | piscidin 6 | Morone chrysops | White bass | 白鲈 |
| KX231321 | piscidin 6 | Morone saxatilis | Striped bass | 条纹鲈 |
| KX231322 | piscidin 7 | Morone chrysops | White bass | 白鲈 |
腹腔注射迟缓爱德华氏菌感染大弹涂鱼的实验方法及感染剂量参考Chen等(2016), 具体步骤如下:收集对数生长期的迟缓爱德华氏菌, 用灭菌生理盐水洗涤3次, 将细菌浓度调整为1.0×105 CFU/mL。细菌感染组大弹涂鱼腹腔注射1.0×104 CFU/尾的迟缓爱德华氏菌, 对照组大弹涂鱼腹腔注入同等剂量的生理盐水, 在注射感染后4、8、12和24h (hours post infection, hpi)时分别收集两个组实验鱼的肝、脾、鳃、肾和皮肤等组织, 并立即放入液氮中冻存, 随后置-70℃超低温冰箱保存。
1.5 实时荧光定量PCR(quantitative real-time PCR, RT-qPCR)参考Chen等(2016)的方法抽提组织中总RNA、合成互补cDNA链并进行RT-qPCR检测目的基因mRNA的表达量。根据转录组测序结果获得的Bppis1序列设计检测引物, Bppis1-T(+): 5′-TGGTGGTGATG ATGGCTGAG-3′和Bppis1-T(-): 5′-CACTTGGAGGTA TTCG GGGC-3′, 预期扩增片段大小为172bp。根据大弹涂鱼18S rRNA基因设计检测引物, Bp18S rRNA-T(+): 5′-GGCCGTTCTTAGTTGGTGGA-3′和Bp18S rRNA-T(-): 5′-CCCGGACATCTAAGGGCAT C-3′, 预期扩增片段大小为112bp。确定的RT-qPCR检测体系共25μL, 包含上下游引物(10μmol/L)各1μL、cDNA模板0.5μL、SYBR Premix Ex Taq(2×)缓冲液12.5μL、灭菌水10μL。在ABI荧光定量PCR仪(Invitrogen, Foster City, CA, USA)上运行检测程序, 程序如下:预变性段共1个循环反应, 95℃ 5min; 扩增段共40个循环, 95℃ 30s, 60℃ 30s, 72℃ 30s;熔解段共1个循环反应, 94℃ 30s, 72℃ 60s, 95℃ 30s。每个样品反复检测4次。根据2–ΔΔCt方法计算Bppis1 mRNA的相对表达量(Livak et al, 2001)。
1.6 体外抑菌实验参考Li等(2014)的方法, 采用微量稀释法测定合成Bppis1肽对不同细菌的最低抑菌浓度(minimum inhibitory concentration, MIC), 略作改进。具体方法如下:采用二倍稀释法将合成Bppis1肽配制成1.563、3.125、6.25、12.5、25、50和100μg/mL共7个浓度; 将副溶血弧菌(Vibrio parahaemolyticus)、金黄色葡萄球菌(Staphylococcus aureus)、溶藻弧菌(Vibrio alginolyticus)、大肠杆菌(Escherichia coli)、创伤弧菌(Vibrio vulnificus)、哈维氏弧菌(Vibrio harveyi)、嗜水气单胞菌(Aeromonas hydrophila)、鳗弧菌(Vibrio anguillarum)、迟缓爱德华氏菌、单核细胞增生李斯特菌(Listeria monocytogenes)和海豚链球菌(Streptococcus iniae)等11种细菌培养至对数生长期, 用无菌生理盐水分别调整这些细菌的浓度为1.0×105 CFU/mL; 在96孔微孔板中每孔加入20μL 1.0×105 CFU/mL实验细菌的菌悬液, 然后加入80μL不同浓度的合成Bppis1肽, 混匀后在适当的温度条件下培养24h。采用Varioskan Flash全波长多功能酶标仪(Thermo Fisher Scientific, Waltham, MA, USA)测定OD600值。通过细菌沉降和600nm处吸光度值计算MIC, 同时设置卡那霉素为阳性对照。
1.7 吞噬实验参考Chen等(2016)的方法测定Bppis1对大弹涂鱼MO/MΦ吞噬能力的影响, 方法如下:分别将对数生长期的大肠杆菌和创伤弧菌标记异硫氰酸荧光素(fluorescein isothiocyanate, FITC), 分别命名为FITC-E. coli和FITC-V. vulnificus。将1.0或10.0μg/mL Bppis1肽加入到MO/MΦ中, 预处理8h, 然后以感染复数(multiplicity of infection, MOI)为10︰1的比例加入FITC-E. coli或FITC-V. vulnificus, 孵育30min, 灭菌PBS洗涤3次以除去未吞噬细菌, 台盼蓝淬灭细胞外荧光, 最后用FACS缓冲液(含0.2% BSA和0.1%叠氮化钠)重悬细胞。使用Gallios Flow Cytometer (Beckman Coulterr, Fullerton, CA, USA)对被吞噬细菌的荧光信号进行流式检测。大弹涂鱼MO/MΦ吞噬细菌的相对平均荧光强度(relative fluorescence intensity, MFI)用FlowJo软件分析。
2 结果 2.1 Bppis1 cDNA序列分析软件分析结果显示, Bppis1 cDNA全长327bp (GenBank登录号为MF459711), 包含一个完整的、长度为207bp的开放阅读框, 预测编码一个由68个氨基酸组成的、相对分子量大小为7.7kDa的多肽, 等电点为5.51。该多肽N-末端含一个由22个氨基酸组成的信号肽, 裂解位点为G20E21G22-F23F24, C-末端含一个由28个氨基酸组成的末端功能前区, 其成熟肽由18个氨基酸组成(图 1)。
氨基酸序列多重比对结果显示, 鱼类piscidin在信号肽区间序列最为保守, 终止于1个GEG或GEC序列后, 成熟肽和末端功能前区序列变异较大(图 1)。其中, 大弹涂鱼piscidin与其他已知物种piscidin序列之间同源性较低, 为5.8%—40.8%, 与黄条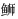
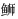
取健康大弹涂鱼的肝、脾、肾、鳃和皮肤运行RT-qPCR检验程序, 结果显示Bppis1 mRNA在健康大弹涂鱼鳃组织中含量最高, 其余依次为皮肤、肝、脾和肾(图 3A)。与对照组对比, 当迟缓爱德华氏菌感染4h时, 脾、肾、肝和皮肤中Bppis1 mRNA的表达量显著提高, 分别是对照组表达量的2.17、3.17、3.32和20.76倍(P < 0.05);在8h时, 所有检测组织中Bppis1 mRNA的表达量均显著增加, 在肝、肾、鳃和皮肤中达到峰值, 分别为对照组的5.84、15.51、3.78和60.86倍(P < 0.05);在12h时, 脾中Bppis1 mRNA的表达量继续增加, 达到峰值, 为对照组的20.60倍(P < 0.05);在24h时, 肾、肝和鳃中Bppis1 mRNA的表达量与对照组无明显差异(图 3B—图 3F)。
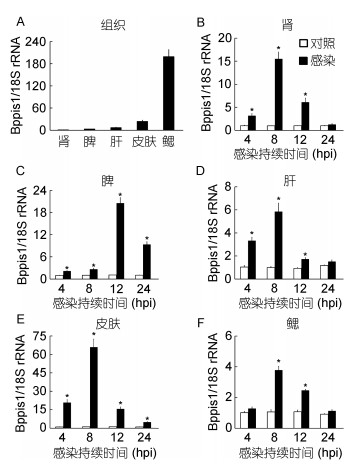 |
| 图 3 RT-qPCR分析Bppis1 mRNA的表达 Fig. 3 RT-qPCR analysis of Bppis1 mRNA 注:A. Bppis1 mRNA在健康大弹涂鱼中的表达; B—F: Bppis1 mRNA在迟缓爱德华氏菌感染大弹涂鱼组织中的表达。以Bppis1 mRNA与18S rRNA基因的比值作为Bppis1的相对表达量, *表示与对照组比较差异显著(P < 0.05) (n=4) |
利用酶标仪测定Bppis1肽对11种细菌的体外抑菌活性, 结果表明, Bppis1具备较广泛的抗菌活性, 对溶藻弧菌、副溶血弧菌和鳗弧菌的MIC为50μg/mL; 对哈维氏弧菌和嗜水气单胞菌的MIC为25μg/mL; 对创伤弧菌和大肠杆菌的MIC分别为12.5和6.25μg/mL, 并且抑菌效果优于对照组卡那霉素, 但对迟缓爱德华氏菌、金黄色葡萄球菌、单核细胞增生李斯特菌和海豚链球菌无明显的抑菌活性(表 2)。
| 细菌名 | 分离株/菌株 | 培养基 | 培养温度(℃) | Bppis1 MIC (μg/mL) | 卡那霉素MIC (μg/mL) |
| 创伤弧菌 | ATCC279562 | TSB | 28 | 12.5 | 25 |
| 溶藻弧菌 | ATCC17749 | TSB | 28 | 50 | 25 |
| 副溶血弧菌 | ATCC33847 | TSB | 28 | 50 | 50 |
| 哈维氏弧菌 | ATCC33866 | TSB | 28 | 25 | 1.563 |
| 鳗弧菌 | ATCC19264 | TSB | 28 | 50 | 25 |
| 迟缓爱德华氏菌 | Et-CD | LB | 37 | — | 25 |
| 大肠杆菌 | K12 | LB | 37 | 6.25 | 50 |
| 金黄色葡萄球菌 | ATCC6538 | LB | 37 | — | 12.5 |
| 嗜水气单胞菌 | ATCC7966 | LB | 37 | 25 | 6.25 |
| 单核细胞增生李斯特菌 | ATCC19115 | BHI | 37 | — | 1.563 |
| 海豚链球菌 | ATCC29178 | BHI | 28 | — | 6.25 |
| 注:“—”表示Bppis1在100μg/mL时无抑菌活性 | |||||
采用Gallios Flow Cytometer检测合成Bppis1肽对大弹涂鱼MO/MΦ吞噬能力的影响。结果显示, 与对照组相比, 经1.0μg/mL的合成Bppis1肽处理后, MO/MΦ对FITC-E. coli吞噬活性无明显变化, 但对FITC-V. vulnificus吞噬活性显著增加, 为对照组的1.51倍; 经10.0μg/mL的合成Bppis1肽处理后, MO/MΦ对FITC-E. coli和FITC-V. vulnificus的吞噬活性均无明显变化(图 4)。
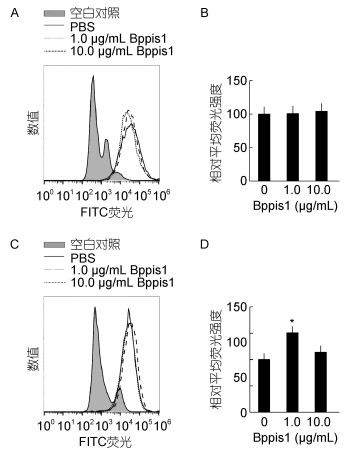 |
| 图 4 合成Bppis1肽对大弹涂鱼MO/MΦ吞噬活性的影响 Fig. 4 Effect of synthetic Bppis1 on phagocytosis activity of mudskipper MO/MΦ 注:A和C:吞噬流式图; B和D:相对平均荧光强度。PBS处理组的相对平均荧光强度数值设定为100, 实验组的相对平均荧光强度用PBS处理组数值的倍数表示, *表示与对照组比较差异显著(P < 0.05) (n=3) |
Piscidin作为抗菌肽piscidin家族成员之一, 是鱼类先天免疫的重要组成部分。本研究从大弹涂鱼MO/MΦ中鉴定了Bppis1基因cDNA序列。序列分析结果表明, Bppis1具有与其他物种piscidin相似的结构特征, 由信号肽、成熟肽和末端功能前区组成, 其中信号肽序列最为保守, 以GEG序列终止, 成熟肽和末端功能前区序列变异较大。Bppis1与其他已知物种piscidin序列之间同源性较低, 与黄条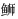
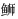
组织特征分析表明, Bppis1 mRNA在健康大弹涂鱼各组织中广泛表达, 且在鳃中表达量最高, 与已报道的南极独角雪冰鱼(Buonocore et al, 2012)、条石鲷(Bae et al, 2016; Umasuthan et al, 2016)、罗非鱼(Peng et al, 2012)、大黄鱼(Niu et al, 2013)等鱼类研究结果较为一致。鳃是鱼类抵抗病原入侵的重要屏障之一, Bppis1在鳃中表达量丰富, 揭示其在大弹涂鱼天然免疫应答中扮演重要角色。多篇文献表明鱼类piscidin的高表达与感染病原体紧密相联, 研究结果显示病原感染后piscidin的表达显著上调(Sun et al, 2007; Niu et al, 2013; Umasuthan et al, 2016; Zhuang et al, 2017)。例如, 斜带石斑鱼感染副溶血弧菌后, 脾中ecPis-1 mRNA表达在3h时显著上调(P < 0.05), 体肾中ecPis-2和ecPis-3 mRNA表达均在12h显著上调, 脾和头肾中ecPis-2和ecPis-4 mRNA在12h和24h时均显著上调(Zhuang et al, 2017);条石鲷感染条石鲷虹彩病毒(rock bream iridovirus, RBIV)、迟缓爱德华氏菌和海豚链球菌后, 鳃和头肾中Of-Pis1 mRNA表达均在3h时显著上调, 而且RBIV感染使得头肾中Of-Pis1 mRNA表达在12h达到峰值, 约为对照组的12倍(Umasuthan et al, 2016)。本研究中, 大弹涂鱼感染迟缓爱德华氏菌后, 肾、脾、肝、皮肤和鳃中Bppis1 mRNA表达结果与上述论文中的结论相似, 只是峰值数据和到达峰值的时间点略有差别, 肾、肝、皮肤和鳃中Bppis1 mRNA表达均在8h时达到峰值, 分别为对照组的15.51、5.84、60.86和3.78倍(P < 0.05), 脾中Bppis1 mRNA表达在12h达到峰值, 为对照组的20.6倍(P < 0.05), 揭示Bppis1可能在大弹涂鱼抗迟缓爱德华氏菌感染过程中发挥重要作用。
研究发现, piscidin对病毒、细菌、真菌和寄生虫均有抑制作用, 主要通过破坏细菌、真菌和寄生虫的细胞膜发挥直接的抑制活性(Chinchar et al, 2004; Campagna et al, 2007; Sung et al, 2008; Hayden et al, 2015; Li et al, 2016; Umasuthan et al, 2016; Pan et al, 2017)。体外抑菌实验结果表明, 人工合成或重组表达的piscidin成熟肽具有广泛的抗细菌活性, 对革兰氏阳性菌和阴性菌均有抑制作用(Bae et al, 2016; Umasuthan et al, 2016)。例如, 在条石鲷中, 重组表达的piscidin (pOf-Pis)对Vibrio tapetis、大肠杆菌和海豚链球菌均有较强抑菌活性, MIC分别为22.5、45和45µg/mL, 对迟缓爱德华氏菌抑菌活性较弱, MIC大于90µg/mL, 并且不能完全抑制迟缓爱德华氏菌的生长(Umasuthan et al, 2016);人工合成的piscidin (RbPisc)对海豚链球菌、哈维氏弧菌和奥氏弧菌(V. ordalii)的抑菌活性非常强, MIC均低于0.9µg/mL, 对大肠杆菌、溶藻弧菌、坎氏弧菌(V. campbellii)和创伤弧菌抗菌活性较强, MIC分别为1.9—3.9、0.9—1.9、1.9和3.9—7.8µg/mL, 对迟缓爱德华氏菌几乎没有抑制活性, MIC为250—500µg/mL (Bae et al, 2016)。在罗非鱼中, 人工合成的piscidin 3 (TP3)和piscidin 4 (TP4)对创伤弧菌、嗜水气单胞菌、溶藻弧菌、铜绿假单胞菌(Pseudomona aeruginosa)、无乳链球菌(Streptococcus galactiae)和粪肠球菌(Enterococcus faecalis)均有较强的抑菌活性, 而TP1、TP2和TP5没有明显的抑菌活性(Peng et al, 2012)。在大黄鱼中, 人工合成的piscidin (Lcpis5lt3)对单核细胞增生李斯特菌、金黄色葡萄球菌、鳗弧菌、溶藻弧菌、副溶血弧菌和嗜水气单胞菌具有明显的抗菌效果, 对迟缓爱德华氏菌、创伤弧菌、哈维氏弧菌和海豚链球菌无明显抑制作用(Yang et al, 2016)。本研究中, 人工合成的Bppis1成熟肽对大肠杆菌和弧菌科6种细菌有明显的抗菌活性, MIC为6.25—50μg/mL, 但对迟缓爱德华氏菌以及3株革兰氏阳性菌无抗菌活性, 与上述研究结果有明显差异, 说明不同鱼类的piscidin对相同细菌的抗菌活性不同, Bppis1可能仅具有抗革兰氏阴性菌活性。
新近研究表明, 罗非鱼TP3和TP4能通过影响免疫相关基因, 如转移生长因子(transforming growth factor β, TGF-β)和细胞因子类白细胞介素(interleukin, IL)-1β、IL-6、IL-8等mRNA的表达来发挥免疫调节功能(Lin et al, 2016; Pan et al, 2017)。此外, Huang等(2015)研究发现, 2.5—10µg/mL TP4不仅能刺激纤维原细胞系(Hs-68)和角化细胞系(HaCaT)的增殖, 也能影响TGF、血管上皮生长因子和表皮生长因子调节的伤口闭合活性, 从而增加耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus, MRSA)感染大鼠的存活率。本研究发现, 大弹涂鱼MO/MΦ经1.0μg/mL的Bppis1处理后, 对创伤弧菌的吞噬作用显著增强, 揭示Bppis1也具有免疫调节功能, 可能通过促进免疫细胞的吞噬活性发挥作用, 但具体作用机制尚待进一步研究。
4 结论本研究测定了大弹涂鱼Bppis1基因cDNA序列, 序列分析揭示其与黄条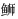
| 王克坚., 2011. 海洋鱼类和青蟹抗菌肽hepcidin和scygonadin的研究. 厦门大学学报(自然科学版), 50(2): 418–424 |
| 陈梅珍, 陈炯, 陆新江, 等, 2010. 香鱼hepcidin基因的克隆、序列分析及组织表达特征. 动物学研究, 31(6): 595–600 |
| Bae J S, Jung J M, An C M, et al, 2016. Piscidin:Antimicrobial peptide of rock bream, Oplegnathus fasciatus. Fish & Shellfish Immunology, 51: 136–142 |
| Bae J S, Shim H S, Hwang S D, et al, 2014. Expression analysis and biological activity of moronecidin from rock bream, Oplegnathus fasciatus. Fish & Shellfish Immunology, 40(2): 345–353 |
| Brogden K A, 2005. Antimicrobial peptides: pore formers or metabolic inhibitors in bacteria? Nature Reviews Microbiology, 3(3): 238-250 |
| Browne M J, Feng C Y, Booth V, et al, 2011. Characterization and expression studies of Gaduscidin-1 and Gaduscidin-2; paralogous antimicrobial peptide-like transcripts from Atlantic cod (Gadus morhua). Developmental & Comparative Immunology, 35(3): 399–408 |
| Buonocore F, Randelli E, Casani D, et al, 2012. A piscidin-like antimicrobial peptide from the icefish Chionodraco hamatus (Perciformes:Channichthyidae):molecular characterization, localization and bactericidal activity. Fish & Shellfish Immunology, 33(5): 1183–1191 |
| Campagna S, Saint N, Molle G, et al, 2007. Structure and mechanism of action of the antimicrobial peptide piscidin. Biochemistry, 46(7): 1771–1778 DOI:10.1021/bi0620297 |
| Chen J, Chen Q, Lu X J, et al, 2016. The protection effect of LEAP-2 on the mudskipper (Boleophthalmus pectinirostris) against Edwardsiella tarda infection is associated with its immunomodulatory activity on monocytes/macrophages. Fish & Shellfish Immunology, 59: 66–76 |
| Chinchar V G, Bryan L, Silphadaung U, et al, 2004. Inactivation of viruses infecting ectothermic animals by amphibian and piscine antimicrobial peptides. Virology, 323(2): 268–275 DOI:10.1016/j.virol.2004.02.029 |
| Choi K Y, Chow L N, Mookherjee N., 2012. Cationic host defence peptides:multifaceted role in immune modulation and inflammation. Journal of Innate Immunity, 4(4): 361–370 |
| Cole A M, Weis P, Diamond G., 1997. Isolation and characterization of pleurocidin, an antimicrobial peptide in the skin secretions of winter flounder. Journal of Biological Chemistry, 272(18): 12008–12013 DOI:10.1074/jbc.272.18.12008 |
| Fernandes J M, Ruangsri J, Kiron V., 2010. Atlantic cod piscidin and its diversification through positive selection. PLoS One, 5(3): e9501 |
| Hancock R E, Haney E F, Gill E E., 2016. The immunology of host defence peptides:beyond antimicrobial activity. Nature Reviews Immunology, 16(5): 321–334 DOI:10.1038/nri.2016.29 |
| Hayden R M, Goldberg G K, Ferguson B M, et al, 2015. Complementary effects of host defense peptides piscidin 1 and piscidin 3 on DNA and lipid membranes:biophysical insights into contrasting biological activities. The Journal of Physical Chemistry B, 119(49): 15235–15246 DOI:10.1021/acs.jpcb.5b09685 |
| Hilchie A L, Wuerth K, Hancock R E., 2013. Immune modulation by multifaceted cationic host defense (antimicrobial) peptides. Nature Chemical Biology, 9(12): 761–768 DOI:10.1038/nchembio.1393 |
| Huang H N, Chan Y L, Wu C J, et al, 2015. Tilapia piscidin 4 (TP4) stimulates cell proliferation and wound closure in MRSA-infected wounds in mice. Marine Drugs, 13(5): 2813–2833 DOI:10.3390/md13052813 |
| Iijima N, Tanimoto N, Emoto Y, et al, 2003. Purification and characterization of three isoforms of chrysophsin, a novel antimicrobial peptide in the gills of the red sea bream, Chrysophrys major. European Journal of Biochemistry, 270(4): 675–686 DOI:10.1046/j.1432-1033.2003.03419.x |
| Lai Y, Gallo R L., 2009. AMPed up immunity:how antimicrobial peptides have multiple roles in immune defense. Trends in Immunology, 30(3): 131–141 DOI:10.1016/j.it.2008.12.003 |
| Lauth X, Shike H, Burns J C, et al, 2002. Discovery and characterization of two isoforms of moronecidin, a novel antimicrobial peptide from hybrid striped bass. Journal of Biological Chemistry, 277(7): 5030–5039 DOI:10.1074/jbc.M109173200 |
| Lazarovici P, Primor N, Loew L M., 1986. Purification and pore-forming activity of two hydrophobic polypeptides from the secretion of the Red Sea Moses sole (Pardachirus marmoratus). Journal of Biological Chemistry, 261(35): 16704–16713 |
| Li H X, Lu X J, Li C H, et al, 2014. Molecular characterization and functional analysis of two distinct liver-expressed antimicrobial peptide 2 (LEAP-2) genes in large yellow croaker (Larimichthys crocea). Fish & Shellfish Immunology, 38(2): 330–339 |
| Li Z P, Chen D W, Pan Y Q, et al, 2016. Two isoforms of piscidin from Malabar grouper, Epinephelus malabaricus:Expression and functional characterization. Fish & Shellfish Immunology, 57: 222–235 |
| Lin W C, Chang H Y, Chen J Y., 2016. Electrotransfer of the tilapia piscidin 3 and tilapia piscidin 4 genes into skeletal muscle enhances the antibacterial and immunomodulatory functions of Oreochromis niloticus. Fish & Shellfish Immunology, 50: 200–209 |
| Livak K J, Schmittgen T D., 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method. Methods, 25(4): 402–408 DOI:10.1006/meth.2001.1262 |
| Lu X J, Chen J, Huang Z A, et al, 2011. Identification and characterization of a novel cathelicidin from ayu, Plecoglossus altivelis. Fish & Shellfish Immunology, 31(1): 52–57 |
| Niu S F, Jin Y, Xu X, et al, 2013. Characterization of a novel piscidin-like antimicrobial peptide from Pseudosciaena crocea and its immune response to Cryptocaryon irritans. Fish & Shellfish Immunology, 35(2): 513–524 |
| Pan C Y, Chen J Y, Cheng Y S, et al, 2007. Gene expression and localization of the epinecidin-1 antimicrobial peptide in the grouper (Epinephelus coioides), and its role in protecting fish against pathogenic infection. DNA and Cell Biology, 26(6): 403–413 DOI:10.1089/dna.2006.0564 |
| Pan C Y, Tsai T Y, Su B C, et al, 2017. Study of the antimicrobial activity of tilapia piscidin 3 (TP3) and TP4 and their effects on immune functions in hybrid tilapia (Oreochromis spp. ). PLoS One, 12(1): e0169678 DOI:10.1371/journal.pone.0169678 |
| Peng K C, Lee S H, Hour A L, et al, 2012. Five different piscidins from Nile tilapia, Oreochromis niloticus:analysis of their expressions and biological functions. PLoS One, 7(11): e50263 DOI:10.1371/journal.pone.0050263 |
| Ruangsri J, Salger S A, Caipang C M, et al, 2012. Differential expression and biological activity of two piscidin paralogues and a novel splice variant in Atlantic cod (Gadus morhua L. ). Fish & Shellfish Immunology, 32(3): 396–406 |
| Salerno G, Parrinello N, Roch P, et al, 2007. cDNA sequence and tissue expression of an antimicrobial peptide, dicentracin; a new component of the moronecidin family isolated from head kidney leukocytes of sea bass, Dicentrarchus labrax. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 146(4): 521–529 DOI:10.1016/j.cbpb.2006.12.007 |
| Silphaduang U, Noga E J., 2001. Antimicrobials:Peptide antibiotics in mast cells of fish. Nature, 414(6861): 268–269 DOI:10.1038/35104690 |
| Subramanian S, Ross N W, MacKinnon S L., 2009. Myxinidin, a novel antimicrobial peptide from the epidermal mucus of hagfish, Myxine glutinosa L. Marine Biotechnology, 11(6): 748–757 DOI:10.1007/s10126-009-9189-y |
| Sun B J, Xie H X, Song Y, et al, 2007. Gene structure of an antimicrobial peptide from mandarin fish, Siniperca chuatsi (Basilewsky), suggests that moronecidins and pleurocidins belong in one family:the piscidins. Journal of Fish Diseases, 30(6): 335–343 DOI:10.1111/jfd.2007.30.issue-6 |
| Sung W S, Lee J, Lee D G., 2008. Fungicidal effect and the mode of action of piscidin 2 derived from hybrid striped bass. Biochemical and Biophysical Research Communications, 371(3): 551–555 DOI:10.1016/j.bbrc.2008.04.107 |
| Tamura K, Peterson D, Peterson N, et al, 2011. MEGA5:molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods. Molecular Biology and Evolution, 28(10): 2731–2739 DOI:10.1093/molbev/msr121 |
| Umasuthan N, Mothishri M S, Thulasitha W S, et al, 2016. Molecular, genomic, and expressional delineation of a piscidin from rock bream (Oplegnathus fasciatus) with evidence for the potent antimicrobial activities of Of-Pis1 peptide. Fish & Shellfish Immunology, 48: 154–168 |
| Wan M, van der Does A M, Tang X, et al, 2014. Antimicrobial peptide LL-37 promotes bacterial phagocytosis by human macrophages. Journal of Leukocyte Biology, 95(6): 971–981 DOI:10.1189/jlb.0513304 |
| Yang J, Lu X J, Chai F C, et al, 2016. Molecular characterization and functional analysis of a piscidin gene in large yellow croaker (Larimichthys crocea). Zoological Research, 37(6): 347–355 |
| Yin Z X, He W, Chen W J, et al, 2006. Cloning, expression and antimicrobial activity of an antimicrobial peptide, epinecidin-1, from the orange-spotted grouper, Epinephelus coioides. Aquaculture, 253(1): 204–211 |
| Zhou Q J, Su Y Q, Niu S F, et al, 2014. Discovery and molecular cloning of piscidin-5-like gene from the large yellow croaker (Larimichthys crocea). Fish & Shellfish Immunology, 41(2): 417–420 |
| Zhu J, Wang H, Wang J, et al, 2017. Identification and characterization of a β-defensin gene involved in the immune defense response of channel catfish, Ictalurus punctatus. Molecular Immunology, 85: 256–264 DOI:10.1016/j.molimm.2017.03.009 |
| Zhuang Z R, Yang X D, Huang X Z, et al, 2017. Three new piscidins from orange-spotted grouper (Epinephelus coioides):Phylogeny, expression and functional characterization. Fish & Shellfish Immunology, 66: 240–253 |
 2018, Vol. 49
2018, Vol. 49