
中国海洋湖沼学会主办。
文章信息
- 李磊, 刘金殿, 黄士林, 唐峰华, 陈玉生, 赵永超, 许呈林, 王云龙, 沈新强, 蒋玫. 2018.
- LI Lei, LIU Jin-Dian, HUANG Shi-Lin, TANG Feng-Hua, CHEN Yu-Sheng, ZHAO Yong-Chao, XU Cheng-Lin, WANG Yun-Long, SHEN Xin-Qiang, JIANG Mei. 2018.
- 基于综合生物标志物响应评价苯并芘对脊尾白虾(Exopalaemon carinicauda)的毒性效应
- INTEGRATED ASSESSMENT OF BIOMARKER RESPONSES IN EXOPALAEMON CARINICAUDA EXPOSED TO BENZO[A]PYRENE
- 海洋与湖沼, 49(2): 444-451
- Oceanologia et Limnologia Sinica, 49(2): 444-451.
- http://dx.doi.org/10.11693/hyhz20170800218
-
文章历史
- 收稿日期:2017-08-30
- 收修改稿日期:2018-01-06
2. 海盐县海洋与渔政管理站 嘉兴 314300;
3. 中国水产科学研究院东海水产研究所 上海 200090;
4. 江苏省海洋水产研究所 南通 226007
2. Ocean and Fishery Management Station of Haiyan County, Jiaxing 314300, China;
3. East China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Shanghai 200090, China;
4. Marine Fisheries Research Institute of Jiangsu, Nantong 226007, China
苯并[a]芘(benzo[a]pyrene, BaP)是一种具有很强的致畸、致突变等毒性效应的多环芳烃(polycyclic aromatic hydrocarbons, PAHs)类污染物, 主要来源于有机物质的高温分解和不完全燃烧, 在人类活动的影响下, 已经广泛存在于海洋环境中(Ren et al, 2015)。BaP在水体中以溶解态、吸附于悬浮颗粒物或者与其他物质结合的状态存在, 海洋生物鳃的呼吸作用, 即水体暴露是海洋生物吸收BaP的主要途径, 也可以通过生物体的表皮渗透或者摄食活动进入生物体内, 由于BaP易溶于脂肪, BaP能快速进入生物体组织, 并且不易排出生物体外(Wang et al, 2005)。BaP本身毒性不大, 化学性质活性较弱, 但在生物体内各种新陈代谢酶的作用活化后, 代谢产物会对生物体产生各种毒害作用(Haasch et al, 1993)。生物标志物是反映污染物对生物体早期影响的灵敏性分子生态毒理学指标, 环境中污染物的毒性效应可以通过生物标志物的变化进行评价(Lamet al, 2003)。Da Silva Rocha等(2012)利用7-乙氧基异吩噁唑酮-脱乙基酶(EROD)作为生物标志物评价了不同浓度BaP暴露对大西洋虾(Xiphopenaeus kroyeri)肌肉组织的毒性效应; Banni等(2009)利用一相代谢酶EROD、二相代谢酶谷胱甘肽硫转移酶(GST)活性变化研究了BaP暴露对金头鲷肝脏的毒性效应; 任加云等(2006)利用超氧化物歧化酶(SOD)、过氧化氢酶(CAT)等抗氧化酶的活性、脂质过氧化(LPO)含量的变化研究了栉孔扇贝(Chlamys farreri)消化盲囊和鳃丝对BaP暴露的响应。但不同生物标志物对污染物的敏感程度存在差异, 且随时间变化而变化, 孤立分析某一种生物标志物对污染物暴露的响应并不能有效地评估其对生物的毒性效应, 综合生物标志物响应(Integrated Biomarker Response, IBR)指数能够评价多种生物标志物的综合响应, 避免各类生物标志物响应不同步引起的评估结果的偏差与不准确性, 更全面的评价污染物对生物的潜在影响。Kim等(2016)通过IBR定量评价了虾类(Cyprinus carpio)中多种生物标志物对多环芳烃短时间暴露的响应; Hou等(2016)应用IBR评价了ZnO纳米颗粒对生物膜的抗氧化酶的生态毒性; 蒋玫等(2015)应用IBR评价了0号柴油对黑鲷(Sparus macrocephalus)的毒性效应。脊尾白虾(Exopalaemon carinicauda)是一种重要的养殖经济虾类, 但目前国内外研究未见基于IBR评价BaP对脊尾白虾的毒性效应。
本研究通过BaP暴露下脊尾白虾肝胰脏、肌肉组织生物标志物(EROD、GST、SOD、CAT、MDA)的变化情况, 运用IBR定量评价BaP胁迫对脊尾白虾肝胰脏、肌肉组织的毒性效应差异, 分析探讨脊尾白虾肝胰脏、肌肉组织对BaP胁迫的响应并探讨其致毒机理, 为脊尾白虾的健康养殖, 生物质量控制提供科学依据。
1 材料与方法 1.1 实验材料海水取自启东市自然海区, 经过沉淀、砂滤、消毒后使用(盐度21, pH 8.1);脊尾白虾由江苏省金海岸水产研究所提供, 平均质量为(2.71±0.43)g, 实验前驯养15d;实验容器为150L的玻璃缸; BaP购自Sigma公司(USA), 使用丙酮作为助溶剂配置成母液。
1.2 实验方法通过预实验确定BaP暴露下脊尾白虾全部死亡和全部存活的浓度, 以此为依据, 设置2组实验浓度(0.45μg/L, 0.05μg/L), 另外设置1组海水对照组, 1组丙酮对照组(丙酮体积比 < 0.01%), 每组设3个重复; 分别放置70尾脊尾白虾, 24h充氧(溶解氧含量 > 5mg/L), 实验期间水温保持为(21±0.5)℃, 每组加入100L海水, 每24h时100%换水一次, 注意观察, 及时将行为异常或者死亡的受试生物捞出, 每天定时定量喂食配合饲料; 分别于第0、1、5、10、15天采集10尾样品, 取肝胰脏、肌肉组织并迅速保存在液氮中。
1.3 样品制备与毒理学指标的测定 1.3.1 样品制备将样品置于匀浆缓冲液中(0.15mol/L KCl, 20%(体积分数)甘油, pH为7.4的0.1mol/L的Tris-HCl缓冲液), 于冰浴中充分匀浆, 然后将匀浆液在4℃、10000r/min条件下离心20min, 取上清液分别测定酶活性。
1.3.2 毒理学指标的测定采用Pohl等(1980)快速终止荧光法测定EROD活性, Habig等(1974)的方法测定GST活性, 黄嘌呤氧化酶法测定SOD活性, 紫外分光光度法测定CAT活性(李康等, 2006), MDA含量采用硫代巴比妥法测定(任加云等, 2006)。
1.4 数据的处理和分析数据以平均值±标准差(Means±SD)表示, 并采用t检验法统计分析实验组与对照组间的数据差异, 显著性水平设为0.05。
IBR方法参照Kim等(2016)进行, 首先计算其在每个取样时间点测定结果的平均值(xi)以及在所有取样时间点测定结果的总平均值(x)和标准差(s), 按下式对每个取样点的xi进行均一化处理:
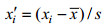 (1)
(1)式(1)中, xi'为xi均一化后的值。
每个取样时间点上该生物标志物的得分Bi值计算公式为
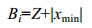 (2)
(2)式(2)中, |xmin|为所有每个取样点中该生物标志物均一化数据最小值的绝对值。某取样时间点上每种生物标志物的Bi值大小以星状图中辐射线的长度来表示。某取样时间点的IBR值通过计算星状图面积(即图中由相邻生物标志物的辐射线围成的三角形面积Ai之和得到:
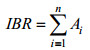 (3)
(3) (4)
(4)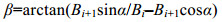 (5)
(5)式(3)—(5)中, n为所选用的生物标志物个数; α为相邻2条辐射线的夹角, α=2π/n; Bn+1=B1。当n=4时, α=π/2, 相应的Ai计算公式可简化为Ai=BiBi+1/2。
2 结果 2.1 BaP对脊尾白虾肝胰脏、肌肉组织生物标志物的诱导在本实验中, 丙酮处理组的各毒理指标与对照组相比变化不显著(P > 0.05)(图 1—图 5), 因此用丙酮作为助溶剂是可行的。
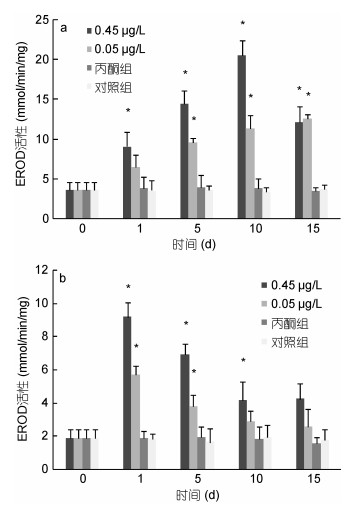 |
| 图 1 BaP对肝胰脏(a)、肌肉组织(b)EROD活性的影响 Fig. 1 Effects of BaP on EROD activities of hepatopancreas (a) and muscle (b) 注: *表示与对照组相比差异显著(P < 0.05), 下同 |
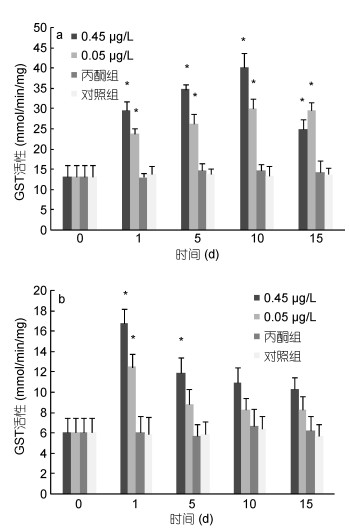 |
| 图 2 BaP对肝胰脏(a)、肌肉组织(b)GST活性的影响 Fig. 2 Effects of BaP on GST activities of hepatopancreas (a) and muscle (b) |
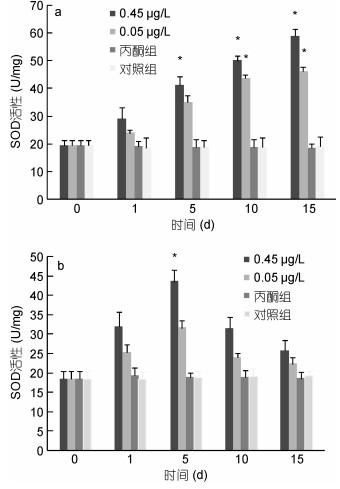 |
| 图 3 BaP对肝胰脏(a)、肌肉组织(b)SOD活性的影响 Fig. 3 Effects of BaP on SOD activities of hepatopancreas (a) and muscle (b) |
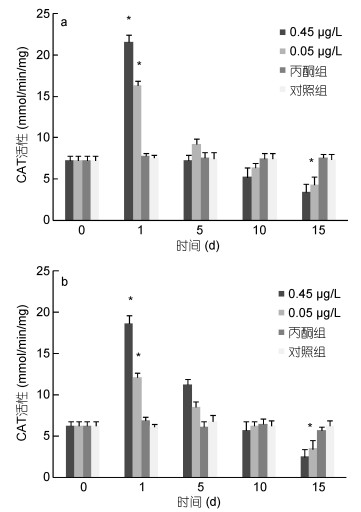 |
| 图 4 BaP对肝胰脏(a)、肌肉组织(b)CAT活性的影响 Fig. 4 Effects of BaP on CAT activities of hepatopancreas (a) and muscle (b) |
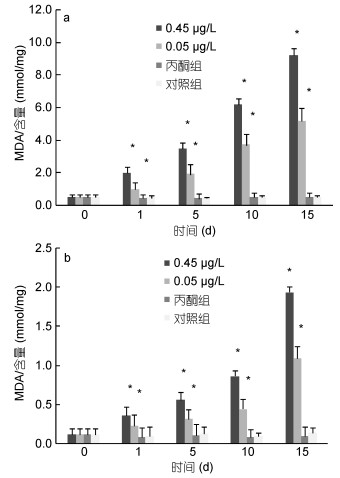 |
| 图 5 BaP对肝胰脏(a)、肌肉组织(b)MDA含量的影响 Fig. 5 Effects of BaP on MDA content of hepatopancreas (a) and muscle (b) |
0.45μg/L实验组脊尾白虾肝胰脏组织的EROD活性呈现先上升后下降的趋势, 在第10天时达到峰值, 为第0天的5.62倍, 在第15天时EROD活性依然显著高于对照组水平(P < 0.05); 0.05μg/L实验组脊尾白虾肝胰脏组织的EROD活性则呈现逐渐上升的趋势, 第15天时的峰值为第0天的3.45倍, 并且显著高于对照组水平(P < 0.05)(图 1a)。0.45μg/L、0.05μg/L实验组脊尾白虾肌肉组织的EROD活性均呈现先上升后下降的趋势, 且均在第1天时达到峰值, 分别为第0天的4.95倍、3.08倍, 0.45μg/L实验组EROD活性在第15天时依然显著高于对照组水平(P < 0.05), 而0.05μg/L实验组EROD活性在第10天时开始与对照组无显著性差异(P > 0.05)(图 1b)。
0.45μg/L、0.05μg/L实验组脊尾白虾肝胰脏组织的GST活性均呈现先上升后下降的趋势, 且均在第10天时达到峰值, 分别为第0天的3.15倍、2.28倍, 且在第15天时两个实验组GST活性依然显著高于对照组水平(P < 0.05)(图 2a)。0.45μg/L、0.05μg/L实验组脊尾白虾肌肉组织的GST活性也均呈现先上升后下降的趋势, 且均在第1天时达到峰值, 分别为第0天的2.74倍、2.04倍, 0.45μg/L实验组GST活性在第10天开始与对照组无显著性差异(P > 0.05), 而0.05μg/L实验组GST活性在第5天开始与对照组无显著性差异(P > 0.05)(图 2b)。
0.45μg/L、0.05μg/L实验组脊尾白虾肝胰脏组织的SOD活性均呈现逐渐上升的趋势, 0.45μg/L实验组SOD活性从第5天开始显著高于对照组(P < 0.05), 0.05μg/L实验组SOD活性从第10天开始显著高于对照组(P < 0.05), 在第15天达到峰值时两个实验组SOD活性分别为第0天的3.04倍、2.38倍(图 3a)。0.45μg/L、0.05μg/L实验组脊尾白虾肌肉组织的SOD活性均呈现先上升后下降的趋势, 0.45μg/L实验组SOD活性在第5天时显达到峰值并著高于对照组(P < 0.05), 为第0天的2.37倍, 0.05μg/L实验组SOD活性在第5天时显达到峰值但与对照组并无显著性差异(P > 0.05), 为第0天的1.72倍(图 3b)。
0.45μg/L、0.05μg/L实验组脊尾白虾肝胰脏组织的CAT活性均呈现先上升后下降的趋势, 且均在第1天即达到峰值且均显著高于对照组水平(P < 0.05), 分别为第0天的2.97倍、2.25倍, 随后逐渐下降, 第15天时0.45μg/L实验组CAT活性显著低于对照组水平(P < 0.05), 0.05μg/L实验组CAT活性与对照组之间则无显著性差异(P > 0.05)(图 4a)。0.45μg/L、0.05μg/L实验组脊尾白虾肌肉组织的CAT活性也均呈现先上升后下降的趋势, 且均在第1天即达到峰值且均显著高于对照组水平(P < 0.05), 分别为第0天的3.02倍、1.97倍, 随后逐渐下降, 第15天时0.45μg/L实验组CAT活性显著低于对照组水平(P < 0.05), 0.05μg/L实验组CAT活性与对照组之间则无显著性差异(P > 0.05)(图 4b)。
0.45μg/L、0.05μg/L实验组脊尾白虾肝胰脏、肌肉组织的MDA含量均呈现逐渐上升的趋势, 且各实验组MDA含量从第1天开始即显著高于对照组(P < 0.05), 在第15天达到峰值时两个实验组肝胰脏组织的MDA含量分别为第0天的19.39倍、10.90倍(图 5a); 两个实验组肌肉组织的MDA含量分别为第0天的16.18倍、9.10倍(图 5b)。
2.2 综合生物标志物分析不同浓度BaP暴露条件下IBR值以星状图的形式表示(图 6, 图 7), 星状图中的多边形面积即为IBR值。可以看出, 在不同实验时间点, 0.45μg/L、0.05μg/L实验组脊尾白虾肝胰脏、肌肉组织各生物标志物均受到了诱导或者抑制, 与0.05μg/L实验组和对照组相比, 0.45μg/L实验组星状图覆盖面积较大, 其IBR值也相应较大, 同时, 各实验组覆盖面积, 即IBR值也随时间变化。
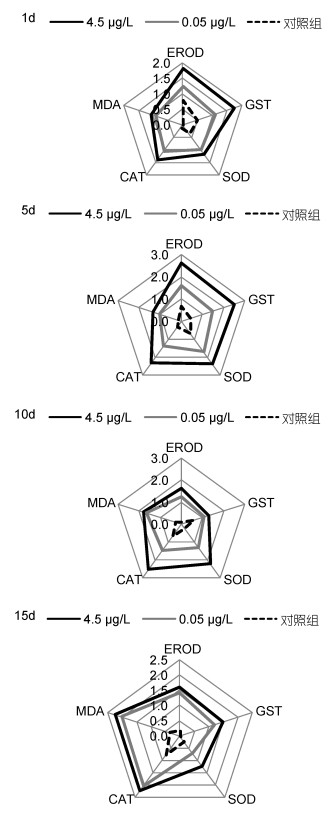 |
| 图 6 不同时间BaP胁迫下肝胰脏组织IBR星状图 Fig. 6 Star plots for biomarker responses in hepatopancreas |
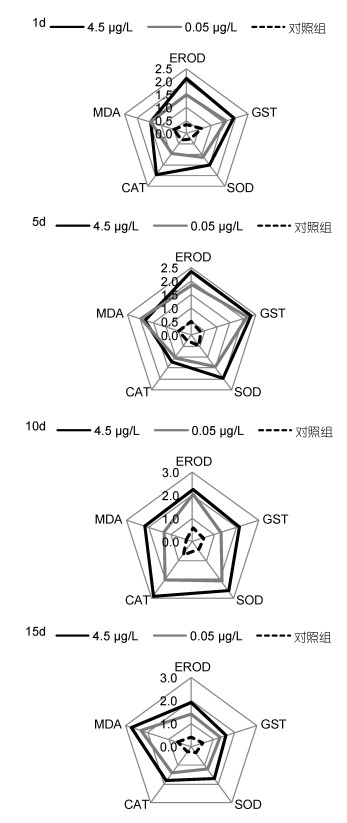 |
| 图 7 不同时间BaP胁迫下肌肉组织IBR星状图 Fig. 7 Star plots for biomarker responses in muscle |
各实验组脊尾白虾肝胰脏、肌肉组织IBR值随暴露时间的变化如图 8所示, 1—10d各实验组脊尾白虾肝胰脏、肌肉组织IBR值均呈现先上升后下降的趋势, 其中肝胰脏组织IBR值在第10天到达峰值, 为23.43(图 8a); 肌肉组织IBR值在第5天到达峰值, 为15.44(图 8b)。各实验组脊尾白虾肝胰脏、肌肉组织IBR值随暴露浓度的变化如图 9所示, 0.45μg/L、0.05μg/L、对照组实验组肝胰脏IBR值分别为44.23、29.01、1.85(图 9a); 0.45μg/L、0.05μg/L实验组肝胰脏组织IBR值分别为32.07、17.51、1.28(图 9b)。0.45μg/L实验组IBR值显著高于0.05μg/L和对照组, 相同BaP暴露浓度下, 肝胰脏组织IBR值则显著高于肌肉组织。
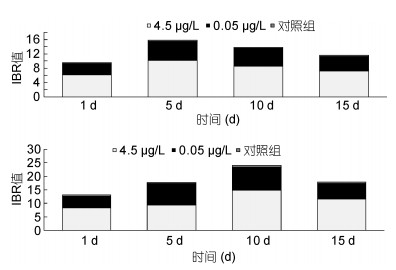 |
| 图 8 IBR值(肝胰脏(a), 肌肉组织(b))随时间的变化 Fig. 8 IBR values of hepatopancreas (a) and muscle (b) changes vs time |
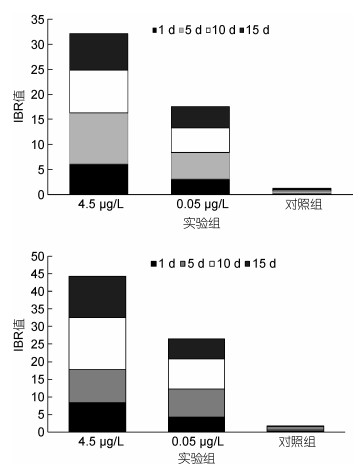 |
| 图 9 IBR值(肝胰脏(a)、肌肉组织(b))随浓度的变化 Fig. 9 IBR values of hepatopancreas (a) and muscle (b) changes vs concentrations |
BaP的生物转化可以分成Ⅰ相和Ⅱ相反应, EROD属于混合功能氧化酶系(mixed function oxidase, MFO)中细胞色素P450依赖的典型Ⅰ相代谢酶, 能够被BaP诱导, 催化生物体中BaP的降解过程(Gagnon et al, 2000), 随后, 在Ⅱ相反应中, GST催化谷胱苷肽等生物内源性的水溶性分子与Ⅰ相代谢产物结合, 形成更为亲水的物质排出体外, 从而起到代谢解毒作用(Gadagbui et al, 2000)。在本研究中, 0.45μg/L实验组脊尾白虾肝胰脏、肌肉组织对EROD、GST的诱导效应均高于0.05μg/L实验组, 表现出一定的剂量-效应关系。同时, 0.45μg/L、0.05μg/L实验组脊尾白虾肝胰脏、肌肉组织的EROD、GST活性随时间的变化均表现为先上升后下降, 但肌肉组织的EROD、GST活性被诱导的峰值均低于肝胰脏组织, 这表明, 相比较肌肉组织, BaP对肝胰脏的诱导更强。这是因为肝胰脏是生物体主要的内源性、外源性污染物的解毒代谢组织, 其解毒代谢功能相比较肌肉能力更强(Santos et al, 2004)。在第15天, 暴露实验结束时, 两个浓度实验组的肝胰脏组织EROD、GST活性依然显著高于对照组水平(P < 0.05), 而肌肉组织则仅有0.45μg/L实验组EROD活性依然显著高于对照组水平(P < 0.05)也证明了脊尾白虾的肝胰脏组织具有更强的解毒代谢功能。
EROD、GST的解毒代谢过程伴随着大量活性氧自由基(O2–, ·OH, H2O2等)的产生, 活性氧自由基能够引起酶失活、脂质过氧化、DNA断裂等机体损伤。生物体内的抗氧化酶防御系统则能够清除活性氧, 其中SOD能将O2–转化成H2O2, CAT能进一步将H2O2转化成水(Solé et al, 1995; Solé, 2000)。在本研究中, 脊尾白虾的肝胰脏、肌肉组织SOD、CAT也表现出一定的剂量-效应关系, 0.45μg/L实验组脊尾白虾肝胰脏、肌肉组织对SOD、CAT的诱导效应均高于0.05μg/L实验组。在BaP的暴露初期, 应激反应促使生物机体组织提高SOD、CAT活性清除过量的活性氧自由基, 但随着曝露时间增加, 活性氧自由基的产生超过了SOD、CAT的清除能力, 过量的活性氧自由基对脊尾白虾的机体组织造成了损伤, 抑制了SOD、CAT酶的活性, 肝胰脏的SOD活性尽管表现为持续增加, 但其增加幅度却逐渐减少。
当活性氧自由基在生物机体内累积到一定程度时, 会导致机体的脂质氧化作用, 脂质氧化作用可以用丙二醛(MDA)的含量代表(Thomas et al, 1990)。在本研究中, 0.45μg/L、0.05μg/L实验组脊尾白虾肝胰脏、肌肉组织的MDA含量在第1天即开始显著升高(P < 0.05)并持续上升, 表明此时已经开始产生脂质氧化作用并随暴露时间延长趋于严重; 同时, 肝胰脏组织MDA含量高于肌肉组织, 表明作为解毒代谢主要器官的的肝胰脏组织受到的脂质氧化作用更加严重。
脊尾白虾肝胰脏、肌肉组织的EROD、GST、SOD、CAT、MDA对BaP暴露的响应并不一致, 单独使用某一个指标不能较为全面评价BaP对脊尾白虾的毒性效应。IBR可以通过量化的数值直观反映BaP的暴露毒性, 从而有效比较不同暴露浓度下的BaP毒性差异。在本研究中, 脊尾白虾肝胰脏、肌肉组织IBR值表现出了显著的剂量-毒性效应以及组织特异性, 对相同组织, 高浓度实验组的IBR值高于低浓度实验组, 而对相同实验浓度, 肝胰脏组织的IBR值高于肌肉组织。这个结果不但验证了肝胰脏的主要解毒代谢功能, 更量化了其与肌肉组织的差异, 表明IBR可以作为一种定量评价污染物毒性效应的有效工具。
4 结论(1) 不同浓度的BaP暴露对脊尾白虾肝胰脏、肌肉组织的EROD、GST、SOD、CAT、MDA毒性效应指标均有不同程度的诱导作用, 剂量效应关系与时间效应关系明显, 暴露过程中各毒性效应指标整体呈现出先诱导后抑制的规律性变化。
(2) 脊尾白虾肝胰脏、肌肉组织IBR值均呈现先上升后下降的趋势, IBR值与BaP暴露浓度及时间存在剂量效应关系与时间效应关系, 脊尾白虾肝胰脏、肌肉组织对BaP的暴露响应存在差异性, 肝胰脏生物标志物综合应激活性高于肌肉组织。
| 任加云, 潘鲁青, 苗晶晶., 2006. 苯并(a)芘和苯并(k)荧蒽混合物对栉孔扇贝毒理学指标的影响. 环境科学学报, 26(7): 1180–1186 |
| 李康, 周忠良, 陈立侨等, 2006. 苯并[a]芘对鲫鱼生物标志物的影响研究. 环境科学研究, 19(1): 91-95 |
| 蒋玫, 李磊, 沈新强, 等, 2015. 基于整合生物标志物响应指数评价0号柴油对黑鲷(Sparus macrocephalus)的毒性效应. 生态与农村环境学报, 31(2): 230–237 DOI:10.11934/j.issn.1673-4831.2015.02.014 |
| Banni M, Bouraoui Z, Ghedira J et al, 2009. Acute effects of benzo[a]pyrene on liver phase I and Ⅱ enzymes, and DNA damage on sea bream Sparus aurata. Fish Physiology and Biochemistry, 35(2): 293-299 |
| Da Silva Rocha A J, Gomes V, De Arruda Campos Rocha Passos M J et al, 2012. EROD activity and genotoxicity in the seabob shrimp Xiphopenaeus kroyeri exposed to benzo[a]pyrene (BaP) concentrations. Environmental Toxicology and Pharmacology, 34(3): 995-1003 |
| Gadagbui B K M, James M O., 2000. Activities of affinity-isolated glutathione S-transferase (GST) from channel catfish whole intestine. Aquatic Toxicology, 49(1-2): 27–37 DOI:10.1016/S0166-445X(99)00073-9 |
| Gagnon M M, Holdway D A., 2000. EROD induction and biliary metabolite excretion following exposure to the water accommodated fraction of crude oil and to chemically dispersed crude oil. Archives of Environmental Contamination and Toxicology, 38(1): 70–77 DOI:10.1007/s002449910009 |
| Haasch M L, Lech J J, Prince R, et al, 1993. Caged and wild fish:Induction of hepatic cytochrome P-450 (CYP1A1) as an environmental biomonitor. Environmental Toxicology and Chemistry, 12(5): 885–895 DOI:10.1002/etc.v12:5 |
| Habig W H, Pabst M J, Jakoby W B., 1974. Glutathione S-transferases. The first enzymatic step in mercapturic acid formation. Journal of Biological Chemistry, 249(22): 7130–7139 |
| Hou J, You G X, Xu Y, et al, 2016. Antioxidant enzyme activities as biomarkers of fluvial biofilm to ZnO NPs ecotoxicity and the Integrated Biomarker Responses (IBR) assessment. Ecotoxicology and Environmental Safety, 133: 10–17 DOI:10.1016/j.ecoenv.2016.06.014 |
| Kim J H, Kim W K, et al, 2016. Use of the integrated biomarker response to measure the effect of short-term exposure to dibenz[a, h]anthracene in common carp (Cyprinus carpio). Bulletin of Environmental Contamination and Toxicology, 96(4): 496–501 DOI:10.1016/j.ecoenv.2016.06.014 |
| Lam P K S, Gray J S., 2003. The use of biomarkers in environmental monitoring programmes. Marine Pollution Bulletin, 46(2): 182–186 DOI:10.1016/S0025-326X(02)00449-6 |
| Pohl R J, Fouts J R, 1980. A rapid method for assaying the metabolism of 7-ethoxyresorufin by microsomal subcellular fractions. Analytical Biochemistry, 107(1): 150–155 |
| Ren X Y, Pan L Q, Lin W, 2015. Toxic effects upon exposure to benzo[a]pyrene in juvenile white shrimp Litopenaeus vannamei. Environmental Toxicology and Pharmacology, 39(1): 194–207 |
| Santos M A, Pacheco M, Ahmad I., 2004. Anguilla anguilla L. antioxidants responses to in situ bleached kraft pulp mill effluent outlet exposure. Environment International, 30(3): 301–308 |
| Solé M, Porte C, Albaigés J., 1995. The use of biomarkers for assessing the effects of organic pollution in mussels. Science of the Total Environment, 159(2-3): 147–153 DOI:10.1016/0048-9697(95)04182-Z |
| Solé M., 2000. Assessment of the results of chemical analyses combined with the biological effects of organic pollution on mussels. Trac Trends in Analytical Chemistry, 19(1): 1–9 DOI:10.1016/S0165-9936(99)00174-0 |
| Thomas J P, Maiorino M, Ursini F, et al, 1990. Protective action of phospholipid hydroperoxide glutathione peroxidase against membrane-damaging lipid peroxidation. In situ reduction of phospholipid and cholesterol hydroperoxides. Journal of Biological Chemistry, 265(1): 454–461 |
| Wang S H, Wang X H, Hong H S., 2005. Specific characteristic of tissue bioaccumulation of PAHs in green lipped mussels (Perna viridis) at different growth stages. Marine Environmental Science, 24(3): 29–32 |
 2018, Vol. 49
2018, Vol. 49


