中国海洋湖沼学会主办。
文章信息
- 王玉, 彭吉星, 吴海燕, 郭萌萌, 佟蒙蒙, 谭志军. 2018.
- WANG Yu, PENG Ji-Xing, WU Hai-Yan, GUO Meng-Meng, TONG Meng-Meng, TAN Zhi-Jun. 2018.
- 基于高效液相色谱法的扇贝毒素-2制备方法研究
- PREPARATION OF PECTENOTOXIN-2 BY HIGH-PERFORMANCE LIQUID CHROMATOGRAPHY
- 海洋与湖沼, 49(3): 568-576
- Oceanologia et Limnologia Sinica, 49(3): 568-576.
- http://dx.doi.org/10.11693/hyhz20171000272
-
文章历史
- 收稿日期:2017-10-24
- 收修改稿日期:2018-01-19
2. 中国水产科学研究院黄海水产研究所 青岛 266071;
3. 舟山市疾病预防控制中心 舟山 316021
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China;
3. Key Laboratory of Testing and Evaluation for Aquatic Product Safety and Quality, Ministry of Agriculture, Zhoushan 316021, China
近年来, 人类因误食沾染贝类毒素的海产品而造成中毒的现象屡见不鲜。贝类毒素主要由有毒藻类产生, 通过滤食过程积累在海洋生物体内, 被人类误食后影响身体健康(Hallegraeff et al, 2003; FAO, 2004; Reguera et al, 2014)。扇贝毒素(Pectenotoxins, PTXs)是一种肝毒素, 能诱导肝细胞快速坏死, 是具有大环内酯结构的脂溶性聚醚类化合物, 因常在贝类毒素中毒事件中与腹泻性贝毒大田海绵酸(Okadaic acid, OA)和鳍藻毒素(Dinophysistoxin, DTXs)共同大量检出而引起广泛关注(Suzuki et al, 2009; Reguera et al, 2014; 王艳龙等, 2016)。迄今已有20余种PTXs类组分及其衍生物被鉴定, 其中尤以扇贝毒素-2(Pectenotoxin-2, PTX2)最为常见(Reguera et al, 2014; García et al, 2016)(图 1)。自1984年PTXs在日本养殖的扇贝Patinopecten yessoensis中被首先鉴定出后, 扇贝毒素陆续在全球其他海域被发现(Hallegraeff et al, 2003; Miles et al, 2004; Suzuki et al, 2006; Reguera et al, 2012; Li et al, 2017)。鉴于PTXs潜在的细胞毒性(Miles et al, 2004; Kim et al, 2008), 欧盟规定了水产品可食用组织中PTXs的含量, 与OA和DTXs之和不得超过160μg/kg, 且为防止按照此标准造成急性参考剂量(ARfD)超标, 规定食用400g贝肉中PTXs含量不得超过120μg/kg (Alexander et al, 2009)。因此建立一套完整的PTXs监测和检测技术, 自主制备PTXs毒素标准品, 是实现海产品食用安全的必需手段。
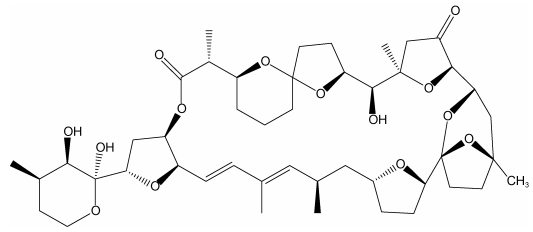 |
| 图 1 PTX2的化学结构式(James et al, 1999) Fig. 1 The chemical structure of PTX2 (James et al, 1999) |
扇贝毒素, 特别是PTX2, 主要由海洋甲藻中的鳍藻属(Dinophysis spp.)产生, 如倒卵形鳍藻(Dinophysis fortii)、渐尖鳍藻(D. acuminata)、尖锐鳍藻(D. acuta)、具尾鳍藻(D. caudata)、勇士鳍藻(D. miles)等(Suzuki et al, 2009; Reguera et al, 2012; Nielsen et al, 2013; Tong et al, 2015)。但由于鳍藻的混合营养特性, 即鳍藻的生长和繁殖需要三级食物链[鳍藻—红色中缢虫(Mesodinium rubrum)—隐藻(Geminigera cryophila)]来完成(Park et al, 2006), 这为从大规模培养的鳍藻中提取PTX2带来一定的困难。因此, 国际上一般是通过大量收集浓缩野外海水样品或染毒贝类来获取PTX2标准品的制备原料。这样的工艺不仅制备过程复杂且工序繁琐, 更重要的是原料来源极不稳定, 无法满足常规监管及应急需要。
因此, 本研究以上述三级食物链为实验手段(Gao et al, 2017), 成功大规模培养了来自中国大连海域的渐尖鳍藻(DAYS01-E6株), 为制备PTX2提供了充足的原料。并在此基础上, 重点研究了在纯种鳍藻细胞中提取、分离、HPLC纯化PTX2的标准化方法, 同时采用高效液相色谱-串联质谱(HPLC-MS/MS)进行定量检测, 为建立高效快速的PTX2标准物质研制方法奠定基础。
1 材料与方法 1.1 藻细胞的培养与收集渐尖鳍藻(DAYS01-E6株)于2014年单细胞分离于中国大连海域(Gao et al, 2017), 红色中缢虫(JAMR)和隐藻(JATA)来自日本海域(Nagai et al, 2008), 该三株藻样均在15℃, 低光照(~50μmol photons/m2·s), 光暗周期比14h:10h的环境下培养。
将30mL(~4000cells/mL)的红色中缢虫和2mL (~200000cells/mL)隐藻, 接种到30mL f/6-Si培养基中, 当隐藻全部被摄食后, 红色中缢虫可用来作为渐尖鳍藻的食物。取一定量的DAYS01-E6加入到含800mL f/2-Si培养基的锥形瓶中, 每周加入约2倍其细胞密度的红色中缢虫。当鳍藻密度达到~8000cells/mL时, 对藻细胞进行收集。收集时, 首先将藻液经15μm筛绢过滤, 将收集到筛绢上的藻细胞用f/2-Si培养液冲洗到15mL离心管中, 置于-80℃冰箱冻存备用。
1.2 扇贝毒素-2提取 1.2.1 细胞破碎方法本研究从五种细胞破碎方法中进行筛选, 分别是:
(a) 煮沸法:取冰冻状态的藻液于100℃沸水浴中加热10min;
(b) 反复冻融法:冰冻状态的藻液于室温下解冻, 化冻完全后, 再次置于-80℃冰箱冷冻, 反复冻融3次;
(c) 超声破碎法:取室温解冻状态藻液置于超声波清洗器中水浴超声破碎15min(超声功率300W, 频率40kHz);
(d) 超声波细胞破碎法:取室温解冻状态藻液, 在冰水浴条件下使用超声波细胞破碎机进行细胞破碎(超声功率325W、超声频率25kHz、破碎时间/超声时间5s/10s、持续时间20min, 温度不超过20℃, 仪器连续工作时间不超过120min);
(e) 反复冻融结合超声波细胞破碎法:结合(b)和(d), 具体条件参上。显微镜观察破碎前后完整细胞的个数, 计数三次记录平均值, 其中破碎前细胞数C0, 破碎后为C1, 并用L=(1–C1/C0)×100%计算细胞破碎率。
对上述细胞破碎方法进行比较, 选取最优方式用于毒素提取。
1.2.2 毒素提取方法本研究比较了三种液液萃取方法和三种固相萃取方式对破碎细胞中PTX2的提取效果, 其中液液萃取选用的有机试剂为:
(1) 甲醇直接提取法:冻融后的藻细胞加入等体积80%甲醇, 按(d)进行细胞破碎。离心3min (8000r/ min), 取出上清液旋转蒸发浓缩, 待进一步纯化。
(2) 丙酮直接提取法:取收集的藻液反复冻融三次后摇匀。加入等体积丙酮溶液, 按(d)进行细胞破碎。离心3min (8000r/min), 取出上清液蒸发浓缩, 待纯化。
(3) 乙醚-二氯甲烷萃取法:取破碎后的藻液, 依次用等体积乙醚和二氯甲烷各萃取两次, 萃取时充分震荡, 合并萃取液, 加入无水硫酸钠或无水硫酸镁除水后除去干燥剂, 用35—40℃旋转蒸发浓缩后, 待纯化(Miles et al, 2004)。
固相萃取提取方式则比较了三种针对脂溶性毒素有良好吸附能力的固相萃取小柱, 分别为: Waters Oasis HLB SPE (60mg/3mL, 美国Waters公司), Phenomenex Strata-X SPE (60mg/3mL, 美国Phenomenex公司), Waters Sep-Pak C18 SPE (60mg/ 3mL, 美国Waters公司), 具体方法为:
(4) SPE固相萃取法: SPE柱先分别依次用3mL甲醇和3mL Milli-Q水进行活化平衡, 然后直接加入10mL破碎的藻液, 1mL纯水淋洗以去除极性物质, 减压抽干后, 用0.5mL甲醇洗脱两次, 并收集洗脱液, 过0.22μm有机相滤膜, 待进一步纯化。三种SPE柱的处理方式和步骤相同。
毒素提取方法的选取, 以毒素提取回收率的高低来决定。将一定量的PTX2毒素标准品T0加入到冻融后的藻液样品中, 作为实验组, 不添加标准品的样品作为对照组, 分别测定经上述提取方法后的PTX2毒素含量, 其中对照组PTX2毒素含量为T1, 实验组为T2, 并用计算公式R=(T2–T1)/T0来计算回收率。
1.2.3 葡聚糖凝胶色谱柱分离液液萃取后的PTX2粗提液选用葡聚糖凝胶柱净化。凝胶柱采用Sephadex LH20进行装填, 凝胶材料经甲醇活化后, 湿法装填入玻璃层析柱(60cm×1.2cm)。将经有机试剂提取后的扇贝毒素浓缩提取液(3mL)上样后, 用甲醇洗脱, 分段收集, 每管收集液为10mL。从各管取1mL进行HPLC-MS/MS分析。根据该结果, 收集含PTX2的组分(约为250—600mL)合并、浓缩, 进行高效液相色谱纯化。
1.3 液相色谱纯化过程采用配有光电二极管阵列检测器及Empower3数据处理系统的Waters e2695高效液相色谱进行分析。制备色谱条件:色谱柱Phenomenex Kinetex C18 (4.8mm×250mm, 5μm); 柱温: 40℃; 检测波长: 235nm; 流速: 1mL/min; 流动相A:纯水(含6.7mmol/L氨水); 流动相B:色谱纯乙腈/水(90:10, v/v, 含6.7mmol/L氨水); 梯度洗脱程序为: 0— 15.0min, 20% B; 15.0—20.0min, 20%—80% B; 20.0— 20.1min, 80%—20% B; 20.1—25.0min, 20% B。根据PTX2在235nm处有较强吸收这一特点, 采用二极管阵列检测器在紫外光区对其进行检测。总分析时间为26min, 根据峰形收集15—17min流出液, 40℃减压蒸发浓缩, 甲醇稀释溶解后, HPLC-MS/MS分析PTX2纯度。
1.4 液相色谱-串联质谱分析条件采用5500QTRAP四极杆-线性离子阱复合质谱(ESI源)进行分析。液相色谱条件: Phenomenex XB-C18色谱柱(2.1mm×100mm, 2.6µm); 延迟柱: C18色谱柱(2.1mm×50mm, 5µm); 柱温: 40℃; 流速: 0.350mL/min; 进样量: 5µL; 流动相:流动相A为水(含50mmol/L甲酸、2mmol/L甲酸铵), 流动相B为95%乙腈水溶液(含50mmol/L甲酸、2mmol/L甲酸铵); 梯度洗脱: 0—7.0min, 20% B; 7.0—10.0min, 20%— 90% B; 10.0—10.1min, 90%—20% B; 10.1—12.0min, 20% B。
质谱条件:电喷雾离子源(ESI), 多反应监测(MRM), 正负离子同时监测模式; 气帘气: 20psi; 正负离子喷雾电压为: 5.5kV和-4.5kV; 离子源温度: 550℃; 离子源气1: 345kPa; 离子源气2: 345kPa; 其他监测参数见表 1。PTX2及其常见伴生毒素OA、DTX2、DTX1、YTX、GYM、SPX1等毒素标准品购自于加拿大国家海洋生物研究中心, 标准曲线采用五个不同梯度的浓度(10—200ng/mL)进行计算; 以三倍信噪比(S/N≥3)确定方法的检出限(LOD), 以10倍信噪比(S/N≥10)确定检测组分的定量限(LOQ), 其中PTX2的检出限为6ng/mL, 定量限为19.8ng/mL。
| 化合物 | 检测离类型(m/z) | 定量离子对 | 碰撞能(eV) | 定性离子对 | 碰撞能(eV) | 去簇电压(v) |
| 大田软海绵酸 (okadaic acid, OA) |
[M–H]– | 803.5/255.1 | –61 | 803.5/563.4 | –55 | –40 |
| 鳍藻毒素-2 (dinophysistoxin-2, DTX2) |
[M–H]– | 803.5/255.1 | –61 | 803.5/563.4 | –55 | –40 |
| 鳍藻毒素-1 (dinophysistoxin-1, DTX1) |
[M–H]– | 817.5/255.2 | –65 | 817.5/563.3 | –60 | –20 |
| 虾夷扇贝毒素 (yessotoxin, YTX) |
[M–H]– | 1141.5/1061.7 | –50 | 1141.5/855.5 | –102 | –30 |
| 扇贝毒素-2sa (pectenotoxin-2SA, PTX2sa) |
[M–H]– | 875.5/137.2 | –61 | 875.5/179.2 | –61 | –50 |
| 扇贝毒素-2 (pectenotoxin-2, PTX2) |
[M+NH4]+ | 876.5/212.7 | 50 | 876.4/823.0 | 30 | 40 |
| 扇贝毒素-11 (pectenotoxin-11, PTX11) |
[M+NH4]+ | 892.5/212.7 | 50 | 892.5/839.5 | 30 | 40 |
| 扇贝毒素-12 (pectenotoxin-12, PTX12) |
[M+NH4]+ | 874.5/212.7 | 50 | 874.5/821.5 | 30 | 40 |
| 扇贝毒素-1 (pectenotoxin-1, PTX1) |
[M+NH4]+ | 892.5/213.2 | 50 | 892.5/839.5 | 40 | 40 |
| 环亚胺毒素 (gymnodimine, GYM) |
[M+H]+ | 692.5/444.4 | 50 | 692.5/674.4 | 40 | 50 |
| 螺环内酯毒素 (spirolides-1, SPX1) |
[M+H]+ | 508.3/490.3 | 35 | 508.3/136.1 | 50 | 60 |
本研究利用高效液相色谱-串联质谱(HPLC- MS/MS)方法对上述脂溶性毒素进行定性和定量检测, 用于对毒素提取和纯化方法的筛选。
首先, 纯种渐尖鳍藻藻液的PTXs毒素分析。针对实验室前期建立的OA、DTXs和PTXs等脂溶性贝类毒素检测方法(Wu et al, 2014)进行优化, 以确定提取物中是否含有除PTX2外的其他扇贝毒素(Suzuki et al, 2006; Ito et al, 2008)。具体操作为:采用QTRAP系统MIM(多粒子监测)作为预扫描模式, 建立非目标物筛查方法。采用MIM-ER-EPI工作模式, 电喷雾离子源(Turbo Ion Spray)作为离子源, 正离子模式检测, 其中四级杆Q3和Q1设置为相同质荷比的方法, 设定选择的离子为[M+NH4]+, 扫描离子质荷比(m/z)范围为655—1055的离子。为避免母离子在Q2碰撞池碎裂, 将碰撞能设为5V。每对离子驻留和停顿时间设为1ms, 该方法一个周期为1.3s。根据理论质量数的选定, 在m/z为876.5(图 2b)、892.5(图 2c)、894.5和874.5(图 2d)(Miles et al, 2004, 2006; Gerssen et al, 2009)处检测到色谱峰, 且峰形良好, 初步判断为PTX12(874.5)、PTX2(876.5)、PTX11、PTX1、PTX12sa (892.5)和PTX2sa(894.5), 在m/z为906.5处没有色谱峰检出, 初步判断没有PTX6和PTX7(图 2e)。
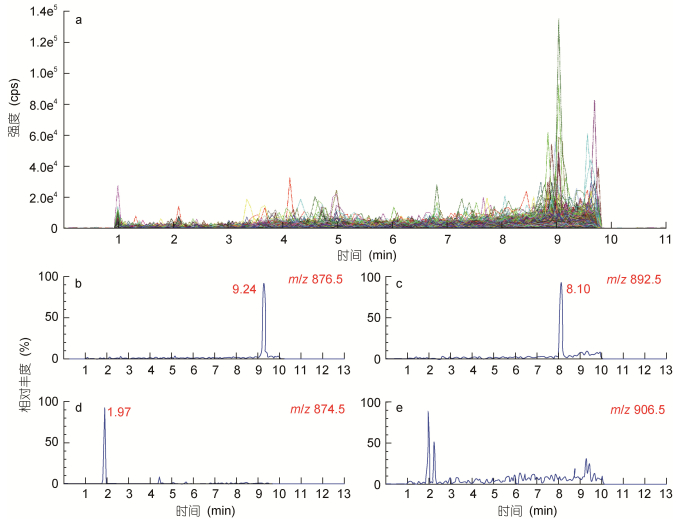 |
| 图 2 MIM扫描模式的总离子流图(a)与特定离子提取图(b, c, d, e) Fig. 2 Chromatography in MIM scanning mode on total ion (a) and selected ion (b, c, d, e) 注: b: m/z 876.5; c: m/z 892.5; d: m/z 874.5; e: m/z 906.5 |
为进一步确定渐尖鳍藻中PTXs毒素的种类, 本研究结合IDA-EPI采集模式, 以多反应监测+正负离子监测模式重点优化检测到的PTXs毒素的子离子和碰撞能, 增加了PTX2sa、PTX11、PTX12和PTX1的MRM扫描离子(表 1); 检测过程中, 通过预设条件对疑似检测结果触发EPI增强子离子扫描, 获得未知化合物的增强二级质谱图, 该质谱图可与在线质谱谱库进行匹配辅助定性。研究结果显示, 实验培养的渐尖鳍藻(DAYS01-E6株)产毒种类除OA、DTX2和DTX1外, PTXs包括PTX2、PTX11, 且PTX2含量远高于其他四种毒素(图 5), 适用于毒素制备。
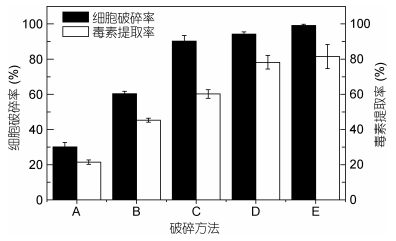 |
| 图 3 破碎方法对细胞破碎率和毒素提取率的影响(n=5) Fig. 3 Responses of different cell disruption methods on cell disruption rate and toxin extraction efficiency (n=5) 注: A:煮沸法; B:反复冻融法; C:超声破碎法; D:超声波细胞破碎法; E:反复冻融结合超声波细胞破碎法 |
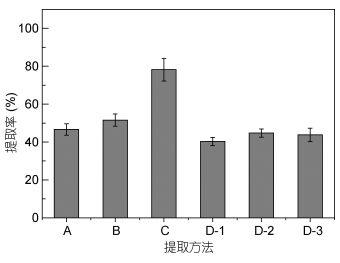 |
| 图 4 提取方法对PTX2毒素提取回收率的比较(n=5) Fig. 4 PTX2 toxin extraction efficiency from Dinophysis spp by different extraction methods (n=5) 注: A:甲醇直接提取法; B:丙酮直接提取法; C:乙醚-二氯甲烷萃取法; D-1:固相萃取小柱Waters Oasis HLB; D-2:固相萃取小柱Phenomenex Strata-X; D-3:固相萃取小柱Waters Sep-Pak C18 |
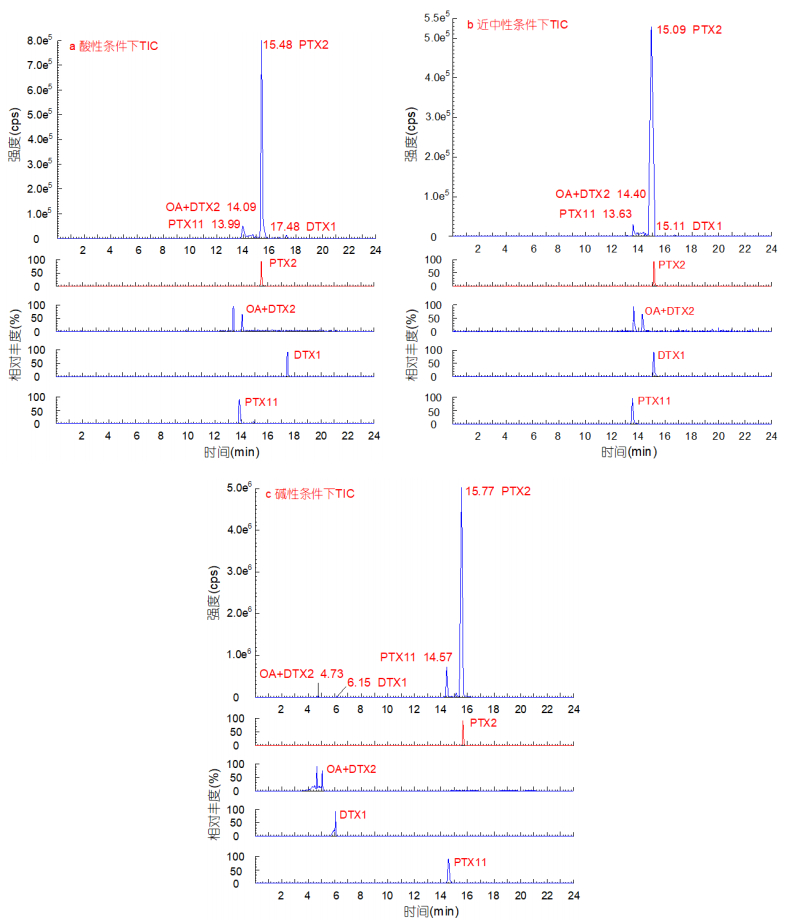 |
| 图 5 三种流动相条件下HPLC-MS/MS检测的鳍藻中毒素粗提物的总离子流色谱图和提取离子色谱图 Fig. 5 TIC and XIC chromatograms of toxin extractions from Dinophsis.spp. by HPLC-MS/MS in three types of mobile phase 注: TIC: total ion chromatography, 总离子流色谱图; XIC: extracted ion chromatography, 提取离子色谱图 |
细胞的充分破碎有利于PTXs的释放和提取(Cuellar-Bermudez et al, 2015)。本研究采用了五种细胞破碎的方法, 其破碎程度及PTX2提取效率如图 3所示。这五种破碎方法均可对藻细胞进行不同程度的破碎, 其中反复冻融和超声波细胞破碎法对毒素提取率最高, 为81.51% (n=5), 其次是超声波细胞破碎法(78.24%)、超声破碎法(60.23%)和反复冻融法(45.27%)(图 3)。煮沸法的毒素提取效率最低(21.45%), 这可能与PTXs在高温环境下易变性或转化有关(García et al, 2016)。冰水浴超声细胞破碎的过程在较低的温度下进行, 适用于对PTX2等热敏性物质的提取, 并得到相对较高的毒素提取率。同时, 实验发现冻融对细胞破碎也有一定的效果, 如一次冻融后的细胞破碎率不高(22.30%), 但多次冻融其破碎效率显著提高。为避免多次冻融过程的耗时低效问题(钟韵山等, 2014), 本研究结合了超声波等辅助方法。超声波破碎具有耗能较低、破碎均匀、易于操作以及处理时间短(Halim et al, 2012)等优点, 在对超声波破碎法和超声细胞破碎法的选择中, 该细胞破碎率分别达到90.24%和94.24%, 同时, 对PTX2毒素的提取, 超声细胞粉碎机也优于超声清洗器(81.51% > 78.24%)。反复冻融与超声波细胞破碎相结合可获得最大的细胞破碎率和毒素提取率, 分别为99.2%和81.5%。因此, 实验最终采用反复冻融结合超声波细胞破碎法对鳍藻细胞破碎。
2.2.2 提取方法对制备的影响实验采用液相萃取(LPE)和固相萃取(SPE)法对PTX2的提取效率进行分析, 并采用加标回收进行验证(图 4)。从图 4中可以看出, 有机试剂能较高效地提取藻细胞中的PTX2毒素, 提取效率随有机试剂种类和浓度的变化而改变。PTX2是脂溶性物质, 本研究选择的三种试剂均为常用的脂溶性物质溶剂(Miles et al, 2004, 2006; Matsushima et al, 2015; Li et al, 2017), 其中乙醚-二氯甲烷的提取效率最高, 达到78.2% (n=5), 其次是丙酮(51.6%), 甲醇的提取效率最低(46.6%)。同时, 乙醚和二氯甲烷的毒性均小于丙酮与甲醇, 且具有价格优势, 因此被选定为PTX2毒素最优的液液萃取试剂。然后利用葡聚糖凝胶色谱柱分离去除粗提物中的大量藻类色素和脂肪酸等杂质, 最后进行HPLC-MS/ MS分析。
固相萃取操作简单, 三种SPE小柱吸附填充物均为反相吸附剂, 过程包括活化、上样、淋洗和洗脱四步, 将藻液中的脂溶性毒素提取出来, 同时能去除样品中大量的亲水性杂质。根据SPE填充物的孔径、材质等特征, 脂溶性毒素的吸附效率不同(Wu et al, 2014)。本研究发现Phenomenex Strata-X SPE和Sep-Pak C18 SPE对PTX2毒素的吸附效率相似(44%), 且优于Oasis HLB SPE柱(40%)。相对液相萃取的方法, 固相萃取方法可明显减少基质成分, 降低藻类基质效应对质谱分析的影响, 但其回收率较低。
综合考虑提取方法的稳定性、操作便捷性、毒素的提取效率等, 本方法选用乙醚-二氯甲烷作为提取剂, 通过凝胶色谱减少基质杂质的影响, 对鳍藻破碎细胞中PTX2毒素进行提取。
2.3 色谱制备条件的优化采用制备型HPLC, 利用化合物在反相柱上的不同保留能力进行分离。由于不同条件下藻液中不同毒素的电荷状态不同, 其洗脱顺序随流动相的变化而改变(Gerssen et al, 2009), 且流动相的pH值对毒素的分离有重要影响。由于OA和DTXs含有羧基, 因此其在酸性条件下处于中性状态, 在碱性条件下会失去氢离子而带有负电荷。而PTXs不含有可电离的基团, 因此在任何状态下都处于中性状态。为使PTX2能够最大程度的与其他毒素的分离, 实验首先使用相同的洗脱程序, 比较酸性、中性、碱性等三种流动相条件下的洗脱结果。其中, 酸性条件(pH=2.74):流动相A为纯水(含50mmol/L甲酸、2mmol/L甲酸铵), 流动相B为90%乙腈水溶液(含50mmol/L甲酸、2mmol/L甲酸铵); 近中性条件(pH 6.07):流动相A为纯水(含2mmol/L甲酸铵), 流动相B为90%乙腈水溶液(含2mmol/L甲酸铵); 碱性条件(pH 10.94):流动相A为纯水(含6.7mmol/L氨水), 流动相B为90%乙腈水溶液(含6.7mmol/L氨水)。分析发现, 酸性条件下(图 5a), PTX2可与其他毒素基线分离, 但分离度较低; 在中性条件下(图 5b), PTX2(tR=15.09min)与DTX1(tR=15.11min)共流出(检出时间几乎相同, 不易分离)。这种条件不会影响PTX2和DTX1的定量分析, 是因为在HPLC-MS/MS检测过程中, 由于毒素的电荷状态不同, DTX1易在负离子模式下检出, PTX2则易在正离子模式检出, HPLC-MS/MS可以进行快速的正负离子模式转换, 或者通过进样两次, 分别进行正、负离子的检测来实现。但在制备过程中, 毒素检出时间相近会导致DTX1与PTX2同时流出或流出时间差异较小, 而使得PTX2被DTX1污染。。在碱性条件下, OA和DTXs的保留时间明显缩短(tR < 7min), PTX2洗脱时间增加(tR=15.77min), 且与PTX11检出时间(tR=14.57min)有差异(图 5c), 可实现PTX2与其他脂溶性毒素的分离。
实验结果同时表明, 本实验检测出的毒素(OA+DTX2、DTX1、PTX2和PTX11)在碱性条件下均有较高的响应值, 这可能与碱性条件下PTXs电离效率提高(Gerssen et al, 2009), 同时毒素分子中酸性基团与色谱柱填充物的亲和作用减少有关(García-Altares et al, 2013)。此外, 实现本实验流动相碱性条件所用的氢氧化铵, 比Gerssen等(2009)的验证毒素稳定性实验中要少得多(6.7mmol/L与591mmol/L), 能确保PTX2处于稳定状态(Gerssen et al, 2009), 同时, 本研究可达到超过90%的PTX2回收率。
综上, 使用含有氨水(6.7mmol/L)的碱性流动相促进了PTX2与其他毒素的分离, 同时提高了毒素的响应值, 因此被选定为PTX2毒素检测和制备的流动相(图 6)。
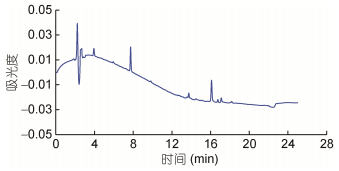 |
| 图 6 HPLC分离的PTX2色谱图 Fig. 6 HPLC chromatogram of PTX2 |
PTX2的纯化效果用最终得到的PTX2纯度来表示。将收集到的实验室培养的渐尖鳍藻细胞, 经选用最优的细胞破碎方法(反复冻融结合超声波破碎法)、PTX2提取(乙醚和二氯甲烷萃取法)、葡聚糖凝胶色谱柱分离和HPLC纯化后, 将色谱分离收集的PTX2粗提液减压蒸发浓缩, 最终溶解于甲醇中。其中, 凝胶柱净化得率为78.5%, 与采用的乙醚-二氯甲烷萃取法的毒素回收率(78.2%)相乘后, 毒素的总得率为61.4%±5.5%。由HPLC-MS/MS测得PTX2毒素峰面积A, 与测得的未经HPLC纯化的PTX2毒素(PTX2和杂质)总峰面积B的比例, 得到PTX2的纯度。结果表明本实验采用的HPLC纯化后纯度值约为93.2% (n=5), 该流程能够有效的从渐尖鳍藻细胞中收集得到高纯度的PTX2。
2.5 实际样品测定应用采用上述优化的HPLC-MS/MS分析方法对多种脂溶性毒素进行定量分析。其中OA、DTX2、DTX1、YTX、GYM和SPX1毒素依然采用购买的标准毒素溶液, 并用购买的PTX2和本方法提取纯化出的PTX2溶液分别作为标准毒素溶液, 做标准曲线, 检测方法中PTX2的检出限为0.6μg/kg, 定量限为1.98μg/kg。实验对2016—2017年广西北部湾海域贝类养殖区采集的贝肉样品(n=3)和2015—2016年于青岛黄海海域流清湾贝类养殖区采集的贝肉样品(n=3)进行分析, 发现部分样品中DTX2、PTX2、PTX2sa、GYM、SPX1均有检出, 以购买的PTX2和本方法提取纯化出的PTX2为标准品, 检出的PTX2范围分别为1.98—13.23μg/kg和2.01—13.31μg/kg, 检出率都为20.19%。检测结果与使用加拿大生物研究所购置的PTX2标准品没有显著性差异(P < 0.05)。
因此, 本研究制备的高纯度PTX2可用于贝类毒素的日常监测筛查。
3 结论本研究建立了一种从渐尖鳍藻纯种藻液中制备高纯度PTX2的方法。首先大量培养渐尖鳍藻, 收集藻细胞作为原料, 再通过反复冻融结合超声波破碎法进行细胞破碎, 乙醚和二氯甲烷进行PTX2毒素萃取, 葡聚糖凝胶色谱柱分离去除杂质, 高效液相色谱法纯化(碱性的流动相、C18半制备型色谱柱), 最终分离得到纯度为93.2%的PTX2。本研究选定的方法简单快捷, 高效易操作, 为从大规模培养的鳍藻细胞中制备高纯度PTX2毒素提供了技术支持。
| 王艳龙, 陈军辉, 高莉媛, 等, 2016. 超高效液相色谱-串联质谱法测定海水悬浮颗粒物中的8种典型脂溶性藻毒素. 分析化学, 44(3): 335–341 DOI:10.11895/j.issn.0253-3820.150714 |
| 钟韵山, 徐仰仓, 荆柏林, 等, 2014. 小球藻破壁技术研究进展. 食品研究与开发, 35(14): 120–124 DOI:10.3969/j.issn.1005-6521.2014.14.033 |
| Alexander J, Benford D, Boobis A, et al, 2009. Marine biotoxins in shellfish-Summary on regulated marine biotoxins1 Scientific Opinion of the Panel on Contaminants in the Food Chain. The EFSA Journal..1306(2009), 1306(2009): 6–23 |
| Cuellar-Bermudez S P, Aguilar-Hernandez I, Cardenas-Chavez D L, et al, 2015. Extraction and purification of high-value metabolites from microalgae:essential lipids, astaxanthin and phycobiliproteins. Microbial Biotechnology, 8(2): 190–209 DOI:10.1111/mbt2.2015.8.issue-2 |
| FAO (Food and agriculture organization of the United Nations), 2004. Marine biotoxins. Rome: FAO, 14 |
| Gao H, An X L, Liu L, et al, 2017. Characterization of Dinophysis acuminata from the Yellow Sea, China, and its response to different temperatures and Mesodinium prey. Oceanological and Hydrobiological Studies, 46(4): 439–450 |
| García C, Oyaneder-Terrazas J, Contreras C, et al, 2016. Determination of the toxic variability of lipophilic biotoxins in marine bivalve and gastropod tissues treated with an industrial canning process. Food Additives & Contaminants:Part A, 33(11): 1711–1727 |
| García-Altares M, Diogène J, De La Iglesia P, 2013. The implementation of liquid chromatography tandem mass spectrometry for the official control of lipophilic toxins in seafood:single-laboratory validation under four chromatographic conditions. Journal of Chromatography A, 1275: 48–60 DOI:10.1016/j.chroma.2012.12.021 |
| Gerssen A, Mulder P P J, McElhinney M A, et al, 2009. Liquid chromatography-tandem mass spectrometry method for the detection of marine lipophilic toxins under alkaline conditions. Journal of Chromatography A, 1216(9): 1421–1430 |
| Halim R, Harun R, Danquah M K, et al, 2012. Microalgal cell disruption for biofuel development. Applied Energy, 91(1): 116–121 |
| Hallegraeff G M, Anderson D M, Cembella A D et al, 2003. Manual on Harmful Marine Microalgae. In: Hallegraeff G M, Anderson D M, Cembella A D eds. Monographs on Oceanographic Methodology. Paris: UNESCO, 1-793 |
| Ito E, Suzuki T, Oshima Y, et al, 2008. Studies of diarrhetic activity on pectenotoxin-6 in the mouse and rat. Toxicon, 51(4): 707–716 DOI:10.1016/j.toxicon.2007.12.006 |
| James K J, Bishop A G, Draisci R, et al, 1999. Liquid chromatographic methods for the isolation and identification of new pectenotoxin-2 analogues from marine phytoplankton and shellfish. Journal of Chromatography A, 844(1-2): 53–65 DOI:10.1016/S0021-9673(99)00309-X |
| Kim M O, Moon D O, Kang S H, et al, 2008. Pectenotoxin-2 represses telomerase activity in human leukemia cells through suppression of hTERT gene expression and Akt-dependent hTERT phosphorylation. FEBS Letters, 582(23-24): 3263–3269 |
| Li M H, Sun G, Qiu J B, et al, 2017. Occurrence and variation of lipophilic shellfish toxins in phytoplankton, shellfish and seawater samples from the aquaculture zone in the Yellow Sea, China. Toxicon, 127: 1–10 DOI:10.1016/j.toxicon.2016.12.009 |
| Matsushima R, Uchida H, Nagai S, et al, 2015. Assimilation, accumulation, and metabolism of dinophysistoxins (DTXs) and pectenotoxins (PTXs) in the several tissues of Japanese scallop Patinopecten yessoensis. Toxins, 7(12): 5141–5154 DOI:10.3390/toxins7124870 |
| Miles C O, Wilkins A L, Hawkes A D, et al, 2006. Isolation and identification of pectenotoxins-13 and -14 from Dinophysis acuta in New Zealand. Toxicon, 48(2): 152–159 DOI:10.1016/j.toxicon.2006.04.005 |
| Miles C O, Wilkins A L, Munday R, et al, 2004. Isolation of pectenotoxin-2 from Dinophysis acuta and its conversion to pectenotoxin-2 seco acid, and preliminary assessment of their acute toxicities. Toxicon, 43(1): 1–9 DOI:10.1016/j.toxicon.2003.10.003 |
| Nagai S, Nitshitani G, Tomaru Y, et al, 2008. Predation by the toxic dinoflagellate Dinophysis fortii on the ciliate Myrionecta rubra and observation of sequestration of ciliate chloroplasts. Journal of Phycology, 44(4): 909–922 DOI:10.1111/jpy.2008.44.issue-4 |
| Nielsen L T, Krock B, Hansen P J, 2013. Production and excretion of okadaic acid, pectenotoxin-2 and a novel dinophysistoxin from the DSP-causing marine dinoflagellate Dinophysis acuta-effects of light, food availability and growth phase. Harmful Algae, 23: 34–45 |
| Park M G, Kim S, Kim H S, et al, 2006. First successful culture of the marine dinoflagellate Dinophysis acuminata. Aquatic Microbial Ecology, 45: 101–106 DOI:10.3354/ame045101 |
| Reguera B, Riobó P, Rodríguez F, et al, 2014. Dinophysis toxins:causative organisms, distribution and fate in shellfish. Marine Drugs, 12(1): 394–461 DOI:10.3390/md12010394 |
| Reguera B, Velo-Suárez L, Raine R, et al, 2012. Harmful Dinophysis species:a review. Harmful Algae, 14: 87–106 DOI:10.1016/j.hal.2011.10.016 |
| Suzuki T, Miyazono A, Baba K, et al, 2009. LC-MS/MS analysis of okadaic acid analogues and other lipophilic toxins in single-cell isolates of several Dinophysis species collected in Hokkaido, Japan. Harmful Algae, 8(2): 233–238 DOI:10.1016/j.hal.2008.06.001 |
| Suzuki T, Walter J A, LeBlanc P, et al, 2006. Identification of pectenotoxin-11 as 34S-hydroxypectenotoxin-2, a new pectenotoxin analogue in the toxic Dinoflagellate Dinophysis acuta from New Zealand. Chemical Research in Toxicology, 19(2): 310–318 DOI:10.1021/tx050240y |
| Tong M M, Smith J L, Richlen M, et al, 2015. Characterization and comparison of toxin-producing isolates of Dinophysis acuminata from New England and Canada. Journal of Phycology, 51(1): 66–81 DOI:10.1111/jpy.12251 |
| Wu H Y, Guo M M, Tan Z J, et al, 2014. Liquid chromatography quadrupole linear ion trap mass spectrometry for multiclass screening and identification of lipophilic marine biotoxins in bivalve mollusks. Journal of Chromatography A, 1358: 172–180 DOI:10.1016/j.chroma.2014.06.105 |
 2018, Vol. 49
2018, Vol. 49


