中国海洋湖沼学会主办。
文章信息
- 邹怡欣, 黄海龙, 乔龙亮, 党晨阳, 庞建虎, 吕佩文, 王佳棋, 朱鹏. 2018.
- ZOU Yi-Xin, HUANG Hai-Long, QIAO Long-Liang, DANG Chen-Yang, PANG Jian-Hu, LÜ Pei-Wen, WANG Jia-Qi, ZHU Peng. 2018.
- 基于LAMP-LFD技术的有害赤潮藻东海原甲藻(Prorocentrum donghaiense)快检方法
- RAPID DETECTION OF PROROCENTRUM DONGHAIENSE BASED ON LOOP-MEDIATED ISOTHERMAL AMPLIFICATION COMBINED WITH LATERAL FLOW DIPSTICK
- 海洋与湖沼, 49(3): 586-593
- Oceanologia et Limnologia Sinica, 49(3): 586-593.
- http://dx.doi.org/10.11693/hyhz20170800208
-
文章历史
- 收稿日期:2017-08-18
- 收修改稿日期:2017-11-20
赤潮灾害频发已经成为制约海洋经济可持续发展的严重环境问题之一(Zingone et al, 2000; 曹敏杰, 2015)。东海是中国近海赤潮问题最严重的海区(任姝彤, 2015), 而东海原甲藻(Prorocentrum donghaiense)作为一种有害赤潮藻, 已成为东海赤潮多发区最具有代表性的藻种之一(朱德弟等, 2009; 周名江等, 2003。其在长江口附近、浙江近海以及福建沿岸海域几乎每年都会引发世界罕见的大规模赤潮。该藻是由Lu等(2005)在东海分离的一种原甲藻, 依照其超微结构, 细胞形状特性, 确定为一新种。过去的二十年间, 东海原甲藻暴发赤潮频率高范围广, 且持续时间长, 其现场密度(细胞密度107ind./L)对较低等的浮游动物的繁殖存在一定程度的不利影响(Li et al, 2010; Lu et al, 2005)。2000年以来, 东海原甲藻连续几年在我国舟山群岛和东海长江口海域暴发了大规模赤潮(邓光等, 2009)。2008年, 东海原甲藻赤潮又出现在浙江渔山列岛和中街山列岛, 面积均超过1000km2 (龙华等, 2008)。2010年6月, 福建定海湾发生东海原甲藻与夜光藻双相赤潮, 海区表层水体中东海原甲藻细胞数平均值高达1.47×107ind./L(李正华, 2016)。据数据显示, 2001至2010年间每年都有东海原甲藻赤潮暴发, 在2013年东海原甲藻作为第一优势种引发赤潮的次数达16次, 高于其他赤潮引发种位居第一(黄海燕等, 2016)。
早期赤潮生物的分析鉴定以形态学观察为主, 但东海原甲藻形态微小且与其他原甲藻相似度高, 故难以用显微镜鉴定进行区分。在东海原甲藻被分离定为新种之初就与美国国家海洋藻种中心(Culture center of marine phytoplankton, CCMP)保藏的编号为CCMP1517的具齿原甲藻(Prorocentrum dentatum)藻株是否为同一个种产生了较大争议(吕颂辉等, 2003; 齐雨藻等, 2003; 罗立明, 2006)。由此看来, 相似的形态特征给藻类鉴定带来了很大困难, 而日益严重的赤潮灾害需要更加特异、准确、快速的检测手段。
环介导恒温扩增技术结合横向试纸条(Loop-mediated isothermal amplification combined with lateral flow dipstick, LAMP-LFD)作为新兴检测技术, 在快速检测方面已被多次应用, 如检测海豚链球菌(王瑞娜等, 2014)、猪瘟病毒(朱俊灵等, 2016)、鳗利斯顿氏菌(董培培等, 2011)等。结果显示此技术具有较高的特异性及灵敏度, 具备高效的经济及社会效益。陈先锋等(2015)、Huang等(2017)分别将LAMP-LFD技术应用于扁浒苔(Ulva compressa)和剧毒卡罗藻(Karlodinium veneficum)的检测, 印证了此技术在藻类的快速检测上的巨大优势。
本研究采用了核酸环介导恒温扩增技术, 该方法最初由Notomi等(2000)人设计并用于病原微生物的检测。针对靶基因的不同区域设计了4种特异性引物, 与此同时, 利用Bst DNA聚合酶的链置换活性在恒温条件下(60—65℃)高效(0.5—1h)扩增目标DNA, 并结合横向流动试纸条(Lateral flow dipstick, LFD)试纸条直接对结果进行检测, 进一步简化实验操作。LAMP-LFD技术通过将LAMP引物中的上游内引物FIP、环引物LF分别进行生物素标记和异硫氰酸荧光素标记后进行基因组DNA的恒温扩增, 扩增产物采用具有生物素抗体和异硫氰酸荧光素抗体的横向流动试纸条进行检测, 肉眼直接观察结果。和其他LAMP产物检测手段相比, LFD操作简便, 安全无污染, 不需任何仪器设备; 通过探针的特异性杂交进一步降低结果的假阳性(周前进, 2016)。
本研究根据东海原甲藻DNA的ITS序列设计了3对引物及1条异硫氰酸荧光素标记的探针, 经优化反应条件后建立LAMP-LFD检测技术, 为东海原甲藻的检测提供一种快速便捷的检测方法。
1 材料与方法 1.1 菌株和样品选取有害赤潮藻东海原甲藻作为实验对象, 并选取塔玛亚历山大藻、盒型藻、裸甲藻、中肋骨条藻、米氏凯伦藻、赤潮异弯藻、剧毒卡罗藻7种常见赤潮引发种用于LAMP-LFD技术的特异性分析实验, 藻种具体信息见表 1。藻种均由宁波大学海洋学院藻种库提供。
| 藻名 | 英文名称 | 分离株 |
| 塔玛亚历山大藻 | Alexandrium tamarense | NMBjah048 |
| 盒型藻 | Odontellacf sinensis | NMBguh018 |
| 东海原甲藻 | P. donghaiense | NMBRah03-2 |
| 裸甲藻 | Gymnodinium spp. | NMBjah053 |
| 中肋骨条藻 | Skeletonema costatum | NMBguh004-2 |
| 米氏凯伦藻 | Karenia mikimotoi | NMBjah049 |
| 赤潮异弯藻 | Heterosigma askashiwo | NMBjah0552 |
| 剧毒卡罗藻 | K. veneficum | NMBjah047 |
藻种使用f/2海水培养基, 光照强度18—27mol/ (m2·s), 温度22℃, 盐度23—25个单位, 12h光暗交替, 静置培养。为了避免藻细胞结块, 需每天手动摇瓶3次, 待所有培养物在相同条件下生长至固定相后用于实验(Kiatpathomchai et al, 2008)。
1.2 藻基因组DNA的提取各藻分离株基因组DNA提取参照基因组DNA提取试剂盒(Takara)进行。简言之, 将培养至对数期的藻液离心获得藻细胞后, 用含RNase A (10mg/mL)和Proteinase K (20mg/mL)的裂解液在56℃下裂解30min后用试剂盒进行DNA抽提, 而后用50µL蒸馏水洗脱基因组DNA。获得的样品经1%凝胶检测后–20℃保存备用。DNA的浓度和纯度测定使用Eppendorf biophotometer紫外分光光度计, 每个样本重复测定3次后取其平均值。实验前, 将所有藻基因组DNA稀释到相同数量级。
1.3 东海原甲藻ITS区的克隆以及序列的获得将提取的东海原甲藻DNA作为模板, 扩增引物为For: 5′-GTCGTCGACGTAGGTGAACCTGCAGAA GGATCA; Rev: 5′-CCTGCAGTCGACATATGCTTAA ATTCAGCAGG(张宝玉等, 2004)进行东海原甲藻的ITS序列扩增。反应体系(50µL): dNTPs (0.25mmol/L) 2µL, 10×PCR Buffer 2.50µL, 5U/µL rTaq DNA聚合酶0.25µL, 引物终浓度0.20µmol/L, 模板1µL, 用双蒸水定容。反应条件为: 94℃预变性5min; 接着进行35个循环: 94℃变性40s, 55℃复性45s, 72℃延伸60s;末次循环结束后72℃延伸10min。1%琼脂糖凝胶检测PCR扩增产物。分离产物经割胶回收后进行目的片段的重组质粒制备(Takara pmd19-T Vector), 阳性重组质粒由桑尼生物科技有限公司(上海)测序。
1.4 LAMP引物的设计经BLAST验证后, 测序所得序列与GenBank中序列号为JN595869.1的序列同源性高达100%, 故确定其为东海原甲藻的ITS序列, 序列长度为646bp。利用环介导等温扩增法引物设计软件Primerexplore V5 (http://primerexplorer.jp/e/)并依照引物设计的原则(Piepenburg et al, 2006; Kaewphinit et al, 2013; Khunthong et al, 2013; Wang et al, 2013; Sun et al, 2014)进行引物的设计。针对目标序列的保守区域设计了3对引物, 包含外引物Pd-F3/Pd-B3、内引物Pd-FIP/Pd-BIP、环引物Pd-LF/Pd-LB用于LAMP反应, 引物信息及位置见表 2、图 1。PCR反应使用设计的LAMP外引物(Pd-F3, Pd-B3)作为上下游引物进行扩增。其中, 环引物Pd-LF和上游内引物Pd-FIP的5′端分别进行异硫氰酸荧光素标记以及生物素标记。引物均由生工生物工程(上海)股份有限公司合成。
| 引物 | 类型 | 长度(碱基数) | 引物序列(5′—3′) |
| Pd-F3 | 上游外引物 | 19 | GTCGTCGACGTAGGTGAAC |
| Pd-B3 | 下游外引物 | 18 | CACTGGCAGCAAGGACAA |
| Pd-FIP* | 上游内引物 | 41 | CCACCCAGATCCTCACCAACTG-CTGCAGAAGGATCACTCGC |
| Pd-BIP | 下游内引物 | 40 | TGGAGATAGCATCGATGCCCCC-GCCCAGAAGACGGTCTGA |
| Pd-LF* | 上游环引物 | 22 | ACAATGAATCAAATGGGTGCGT |
| Pd-LB | 下游环引物 | 20 | CGGATACTCGAGGGCAGCAA |
| 注: Pd-LF*: 5′端异硫氰酸荧光素标记; Pd-FIP*: 5′端生物素标记 | |||
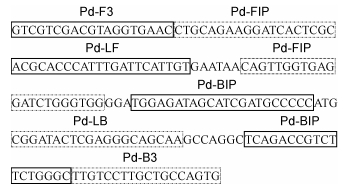 |
| 图 1 东海原甲藻序列LAMP-LFD引物设计示意图 Fig. 1 The diagram of designed primers of P. donghaiense used in LAMP-LFD assay |
使用LAMP外引物(Pd-F3/Pd-B3)作为PCR的上下游引物对模板DNA进行扩增。PCR反应体系(50µL): dNTPs (0.25mmol/L) 2µL, 5U/µL rTaq DNA聚合酶0.25µL, 10×PCR Buffer 2.50µL, 引物终浓度为0.20µmol/L, 模板1µL, 无菌水补足体系。反应条件为: 94℃预变性5min; 接着进行35个循环: 94℃变性40s, 55℃复性40s, 72℃延伸40s;末次循环结束后, 72℃扩增10min(袁健, 2012)。扩增产物采用1%的琼脂糖凝胶电泳观察结果。
1.6 LAMP反应条件优化以实验株的东海原甲藻的基因组DNA(4.7× 10ng/µL)作为模板, 使用LAMP等温扩增试剂盒(北京博奥生物公司)进行LAMP扩增条件的优化。LAMP反应体系(20µL), 包括内引物Pd-FIP/Pd-BIP各1.6µmol/L, 外引物Pd-F3/Pd-B3各0.2µmol/L, 环引物Pd-LF/Pd-LB各0.4µmol/L, BEQ2 10µL, 最后加入2µL模板DNA, 用双蒸水补足体系。以无菌水作模板为阴性对照。分别在61、63和65℃下进行实时荧光定量LAMP扩增反应, 分析起峰时间和荧光强度的变化确定最适反应温度和时间。
1.7 利用LFD检测LAMP产物(LAMP-LFD)利用优化后的LAMP反应体系进行恒温扩增。将经生物素标记的Pd-FIP-bio和FITC探针标记的Pd-LF-fitc分别代替原LAMP反应体系中的Pd-FIP和Pd-LF进行等温扩增。反应后取5µL扩增产物加入50µL Buffer中混匀, 垂直插入LFD试纸条常温反应约3min, 肉眼直接判断结果(蔡怡等, 2016; 周前进等, 2016)。有生物素标记的LAMP产物与探针Pd-BIP-fitc特异性杂交后形成的杂交产物与LFD上的生物素抗体结合在检测线上, 而未杂交的探针则结合在控制线上(陈先锋, 2015), 结果可通过检测线与控制线的显色情况直接判断。检测用LFD检测试剂盒(Milenia GenLine Hybri Detect)购自宁波博奥生物公司。
1.8 PCR、LAMP、LAMP-LFD特异性比较选取塔玛亚历山大藻、盒型藻、裸甲藻、中肋骨条藻、赤潮异弯藻、米氏凯伦藻、剧毒卡罗藻7种东海常见赤潮藻基因组DNA为模板, 按优化后的反应体系和条件进行LAMP扩增以验证引物的特异性。无菌水为模板作阴性对照。扩增产物分别用LFD试纸条和荧光定量仪检测。
以设计的LAMP外引物(F3/B3)为上下游引物, 提取的8个藻的基因组DNA为模板进行PCR的扩增。反应体系(50µL): 5U/µL rTaq DNA聚合酶0.25µL, dNTPs (0.25mmol/L) 2µL, 10×PCR Buffer 2.50µL, 引物终浓度0.20µmol/L, 模板DNA 1µL, 无菌水补足体系。以无菌水为模板作为阴性对照。PCR反应条件为:预变性94℃ 5min; 接着进行35个循环: 94℃变性40s, 55℃复性40s, 72℃延伸40s;末次循环结束后, 72℃扩增10min。1%琼脂糖凝胶电泳检测检测扩增产物。
1.9 PCR、LAMP、LAMP-LFD灵敏度比较以提取的东海原甲藻的基因组DNA 10倍梯度稀释(4.7×101—4.7×10–6ng/µL)后的8个基因组DNA为模板, 无菌水作为阴性对照, 进行有biotin标记的LAMP反应。扩增产物分别用LFD和荧光定量仪检测。用于确定LAMP技术的最低检测限度并比较其与PCR扩增灵敏度的优劣。
以上述8个浓度的基因组DNA为模板, LAMP外引物Pd-F3和Pd-B3为上下游引物, 进行PCR扩增。扩增产物经1%琼脂糖凝胶电泳检测。
1.10 LAMP-LFD的野外样验证从东海各站点采集的10个海水样品, 具体地理位置见图 2。样品经20µm的滤膜过滤后, 取500mL滤液离心得藻细胞后用于基因组DNA的提取, 具体方法参考1.2所述。提取的野外样品基因组DNA用于LAMP-LFD的鉴定。
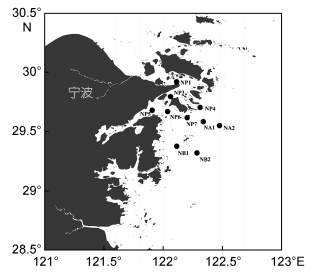 |
| 图 2 野外样的地理位置 Fig. 2 Geographic location of the field for sampling |
由实时荧光定量LAMP可知, 引物在61、63、65℃的起峰时间都在10min左右, 且分别在22、20、21min达到稳定期, 从扩增时间来看, 温度对本研究扩增反应影响不大。较61、65℃时的扩增结果而言, 63℃下有最高荧光强度, 见图 3。故最终确定环介导等温扩增技术的最适条件为63℃恒温30min。
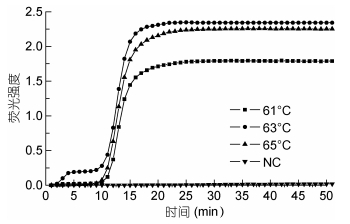 |
| 图 3 LAMP反应条件的优化 Fig. 3 Optimization of LAMP reaction conditions 注: NC:阴性对照, 以无菌水为模板。 |
以所建立的LAMP-LFD、LAMP与PCR的实验方法对8株常见赤潮藻进行检测。产物分别经由横向流动试纸条、荧光定量和凝胶电泳检测, 见图 4。结果表明, PCR检测结果东海原甲藻呈阳性扩增, 但同时塔玛亚历山大藻、米氏凯伦藻和剧毒卡罗藻的DNA也出现了非特异性扩增现象。LAMP反应中, 东海原甲藻存在明显扩增, 在10min左右即出现了明显的“S”型荧光曲线, 22min左右扩增即达到稳定期, 其余7株藻扩增曲线平滑, 均没有产生特异性荧光曲线。而LFD试纸条仅在东海原甲藻扩增时出现了明显检测线, 其余藻类皆未能检测到条带, 为阴性。
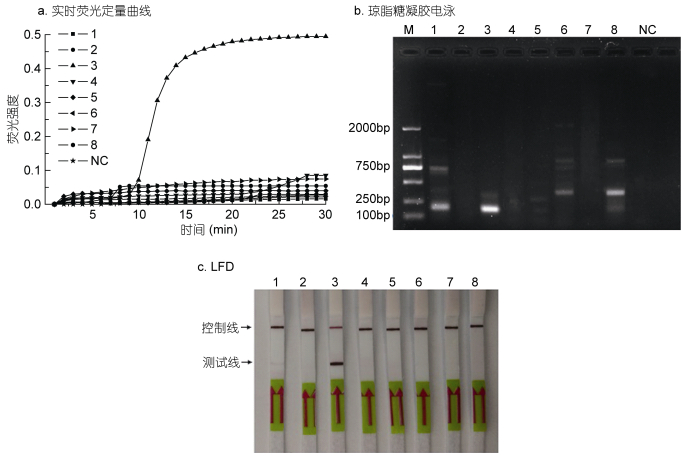 |
| 图 4 LAMP、PCR、LAMP-LFD特异性比较 Fig. 4 Comparison in the specificity of LAMP (a), PCR (b), LAMP-LFD (c) for detection of P. donghaiense 注: M: DL2000 DNA Marker; NC:阴性对照, 以无菌水为模板; 1—8分别表示以塔玛亚历山大藻、盒型藻、东海原甲藻、裸甲藻、中肋骨条藻、米氏凯伦藻、赤潮异弯藻、剧毒卡罗藻DNA为模板。 |
以不同浓度的东海原甲藻基因组DNA为模板, 验证LAMP的灵敏度。产物分别经由横向流动试纸条、荧光定量和凝胶电泳检测, 见图 5。结果表明, 通过PCR方法能够检测到的最低浓度为0.47ng/µL。当模板浓度稀释至47pg/µL时, LAMP仍能检测到明显“S”型荧光曲线, 且随着基因组DNA浓度的降低, 曲线出峰时间和到达稳定期时间有规律后移, 但基本都能在30min左右完成扩增。利用LFD能够检测到的最低浓度是47pg/µL, 与LAMP反应相同, 是以Pd-F3和Pd-B3为引物的常规PCR检测灵敏度的10倍。
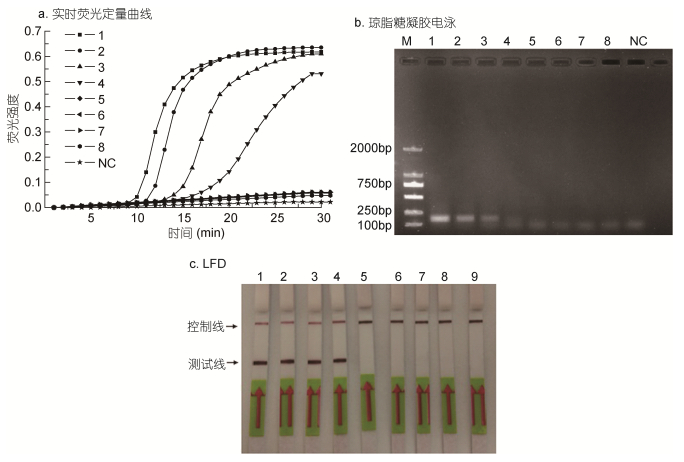 |
| 图 5 LAMP (a)、PCR (b)、LAMP-LFD (c)灵敏度比较 Fig. 5 Comparison in the sensitivity of LAMP (a), PCR (b), LAMP-LFD (c) for detection of P. donghaiense 注: M: DL2000 DNAMarker; NC:阴性对照, 以无菌水为模板; 1—8分别表示以浓度为4.7×101、4.7、4.7×10–1、4.7×10–2、4.7×10–3、4.7×10–4、4.7×10–5、4.7×10–6ng/µLDNA为模板。 |
LAMP-LFD结果为: NP-1, NP-4, NA-1海水样品基因组DNA样品同时出现检测线和控制线, 检测结果呈阳性, 有东海原甲藻的特异性扩增; 其余7个样品无检测线有控制线, 结果均呈阴性, 见图 6。总体而言, LAMP-LFD技术适用于本领域的野外快速检测。
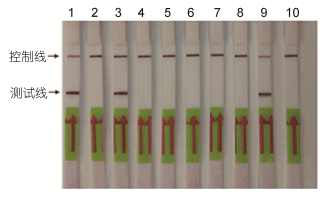 |
| 图 6 LAMP-LFD野外样结果 Fig. 6 LAMP-LFD for detection of field samples 注: 1—10分别表示水样NP-1、NP-3、NP-4、NP-5、NP-6、NP-7、NB-1、NB-2、NA-1、NA-2 |
近年由东海原甲藻引起的赤潮在我国呈现高发、频发的态势, 给水产养殖、旅游等产业以及海洋生态环境产生了巨大的影响。因此, 建立准确有效的东海原甲藻野外快检技术对赤潮的检测、预防和控制具实际意义。
目前, 从分子水平对藻类进行鉴定已逐步成为研究热点, 免疫学检测方法(ELISA)和基于PCR的分子生物学检测方法被运用于藻类检测中(唐晨, 2012)。王曲圆等(2013)人通过扩增藻的细胞色素b基因建立了东海原甲藻的荧光定量PCR体系; 袁健(2012)针对核糖体DNA的ITS序列建立了包括东海原甲藻在内的三种东海赤潮藻的荧光定量PCR定性定量分析方法; 张宝玉等(2005)使用ITS序列设计的DNA探针通过荧光原位杂交技术有效地鉴定了东海原甲藻以及塔玛亚历山大藻。但是荧光原位杂交对样品和实验操作环境要求高、需要经验丰富的操作人员; PCR技术灵敏度高, 但对仪器设备要求高, 此类方法仅限于实验室检测。新兴的LAMP技术特异性强、灵敏度高, 较传统PCR、荧光原位杂交、ELISA等技术有设备要求低、时间短、操作简便等优点, 被逐步运用于分子水平的检测。蔡怡等(2016)人利用LAMP-LFD技术特异性的检测山茶梗结线虫的检测极限低至4pg/µL, 低于常规PCR方法的100倍。周圆(2016)等人利用LAMP-LFD技术对油菜茎基溃疡病菌的检测灵敏度为114fg/µL, 比PCR检测高10倍。LAMP技术因其在检测领域显现出来的优势在藻类的分子鉴定和检测中也有了更广泛的运用, 该技术已被用来检测短凯伦藻(张凤英等, 2012)、产毒亚历山大藻(刘芳等, 2007)、米氏凯伦藻(王越, 2015)等并显示出良好的特异性和灵敏度, 在野外样品的检测中也表现出良好的实用性。
近年来, 转录间隔区(Internal transcribed spacer, ITS)序列和编码核糖体RNA基因(Ribosomal RNA gene, rRNA)作为分子指标已被广泛应用于藻类的分类以及种类鉴定(张宝玉等, 2004)。其中, ITS在同种生物中非常保守, 其选择压力小、变异速率快, 可用于属级、种级甚至种以下水平的比较。另外, ITS区长度较稳定, 含5.8S在内总长保持在500—800bp, 其两端的18S、28S序列有高保守性, 可方便的设计通用引物对ITS区进行扩增并测定序列(高杨, 2004)。
本研究针对东海原甲藻的特异性序列设计了六条引物, 优化条件后, 用于LAMP-LFD检测。结果表明, 在63℃下运用环介导等温扩增30min后, 将LFD试纸条垂直插入反应液5min后即可用肉眼观察(王瑞娜, 2014)。利用该技术不仅可检出低浓度的东海原甲藻, 而且针对塔玛亚历山大藻、赤潮异弯藻、米氏凯伦藻、中肋骨条藻等引发赤潮的常见藻类表现出良好的特异性。本实验建立的LAMP-LFD方法最低可检测到47pg/µL的东海原甲藻基因组DNA, 是以Pd-F3和Pd-B3为特异性引物的PCR方法的10倍。进一步将LAMP-LFD方法用于东海原甲藻野外样检测, 部分样品有特异性条带, 结果表现良好的实用性。
使用LAMP-LFD方法检测, 使检测时间大大缩短, 并且检测结果可视化。若模板采用简单的煮沸方法提取(Shi et al, 2009), 只需要一个简单的恒温水浴锅在短时间内即可完成核酸的扩增以及检测。由于对设备的要求低、操作简单、成本低廉, 非专业的检测人员足可以胜任该工作。LAMP-LFD技术使整个检测过程在一定程度上摆脱了实验室条件的限制, 更加适用于野外检测。该项技术还可推广到其他有害赤潮藻的快速检测, 可准确、高效、特异地鉴别有害赤潮藻, 为沿海地区赤潮藻的大暴发提供预警以便进行早期防治。
4 结论本研究根据东海原甲藻的ITS序列建立了LAMP-LFD特异性检测方法。该技术在东海原甲藻的野外快速检测方面具有重要意义, 可以在水体中东海原甲藻浓度低的时候监测赤潮生长的趋势并及时进行防治。其种种特点使LAMP-LFD技术在实际应用中具有很大的优势, 作为一项新型的藻野外快检技术, 有望得到大规模的应用。
| 王越, 沈盎绿, 赵世烨, 等, 2015. pH对米氏凯伦藻(Karenia mikimotoi)种群生长、营养吸收及无机碳亲和力的影响. 海洋环境科学, 34(4): 488–493 |
| 王曲圆, 甄毓, 袁健, 等, 2013. 东海原甲藻细胞色素b基因实时荧光定量PCR检测体系优化. 应用生态学报, 24(2): 541–548 |
| 王瑞娜, 周前进, 陈炯, 2014. 环介导等温扩增联合横向流动试纸条可视化检测海豚链球菌方法的建立. 农业生物技术学报, 22(12): 1584–1594 DOI:10.3969/j.issn.1674-7968.2014.12.014 |
| 邓光, 耿亚洪, 胡鸿钧, 等, 2009. 几种环境因子对高生物量赤潮甲藻——东海原甲藻光合作用的影响. 海洋科学, 33(12): 34–39 |
| 龙华, 周燕, 余骏, 等, 2008. 2001-2007年浙江海域赤潮分析. 海洋环境科学, 27(S1): 1–4 |
| 任姝彤, 2015. 中国近海突发性海洋灾害的特征分析与评分. 青岛: 中国海洋大学硕士学位论文 |
| 刘芳, 王丽, 李琳, 等, 2007. 环介导等温核酸扩增技术快速检测产毒亚历山大藻. 现代食品科技, 23(11): 71–74 |
| 吕颂辉, 张玉宇, 陈菊芳, 2003. 东海具齿原甲藻的扫描电子显微结构. 应用生态学报, 14(7): 1070–1072 |
| 朱俊灵, 叶佐东, 邓洁汝, 等, 2016. 猪瘟病毒RT-LAMP-LFD检测方法的建立与应用. 华南农业大学学报, 37(1): 1–7 |
| 朱德弟, 陆斗定, 王云峰, 等, 2009. 2005年春初浙江近海的低温特征及其对大规模东海原甲藻赤潮发生的影响. 海洋学报, 31(6): 31–39 |
| 齐雨藻, 王艳, 2003. 我国东海赤潮原甲藻应属哪种?. 应用生态学报, 14(7): 1188–1190 |
| 张凤英, 石彦红, 马凌波, 等, 2012. 环介导恒温扩增技术快速检测短凯伦藻. 应用与环境生物学报, 18(3): 482–488 |
| 张宝玉, 王广策, 齐雨藻, 等, 2005. 用荧光原位杂交(FISH)技术鉴定赤潮甲藻的研究. 高技术通讯, 15(11): 101–105 DOI:10.3321/j.issn:1002-0470.2005.11.020 |
| 张宝玉, 王广策, 张炎, 等, 2004. 东海原甲藻(Prorocentrum donghaiense)和海洋原甲藻APBM(P. micans APBM)的5.8S rDNA及其转录间隔区(ITS)的克隆和序列分析. 海洋与湖沼, 35(3): 264–272 |
| 李正华, 2016. 福建定海湾一次东海原甲藻与夜光藻双相赤潮浅析. 渔业研究, 38(2): 132–136 |
| 陈先锋, 周前进, 王瑞娜, 等, 2015. 环介导等温扩增联合横向流动试纸条快速检测扁浒苔(Ulva compressa)的研究. 海洋与湖沼, 46(4): 819–827 |
| 周圆, 黄海龙, 李孝军, 等, 2016. 油菜茎基溃疡病菌LAMP-LFD检测方法的建立. 植物检疫, 30(4): 32–37 |
| 周名江, 颜天, 邹景忠, 2003. 长江口邻近海域赤潮发生区基本特征初探. 应用生态学报, 14(7): 1031–1038 |
| 周前进, 陈先锋, 蔡怡, 等, 2016. 孔石莼(Ulva pertusa) LAMP-LFD快速检测方法的建立. 海洋与湖沼, 47(2): 380–389 |
| 罗立明, 胡鸿钧, 李夜光, 等, 2006. 东海原甲藻的分子鉴定. 海洋学报, 28(1): 127–131 |
| 唐晨, 2012. PCR技术在对典型有害藻类检测中的应用. 上海: 上海海洋大学硕士学位论文 |
| 袁健, 2012. 东海三种重要赤潮藻荧光定量PCR检测技术的建立和应用. 青岛: 中国海洋大学博士学位论文 |
| 高杨, 2004. 有害赤潮藻的分子生物学分类与鉴定. 厦门: 厦门大学硕士学位论文 |
| 曹敏杰, 2015. 浙江近岸海域海洋生态环境时空分析及预测关鍵抆术研究. 杭州: 浙江大学博士学位论文 |
| 黄海燕, 康林冲, 杨翼, 等, 2016. 2013年我国近海赤潮引发种种类和分布研究. 海洋科学, 40(11): 17–27 DOI:10.11759/hykx20160227001 |
| 董培培, 李长红, 丁文超, 等, 2011. 环介导等温扩增技术与横向流动试纸条法快速检测鳗利斯顿氏菌的研究. 水产科学, 30(2): 63–68 |
| 蔡怡, 周前进, 顾建锋, 等, 2016. 山茶根结线虫的LAMP-LFD快速检测方法. 农业生物技术学报, 24(5): 770–780 |
| Huang H L, Zhu P, Zhou C X, et al, 2017. The development of loop-mediated isothermal amplification combined with lateral flow dipstick for detection of Karlodinium veneficum. Harmful Algae, 62: 20–29 DOI:10.1016/j.hal.2016.11.022 |
| Kaewphinit T, Arunrut N, Kiatpathomchai W, et al, 2013. Detection of Mycobacterium tuberculosis by using loop-mediated isothermal amplification combined with a lateral flow dipstick in clinical samples. Biomed Research International, 2013: 926230 |
| Khunthong S, Jaroenram W, Arunrut N, et al, 2013. Rapid and sensitive detection of shrimp yellow head virus by loop-mediated isothermal amplification combined with a lateral flow dipstick. Journal of virological methods, 188(1): 51–56 |
| Kiatpathomchai W, Jaroenram W, Arunrut N, et al, 2008. Shrimp taura syndrome virus detection by reverse transcription loop-mediated isothermal amplification combined with a lateral flow dipstick. Journal of Virological Methods, 153(1): 214–217 |
| Li J, Glibert P M, Zhou M J, 2010. Temporal and spatial variability in nitrogen uptake kineticsduring harmful dinoflagellate blooms in the East China Sea. Harmful Algae.2010, 9(6): 531–539 |
| Lu D D, Jeanette G, 2001. Five red tide species in genus Prorocentrum including the description of Prorocentrum donghaiense Lu SP. nov. from the East China Sea. Chinese Journal of Oceanology and Limnology, 19(4): 337–344 DOI:10.1007/BF02850738 |
| Lu D D, Goebel J, Qi Y Z, et al, 2005. Morphological and genetic study of Prorocentrum donghaiense Lu from the East China Sea, and comparison with some related Prorocentrum species. Harmful Algae, 4(3): 493–505 DOI:10.1016/j.hal.2004.08.015 |
| Notomi T, Okayama H, Masubuchi H, et al, 2000. Loop-mediated isothermal amplification of DNA. Nucleic Acids Research, 28(12): e63 DOI:10.1093/nar/28.12.e63 |
| Piepenburg O, Williams C H, Stemple D L, et al, 2006. DNA detection using recombination proteins. PLoS Biology, 4(7): e204 DOI:10.1371/journal.pbio.0040204 |
| Shi Y H, Zhang F Y, Ma L B, 2009. Reliable and rapid genomic DNA extraction method of three species of red tide algae. Marine Fisheries, 31(4): 438–443 |
| Sun Y L, Yen C H, Tui C F, 2014. 7Visual detection of canine parvovirus based on loop-mediated isothermal amplification combined with enzyme-linked immunosorbent assay and with lateral flow dipstick. The Journal of Veterinary Medical Science, 6(4): 509–516 |
| Wang X M, Teng D, Guan Q F, et al, 2013. Detection of roundup ready soybean by loop-mediated isothermal amplification combined with a lateral-flow dipstick. Food Control, 29(1): 213–220 DOI:10.1016/j.foodcont.2012.06.007 |
| Zingone A, Enevoldsen H O, 2000. The diversity of harmful algal blooms:a challenge for science and management. Ocean & Coastal Management, 43(8-9): 725–748 |
 2018, Vol. 49
2018, Vol. 49


