
中国海洋湖沼学会主办。
文章信息
- 刘群, 韩进刚, 王菁, 张丹, 霍文慧, 陈浩楠, 耿绪云, 孙金生. 2018.
- LIU Qun, HAN Jin-Gang, WANG Jing, ZHANG Dan, HUO Wen-Hui, CHEN Hao-Nan, GENG Xu-Yun, SUN Jin-Sheng. 2018.
- 天津地区养殖鲤鱼(Cyprinus carpio)鲤浮肿病毒(CEV)PCR检测与人工感染试验
- PCR DETECTION AND ARTIFICIAL INFECTION TEST OF CARP EDEMA VIRUS (CEV) IN COMMON CARP CYPRINUS CARPIO IN CULTURED IN TIANJIN DISTRICT
- 海洋与湖沼, 49(3): 638-645
- Oceanologia et Limnologia Sinica, 49(3): 638-645.
- http://dx.doi.org/10.11693/hyhz20171100281
-
文章历史
- 收稿日期:2017-11-06
- 收修改稿日期:2018-02-22
2. 天津市水产生态及养殖重点实验室 天津农学院 天津 300384
2. Tianjin Key Lab of Aqua-Ecology and Aquaculture, Department of Fisheries Science, Tianjin Agricultural University, Tianjin 300384, China
鲤浮肿病毒(Carp Edema Virus, CEV)被认为是锦鲤睡眠病(koi sleepy disease, KSD)的致病原(Oyamatsu et al, 1997a; Adamek et al, 2016), 该病原最初发现于20世纪70年代日本养殖的稚鱼期锦鲤(Cyprinus carpio)。此病发生于每年6月至7月, 患病鱼通常在池塘角落、岸边或进水口处漂浮, 病鱼身体呈浮肿状, 尤其尾柄部呈白色不透明状, 眼球凹陷, 鳃丝呈棍棒化, 有明显黏连现象, 发病鱼死亡数量会急剧增多, 数日内即可造成大量死亡(Ono et al, 1986; Oyamatsu et al, 1997b; Amita et al, 2002; Miyazaki et al, 2005; 畑井喜司雄等, 2007)。病毒学研究证实, CEV存在于细胞质内, 粒子直径约250—280nm, 并且带有外观形似桑葚样的囊膜(Ono et al, 1986; Oyamatsu et al, 1997b; Miyazaki et al, 2005), 同时, 在粒子内部存在有拟核, 基于此, 有学者认为其同香鱼痘病毒(ayu poxvirus)、大马哈鱼鳃痘病毒(salmon gill poxvirus)归属于痘病毒科Poxviridae (Matras et al, 2016)。但查阅国际病毒分类命名委员会(International Committee on Taxonomy of Viruses, ICTV)最新报告(King et al, 2012)发现, 该报告现今未收录CEV的相关信息。
近年来, 诸多国家如奥地利、捷克、德国、法国、荷兰、英国、意大利、波兰、巴西等, 已在患病锦鲤或鲤鱼中检出CEV (Way et al, 2013; Haenen et al, 2014; Jung-Schroers et al, 2015; Lewisch et al, 2015a, b; Pretto et al, 2015; Vesely et al, 2015; Viadanna et al, 2015)。在2015年第19届欧盟鱼类疾病参考实验室(European Union Reference Laboratory for Fish Diseases)年度研讨会上, 锦鲤睡眠病(KSD)作为一种新出现的鱼类疾病, 被认为应给予更多的关注, 同时, 亟需在欧盟域内国家开展疫病传播的风险评估(Haenen et al, 2015)。2013年6月开始, 针对天津地区鲤鱼大规模暴发性死亡, 天津市水生动物疫病预防控制中心开展相应的流行病学调查工作, 主要检测细菌、寄生虫、锦鲤疱疹病毒(KHV)、鲤春病毒血症病毒(SVCV)和金鱼造血器官坏死病毒(CyHV-Ⅱ), 但结果均为阴性。2015年7月, 我中心在发病鲤鱼中首次检出CEV, 此前, 该病毒在我国养殖锦鲤和鲤鱼均未检出, 亦没有相关的报道。本研究旨在分析天津地区养殖鲤鱼携带CEV的情况, 并分析其与国际上发现的CEV毒株的进化关系。研究结果揭示我国鲤鱼养殖产业可能面临新的疫情, 该疫病的出现会严重制约鲤鱼养殖业的发展, 需引起养殖业的高度重视。
1 材料与方法 1.1 样品采集与处理2015年7月、2016年6—7月自天津地区某淡水鱼养殖场采集发病鲤鱼, 个体大小20—30cm, 发病鱼养殖池塘中混养有其它品种鱼类, 包括鲢鱼、鲫鱼、草鱼, 养殖水温25—28℃。于实验室采集病鱼新鲜组织样品, 保存于–80℃。
1.2 DNA提取切取濒死发病鱼鳃组织于研钵, 对样品进行组织研磨。挑取少量研磨液于1.5mL RNase-free离心管, 使用血液/细胞/组织基因组DNA提取试剂盒(DP304, TIANGEN)提取样品DNA, 并经超微量核酸测定仪(IMPLEN, German)测定浓度及纯度。
1.3 CEV套式PCR参考CEV套式PCR检测方法(Oyamatsu et al, 1997a)进行样品检测, 同时以健康鲤鱼基因组DNA作为阴性对照。
1.3.1 第1步PCR在PCR管中加入2.5μL 10x Ex Taq PCR Buffer (Mg2+ free, TaKaRa)、2μL MgCl2 (25mmol/L)、1.5μL dNTPs (10mmol/L)、引物F1 (20μmol/L)和R1 (20μmol/L)各1μL、0.5μL Ex Taq DNA聚合酶(5U/μL)、14.5μL RNase-free H2O, 2μL模板, 扩增反应程序为: 94℃ 2min; 94℃ 30s、58℃ 30s、72℃ 50s, 35个循环; 72℃ 5min, 4℃保温。
1.3.2 第2步PCR在PCR管中加入2.5μL 10x Ex Taq PCR Buffer (Mg2+ free, TaKaRa)、2μL MgCl2 (25mmol/L)、1.5μL dNTPs (10mmol/L)、引物F2 (20μmol/L)和R2 (20μmol/L)各1μL、0.5μL Ex Taq DNA聚合酶(5U/μL)、14.5μL RNase-free H2O, 2μL稀释10倍后的第1步PCR产物作为模板, 扩增反应程序为: 94℃ 3min; 94℃ 20s、58℃ 20s、72℃ 20s, 35个循环; 72℃ 5min, 4℃保温。对上述两步PCR产物进行1%琼脂糖凝胶电泳, 使用凝胶成像仪(Bio-RAD)照相。套式PCR检测所用引物序列信息见表 1。
| 引物名称 | 引物序列(5′—3′) | 扩增片段大小(bp) |
| F1 | GCT GTT GCA ACC ATT TGA GA | 547 |
| R1 | TGC AGG TTG CTC CTA ATC CT | |
| F2 | GCT GCT GCA CTT TTA GGA GG | 180 |
| R2 | TGC AAG TTA TTT CGA TGC CA |
将阳性PCR产物送往生物公司(金唯智, 天津)进行序列测定, 并利用MEGA6软件对测序所得序列进行分析以及系统发育树的构建。
1.5 人工浸泡感染试验采用编号JY1650鳃组织样品按1:10比例加入TNEP缓冲液(含0.2mg/mL PMSF异丙醇溶液)研磨后, 经差速离心取上清液, 以0.22μm滤膜过滤除菌, 采用组织液终浓度为10–3g/L浸泡1.5h的方式进行人工感染试验。试验对象为鲤鱼(体长14±2cm), 试验期间水温(25±1.5)℃, 并设置对照组。试验中, 每一组设置两个重复, 每个重复19尾鱼。
1.6 养成期鲤鱼CEV携带率检测为跟踪了解养成期鲤鱼携带CEV情况, 选取天津市宝坻区战备闸某淡水鱼养殖场作为采样地点。该养殖场曾于2015年7月出现仅有鲤鱼大量死亡, 后经实验室方法诊断为CEV阳性。2016年9月随机采集40尾养成期鲤鱼进行CEV携带率检测, 方法同1.3。
2 结果与分析 2.1 样品采集及观察2015—2016年所采集的发病鲤鱼样品主要涉及天津地区4个涉农区(汉沽、宝坻、蓟州、静海)的淡水鱼养殖场, 样品体长多集中在20—30cm(表 2)。在养殖场发病池塘只有鲤鱼出现死亡情况, 混养的其它品种(鲢鱼、鲫鱼、草鱼)未出现死亡。观察鲤鱼发病症状, 与健康鲤鱼相比, 发病鱼滞游于浅水区水面, 体色发黑, 头部上方颅骨软组织周围皱缩, 眼球凹陷, 鳃粘脏, 黏液较多。解剖发现, 病鱼肝胰脏发白, 脾脏肿大, 脑球表面颜色呈红色。
| 样品编号 | 采样日期(年.月.日) | 采样地点 | 发病面积(ha) | 体长(cm) |
| JY600 | 2015.07.09 | 汉沽 | 13.33 | 20—30 |
| JY601 | 2015.07.09 | 汉沽 | 13.33 | 20—30 |
| JY1605 | 2015.07.14 | 宝坻 | 1.33 | 20 |
| JY1641 | 2015.07.28 | 宝坻 | 1.33 | 25—30 |
| JY1650 | 2015.07.30 | 蓟州 | 0.87 | 30 |
| JY1856 | 2016.06.08 | 宝坻 | 13.33 | 20 |
| JY1857 | 2016.06.08 | 宝坻 | 13.33 | 20 |
| JY1909 | 2016.07.04 | 宝坻 | 1.00 | 20 |
| JY1965 | 2016.07.18 | 宝坻 | 1.33 | 20 |
| JY1966 | 2016.07.18 | 静海 | 1.33 | 20 |
| JY2012 | 2016.09.25 | 宝坻 | 13.33 | 29—35 |
采用CEV套式检测方法(Oyamatsu et al, 1997a)对2015年7月、2016年6—7月采集的10份发病鱼样品进行检测, 第1步PCR反应结果表明, 只有源于2015年采集的编号为JY1650样品可扩增得到547bp目的条带(图 1a), 为阳性, 而其余样品均未获得此目的条带(图 1a, 图 1b); 第2步PCR反应显示, 10个样品均能扩增出180bp目的条带(图 1a, 图 1b), 结果为阳性。
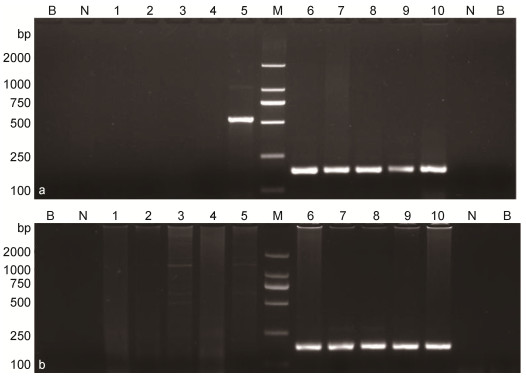 |
| 图 1 发病鲤鱼CEV套式PCR检测结果 Fig. 1 Result of detecting CEV from the common carp by nested-PCR 注: M: DL 2000 Marker; N:阴性对照; B:空白对照; a: 2015年发病鲤鱼样品套式PCR检测结果; 泳道1—5:分别为样品JY600/JY601/JY1605/JY1641/JY1650第1步PCR检测结果, 目的条带547bp; 泳道6—10:分别为样品JY600/JY601/JY1605/JY1641/JY1650第2步PCR检测结果, 目的条带180bp; b: 2016年发病鲤鱼样品套式PCR检测结果; 泳道1—5:分别为样品JY1856/JY1857/JY1909/JY1965/JY1966第1步PCR检测结果, 目的条带547bp; 泳道6—10:分别为样品JY1856/JY1857/JY1909/JY1965/JY1966第2步PCR检测结果, 目的条带180bp |
对上述Nested-PCR第1次扩增产物及第2次扩增产物进行测序, 将所得序列(图 2)同GenBank登录号分别为KM283182、KX186571的CEV DNA序列进行BLAST比对分析(表 3), 结果本研究中样品JY1650第1步PCR产物所得序列(图 2a)与KM283182、KX186571对应序列相似性分别为97%、99%, 该样品第2步PCR产物所得序列(图 2b)与以上两登录号对应序列相似性分别为96%、98%;样品JY1856第2步PCR产物所得序列(图 2b)与KM283182、KX186571对应序列相似性分别为95%、96%;其余样品第2步PCR所得产物序列(图 2b)与以上两登录号对应序列相似性分别都为86%、85%。
 |
| 图 2 MEGA6软件多序列比对结果 Fig. 2 Result of multiple sequence alignment according to MEGA6 注: a:第1步PCR产物序列与CEV相关序列(KM283182、KX186571)比对结果; b: 10个样品第2步PCR产物序列与CEV相关序列(KM283182、KX186571)比对结果 |
| 来源 | 长度(bp) | 比对对象 | 总分 | 查询覆盖率(%) | 最大一致性(%) | 相似性(%) |
| JY1650 | 507 | KM283182 | 843 | 100 | 97 | 97 |
| KX186571 | 909 | 100 | 99 | 99 | ||
| JY1650 | 140 | KM283182 | 231 | 100 | 96 | 96 |
| KX186571 | 243 | 100 | 98 | 98 | ||
| JY1856 | 140 | KM283182 | 220 | 100 | 95 | 95 |
| KX186571 | 231 | 100 | 96 | 96 | ||
| JY600 | 140 | KM283182 | 154 | 100 | 86 | 86 |
| KX186571 | 143 | 100 | 85 | 85 | ||
| JY601 | 140 | KM283182 | 154 | 100 | 86 | 86 |
| KX186571 | 143 | 100 | 85 | 85 | ||
| JY1605 | 140 | KM283182 | 154 | 100 | 86 | 86 |
| KX186571 | 143 | 100 | 85 | 85 | ||
| JY1641 | 140 | KM283182 | 154 | 100 | 86 | 86 |
| KX186571 | 143 | 100 | 85 | 85 | ||
| JY1857 | 140 | KM283182 | 154 | 100 | 86 | 86 |
| KX186571 | 143 | 100 | 85 | 85 | ||
| JY1909 | 140 | KM283182 | 154 | 100 | 86 | 86 |
| KX186571 | 143 | 100 | 85 | 85 | ||
| JY1965 | 140 | KM283182 | 154 | 100 | 86 | 86 |
| KX186571 | 143 | 100 | 85 | 85 | ||
| JY1966 | 140 | KM283182 | 154 | 100 | 86 | 86 |
| KX186571 | 143 | 100 | 85 | 85 |
由第1步PCR产物序列构建系统发育树, 结果表明, JY1650和KX186571病毒株聚为一支, 并且与KM283182病毒株位于一条主分支上。最终体现为JY1650与GenBank No.KX186571病毒株的亲缘关系较近, 而与GenBank No.KM283182病毒株的亲缘关系相对较远(图 3a)。
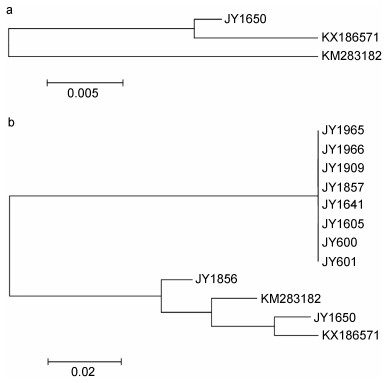 |
| 图 3 基于CEV套式PCR产物序列同源性的系统进化分析 Fig. 3 Phylogenetic analysis of CEV strains based on the sequences of the nested-PCR products 注: a:基于第1次PCR扩增产物序列构建的系统发育树; b:基于第2次PCR扩增产物序列构建的系统发育树 |
由第2步PCR产物序列构建系统发育树, 结果表明, JY1856、KM283182病毒株首先从JY1650、KX186571病毒株的亲缘关系中分离出来, 位于一条分支上。在这条分支中, JY1856与KM283182病毒株亲缘关系较近, 与KX186571病毒株关系较远; JY1650与KX186571病毒株亲缘关系较近, 与KM283182病毒株关系较远。最终这一分支与JY600、JY601、JY1605、JY1641、JY1857、JY1909、JY1965、JY1966等8株病毒株一起位于一条主分支(图 3b)。
2.5 人工浸泡感染试验结果实验过程中, 浸泡实验组部分死亡鱼体色发黑, 头部上方颅骨软组织周围皱缩, 眼球凹陷(图 4), 其表观症状与原始样品外观症状基本一致。经过77d试验, 试验对象不再死亡, 计算累计死亡率。结果, 浸泡实验组累计死亡率为71.1%±3.2%, 对照组为13.3%;浸泡实验组半数致死时间(median lethal time, LT50)为55d(图 5)。同时, 对试验所用鲤鱼进行CEV套式PCR检测方法(Oyamatsu et al, 1997a), 结果浸泡实验组CEV阳性检出率为68.4%, 对照组未检出。
 |
| 图 4 人工浸泡感染试验死亡鱼表观症状 Fig. 4 Apparent symptoms of the dead fish in immersion test |
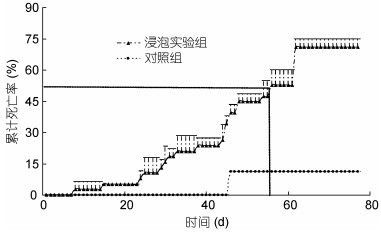 |
| 图 5 样品JY1650人工感染试验累计死亡率与感染时间关系 Fig. 5 Artificial infection of sample JY1650 with virus extraction |
于2016年9月随机采集的养成期鲤鱼编号为JY2012, 其平均体长为32±3cm, 观察其外观未发现眼球凹陷、头部上方颅骨软组织周围皱缩等自然感染鲤浮肿病毒的发病鱼显著特征。
对养成期鲤鱼进行CEV套式PCR检测, 其中, 套式PCR第1步检测结果均为阴性, 套式PCR第2步检测结果(图 6)表明, 40尾养成期鲤鱼中有31尾为CEV阳性。经计算, 此次随机采集的某鲤鱼养殖场养成期鲤鱼CEV携带率为77.5%。
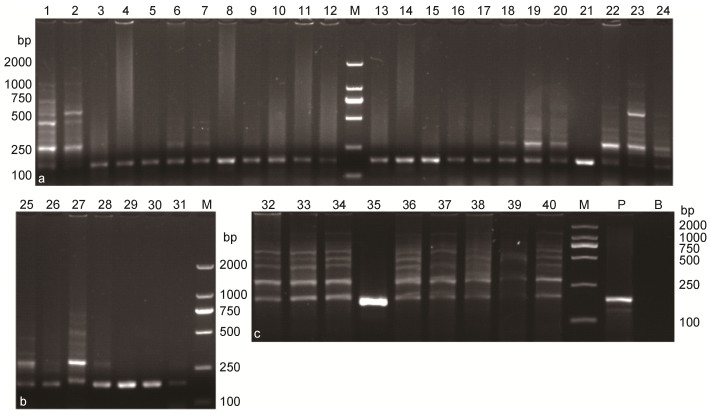 |
| 图 6 养成期鲤鱼CEV套式PCR第2步检测结果 Fig. 6 Result of detecting CEV from the adult common carp by the second of nested-PCR 注: M: DL 2000 Marker; P:阳性对照; B:空白对照; 泳道1—40:分别为40尾随机采集鲤鱼样品CEV套式PCR第2步检测结果, 目的条带180bp |
CEV于20世纪70年代首次在日本养殖的锦鲤中检测到, 此后的研究表明, CEV同样可以在发病的鲤鱼中被检测到(Hesami et al, 2015)。CEV存在于细胞质内, 粒子直径约250—280nm, 外形具有似桑葚样的囊膜(Ono et al, 1986; Oyamatsu et al, 1997b; Miyazaki et al, 2005), 现有研究将其归于痘病毒科Poxviridae (Ono et al, 1986; Matras et al, 2016)。
尽管CEV的相关报道相对较少, 但国外研究对CEV的流行状况、临床症状、致病机理、传播机制等方面都有所涉及, 有一定的研究基础。针对CEV的检测, 目前主要依靠PCR的方法进行。在其研究早期, 首先采用的是基于一段1272bp长度序列的套式PCR (Ono et al, 1986; Oyamatsu et al, 1997b)。此后随着研究深入, 研究出了可检测源于特定组织样品的套式PCR检测方法(Way et al, 2013; Haenen et al, 2016), 以及能够对该病毒进行定量的PCR检测方法(Adamek et al, 2016), 但仍是基于上面提及的该病毒部分序列进行。这同时也说明了目前针对该病毒的研究还不够深入和细化, 开展更系统和层次化的研究已迫在眉睫。
本研究中采集的疑似患有锦鲤睡眠病(KSD)的鲤鱼样品, 观察其外观症状发现, 眼球凹陷, 颅骨上方凹凸不平等同国外学者研究相吻合(Ono et al, 1986; Oyamatsu et al, 1997b; 畑井喜司雄等, 2007), 但国外研究中提及的病鱼身体呈浮肿状, 尤其尾柄部呈白色不透明状的现象在本研究中表现不明显, 猜测产生这一差异的原因可能是不同病毒株的差异或病毒感染程度不同导致。与KSD相比, 由锦鲤疱疹病毒(koi herpesvirus, KHV)引发的锦鲤疱疹病毒病(koi herpesvirus disease, KHVD)具有相似的临床症状, 主要表现为行动迟缓, 鱼眼凹陷, 皮肤和鳃苍白、颜色不规则, 伴有中度至严重的鳃坏死, 体表多黏液(刘宗晓等, 2006; OIE, 2017)。但在本研究的流行病学调查中并未检出KHV阳性样品, 故在生产实践中, 仅凭临床症状来区分KSD与KHVD无法获得准确的诊断结果, 仍需通过进一步的实验研究手段进行确诊。
通过对CEV阳性样品测序序列的进化分析证实, 2015—2016年所采集的10份样品中, 样品编号JY1856和JY1650分别与来自德国的KM283182病毒株以及来自中国的KX186571病毒株亲缘关系较近, 其它样品同这两株病毒株存在微进化关系。至此, 可以判定此10株样品与CEV同源性较大, 但是由于已知的CEV参考序列极少, 还无法得到更多的同源性比较结果, 以致于这些样品归属于CEV何种病毒株, 以及该病毒在我国鲤鱼养殖中的流行情况, 仍有待进一步研究。
本研究以暴发流行病的养殖鲤鱼组织液作为攻毒原液, 通过人工浸泡感染方式回接给健康的鲤鱼, 导致健康的鲤鱼部分出现与自然发病鱼相似的病症而死亡, 同时, 较高的检出率(68.4%)表明鲤鱼可能是CEV中国株的敏感宿主, 说明CEV是一种引起鲤鱼暴发性流行病的病原体, 能够对鲤鱼造成较高的死亡率(71.1%±3.2%)。针对同一养殖区域的养成期鲤鱼随机采集样品, CEV携带率达到77.5%, 但未出现显著的发病症状。综合分析人工浸泡感染试验与养成期鲤鱼CEV携带率检测结果, CEV可在幼鱼和成鱼中被检出, 说明其对鲤鱼的幼鱼期和成鱼期具有感染性。
此外, 本文通过浸泡感染方式可导致71.1%±3.2%的试验用鱼死亡, 获得该病毒半数死亡时间(LT50)为55d。国外相关研究表明, 该病毒可导致0.05—0.12g试验用鱼呈现72%累计死亡率(Oyamatsu et al, 1997b), 其LT50为15d左右; 可导致20—30g试验用鲤鱼呈现76%累计死亡率(Miyazaki et al, 2005), 其LT50为8d左右。通过比较中外感染试验可以发现, 累计死亡率没有明显的差异, 但本文人工浸泡感染试验LT50相对较长, 分析产生这种差异的原因, 可能与此次试验所用攻毒原液中病毒载量及该CEV中国株致病力有关。
有关对KSD的防控方面, 有研究指出, 使用0.5%盐水进行浸浴能够抑制病原体粘附宿主, 有助于降低该疫病发生时鱼体的死亡率(Seno et al, 2003)。但是, 使用此种方式, 鱼体仍然是具有传染性的, 并不能从根本上杀死病毒。其它的防控措施还包括, 避免水温处于15—25℃时起捕鱼; 对出现可疑临床症状的鱼进行隔离和检测; 尽快从池塘中捞取死鱼降低疾病传播; 养殖过程中避免密度过高; 新鱼入池后, 需在15—25℃水温中隔离检疫至少30d等(Hesami et al, 2015)。针对天津地区KSD的防控工作, 仍需在实践中不断检验获得。
本文采用分子生物学检测方法, 从天津地区养殖鲤鱼中检测到CEV阳性样品, 这是天津地区养殖的鲤鱼样品中首次检出CEV, 同时, 进一步证实了CEV在我国养殖鲤鱼中存在。因此, 我国渔业相关组织及研究机构亟需开展针对CEV的流行病学调查, 以便评估该疫病在我国鲤鱼养殖产业中扩散和传播的风险, 并及时采取有针对性及有效的防控措施防止该疾病的大规模传播和暴发, 从而尽可能降低该疫病对我国鲤鱼养殖产业造成影响和损失。
| 刘宗晓, 刘荭, 江育林, 2006. 锦鲤疱疹病毒病的研究进展. 检验检疫科学, 16(4): 77–80 |
| 畑井喜司雄, 小川和夫编著, 任晓明译, 2007. 新鱼病图谱. 北京: 中国农业大学出版社 |
| Adamek M, Jung-Schroers V, Hellmann J, et al, 2016. Concentration of carp edema virus (CEV) DNA in koi tissues affected by koi sleepy disease (KSD). Dis Aquat Organ, 119(3): 245–251 DOI:10.3354/dao02994 |
| Amita K, Oe M, Matoyama H, et al, 2002. A survey of Koi herpesvirus and carp edema virus in colorcarp cultured in Niigata Prefecture, Japan. Fish Pathol, 37(4): 197–198 DOI:10.3147/jsfp.37.197 |
| Haenen O, Way K, Stone D, et al, 2014. 'Koi sleepy disease' found for the first time in koi carps in the Netherlands. Tijdschr Diergeneeskd, 139(4): 26–29 |
| Haenen O, Way K, Vendramin N et al, 2015. Update on the CEV situation in the EU. In: Report of 19th Annual Meeting of the National Reference Laboratories for Fish Diseases, 27-28 May 2015. Organised by the European Union Reference Laboratory for Fish Diseases National Veterinary Institute, Copenhagen, Denmark |
| Haenen O, Way K, Gorgoglione T, et al, 2016. Novel viral infections threatening Cyprinid fish. Bull Eur Ass Fish Pathol, 36(1): 11–23 |
| Hesami S, Viadanna P, Steckler N et al, 2015. Carp Edema Virus Disease (CEVD)/Koi Sleepy Disease (KSD). University of Florida EDIS Publication FA189. http://edis.ifas.ufl.edu/FA189 |
| Jung-Schroers V, Adamek M, Teitge F, et al, 2015. Another potential carp killer?:Carp Edema Virus disease in Germany. BMC Vet Res, 11: 114 DOI:10.1186/s12917-015-0424-7 |
| King A M Q, Adams M J, Carstens E B et al, 2012. Virus Taxonomy: Ninth Report of the International Committee on Taxonomy of Viruses. Amsterdam: Elsevier/Academic Press |
| Lewisch E, Gorgoglione B, Way K, et al, 2015a. Carp edema virus/koi sleepy disease:An emerging disease in central-east Europe. Transbound Emerg Dis, 62(1): 6–12 DOI:10.1111/tbed.2014.62.issue-1 |
| Lewisch E, Vienna V, 2015b. First incidence of koi sleepy disease in Austria. University of Veterinary Medicine-Vienna. http://www.vetmeduni.ac.at/en/infoservice/presseinformation/press-releases-2015/first-incidence-of-koi-sleepy-diseasecarp-edema-virus-in-austria/ |
| Matras M, Borzym E, Stone D, et al, 2016. Carp edema virus in Polish aquaculture-evidence of significant sequence divergence and a new lineage in common carp Cyprinus carpio (L.). J Fish Dis, 40(3): 319–325 |
| Miyazaki T, Isshiki T, Katsuyuki H, 2005. Histopathological and electron microscopy studies on sleepy disease of koi Cyprinus carpio koi in Japan. Dis Aquat Organ, 65(3): 197–207 |
| OIE, 2017. Manual of diagnostic tests for aquatic animals. World Organisation for Animal Health http://www.oie.int/en/international-standard-setting/aquatic-manual/access-online/ |
| Ono S I, Nagai A, Sugai N, 1986. A histopathological study on juvenile colorcarp, Cyprinus carpio, showing edema. Fish Pathol, 21(3): 167–175 DOI:10.3147/jsfp.21.167 |
| Oyamatsu T, Matoyama H, Yamamoto K Y, et al, 1997a. A trial for the detection of Carp Edema Virus by using Polymerase Chain Reaction. Suisanzoshoku, 45(2): 247–251 |
| Oyamatsu T, Hata N, Yamada K, et al, 1997b. An etiological study on mass mortality of cultured colorcarp juveniles showing edema. Fish Pathol, 32(2): 81–88 DOI:10.3147/jsfp.32.81 |
| Pretto T, Abbadi M, Panzarin V et al, 2015. Carp edema virus (CEV): first detection in Italy. In: 17th International Conference on Diseases of Fish and Shellfish. Las Palmas, Gran Canaria, Spain: European Association of Fish Pathologists |
| Seno R, Hata N, Oyamatsu T, et al, 2003. Curative effect of 0.5% salt water treatment on carp, Cyprinus carpio, infected with Carp Edema Virus (CEV) results mainly from reviving the physiological condition of the host. Suisanzoshoku, 51(1): 123–124 |
| Vesely T, Pokorova D, Reschova S et al, 2015. Detection of carp edema virus in common carp (Cyprinus carpio) and koi in the Czech Republic. In: 17th International Conference on Diseases of Fish and Shellfish. Las Palmas, Gran Canaria, Spain: European Association of Fish Pathologists. |
| Viadanna P, Pilarski F, Hesami S et al, 2015. First report of Carp Edema Virus (CEV) in South American koi. In: 40th Eastern Fish Health Workshop. Charleston, NC |
| Way K, Stone D, 2013. Emergence of Carp edema virus-like (CEV-like) disease in the UK. CEFAS Finfish News, 15: 32–35 |
 2018, Vol. 49
2018, Vol. 49

