
中国海洋湖沼学会主办。
文章信息
- 邢晓丹, 张木子, 黎明, 袁莉霞, 王日昕, 石戈. 2018.
- Xing Xiao-Dan, Zhang Mu-Zi, Li Ming, Yuan Li-Xia, Wang Ri-Xin, Shi Ge. 2018.
- 牛磺酸和甲硫氨酸亚砜亚胺对高血氨症大弹涂鱼氧化应激和炎症反应相关基因影响的比较研究
- COMPARISON EFFECTS OF TAURINE AND METHIONINE SULFOXIMINE ON GENES INVOLVED IN OXIDATIVE STRESS AND INFLAMMATION OF HYPERAMMONEMIA MUDSKIPPER
- 海洋与湖沼, 49(3): 646-652
- Oceanologia et Limnologia Sinica, 49(3): 646-652.
- http://dx.doi.org/10.11693/hyhz20171100285
-
文章历史
- 收稿日期:2017-11-09
- 收修改稿日期:2018-02-19
2. 宁波大学海洋学院 宁波 315211
2. School of Marine Science, Ningbo University, Ningbo 315211, China
集约化养殖条件下, 由于饲料残渣和动物排泄物的氨化作用, 氨氮(Ammonia)很容易在养殖系统中积累(Randall et al, 2002)。氨氮通常以离子态(NH4+)和非离子态(NH3)形式存在。大多数硬骨鱼对NH3非常敏感, 环境中高浓度的氨氮会导致鱼类氨中毒(Benli et al, 2008)。鱼类氨中毒的主要症状包括:生长缓慢(Hegazi et al, 2010)、鳃组织增生、肝脏病变(Benli et al, 2008)、生理代谢紊乱, 甚至死亡(Ip et al, 2001)。早期研究认为, 鱼类氨中毒致死是因为大脑中高含量的NH3在谷氨酰胺合成酶催化下合成大量的谷氨酰胺, 使得星状胶质细胞肿胀引起颅内高压导致死亡(Smart, 1978)。然而, Ip等(2005)向大弹涂鱼腹腔中注射高浓度的醋酸铵后, 发现实验鱼大脑中谷氨酰胺含量并不会持续升高, 推测氨中毒死亡的直接原因可能与机体适应性调节产生的代谢产物所诱发的某些生理应激反应(或病理过程)有关。近年来, 学者们针对鱼类氨中毒致死机制进行大量有益的探索, 更多的研究聚焦于氧化应激与炎症反应。
氨氮胁迫下, 鱼体内N-甲基-D-天冬氨酸(NMDA)型谷氨酸受体被激活, 导致过度产生自由基(ROS), 继而诱发氧化应激(Murthy et al, 2001)。正常生理条件下, 自由基的产生与机体自身的抗氧化酶系统之间存在动态平衡, 然而, 当自由基水平超过一定的生理阈值时, 机体就会受到氧化应激伤害(Zhao et al, 2009)。鱼体内抗氧化酶系统包括:超氧化物歧化酶(Superoxide dismutase, SOD), 能够将ROS催化生成H2O2, 而具有细胞毒性的H2O2在过氧化氢酶(Catalase, CAT)与谷胱甘肽过氧化物酶(Glutathione peroxidase, GPX)的作用下生成无毒的H2O和O2。此外, Atli等(2010)还发现, 谷胱甘肽S-转移酶(Glutathione S-transferase, GST)也参与体内自由基的消除。自由基的过量产生除了引发氧化应激, 还能激活促炎细胞因子, 导致炎症反应(Kim et al, 2011)。肿瘤坏死因子(Tumor necrosis factor, TNF)是一类促炎细胞因子, 参与NF-κB细胞通路的活化, 参与机体的细胞凋亡和炎症反应(Lam et al, 2011)。NF-κB作为环境应激综合信使, 能够激活一系列促炎细胞因子, 包括:诱导型一氧化氮合酶(iNOS)、白细胞介素1(IL 1)、IL 6和IL 12等(Jia et al, 2014)。然而, 迄今为止, 氨氮胁迫引起鱼类氧化应激和炎症反应的分子机制尚不十分清楚。
牛磺酸(Taurine)是一种炎症反应的有效调节剂(Zhang et al, 2010)。Chepkova等(2006)报道, 牛磺酸可以改善线粒体功能、调节谷氨酰胺合成酶活性、降低组织中氨氮和谷氨酰胺含量, 已证实其对小鼠高氨血症能够起到较好的缓释作用。在鱼类研究中, Li等(2016)发现, 向全植物蛋白质的饲料中添加牛磺酸, 能够改善高血氨症对黄颡鱼 Pelteobagrus fulvidraco造成的不利影响。在高等动物中, 甲硫氨酸亚砜亚胺(Methionine sulfoximine, MSO)是一类治疗高血氨症的常用药物, 它是谷氨酰胺合成酶(GS)抑制剂(Brusilow, 2002)。Kosenko等(1999)发现甲硫氨酸亚砜亚胺的保护作用还表现在通过阻断NMDA受体的活化, 达到毒性缓释的作用。
大弹涂鱼(Boleophthalmus pectinirostris)为沿岸暖温性小型鱼类, 栖息于港湾和河口潮间带淤泥, 是一种商业上重要的养殖品种, 在我国福建、浙江、江苏、台湾等地分布较为广泛(Jin et al, 2017)。由于大弹涂鱼具有的较强氨氮耐受能力的特质, 使其成为开展本研究绝佳的实验对象。本研究拟通过查明牛磺酸和甲硫氨酸亚砜亚胺对高氨血症大弹涂鱼氧化应激(SOD, CAT, GPX和GST)和炎症反应(TNF, IL 1, IL 6和IL 8)相关基因表达的影响, 从氧化应激和炎症反应的角阐述度鱼类氨中毒的分子机制, 以期为鱼类氨中毒缓释手段的研发提供理论依据。
1 材料与方法 1.1 实验设计及采样大弹涂鱼购自浙江三门, 在实验室环境中暂养14d。挑选360尾体格健康、大小均一的大弹涂鱼(12.58±0.12g)随机分配到12个300L塑料缸中(N=30)。实验共设置4个处理组(每个处理设置3个重复):组1 (对照组)腹腔注射0.9%氯化钠; 组2腹腔注射LC50的醋酸铵(9μmol/g fish; Ip et al, 2005); 组3腹腔注射100μg/g fish牛磺酸10min后, 注射LC50的醋酸铵(Xing et al, 2016); 组4腹腔注射100μg/g fish甲硫氨酸亚砜亚胺10min后, 注射LC50的醋酸铵(Ip et al, 2005)。胁迫实验持续96h。实验过程中, 养殖用水是盐度为16的海水, 日换水量为总体积的1/3, 水温24—26℃, 溶氧(7.81±0.13)mg/L, 亚硝酸盐<0.5mg/L, 保持自然光照。
在实验结束后, 禁食24h, 每桶随机挑选3尾实验鱼, MS-222麻醉后解剖获得肝脏, 液氮冷冻, –80℃保存, 用于分析相关基因mRNA表达。
1.2 总RNA提取和cDNA合成取0.5g肝脏组织于RNAiso Plus(大连宝生物工程有限公司, 大连, 中国)中匀浆, 加入匀浆液1/5体积的氯仿, 12000r/min, 4℃离心15min, 取上清加入到等体积的异丙醇中, 12000r/min, 4℃离心10min, 弃上清, 加入75%乙醇清洗2遍, 弃上清, 干燥后溶于适量DEPC水中。取1μL总RNA, 使用TransScript All-in- one First-Strand cDNA Synthesis SuperMix for qPCR (One-Step gDNA Removal)试剂盒(北京全式金生物技术有限公司, 北京, 中国)进行第一链cDNA的合成。
1.3 mRNA组织表达量测定基于大弹涂鱼SOD、CAT、GPX、GST、TNF, IL 1, IL 6和IL 8序列, 以β-肌动蛋白为内参基因(β-actin), 采用Primer 5.0软件设计引物, 引物序列见表 1, 所用引物均由生工生物工程(上海)股份有限公司合成。实时荧光定量PCR反应体系包括(20μL): 10μL TransStart Tip Green qPCR SuperMix、0.4μL正向引物、0.4μL反向引物、0.4μL cDNA模板、8.8μL无菌水。反应条件为: 95℃, 5min; 95℃, 20s, 40个循环; 57℃, 25s; 72℃, 25s, 每个反应进行3次重复。将cDNA模板以5为单位进行6个梯度的稀释, 用于制作目的基因和内参基因的标准曲线。采用相对定量2–ΔΔCt法(Schmittgen et al, 2008)计算目的基因的相对表达量。
| 引物名称 | 正向引物序列(5′—3′) | 反向引物序列(5′—3′) | 片段大小(bp) |
| SOD | GGGCTGATAACATCGCTAA | GATGCCAATGACTCCACA | 185 |
| CAT | GGTCTGCTACCCGCCTGTCT | TCCCTCACCTGCTGGTCTTC | 100 |
| GPX | GTGATGATGGGCAGTGAA | TGTCTTGGAGGAAGTAGTTTT | 100 |
| GST | CTCAATCGTACAACGCTCAG | TTCCATTGGGTTGGCTCT | 102 |
| TNF | TGTCACAAACCTCGCTTCTAC | TTCCCATCATCCTCTAACCAT | 160 |
| IL 1 | GATACACTCTGCCGAGGTGAG | CCTGGAGCAAGCACTATTGG | 236 |
| IL 6 | GTCTGCACAGCCACATCAGT | GCGATGACGTCTGGAGAGTT | 256 |
| IL 8 | CTAATGGACAAGGCGTGGAC | GTGTCTGTGGAGAGCGTTGA | 224 |
| β-actin | GAGCGTGGCTACTCTTTCA | GGAGGCAGCAGTGTTCAT | 200 |
| 注: SOD:超氧化物歧化酶; CAT:过氧化氢酶; GPX:谷胱甘肽过氧化物酶; GST:谷胱甘肽S-转移酶; TNF:肿瘤坏死因子; IL 1:白细胞介素1; IL 6:白细胞介素6; IL 8:白细胞介素8 | |||
在统计分析之前, 使用Kolmogorov-Smirnov检验测试所有数据呈正态性分布。数据采用单因素方差分析(One-way ANOVA), 如果F检验呈显著性, 随后采用Tukey多重比较进行差异分析, 差异显着性设置P<0.05。所有分析均采用SPSS 18.0.0 (Chicago, USA)在Windows操作系统中进行。
2 结果组2实验鱼肝脏中SOD基因的mRNA表达量显著最高, 其次为组1, 组4最低(P<0.05;见图 1)。同样, 实验鱼肝脏中CAT, GPX和GST基因的mRNA表达量, 组2显著高于其他组, 组3和组4最低(P<0.05), 但组3和组4之间无显著性差异(P>0.05)。
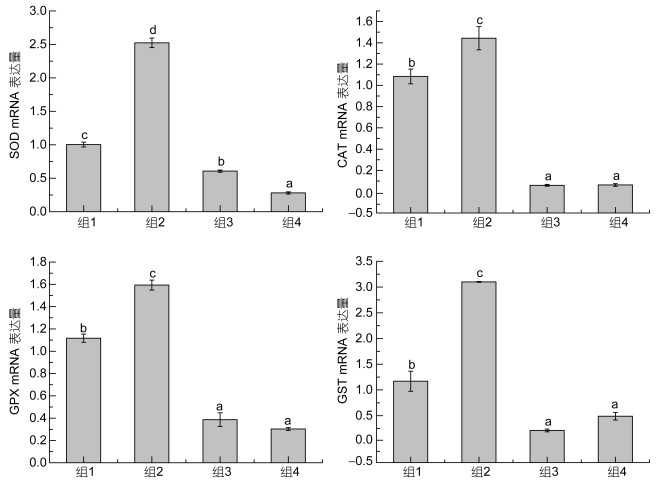 |
| 图 1 牛磺酸和甲硫氨酸亚砜亚胺对高血氨症大弹涂鱼肝脏中SOD、CAT、GPX和GST基因mRNA表达量的影响 Fig. 1 Effects of taurine and methionine sulfoximine on mRNA expression of SOD, CAT, GPX and GST in the liver of hyperammonemia mudskipper 注:不同字母表示差异显著(P<0.05), 相同字母表示无显著差异(P>0.05), 下同 |
组1实验鱼肝脏中TNF基因的mRNA表达量显著最高, 组3显著最低(P<0.05, 见图 2)。组4实验鱼肝脏中IL 1基因的mRNA表达量显著最高(P<0.05), 而其他组之间无显著性差异(P>0.05)。组2实验鱼肝脏中IL 6和IL 8基因的mRNA表达量显著高于其他组(P<0.05), 而组3和组4之间无显著性差异(P>0.05)。
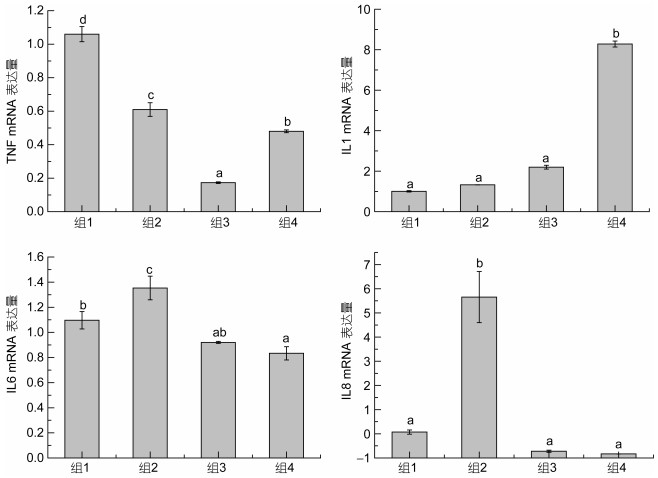 |
| 图 2 牛磺酸和甲硫氨酸亚砜亚胺对高血氨症大弹涂鱼肝脏中TNF、IL 1、IL 6和IL 8基因mRNA表达的影响 Fig. 2 Effects of taurine and methionine sulfoximine on mRNA expression of TNF, IL 1, IL 6 and IL 8 in the liver of hyperammonemia mudskipper |
正常生理条件下, 鱼类能够依靠自身抗氧化酶体系(如: SOD、CAT、GPX和GST)清除多余的自由基, 保护机体免受氧化应激造成的伤害(Trenzado et al, 2009)。然而, 当氨氮胁迫发生时, 高浓度的血氨水平能够过度激活NMDA谷氨酸受体, 大量生成自由基, 继而造成组织或细胞过氧化损伤, 影响机体的免疫力和抗病力(Murthy et al, 2001)。Rigault等(2013)发现, 抗氧化酶活性往往受到mRNA表达水平和蛋白质稳定性的影响。在本研究中, 腹腔注射LC50浓度醋酸铵(组2)的实验鱼肝脏中SOD、CAT、GPX和GST基因的mRNA表达量显着高于对照组(组1), 这个发现与Jin等(2017)报道的氨氮暴露对草鱼Ctenopharyngodon idellus造成生理负面影响的研究结果是一致的。环境应激中, 机体内抗氧化酶相关基因mRNA表达量的上调, 可能与“毒性兴奋作用”影响下机体提高相关酶的需求量有关。相反, 在鲫鱼Carassius auratus (Ren et al, 2016)和南美白对虾Litopenaeus vannamei (Liang et al, 2016)的研究中发现, 氨氮胁迫下, 其抗氧化酶活性显著下降。此外, 在虹鳟Oncorhynchus mykiss、鲤鱼Cyprinus carpio、金鱼Carassius auratus (Sinha et al, 2014)、欧洲鲈鱼Dicentrarchus labrax (Sinha et al, 2015)和罗氏沼虾Macrobrachium rosenbergii (Zhang et al, 2015), 氨氮暴露组与对照组相比, 抗氧化酶没有发现显著性变化。鱼种和大小, 毒性耐力, 氨水平, 管理方法和胁迫方法的差异均能导致研究结果的不同。
本研究发现, 组3(腹腔注射醋酸铵和牛磺酸组)实验鱼肝脏中SOD, CAT, GPX和GST基因的mRNA表达量显著低于组2(腹腔注射醋酸铵)。Mehta等(2001)报道, 牛磺酸能够有效去除机体中的自由基, 包括过氧化氢、超氧化物和过氧亚硝酸盐等。先前的研究发现, 外源牛磺酸可以缓解高血氨症对鲫鱼Carassius auratus和草鱼Ctenopharyngodon idellus抗氧化酶活性造成的不利影响(Ren et al, 2016; Xing et al, 2016)。Sakai等(1990)在高血氨症加利福尼亚湾石首鱼Totoaba macdonaldi的研究中发现, 外源补充牛磺酸能够缓解过氧化氢酶活性抑制的症状, 发现脂质过氧化水平显著降低。此外, 本研究还发现, 通过腹腔注射甲硫氨酸亚砜亚胺能够缓解高血氨对大弹涂鱼抗氧化系统的负面影响。先前的研究发现, 通过向高血氨症大鼠的腹腔中注射甲硫氨酸亚砜亚胺, 大鼠氨中毒的生理症状得到明显的缓解, 甲硫氨酸亚砜亚胺是一种谷氨酰胺合成酶抑制剂, 在体内通过抑制谷氨酰胺合成酶的活性, 进一步阻断谷氨酰胺的释放(Brusilow, 2002; Kosenko et al, 1993)。
机体应激过量产生的自由基不仅会造成氧化损伤, 还会影响促炎性细胞因子的mRNA表达(Ai et al, 2011)。Cheng等(2015)发现, 氨氮胁迫使得暗纹东方鲀Takifugu obscurus促炎性细胞因子(IL 6和IL 12)的mRNA表达量显著上调, 这个结果与本研究的发现是一致:组2(腹腔注射醋酸铵)实验鱼IL 1、IL 6和IL 8基因的mRNA表达量显著高于对照组。尽管生物体内具有多种抗应激的保护机制, 当应激超过一定的生理阈值, 将会诱发机体运动障碍、生理代谢紊乱以及细胞凋亡(Chandra et al, 2000)。然而, 在本研究中, 腹腔注射醋酸铵显著抑制了TNF基因的mRNA表达量, 这可能与促炎性因子释放速度有关。TNF是一种多效促炎细胞因子, 在炎症应答、细胞凋亡、细胞增殖和免疫系统中发挥作用(Lam et al, 2011), TNF的活化还能够激活NF-κB启动细胞凋亡。Li等(2016)发现, 黄颡鱼暴露于氨氮环境, 肝脏中溶菌酶、碱性磷酸酶和酸性磷酸酶活性14d内无显著性差异, 于14d后呈现出显著降低趋势, 提示免疫抑制的发生可能是由于免疫抑制因子逐渐积累造成的。在哺乳类的研究已证实, 氨氮胁迫能够诱导哺乳动物GSM06细胞的DNA损伤和细胞凋亡, 但存在明显的时间和剂量依赖效应(Suzuki et al, 2002)。
牛磺酸是一种机体炎症应答的有效调节剂, 参与机体抗氧化、免疫调节、重金属毒性缓释、渗透压和神经调节等生理活动(Zhang et al, 2010)。Chepkova等(2006)报道, 牛磺酸可以通过改善线粒体功能及调节谷氨酰胺合成酶活性, 降低氨氮和谷氨酰胺的积累, 发挥缓解小鼠高血氨症的作用。本研究发现, 组3(腹腔注射醋酸铵和牛磺酸)实验鱼肝脏中TNF、IL 6和IL 8基因的mRNA表达显着低于组2(腹腔注射醋酸铵), 结果提示, 牛磺酸通过调节促炎症因子的mRNA表达, 降低高血氨症对鱼类造成的伤害。本研究还发现, 组4(腹腔注射醋酸铵和甲硫氨酸亚砜亚胺)实验鱼肝脏中TNF和IL 1基因的mRNA表达量显著高于组3(腹腔注射醋酸铵和牛磺酸), 提示甲硫氨酸亚砜亚胺对炎症因子的释放并没有发挥有效的作用。Brusilow(2002)报道, 甲硫氨酸亚砜亚胺能够抑制谷氨酰胺合成酶活性, 从而减少谷氨酰胺的合成, 继而起到改善细胞肿胀的作用。Kosenko等(1993)的研究指出, 向高血氨症大鼠腹腔中注射甲硫氨酸亚砜亚胺可以缓解大脑星状胶质细胞的肿胀, 但是并没有提高患病动物的存活率。在鱼类研究中, Ip等(2005)报道, 向高血氨症斑马鱼腹腔中注射甲硫氨酸亚砜亚胺, 并没有降低其死亡率, 仅仅是延长了死亡时间。
4 结论综上所述, 本研究发现, 氨氮毒性能够影响鱼体内抗氧化酶系统及免疫应答, 导致氧化损伤和炎症反应; 外源性牛磺酸能够缓解鱼类高血氨症带来的负面影响; 甲硫氨酸亚砜亚胺尽管能够缓解自由基造成的氧化损伤, 但对炎症反应并未发挥有效的作用。
| Ai H X, Shen Y F, Min C, et al, 2011. Molecular structure, expression and bioactivity characterization of TNF13B (BAFF) gene in mefugu, Takifugu obscurus. Fish Shellfish Immunol, 30(6): 1265–1274 DOI:10.1016/j.fsi.2011.03.020 |
| Atli G, Canli M, 2010. Response of antioxidant system of freshwater fish Oreochromis niloticus to acute and chronic metal (Cd, Cu, Cr, Zn, Fe) exposures. Ecotoxicol Environ Saf, 73(8): 1884–1889 DOI:10.1016/j.ecoenv.2010.09.005 |
| Benli A K, K ksal G, zkul A, 2008. Sublethal ammonia exposure of Nile tilapia (Oreochromis niloticus L.):effects on gill, liver and kidney histology. Chemosphere, 72(9): 1355–1358 DOI:10.1016/j.chemosphere.2008.04.037 |
| Brusilow S W, 2002. Hyperammonemic encephalopathy. Medicine, 81(3): 240–249 DOI:10.1097/00005792-200205000-00007 |
| Chandra J, Samali A, Orrenius S, 2000. Triggering and modulation of apoptosis by oxidative stress. Free Radic Biol Med, 29(3-4): 323–333 DOI:10.1016/S0891-5849(00)00302-6 |
| Cheng C H, Yang F F, Ling R Z, et al, 2015. Effects of ammonia exposure on apoptosis, oxidative stress and immune response in pufferfish (Takifugu obscurus). Aquat Toxicol, 164(1): 61–71 |
| Chepkova A N, Sergeeva O A, Haas H L, 2006. Taurine rescues hippocampal long-term potentiation from ammonia-induced impairment. Neurobiol Dis, 23(3): 512–521 DOI:10.1016/j.nbd.2006.04.006 |
| Hegazi M M, Hasanein S S, 2010. Effects of chronic exposure to ammonia concentrations on brain monoamines and ATPases of Nile tilapia (Oreochromis niloticus). Comp Biochem Physiol C Toxicol Pharmacol, 151(4): 420–425 DOI:10.1016/j.cbpc.2010.01.006 |
| Ip Y K, Chew S F, Randall D J, 2001. Ammonia toxicity, tolerance, and excretion. Fish Physiol, 20: 109–148 DOI:10.1016/S1546-5098(01)20005-3 |
| Ip Y K, Leong M W F, Sim M Y, et al, 2005. Chronic and acute ammonia toxicity in mudskippers, Periophthalmodon schlosseri and Boleophthalmus boddaerti:brain ammonia and glutamine contents, and effects of methionine sulfoximine and MK801. J Exp Biol, 208(10): 1993–2004 DOI:10.1242/jeb.01586 |
| Jia R, Cao L P, Du J L, et al, 2014. Effects of carbon tetrachloride on oxidative stress, inflammatory response and hepatocyte apoptosis in common carp (Cyprinus carpio). Aquat Toxicol, 152: 11–19 DOI:10.1016/j.aquatox.2014.02.014 |
| Jin J L, Wang Y, Wu Z X, et al, 2017. Transcriptomic analysis of liver from grass carp (Ctenopharyngodon idellus) exposed to high environmental ammonia reveals the activation of antioxidant and apoptosis pathways. Fish Shellfish Immunol, 63: 444–451 DOI:10.1016/j.fsi.2017.02.037 |
| Kim H Y, Park J, Lee K H, et al, 2011. Ferulic acid protects against carbon tetrachloride-induced liver injury in mice. Toxicology, 282(3): 104–111 DOI:10.1016/j.tox.2011.01.017 |
| Kosenko E, Kaminsky Y G, Felipo V, et al, 1993. Chronic hyperammonemia prevents changes in brain energy and ammonia metabolites induced by acute ammonium intoxication. Biochim Biophys Acta, 1180(3): 321–326 |
| Kosenko E, Kaminski Y, Lopata O, et al, 1999. Blocking NMDA receptors prevents the oxidative stress induced by acute ammonia intoxication. Free Radic Biol Med, 26(11-12): 1369–1374 DOI:10.1016/S0891-5849(98)00339-6 |
| Lam F W S, Wu S Y, Lin S J, et al, 2011. The expression of two novel orange-spotted grouper (Epinephelus coioides) TNF genes in peripheral blood leukocytes, various organs, and fish larvae. Fish Shellfish Immunol, 30(2): 618–629 DOI:10.1016/j.fsi.2010.12.011 |
| Li M, Lai H, Li Q, et al, 2016. Effects of dietary taurine on growth, immunity and hyperammonemia in juvenile yellow catfish Pelteobagrus fulvidraco fed all-plant protein diets. Aquaculture, 450: 349–355 DOI:10.1016/j.aquaculture.2015.08.013 |
| Liang Z X, Liu R, Zhao D P, et al, 2016. Ammonia exposure induces oxidative stress, endoplasmic reticulum stress and apoptosis in hepatopancreas of pacific white shrimp (Litopenaeus vannamei). Fish Shellfish Immunol, 54: 523–528 DOI:10.1016/j.fsi.2016.05.009 |
| Mehta T R, Dawson Jr R, 2001. Taurine is a weak scavenger of peroxynitrite and does not attenuate sodium nitroprusside toxicity to cells in culture. Amino Acids, 20(4): 419–433 DOI:10.1007/s007260170038 |
| Murthy C R K, Rama Rao K V, Bai G, et al, 2001. Ammonia-induced production of free radicals in primary cultures of rat astrocytes. J Neurosci Res, 66(2): 282–288 DOI:10.1002/(ISSN)1097-4547 |
| Randall D J, Tsui T K N, 2002. Ammonia toxicity in fish. Mar Pollut Bull, 45(1-12): 17–23 DOI:10.1016/S0025-326X(02)00227-8 |
| Ren Q Y, Li M, Yuan L X, et al, 2016. Acute ammonia toxicity in crucian carp Carassius auratus and effects of taurine on hyperammonemia. Comp Biochem Physiol C Toxicol Pharmacol, 190: 9–14 DOI:10.1016/j.cbpc.2016.08.001 |
| Rigault C, Le Borgne F, Tazir B, et al, 2013. A high-fat diet increases l-carnitine synthesis through a differential maturation of the Bbox1 mRNAs. Biochim Biophys Acta, 1831(2): 370–377 DOI:10.1016/j.bbalip.2012.10.007 |
| Sakai T, Tabata N, Watanabe K, 1990. Bile pigments in the bile of marine fish:yellowtail, red sea bream, and flounder. Agric Biol Chem, 54(8): 2047–2053 |
| Schmittgen T D, Livak K J, 2008. Analyzing real-time PCR data by the comparative CT method. Nat Protoc, 3(6): 1101–1108 DOI:10.1038/nprot.2008.73 |
| Sinha A K, AbdElgawad H, Giblen T, et al, 2014. Anti-oxidative defences are modulated differentially in three freshwater teleosts in response to ammonia-induced oxidative stress. PLoS One, 9(4): e95319 DOI:10.1371/journal.pone.0095319 |
| Sinha A K, AbdElgawad H, Zinta G, et al, 2015. Nutritional status as the key modulator of antioxidant responses induced by high environmental ammonia and salinity stress in European Sea Bass (Dicentrarchus labrax). PLoS One, 10(8): e0135091 DOI:10.1371/journal.pone.0135091 |
| Smart G R, 1978. Investigations of the toxic mechanisms of ammonia to fish-gas exchange in rainbow trout (Salmo gairdneri) exposed to acutely lethal concentrations. J Fish Biol, 12(1): 93–104 DOI:10.1111/jfb.1978.12.issue-1 |
| Suzuki H, Yanaka A, Shibahara T, et al, 2002. Ammonia-induced apoptosis is accelerated at higher pH in gastric surface mucous cells. Am J Physiol, 283(4): G986–G995 |
| Trenzado C E, Morales A E, Palma J M, et al, 2009. Blood antioxidant defenses and hematological adjustments in crowded/uncrowded rainbow trout (Oncorhynchus mykiss) fed on diets with different levels of antioxidant vitamins and HUFA. Comp Biochem Physiol C Toxicol Pharmacol, 149(3): 440–447 DOI:10.1016/j.cbpc.2008.10.105 |
| Xing X D, Li M, Yuan L X, et al, 2016. The protective effects of taurine on acute ammonia toxicity in grass carp Ctenopharynodon idellus. Fish Shellfish Immunol, 56: 517–522 DOI:10.1016/j.fsi.2016.08.005 |
| Zhang F, Mao Y H, Qiao H Q, et al, 2010. Protective effects of taurine against endotoxin-induced acute liver injury after hepatic ischemia reperfusion. Amino Acids, 38(1): 237–245 DOI:10.1007/s00726-009-0233-z |
| Zhang Y F, Ye C X, Wang A L, et al, 2015. Isolated and combined exposure to ammonia and nitrite in giant freshwater pawn (Macrobrachium rosenbergii):effects on the oxidative stress, antioxidant enzymatic activities and apoptosis in haemocytes. Ecotoxicology, 24(7-8): 1601–1610 DOI:10.1007/s10646-015-1477-x |
| Zhao Y Y, Xie P, Zhang X Z, 2009. Oxidative stress response after prolonged exposure of domestic rabbit to a lower dosage of extracted microcystins. Environ Toxicol Pharmacol, 27(2): 195–199 DOI:10.1016/j.etap.2008.10.005 |
 2018, Vol. 49
2018, Vol. 49


