
中国海洋湖沼学会主办。
文章信息
- 张薇, 孙志宾, 马爱军, 夏丹丹, 王婷, 于宏. 2018.
- ZHANG Wei, SUN Zhi-Bin, MA Ai-Jun, XIA Dan-Dan, WANG Ting, YU Hong. 2018.
- 双锯鱼属(Amphiprion)四种鱼种比较胚胎学研究和进化探讨
- STUDIES ON COMPARATIVE EMBRYOLOGY AND DISCUSSION OF EVOLUTIOLOGY IN FOUR VARIETIES OF AMPHIPRION
- 海洋与湖沼, 49(3): 671-681
- Oceanologia et Limnologia Sinica, 49(3): 671-681.
- http://dx.doi.org/10.11693/hyhz20171100302
-
文章历史
- 收稿日期:2017-11-30
- 收修改稿日期:2018-03-09
2. 上海海洋大学水产与生命学院 上海 201306;
3. 青岛海洋科学与技术国家实验室海洋生物学与生物技术功能实验室 青岛 266071
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China;
3. Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China
观赏渔业作为水产养殖业的一个重要分支, 越来越受到人们的关注, 在国际市场逐渐被重视(Zou, 1998), 同时也是我国发展潜力巨大的新兴产业之一(王吉桥, 2011)。双锯鱼(Amphiprion)(俗称小丑鱼)由于其美丽的外观深受观赏鱼爱好者的喜爱, 一跃成为海水观赏鱼中的新贵。双锯鱼隶属于硬骨鱼纲(Osteichthyes)、鲈形目(Perciformes)、雀鲷科(Pomacentridae)、海葵鱼亚科(Amphiprioninae), 分布在印度洋和太平洋水温较暖的珊瑚礁海域, 是珊瑚礁生态系统不可或缺的生物种类, 也是热带海水观赏鱼中最常见、具有较高观赏利用价值的品种之一(马本贺等, 2017)。目前发现的双锯鱼共有30种, 均来自于海葵鱼亚科中的双锯鱼属(Amphiprion)和棘颊雀鲷属(Premnas), 除透红小丑鱼(Premnas biaculeatus)属于棘颊雀鲷属(Premnas)外, 其他均为双锯鱼属(Amphiprion)。
白条双锯鱼(Amphiprion frenatus)俗称番茄小丑鱼(tomato clownfish), 眼斑双锯鱼(Amphiprion ocellaris)俗称公子小丑鱼(ocellaris clownfish), 均属于双锯鱼属。人工选育的海葵双锯鱼(Amphiprion percula)俗称毕加索小丑鱼(Picasso clownfish), 最先在2004年发现于所罗门群岛的一条雄性鱼, 与普通海葵双锯鱼雌性配对, 经过长期选育得到毕加索小丑鱼, 其产卵后代根据条纹分布和白色条纹的特异性来分辨等级, 后代只有一部分为纯种毕加索小丑鱼, 由于每条鱼都是独一无二的, 因此毕加索小丑鱼的价格要高于其他小丑鱼; 人工选育的眼斑双锯鱼(Amphiprion ocellaris)又称雪印小丑鱼(snowflake clownfish), 最先在1999年发现于英国的热带海水中心, 由于其身体规则不一的白色纹路, 深受人们的喜爱, 根据白纹占据身体的百分比来确定其是否为纯种, 与毕加索小丑鱼一样, 雪印小丑鱼每条都是独一无二的, 没有完全相似的两条(https://www.orafarm.com/)。
目前, 市场上大多数的海水观赏鱼为野生捕捞, 由于过度捕捞, 海域生态遭到严重破坏, 致使小丑鱼数量日益锐减, 为了减少这一现象的发生, 国内外科研人员对小丑鱼的人工繁育进行相关实验的研究, 并在其人工化、规模化养殖技术研究中取得一定成果。Ignatius等(2001)第一次进行了黑双带小丑鱼(Amphiprion sebae)的全人工繁育技术; Madhu等(2002)报道了海葵双锯鱼(Amphiprion percula)的人工繁殖; 滕力平等(2005)报道了二线小丑鱼(Amphiprion larkii)的人工繁殖和胚胎发育, 通过模拟自然环境驯化使其达到性成熟和产卵; Yasir等(2007)报道了眼斑双锯鱼(Amphiprion ocellaris)繁殖习性及胚胎和仔鱼的发育; 鲍鹰等(2009, 2011)先后对白条双锯鱼(Amphiprion frenatus)和透红小丑鱼(Premnas biaculeatus)人工育苗与胚胎发育进行了研究; 鞠晨曦等(2014)对眼斑双锯鱼的胚胎发育等进行了形态学观察; 叶乐等(2010)通过对克氏双锯鱼(Amphiprion clarkii)的全人工培育中发现, 小丑鱼即使离开了海葵的共生关系也可以正常发育。而关于不同鱼种的小丑鱼比较胚胎学的研究尚未见报道。本文对四种小丑鱼在相同生长环境下胚胎发育过程进行观察并比较, 从胚胎学角度探讨这四种小丑鱼的异同, 旨在为其不同种类的进化关系提供基础资料, 为大规模工业化养殖提供理论依据, 为新品种的选育创造基础条件。
1 材料与方法 1.1 实验材料 1.1.1 亲鱼2016年5月购买双锯鱼亲鱼, 其中野生双锯鱼亲鱼购自海南渔民, 人工选育双锯鱼亲鱼购自青岛观赏鱼水族市场, 产卵模式在本实验室已达稳定状态。本实验是从2017年5—9月份为期五个月的产卵观察, 亲鱼品种如图 1。其中, a.白条双锯鱼(番茄小丑鱼) (Amphiprion frenatus)♀×♂是经过驯化的野生鱼; b.眼斑双锯鱼(公子小丑鱼) (Amphiprion ocellaris)♀×♂是经过驯化的野生鱼; c.海葵双锯鱼(毕加索小丑鱼) (Amphiprion percula)♀×♂为人工选育鱼; d.眼斑双锯鱼(雪印小丑鱼) (Amphiprion ocellaris)♀×♂为人工选育鱼。为便于叙述, 下文中小丑鱼均以其俗称描述。
 |
| 图 1 亲鱼图片 Fig. 1 The picture of parental fish |
实验用海水为美国Instant Ocean Reef Crystals Reef盐和反渗透过滤纯水配制而成。
1.2 实验方法 1.2.1 亲鱼培育四对亲鱼培养条件均一致, 水温为26.0±1℃, pH为8.1±0.1, 盐度为30±1, 氨氮量低于0.1mg/L, 溶解氧大于5.8mg/L, 光照强度为2000 lx, 光暗周期为14L:10D, 水温通过循环水系统中的加热棒控制。每天吸出缸底剩饵残渣并及时补充因吸出损失的水, 隔天检测并调整一次盐度。投喂饵料根据Hoff(1996)配方改良而成, 成分为鲜虾肉、鱿鱼、牡蛎、冰冻卤虫、螺旋藻、裂壶藻、各种维生素等配制而成, 于上午8:00, 中午12:00, 下午16:00各投喂一次。
1.2.2 循环水系统该系统用于热带海水养殖鱼类种质的保存与培养, 为立体循环系统。本系统以耐海水腐蚀316L型不锈钢方钢为结构骨架, 架子主体分成三层, 上层和中层放置鱼类养殖缸, 下层放置底缸。鱼缸上方架子上安装有节能LED灯管, 配备微电脑时控开关, 循环定时开关灯; 鱼缸内部接有进水管、溢流管和排污管; 底缸中分割有物理过滤分割区、生物过滤区、加热控温及紫外处理区和上水泵区。该系统的所有电源为集中控制, 同时做好防水和防漏电保护措施。
1.2.3 胚胎发育观察四种小丑鱼产卵时间类似, 产卵时间一般在11:00—16:00之间。产卵的当天, 亲鱼用吻部清理产卵场。雌鱼腹部输卵管伸长, 抖动身体将少量卵产在清理好的卵床上, 雄鱼立即过去授精, 然后雌鱼再产卵, 雄鱼再授精, 如此反复交替进行, 约1—2h后产卵结束, 雌鱼游开雄鱼则守护在卵旁边, 频频用胸鳍扇动受精卵。
产卵当天每0.5h取样观察一次, 第二天每1h取样观察一次, 第三天每2h取样观察一次, 第四天每3h取样观察一次, 第五天之后每天观察2次, 直至鱼孵化。每次取样观察5—10个受精卵。取样时用巴氏滴管将鱼卵的附着丝铲断并吸入滴管, 然后取样置于载玻片上。利用NikonYS100显微镜观察小丑鱼的胚胎发育过程, 记录四种小丑鱼受精卵所处的发育阶段, 进行连续观测和拍摄记录, 分析和比较四种小丑鱼的胚胎变化。
1.2.4 器官形成期的观察当胚胎发育进入器官形成期时, 对四种小丑鱼进行5个时间段(10h, 58h, 105h, 140h, 160h)的观察。方法同1.2.3。
2 结果 2.1 产卵统计如表 1所示, 番茄小丑鱼亲鱼从5—9月份之间共产卵12次, 产卵时间在12:00—13:00, 前4次间隔一致, 为11d, 5—7次间隔要比前三次间隔时间长3d, 为11—15d, 产卵间隔变化不超过5d, 在水温保持稳定的条件下, 胚胎发育时间为10d。如表 2所示, 公子小丑鱼从5—9月份共产卵11次, 产卵时间在15:00—16:00, 产卵间隔在15d左右, 胚胎发育时间为10d。如表 3所示, 毕加索小丑鱼从5—9月份共产卵12次, 产卵时间在12:00—14:00, 产卵间隔12—13d左右, 胚胎发育时间为11d。如表 4所示, 雪印小丑鱼亲鱼从6—9月份共产卵12次, 产卵时间在11:00—13:00, 间隔9—13d, 胚胎发育时间为8d。
| 序号 | 产卵日期(月.日) | 产卵时间(时:分) | 孵化日期(月.日) | 产卵间隔(d) | 孵化期(d) |
| 1 | 05.18 | 13:00 | 05.28 | / | 10 |
| 2 | 05.29 | 13:00 | 06.08 | 11 | 10 |
| 3 | 06.09 | 13:00 | 06.19 | 11 | 10 |
| 4 | 06.20 | 13:00 | 06.28—06.30 | 11 | 8—10 |
| 5 | 07.03 | 12:00 | 07.13 | 13 | 10 |
| 6 | 07.16 | 13:00 | 07.26 | 13 | 10 |
| 7 | 07.29 | 13:00 | 08.08 | 13 | 10 |
| 8 | 08.09 | 13:00 | 08.19 | 11 | 10 |
| 9 | 08.21 | 12:00 | 08.31 | 12 | 10 |
| 10 | 09.01 | 12:00 | 09.11 | 11 | 10 |
| 11 | 09.16 | 13:00 | 09.26 | 15 | 10 |
| 12 | 09.30 | 12:00 | 10.10 | 14 | 10 |
| 序号 | 产卵日期(月.日) | 产卵时间(时:分) | 孵化日期(月.日) | 产卵间隔(d) | 孵化期(d) |
| 1 | 05.11 | 16:00 | 05.21 | / | 10 |
| 2 | 05.26 | 16:00 | 06.05 | 15 | 10 |
| 3 | 06.06 | 15:30 | 06.16 | 11 | 10 |
| 4 | 06.21 | 15:30 | 07.01 | 15 | 10 |
| 5 | 07.05 | 15:00 | 07.15 | 14 | 10 |
| 6 | 07.19 | 15:00 | 07.29 | 14 | 9 |
| 7 | 08.03 | 15:30 | 08.13 | 15 | 10 |
| 8 | 08.16 | 15:00 | 08.26 | 13 | 10 |
| 9 | 08.30 | 15:20 | 09.10 | 14 | 10 |
| 10 | 09.14 | 15:00 | 09.24 | 14 | 10 |
| 11 | 09.29 | 15:00 | 10.09 | 15 | 10 |
| 序号 | 产卵日期(月.日) | 产卵时间(时:分) | 孵化日期(月.日) | 产卵间隔(d) | 孵化期(d) |
| 1 | 05.14 | 13:00 | 05.25 | / | 11v |
| 2 | 05.25 | 14:00 | 06.05 | 11 | 11 |
| 3 | 06.06 | 14:00 | 06.17 | 12 | 11 |
| 4 | 06.18 | 14:00 | 06.29 | 12 | 11 |
| 5 | 06.30 | 12:30 | 07.11 | 12 | 11 |
| 6 | 07.12 | 14:00 | 07.23 | 12 | 11 |
| 7 | 07.24 | 13:00 | 08.04 | 12 | 10 |
| 8 | 08.06 | 13:00 | 08.17 | 13 | 11 |
| 9 | 08.19 | 13:00 | 08.30 | 13 | 11 |
| 10 | 09.03 | 13:00 | 09.14 | 15 | 11 |
| 11 | 09.16 | 14:00 | 09.27 | 13 | 11 |
| 12 | 09.29 | 14:00 | 10.10 | 13 | 11 |
| 序号 | 产卵日期(月.日) | 产卵时间(时:分) | 孵化日期(月.日) | 产卵间隔(d) | 孵化期(d) |
| 1 | 06.01 | 13:00 | / | / | |
| 2 | 06.11 | 13:00 | 06.19 | 10 | 8 |
| 3 | 06.21 | 12:00 | 06.29 | 10 | 8 |
| 4 | 07.04 | 11:00 | 07.12 | 13 | 8 |
| 5 | 07.15 | 13:00 | 07.23 | 11 | 8 |
| 6 | 07.24 | 12:30 | 07.29 | 9 | 7 |
| 7 | 08.06 | 12:00 | 08.14 | 13 | 8 |
| 8 | 08.15 | 14:30 | 08.23 | 9 | 8 |
| 9 | 08.26 | 11:20 | 09.03 | 11 | 8 |
| 10 | 09.05 | 12:00 | 09.13 | 10 | 8 |
| 11 | 09.14 | 13:00 | 09.22 | 9 | 8 |
| 12 | 09.26 | 12:00 | 10.04 | 12 | 8 |
从四种鱼的产卵情况来看, 在相同的生长环境中, 四种小丑鱼产卵时间相差不大, 产卵间隔规律性较强, 但是胚胎发育时间有很大的差别。毕加索小丑鱼最长, 雪印小丑鱼最短。所有小丑鱼几乎均稳定在一个月产卵两次。
2.2 受精卵与胚胎发育的比较统计随机六次小丑鱼产卵卵长(表 5)取平均值和标准差, 番茄小丑鱼卵长为(2.82±0.13)mm, 公子小丑鱼卵长(2.30±0.11)mm, 毕加索小丑鱼卵长(1.93± 0.14)mm, 雪印小丑鱼卵长(1.80±0.18)mm。小丑鱼的整个胚胎发育过程可以分为10个时期:卵裂前期、卵裂期、囊胚期、原肠期、神经胚期、体节期、翻转期、血管形成期、器官形成期、孵化期。图 2—图 5分别为番茄小丑鱼、公子小丑鱼、毕加索小丑鱼和雪印小丑鱼胚胎发育全过程, 四种小丑鱼整个胚胎发育过程形态大同小异(表 6), 但是持续时间不同(图 7)。卵裂期:番茄小丑鱼5.6h, 公子小丑鱼5h, 毕加索小丑鱼5h, 雪印小丑鱼4h;囊胚期:番茄小丑鱼7.4h, 公子小丑鱼7h, 毕加索小丑鱼6h, 雪印小丑鱼7h;原肠期:番茄小丑鱼12.6h, 公子小丑鱼12h, 毕加索小丑鱼14.5h, 雪印小丑鱼13h;神经胚期:番茄小丑鱼2h, 公子小丑鱼3h, 毕加索小丑鱼2h, 雪印小丑鱼4h;体节期:番茄小丑鱼9h, 公子小丑鱼13h, 毕加索小丑鱼10h, 雪印小丑鱼7h;翻转期:番茄小丑鱼22.5h, 公子小丑鱼21h, 毕加索小丑鱼28h, 雪印小丑鱼16h;血管形成期:番茄小丑鱼28h, 公子小丑鱼23h, 毕加索小丑鱼25h, 雪印小丑鱼17h;器官形成期:番茄小丑鱼157h, 公子小丑鱼156h, 毕加索小丑鱼168h, 雪印小丑鱼110h;孵化期均为2h。
 |
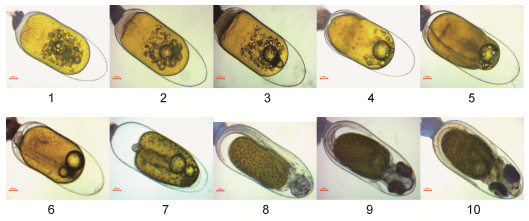
| 图 2 番茄小丑鱼的胚胎发育过程 Fig. 2 The embryonic developmental stages of tomato clownfish 注: 1.卵裂前期; 2.卵裂期; 3.囊胚期; 4.原肠期; 5.神经胚期; 6.体节期; 7.翻转期; 8.血管形成期; 9.器官形成期; 10.孵化期 |
 |
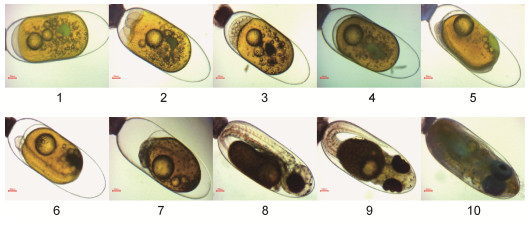
| 图 3 公子小丑鱼的胚胎发育过程 Fig. 3 The embryonic developmental stages of ocellaris clownfish 注: 1.卵裂前期; 2.卵裂期; 3.囊胚期; 4.原肠期; 5.神经胚期; 6.体节期; 7.翻转期; 8.血管形成期; 9.器官形成期; 10.孵化期 |
 |
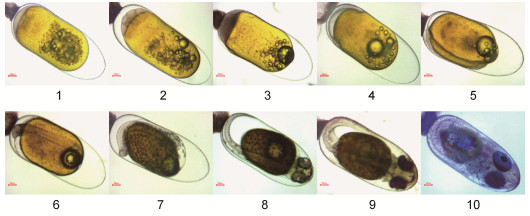
| 图 4 毕加索小丑鱼的胚胎发育过程 Fig. 4 The embryonic developmental stages of Picasso clownfish 注: 1.卵裂前期; 2.卵裂期; 3.囊胚期; 4.原肠期; 5.神经胚期; 6.体节期; 7.翻转期; 8.血管形成期; 9.器官形成期; 10.孵化期 |
 |
| 图 5 雪印小丑鱼的胚胎发育过程 Fig. 5 The embryonic developmental stages of snowflake clownfish 注: 1.卵裂前期; 2.卵裂期; 3.囊胚期; 4.原肠期; 5.神经胚期; 6.体节期; 7.翻转期; 8.血管形成期; 9.器官形成期; 10.孵化期 |
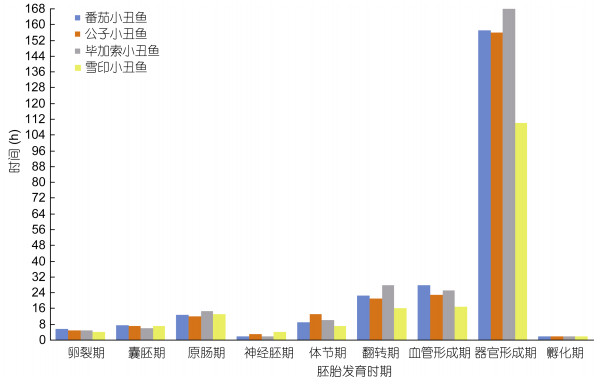 |
| 图 7 四种小丑鱼胚胎发育时间 Fig. 7 Embryonic developmental time of different clownfish |
| 序号 | 番茄小丑鱼(mm) | 公子小丑鱼(mm) | 毕加索小丑鱼(mm) | 雪印小丑鱼(mm) |
| 1 | 2.80 | 2.20 | 1.90 | 1.80 |
| 2 | 2.80 | 2.30 | 1.80 | 1.90 |
| 3 | 2.90 | 2.30 | 2.10 | 1.90 |
| 4 | 2.80 | 2.30 | 2.10 | 1.80 |
| 5 | 2.60 | 2.50 | 1.90 | 1.60 |
| 6 | 3.00 | 2.20 | 1.80 | 1.80 |
| 平均值 | 2.82 | 2.30 | 1.93 | 1.80 |
| 标准差 | 0.13 | 0.11 | 0.14 | 0.18 |
| 发育时期 | 番茄小丑鱼 | 公子小丑鱼 | 毕加索小丑鱼 | 雪印小丑鱼 |
| 卵裂前期 | 卵黄呈橘红色, 有许多小油球无规则地散布在卵黄中, 受精卵吸水膨胀, 胎盘形成 | 卵黄呈橙黄色, 有一个明显的大油球和许多小油球无规则地散布在卵黄中, 受精卵吸水膨胀, 胎盘形成 | 卵黄呈金黄色, 有一个明显的大油球和许多小油球无规则地散布在卵黄中, 受精卵吸水膨胀, 胎盘形成 | 卵黄呈橙黄色, 有一个明显的大油球和许多小油球无规则地散布在卵黄中, 受精卵吸水膨胀, 胎盘形成 |
| 卵裂期 | 卵黄呈橘红色, 卵裂沟出现, 受精卵分裂 | 卵黄呈橙黄色, 卵裂沟出现, 受精卵分裂 | 卵黄呈金黄色, 卵裂沟出现, 受精卵分裂 | 卵黄呈橙黄色, 卵裂沟出现, 受精卵分裂 |
| 囊胚期 | 卵黄呈橘红色, 囊胚腔形成并逐渐向卵黄部分降低, 至囊胚腔内有无数小细胞的界限无法分辨 | 胚盘与卵黄之间形成囊胚腔, 囊胚中部突起呈帽状 | 卵黄囊颜色加深, 细胞分裂至无法计数呈帽状堆积在胚盘上, 逐渐与卵黄顶部形成腔, 为囊胚腔 | 同公子小丑鱼 |
| 原肠期 | 卵黄向橘黄色开始转变, 油球数量逐渐减少, 胚胎处于卵黄的一侧, 绕卵黄1/2, 头部位于动物极一端 | 小的油滴开始消失, 胚层下包达卵黄的1/2时, 胚环明显 | 小油球稍微减少, 可见胚环, 胚层下包 | 同公子小丑鱼 |
| 神经胚期 | 头部的两侧出现视泡 | 胚体背面变厚, 胚孔形成至关闭, 视泡形成 | 胚体背面变厚, 视泡形成, 小油球越来越少, 胚胎从外观看颜色变成暗棕色 | 同公子小丑鱼 |
| 体节期 | 卵外观颜色加深偏深棕色, 胚胎出现肌节, 黑色素细胞形成, 油球明显减少 | 体节增多, 胚体和胚外膜开始有黑色素细胞出现, 小油滴几乎全部消失 | 黑色素开始形成, 小油球几乎全部消失, 肌节清晰可见 | 同公子小丑鱼 |
| 翻转期 | 视杯形成, 具有不透明的眼珠, 胚体黑色素细胞增加, 油球几乎消失 | 心脏出现, 视杯形成, 黑色素细胞增多, 看起来像“草莓”胚体, 胚体背腹面逐渐形成鳍褶, 背、尾、臀、腹鳍褶连成一片 | 黑色素细胞增多, 头部向植物极翻转, 卵黄变少, 心脏形成, 视杯出现 | 同公子小丑鱼 |
| 血管形成期 | 血管形成, 能看到明显的血液流动, 部分能看到血迹, 心脏形成, 呈肉红色, 卵黄减少, 油球消失 | 血管形成, 血液流动明显, 视泡更明显, 眼睛更突出, 心脏形成 | 血管形成, 血液流动清晰可见, 油球全部消失, 眼睛色素加深 | 同公子小丑鱼 |
| 器官形成期 | 各部分鳍已形成, 鱼的雏形已经基本形成, 黑色素逐渐消失 | 胸鳍原基出现, 卵黄囊急剧变小, 胚体迅速变大 | 卵黄变小, 鱼体雏形基本形成, 器官明显, 黑色素点变小模糊 | 同公子小丑鱼 |
| 孵化期 | 孵化当天, 卵黄囊几乎消耗殆尽, 能看到明显银色反光的眼睛 | 孵化当天, 卵黄囊几乎消耗殆尽, 能看到明显银色反光的眼睛 | 孵化当天, 卵黄囊几乎消耗殆尽, 能看到明显银色反光的眼睛 | 同公子小丑鱼 |
四种小丑鱼进入器官形成期后的发育形态对比如图 6所示。10h时, 四种小丑鱼的眼睛、肌节、脑泡、心脏等器官已显现雏形。番茄小丑鱼和公子小丑鱼形态一致胸鳍原基出现, 毕加索小丑鱼胸鳍原基刚刚形成, 还没发育, 而雪印小丑鱼的胸鳍原基已经形成; 58h时, 番茄小丑鱼和公子小丑鱼胸鳍原基基本形成, 番茄小丑鱼心脏跳动次数每分钟95次左右, 公子小丑鱼100次左右, 毕加索小丑鱼胸鳍原基出现, 心脏跳动次数每分钟80—90次, 雪印小丑鱼胚体变大几乎占据了卵的全部空间, 腹鳍原基形成, 眼睛开始发亮, 反光性很强, 心脏跳动次数150次左右; 105h时, 番茄小丑鱼和公子小丑鱼胚体变大, 尾巴连接到眼睛, 眼睛开始发亮反光, 腹鳍原基形成, 番茄小丑鱼心脏跳动次数140次左右, 公子小丑鱼160次左右, 毕加索小丑鱼胸鳍原基已经全部形成, 腹鳍原基出现, 胚体逐渐变大尾巴变粗, 心脏跳动次数每分钟120次左右, 雪印小丑鱼孵化当天, 心脏跳动次数每分钟180次左右, 所有器官基本发育完毕, 吻部轮廓已经形成, 消化道可见, 胚体上黑色素变小, 胚体充满整个卵马上就要破卵而出; 140h时, 孵化前一天番茄小丑鱼和公子小丑鱼吻部轮廓基本形成, 卵黄变小, 消化道可见, 番茄小丑鱼心脏跳动次数每分钟170次左右, 公子小丑鱼180次左右, 毕加索小丑鱼腹鳍原基形成, 尾巴连接到眼睛, 眼睛开始发亮反光, 心脏跳动次数150次左右; 160h, 毕加索小丑鱼孵化当天卵黄囊变小, 嘴部轮廓形成, 消化道可见, 心脏跳动次数180次左右。
 |
| 图 6 四种小丑鱼器官形成期发育特征 Fig. 6 Morphological pattern of the organ formation stage of four clownfish |
据报道, 小丑鱼胚胎发育时间为7d左右(Ignatius et al, 2001; Madhu et al, 2002; 滕力平等, 2005; Yasir et al, 2007; Ho et al, 2008; Gordon et al, 2010), 而本实验条件下的小丑鱼胚胎发育时间均大于7d, 造成胚胎发育时间不同有两方面的原因:一是小丑鱼自身原因, 二是外界环境影响。
3.1 自身因素对胚胎发育时间的影响比较四种小丑鱼的胚胎发育过程发现, 雪印小丑♀×♂, 整个胚胎发育时间最短, 毕加索小丑鱼♀×♂胚胎发育时间最久, 胚胎发育时间与野生种相比有较大差异。笔者推测, 人工选育的小丑鱼在代代选育中已经形成了适合其自身的胚胎发育模式。Dhaneesh等(2012)对海葵双锯鱼培育中发现, 海葵双锯鱼胚胎发育时间为6—7d, 而本实验中毕加索小丑鱼为11d, 差异明显。本实验中雪印小丑鱼的胚胎发育时间最短, 与公子小丑鱼胚胎发育时间差异明显, 从体节期开始能够发现, 雪印小丑鱼每个时期均比公子小丑鱼提前进入发育阶段, 后期跟踪实验发现, 雪印小丑鱼受精卵成活率明显高于公子小丑鱼, 仔稚鱼发育速度明显快于公子小丑鱼, 因此笔者推测, 经人工选育的小丑鱼在人工条件下会更快地进入繁育状态, 在人工条件下更易存活, 这为未来新品种的培育提供了更充分的技术支持。
3.2 外界环境对小丑鱼胚胎发育的影响温度、盐度、光照周期以及卵质量与形态对小丑鱼胚胎发育时间有较大影响。研究发现, 温度、盐度可以通过影响体内节律和生长激素(GH)的循环水平来控制生长(Björnsson, 1997)。在一定范围内, 随着温度升高, 生长速率加快, 到达最适温度达到最高, 之后生长速率会随着温度的升高而降低(Xie et al, 1992; Jobling, 1993)。Kumar等(2010)在温度为28℃, 盐度为22—24的条件下, 黑双带小丑鱼胚胎发育时间为6—8d。本实验中番茄小丑鱼在第4批次孵化期间由于设备故障使得温度升高1℃, 从而导致其提前进入了孵化期。王斌等(2010)对眼斑双锯鱼的人工繁育中发现, 当产卵温度在28℃左右时, 胚胎发育时间为8d, 水温27℃, 胚胎发育时间为9d。正常情况下, 小丑鱼每月产卵两次为最佳状态, 产卵质量也相对较高, 有益于亲鱼产后恢复, 延长亲鱼的寿命。研究发现, 26℃是亲鱼产卵的最佳温度, 高于此温度, 亲鱼产卵频率升高, 胚胎发育时间短, 但是不利于亲鱼的恢复; 如低于此温度, 则胚胎发育时间延长, 受精卵质量变差。
除温度外, 光照周期也是影响胚胎发育的重要因素, 李泽滨等(2017)发现GHR1基因在光照周期24h组中表达量最高, 随着光照周期的降低, GHR1基因的表达量依次降低。本实验在7月26号由于光照设备问题, 光照周期为24L:0D, 公子小丑鱼与雪印小丑鱼还有毕加索小丑鱼均提前进入孵化期。
3.3 四种小丑鱼发育胚胎学比较观察四种小丑鱼受精卵的胚胎发育过程发现, 四种小丑鱼从卵裂期到神经胚期的发育时间相差最多不超过2h, 从体节期到器官形成期时间差异较大。本实验中对四种小丑鱼器官形成期的发育比较可以发现, 番茄小丑鱼和公子小丑鱼胚胎发育时间一致, 器官形成期同一发育形态具有极高的相似性, 毕加索小丑鱼胚胎发育时间最长, 在同一时间形态发育明显慢于其他三种小丑鱼, 卵黄消耗也比其他三种鱼快, 雪印小丑鱼胚胎发育时间最短, 在同一时间形态发育明显较快, 器官完善的也相对最快。因此笔者推测, 小丑鱼的胚胎发育时间与从体节期到孵化期的发育距离有关, 体节期与翻转期发育时间的长短直接影响血管和器官形成期的发育时间, 从而间接影响最后孵化的时间。
对四种小丑鱼胚胎发育形态比较发现, 番茄小丑鱼受精卵与其他三种有明显的不同, 首先卵径明显长于其他小丑鱼, 其次通过观察卵的形态发现, 番茄小丑鱼卵中油球数量明显少于其他小丑鱼且卵中没有大油球, 这或许是番茄小丑鱼的饲养程度易于其他小丑鱼的原因。刘家富(1999)在对大黄鱼(Larimichthys crocea)胚胎发育中也曾报道, 卵径小, 多油球的受精卵孵化率低, 或者虽有孵出但是畸形率很高。四种小丑鱼各个时期形态变化几乎相同, 而受精卵颜色的差异可能是影响小丑鱼成鱼的体色原因之一。番茄小丑鱼受精卵的颜色与棘颊雀鲷属的透红小丑鱼受精卵颜色一样, 且成鱼体色也一致, 因此笔者推测番茄小丑鱼和透红小丑鱼亲缘关系更近。实验发现, 2种野生小丑鱼与2种人工杂交小丑鱼受精卵均具有数量不等、大小不一的油球。结合TYR系统进化树(马本贺, 2016)分析发现, 与小丑鱼亲缘关系较近的乌鳢(Channa argus)、青鳉(Oryzias latipes) (王友红等, 2017)和红鳍东方鲀(Takifugu rubripes) (李明德, 1987)均具有大小不一、数量不等的油球; 而亲缘关系较远的斑马鱼以及虹鳟鱼(韩荀, 1984)卵的油球数量及大小方面与小丑鱼存在差异。因此推断, 油球数量以及大小可作为判断亲缘关系的条件。鱼卵形态学研究发现, 细纹狮子鱼(Liparis tanakae)、凤鲚鱼(Coilia mystus)和虫纹东方鲀(Takifugu vermicularis)等温性鱼类的鱼卵均具有多个油球且大小不等且均属于黏性沉性卵(万瑞景等, 2000), 因此可推测小丑鱼与这三种鱼类存在一定的亲缘关系, 为小丑鱼与这三种鱼的杂交可能性提供了理论支持。
4 结论本研究在相同环境下对同属中四种鱼种的胚胎发育进行比较, 可作为比较胚胎学的一个补充, 可以更真实地反映各个种之间的亲缘关系, 可以根据不同鱼类不同时期发育的形态特征来确定其分类地位。
研究发现, 所有小丑鱼亲鱼均具有护卵习性, 在亲鱼的看护下能正常产卵, 由于在取卵的过程中对亲鱼的惊吓程度, 也有可能会影响胚胎的发育时间。本实验中, 在其中一次亲鱼刚产完卵后将部分卵铲下移到了1000mL的烧杯中培育孵化, 用气石充气模仿亲鱼护卵, 部分受精卵能顺利孵化出仔鱼, 这一发现为未来小丑鱼大规模繁育全人工孵化的新技术提供了依据, 气石充气可以作为一种人工方法模仿亲鱼的护卵行为, 可以作为今后研究的一个方向。通过对小丑鱼比较胚胎学的研究可以丰富小丑鱼人工选育技术, 确定小丑鱼之间、小丑鱼与其他鱼之间的亲缘关系, 为观赏鱼进化学说的发展和新品种培育提供依据。
| 万瑞景, 姜言伟, 2000. 渤、黄海硬骨鱼类鱼卵与仔稚鱼种类组成及其生物学特征. 上海水产大学学报, 9(4): 290–297 |
| 马本贺, 2016. 环境光色对白条双锯鱼(Amphiprion frenatus)幼鱼的影响及相关基因克隆研究. 上海: 上海海洋大学硕士学位论文 |
| 马本贺, 孙志宾, 马爱军, 等, 2017. 环境光色对白条双锯鱼(Amphiprion frenatus)幼鱼生长和体色的影响. 海洋与湖沼, 48(1): 148–154 |
| 王斌, 王士莉, 杨爱国, 等, 2010. 眼斑双锯鱼的人工繁育技术研究. 渔业科学进展, 31(5): 41–46 |
| 王友红, 刘洪军, 于道德, 等, 2017. 海水青鳉胚胎发育的观察. 海洋科学, 41(6): 18–25 DOI:10.11759/hykx2016062003 |
| 王吉桥, 2011. 水生观赏动物养殖学:观赏渔业. 北京: 中国农业出版社, |
| 叶乐, 周泽斌, 吴开畅, 等, 2010. 克氏双锯鱼全人工亲鱼培育技术研究. 科学养鱼,(9): 39–40 |
| 刘家富, 1999. 人工育苗条件下的大黄鱼胚胎发育及其仔、稚鱼形态特征与生态习性的研究. 海洋科学, 23(6): 61–65 |
| 李明德, 1987. 红鳍东方鲀Fugu rubripes (T etS)的胚胎发育. 海洋通报, 6(1): 38–41 |
| 李泽滨, 李云, 蔡生力, 等, 2017. 温度与光照周期对公子小丑鱼幼鱼生长及相关生长基因表达的影响. 上海海洋大学学报, 26(3): 321–329 DOI:10.12024/jsou.20160301699 |
| 韩荀, 1984. 虹鳟鱼胚胎发育的研究. 山西大学学报,(2): 54–61 |
| 鲍鹰, 张鹏, 祝承勇, 等, 2009. 红小丑人工繁殖和育苗的初步研究. 海洋科学, 33(2): 5–10 |
| 鲍鹰, 张鹏, 祝承勇, 等, 2011. 棘颊雀鲷人工繁殖与育苗的初步研究. 海洋科学, 35(3): 67–71 |
| 滕力平, 杨担光, 李晓光, 等, 2005. 二线小丑鱼的人工繁殖. 水产科学, 24(2): 26–28 |
| 鞠晨曦, 李云, 刘红, 等, 2014. 眼斑双锯鱼胚胎发育的形态学观察. 海洋渔业, 36(1): 8–15 |
| Björnsson B T, 1997. The biology of salmon growth hormone:from daylight to dominance. Fish Physiology and Biochemistry, 17(1-6): 9–24 |
| Dhaneesh K V, Kumar T T A, Swagat G, et al, 2012. Breeding and mass scale rearing of clownfish Amphiprion percula:feeding and rearing in brackishwater. Chinese Journal of Oceanology and Limnology, 30(4): 528–534 DOI:10.1007/s00343-012-1184-x |
| Gordon A K, Hecht T, 2010. Histological studies on the development of the digestive system of the clownfish Amphiprion percula and the time of weaning. Journal of Applied Ichthyology, 18(2): 113–117 |
| Ho Y S, Chen C M, Chen W Y, et al, 2008. Embryo development and larval rearing of pink clownfish (Amphiprion perideraion). Journal of the Fisheries Society of Taiwan, 35(1): 75–85 |
| Hoff F H, 1996. Conditioning, Spawning and Rearing of Fish with Emphasis on Marine Clownfish. Dade City, FL, USA: Aquaculture Consultants Inc, |
| Ignatius B, Rathore G, Jagadis I, et al, 2001. Spawning and larval rearing technique for tropical clown fish Amphiprion sebae under captive condition. Journal of Aquaculture in the Tropics, 16(3): 241–249 |
| Jobling M, 1993. Bioenergetics: feed intake and energy partitioning. In: Rankin J C, Jensen F B eds. Fish Ecophysiology. Dordrecht, Netherlands: Springer, 457-466 |
| Kumar T T A, Setu S K, Murugesan P, et al, 2010. Studies on captive breeding and larval rearing of clown fish[a1], Amphiprion sebae (Bleeker, 1853) using estuarine water. Indian Journal of Geo-Marine Sciences, 39(1): 114–119 |
| Madhu K, Madhu R, 2002. Successful breeding of common clownfish Amphiprion percula under captive conditions in Andaman and Nicobar Island. Fish Chimes, 22(9): 16–17 |
| Xie X J, Sun R Y, 1992. The bioenergetics of the southern catfish (Silurus meridionalis Chen):growth rate as a function of ration level, body weight, and temperature. Journal of Fish Biology, 40(5): 719–730 DOI:10.1111/jfb.1992.40.issue-5 |
| Yasir I, Qin J G, 2007. Embryology and early ontogeny of an anemonefish Amphiprion ocellaris. Journal of the Marine Biological Association of the United Kingdom, 87(4): 1025–1033 DOI:10.1017/S0025315407054227 |
| Zou R L, 1998. Hermatrypic corals. Biology Bulletin, 33(6): 8–11 |
 2018, Vol. 49
2018, Vol. 49


