中国海洋湖沼学会主办。
文章信息
- 崔丹丹, 杨柳, 孙雪, 邹昭敏, 李亚鹤, 张琳, 徐年军. 2018.
- CUI Dan-Dan, YANG Liu, SUN Xue, ZOU Zhao-Min, LI Ya-He, ZHANG Lin, XU Nian-Jun. 2018.
- 玉米素和水杨酸对雨生红球藻(Haematococcus pluvialis)生长及虾青素积累的影响
- EFFECTS OF ZEATIN AND SALICYLIC ACID ON GROWTH AND ASTAXANTHIN ACCUMULATION IN HAEMATOCOCCUS PLUVIALIS
- 海洋与湖沼, 49(3): 682-691
- Oceanologia et Limnologia Sinica, 49(3): 682-691.
- http://dx.doi.org/10.11693/hyhz20180100009
-
文章历史
- 收稿日期:2018-01-13
- 收修改稿日期:2018-02-21
2. 浙江省海洋生物工程重点实验室 宁波 315211
2. Key Laboratory of Marine Biotechnology of Zhejiang Province, Ningbo University, Ningbo 315211, China
虾青素(3, 3’-dihydroxy-β, β-carotene-4, 4’-dinoe)是一种酮式类胡萝卜素, 其分子结构中存在9个较长的共轭双键, 该结构形成羟基酮时易与自由基参加反应, 从而清除自由基, 因此具有很强的抗氧化活性(Seabra et al, 2010)。天然虾青素的主要存在形式为3S, 3S’与3R, 3R’两种旋光异构体, 在抗氧化性、稳定性和生物利用率方面都比人工合成虾青素更具优势。虾青素在水产养殖、化妆品、医药等多个领域中具有广泛的应用, 在水产养殖中, 虾青素作为添加剂可以增强动物免疫力、提高卵子质量、减少死亡率、增加色泽等(Sheikhzadeh et al, 2012); 在护肤品中, 虾青素可起到抗皱、防晒和延迟皮肤老化等作用(Tominaga et al, 2012); 在预防和治疗疾病方面, 虾青素可预防高血压、糖尿病、心脑血管疾病、神经性疾病等慢性疾病(Hussein et al, 2007), 还可以通过抑制肿瘤细胞增殖、促进凋亡、抑制转移、增强免疫及调节细胞通讯等方式发挥抗肿瘤作用(吕亭亭等, 2015)。
天然虾青素的生物来源主要有细菌发酵, 如短杆菌(Brevibacterium)、乳酸分支杆菌(Mycobacterium lacticola)、海洋细菌Agrobacterium aurantiactrm和Alcaligens sp.等, 但产量很低(Yokoyama et al, 1995)。利用红发夫酵母(Phaffia rhodozyma)和南极酵母生产虾青素也因为产率过低而告终。而雨生红球藻(Haematococcus pluvialis)被公认为是自然界中积累天然虾青素的最好生物, 在外界环境胁迫下其虾青素含量最高可达细胞干重的3%左右, 已成为虾青素生产研究的热点(Boussiba, 2000)。
目前提高雨生红球藻虾青素积累的方法主要是胁迫诱导法, 如营养、高盐和高光胁迫等(Lee et al, 2010)。为了进一步提高雨生红球藻中虾青素的产量, 一般采用复合胁迫方式进行诱导, 在200μmol/(m2·s)光强下, 虾青素含量与碳氮比正相关, 较低的碳氮比增加雨生红球藻生物量, 导致虾青素产量由于光限制而下降。高光强(300μmol/(m2·s))可消除低碳氮比对虾青素合成的抑制作用(Kang et al, 2007)。如利用乙酸钠作为碳源, 在60μmol/(m2·s)光照强度、缺氮和17.1mmol/L氯化钠条件下培养雨生红球藻, 9d后虾青素含量可达24.5mg/g干重(Vidhyavath et al, 2008)。在高光胁迫下以乙酸钠作为碳源, 5d后雨生红球藻中虾青素含量可达到10.91mg/L(张睿钦等, 2011)。在100μmol/(m2·s)光强和硫饥饿胁迫下培养雨生红球藻, 其虾青素含量达到约25pg/cell, 比对照组高了8倍(He et al, 2007)。
植物激素作为生长调节剂可调控植物的生长发育和生理代谢过程, 如光合作用、次级代谢和脂类代谢等。生长素和细胞分裂素可促进雨生红球藻细胞生长及虾青素的合成(韩春梅等, 2009); 在雨生红球藻的培养过程中添加0.5mg/L 6-卞氨基嘌呤(6-BA)、0.1mg/L赤霉素GA3、0.5mg/L萘乙酸(NAA), 可提高虾青素产量(崔宝霞等, 2008)。水杨酸(SA)和茉莉酸(JA)对植物的次生代谢具有诱导作用, 因此也可以提高雨生红球藻的次生代谢物虾青素的含量。研究发现施加800μmol/L茉莉酸甲酯可显著提升雨生红球藻细胞虾青素合成能力, 与对照组相比提高了约23%(王鑫威等, 2011)。同样, 施加5.0mg/L或10.0mg/L的水杨酸, 能有效诱导藻体内中虾青素的合成(高政权等, 2007; Raman et al, 2011); 此外, 水杨酸和茉莉酸还能显著提高虾青素合成相关基因的表达量, 如β-胡萝卜素酮化酶基因(bkt)和类胡萝卜素加氧酶基因等, 从而促进虾青素的积累(Meng et al, 2006; Gao et al, 2012a, b)。
目前国内外对雨生红球藻的研究多集中在优化培养条件方面, 但由于不同雨生红球藻种间的差异较大, 所得的最适培养条件也不尽相同。本文以本实验室纯化的雨生红球藻为材料, 比较了玉米素和水杨酸对雨生红球藻生长和虾青素积累的影响, 并比较研究了两种植物激素对碳代谢和虾青素合成相关基因——核酮糖-1, 5-二磷酸羧化酶/加氧酶(Rubisco)大亚基(rbcL)、Rubisco活化酶(rca)、碳酸酐酶(ca)、β-胡萝卜素酮化酶(bkt)基因表达的影响, 发现玉米素比水杨酸具有更好促进虾青素积累的效果, 为进一步研究玉米素对雨生红球藻代谢产物积累的规律及其进一步开发利用奠定基础。
1 材料与方法 1.1 材料雨生红球藻(H. pluvialis)来自宁波大学微藻种质库, 经过纯化和鉴定后置于24℃光照培养箱中培养, 营养生长期光照强度为50μmol/(m2·s), 高光胁迫期光照强度为150μmol/(m2·s), 光暗周期12L:12D, 使用NMB3#培养基。
1.2 方法 1.2.1 玉米素及水杨酸浓度筛选将培养至对数生长中期的雨生红球藻混匀接种至150mL新鲜培养基中, 分别添加玉米素至终浓度为0、0.01、0.05、0.1、0.5mg/L, 水杨酸至终浓度为0、5、15、25、50mg/L。接种密度为2.0×104cell/mL, 其他培养条件同1.1。培养5d后测定藻细胞干重和虾青素含量。
1.2.2 不同处理条件将培养至对数生长中期(藻细胞密度为1.9×105cell/mL)的雨生红球藻混匀, 分别添加玉米素(终浓度0.05mg/L)、水杨酸(终浓度25mg/L), 以不加植物激素的处理作为对照组, 于150μmol/(m2·s)高光胁迫条件下培养, 光周期与培养温度等条件同1.1。然后分别6000r/min离心8min收集培养0h、3h、6h、24h、72h、144h、216h的藻液, 测定干重、藻细胞密度、叶绿素含量、叶绿素荧光参数、虾青素含量和基因的表达规律。
1.2.3 细胞密度的测定使用浮游生物计数板进行藻细胞数的测定, 测定3次取其平均值。
1.2.4 细胞干重的测定将10mL藻液用0.22μm水系滤膜进行真空抽滤, 然后将带有藻泥的滤膜于105℃下烘干, 反复几次至恒重, 再精确称量。滤膜需提前烘干称量至恒重。计算滤膜两次质量差即为藻细胞干重。
1.2.5 虾青素含量的测定取20mL藻液, 加入5mL含5% NaOH、30%甲醇的水溶液, 70℃水浴5min。6000r/min离心3min, 去上清液, 藻渣重复操作以上步骤, 藻渣中加入3mL含有少量醋酸的二甲基亚砜, 摇匀后70℃保温5min。6000r/min离心3min, 将上清液移入10mL容量瓶, 以上步骤重复至少3次, 使藻渣颜色退至无色。将收集的上清液用二甲基亚砜精确定容至10mL。在492nm波长下测定其吸光值, 以二甲基亚砜作空白(Boussiba et al, 1992)。
计算公式:溶液中虾青素的浓度(mg/mL): C1=A492×1000/(A1cm×100)A1cm=2200
藻粉中虾青素的百分含量: C2=(C1×10/m)×100%
1.2.6 叶绿素含量测定采用甲醇提取比色法:取20mL藻液用0.22μm水系滤膜进行真空抽滤, 然后将带有藻泥的滤纸置于离心管中, 加入4mL分析甲醇, 涡旋30s, 4℃冰箱中黑暗处理24h, 以甲醇作为对照, 测定提取液在650nm、665nm和750nm处的吸光值。根据下列公式算得藻细胞中叶绿素含量(mg/L):
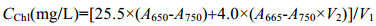
式中, V1表示藻液体积(mL), V2表示甲醇体积(mL)
1.2.7 叶绿素荧光参数的测定使用氙灯脉冲调制荧光仪(Water-PAM)来测定荧光参数。具体步骤如下:在光周期内, 适当取样, 黑暗中适应15min, 在培养光强下测定叶绿素荧光诱导曲线, 获得最大光化学效率(Fv/Fm)、有效光化学效率(Fv′/Fm′), 之后设置8个光强梯度, 分别为114、167、257、379、578、861、1218和1692μmol/(m2·s), 每个光强处理时长设定为10s, 进行快速光响应曲线测定(RLC)的测定。RLC根据以下公式进行拟合:
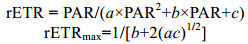
式中, a、b、c为拟合参数, PAR为光化光强度, rETRmax表示最大相对电子传递速率。
1.2.8 RNA提取和cDNA合成雨生红球藻总RNA提取用OMEGA试剂盒(Bioteck公司)。然后取3μL RNA样品在1.0%琼胶糖凝胶上电泳来检测RNA的完整性; 用NanoDrop 1000 Spectrophotometer测定RNA浓度和纯度。最后将检测合格的RNA样品合成cDNA, 用于荧光定量PCR反应。
1.2.9 实时荧光定量PCR根据雨生红球藻转录组测序中(rbcL)、rca、ca、bkt基因序列, 利用Primer Premier 5.0设计荧光定量PCR引物(序列见表 1), 用18S rRNA基因作为内参基因, 所有引物序列均由生工生物工程(上海)公司合成。荧光定量PCR操作及流程参照TransGen试剂盒说明, RT-PCR数据采用2–△△Ct法进行分析(Livak et al, 2001)。
| 引物名称 | 引物序列(5′—3′) |
| 18S F | CCGTCGTAGTCTCAACCAT |
| 18S R | CCTTCCGTCAATTCCTTTA |
| rbcLF | GTGGTTCCCAGTCGGTCTTC |
| rbcLR | CATTTCGCTGCGTTCTTCAT |
| rcaF | TTGGCGATGTGGATGGTGAT |
| rcaR | CGGAATGGTGGAGGAACTGT |
| caF | GAGCAACGGCAGCAACATC |
| caR | CTCCAGCGGGTAATAGGCAC |
| bktF | AAATCAGGCTACCGACATCCA |
| bktR | TGCTGTAGTCAAACCAGGCGTA |
利用Excel工作表对数据进行统计分析, 用Origin 8.0软件作图, 采用单因素方差(one-way ANOVA)对数据进行差异显著性分析, P<0.05表示差异显著。
2 结果与分析 2.1 不同浓度玉米素对雨生红球藻生长及虾青素含量的影响不同浓度玉米素处理对雨生红球藻细胞干重及虾青素含量影响显著(图 1)。通过统计分析发现, 不同玉米素浓度对雨生红球藻细胞的干重有较大的影响, 玉米素浓度为0.05mg/L和0.1mg/L时干重较高, 分别为0.46g/L和0.44g/L, 比对照组分别提高15%和10%。不同浓度玉米素添加后均能提高藻体虾青素含量, 玉米素浓度为0.05mg/L时虾青素含量最高, 达到干重的0.83%, 为对照组的1.9倍。
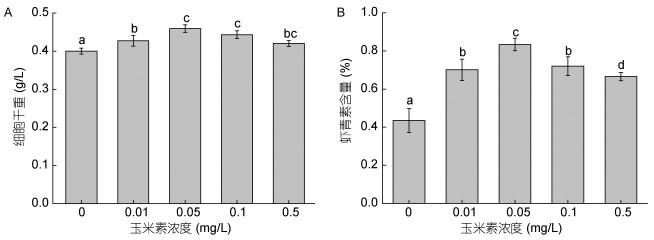 |
| 图 1 不同浓度玉米素对雨生红球藻细胞干重(A)和虾青素含量(B)的影响 Fig. 1 Effects of zeatin concentration on the biomass (A) and astaxanthin content (B) of H. pluvialis |
不同浓度水杨酸对雨生红球藻细胞干重和虾青素含量也有一定的影响(图 2)。结果显示, 水杨酸处理对雨生红球藻细胞干重的影响较小, 仅15mg/L水杨酸组的藻细胞干重高于对照组。但不同浓度水杨酸对虾青素含量的影响较显著, 其中水杨酸浓度为25mg/L时, 虾青素含量最高, 达到干重的0.85%, 为对照组的1.93倍; 当水杨酸浓度为50mg/L时, 虾青素含量又有所降低到对照组的1.59倍, 该结果表明高浓度水杨酸抑制了虾青素的积累。
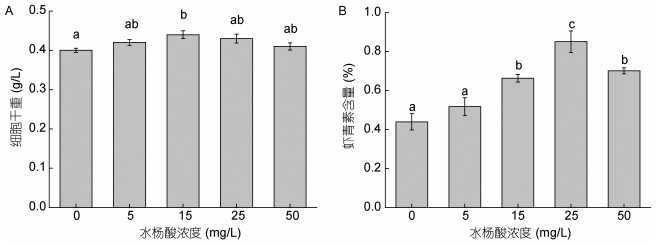 |
| 图 2 不同浓度水杨酸对雨生红球藻细胞干重(A)和虾青素含量(B)的影响 Fig. 2 Effects of salicylic acid concentration on biomass (A) and astaxanthin content (B) of H. pluvialis |
图 3显示高光胁迫下玉米素和水杨酸处理过程中雨生红球藻细胞密度的变化趋势。高光胁迫下, 对照组中藻细胞密度呈缓慢下降的趋势, 216h细胞密度为0h的92.5%。玉米素和水杨酸的添加显著促进了光胁迫下雨生红球藻的生长, 尤其是24h后, 藻细胞密度呈现持续增长的趋势, 玉米素处理组最高可达3.4×105cell/mL (216h); 水杨酸处理组藻细胞密度最高可达3.0×105cell/mL (144h)。
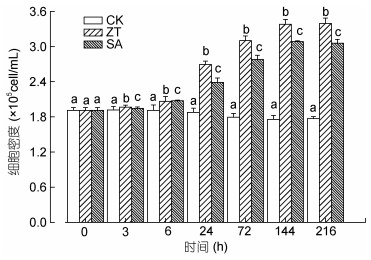 |
| 图 3 玉米素和水杨酸处理条件下雨生红球藻细胞密度变化 Fig. 3 Changes in cell density of H. pluvialis under zeatin and salicylic acid treatments |
图 4显示, 高光胁迫下对照组中雨生红球藻体内叶绿素含量呈逐渐下降趋势, 在216h时其叶绿素含量与起始含量相比, 下降了22.7%。玉米素和水杨酸处理组中叶绿素含量均呈现上升的趋势, 且各时间点均与对照组差异显著(P<0.05), 玉米素处理组在216h达到最大(13.7mg/L), 为对照组的2.4倍; 水杨酸组在144h达到最大(12.7mg/L), 是对照组的2.1倍。表明高光胁迫条件下, 外施玉米素和水杨酸均能有效提高雨生红球藻中叶绿素的含量, 且玉米素效果较好。
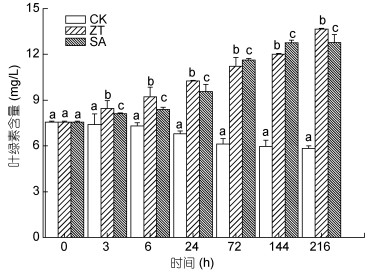 |
| 图 4 玉米素和水杨酸处理下雨生红球藻叶绿素含量变化 Fig. 4 Changes in chlorophyll content of H. pluvialis under zeatin and salicylic acid treatments |
强光作用下, 两个处理组和对照组中雨生红球藻体内虾青素含量随时间增加均呈上升趋势(图 5), 而玉米素和水杨酸处理组显著促进了藻体虾青素的积累, 如在处理216h时, 玉米素处理组与水杨酸处理组中虾青素含量分别比对照组增加了29.2%和25.6% (P<0.05);而相比于水杨酸处理, 玉米素对虾青素含量的促进作用更大。
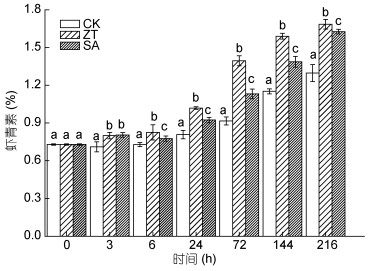 |
| 图 5 玉米素和水杨酸处理下雨生红球藻虾青素含量变化 Fig. 5 Changes in astaxanthin content of H. pluvialis under zeatin and salicylic acid treatments |
图 6和图 7为不同处理条件下雨生红球藻叶绿素荧光参数的变化。对照组中藻细胞最大光化学效率(Fv/Fm)在24h后呈逐渐下降趋势, 在216h时, 其Fv/Fm值相比于起始值(0h), 下降了18.8% (P<0.05)。玉米素和水杨酸处理组中, 随着处理时间的延长, 藻体Fv/Fm则无显著变化(P>0.05), 维持在0.71左右。且在24h后均显著高于对照组, 即外源施加玉米素和水杨酸能减缓雨生红球藻Fv/Fm的下降。两种植物激素胁迫处理对雨生红球藻有效光化学效率(Fv′/Fm′)的作用不明显, 其值维持在0.4左右, 无显著差异(P>0.05)(图 6B)。
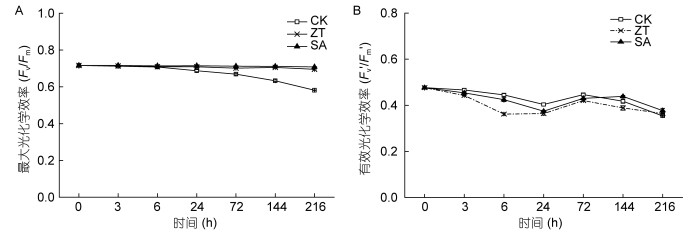 |
| 图 6 玉米素和水杨酸处理下雨生红球藻最大光化学效率(Fv/Fm, A)和有效光化学效率(Fv′/Fm′, B)的变化 Fig. 6 Changes in Fv/Fm and Fv′/Fm′ of H. pluvialis under zeatin and salicylic acid treatments |
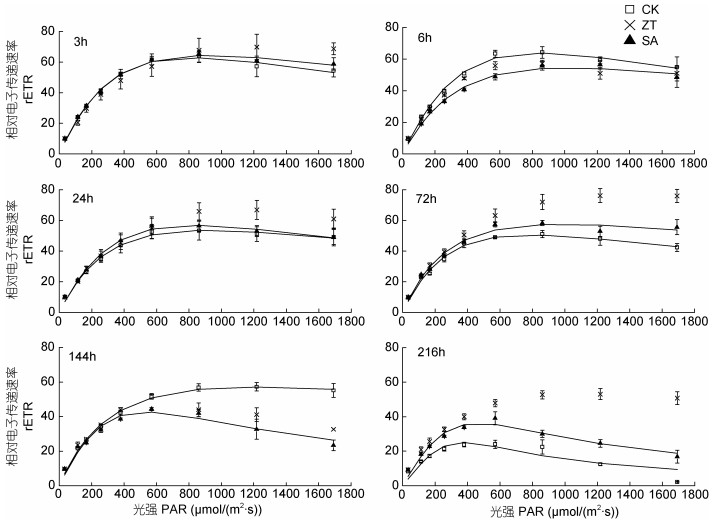 |
| 图 7 玉米素和水杨酸处理下雨生红球藻相对电子传递速率(rETR)的变化 Fig. 7 The changes in relative electron transport rate (rETR) of H. pluvialis under zeatin and salicylic acid treatments |
图 7表明不同植物激素处理条件下, 雨生红球藻细胞相对电子传递速率(rETR)与光强、处理时间的关系。处理前期(24h内), 随着光强的增加, rETR逐渐增加并趋于稳定, 处理144h和216h后, rETR在高光条件下呈现下降的趋势。随着处理时间的延长, 对照组中最大相对电子传递速率(rETRmax)呈下降趋势, 玉米素、水杨酸则延缓了该趋势, 尤其是玉米素的延缓效果更明显。
2.7 玉米素和水杨酸对雨生红球藻rbcL基因表达的比较如图 8所示, 高光胁迫下, 对照组rbcL基因表达量均低于起始值, 随着胁迫时间的增加, 呈先下降后上升, 总体下降趋势, 并在72h时达到最低值; 72h后基因表达量无明显变化, 表明高光胁迫对藻细胞内rbcL基因表达具有抑制作用。玉米素处理组中, rbcL基因表达量呈先下降后上升, 再下降再上升的趋势, 且rbcL表达量均高于对照组, 并在6h达到最高值; 水杨酸处理组中, 3h时rbcL基因表达量上升, 6—24h时, 表达量降低但仍显著高于对照组(P<0.05), 但随着时间的增加, 表达量均显著低于对照组(P<0.05), 在216h时只有对照组的24.2%;可见在高光胁迫下, 外源玉米素能减缓高光胁迫引起藻体内rbcL基因的下调, 而水杨酸相反。
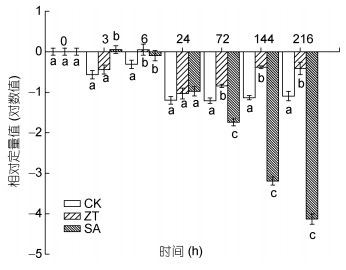 |
| 图 8 玉米素和水杨酸处理条件下雨生红球藻rbcL基因表达量的变化 Fig. 8 Changes of rbcL gene expression of H. pluvialis under zeatin and salicylic acid treatments |
如图 9所示, 不同植物激素处理条件下, 随着时间的延长, 藻细胞中rca基因表达变化呈先降低后上升再降低的趋势。在6h时, 表达量均降到最低值。在玉米素处理组中, rca基因的表达量显著高于对照组(P<0.05), 表明高光胁迫下外施玉米素能减缓rca基因的下调表达。水杨酸处理组中, 前72h内rca基因表达量均高于对照组, 但随着时间的延长, 表达量逐渐降低, 这表明在短时间内外源添加水杨酸也能减缓高光胁迫引起的rca基因的下调表达。
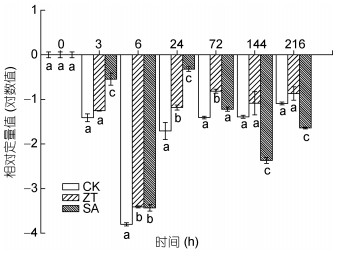 |
| 图 9 玉米素和水杨酸处理条件下雨生红球藻rca基因表达量的变化 Fig. 9 Changes of rca gene expression of H. pluvialis in zeatin and salicylic acid treatments |
从图 10中可以看出, 处理开始时ca基因的表达量均显著升高(P<0.01), 在144h时表达量最高, 而后有所下降, 这表明高光对虾青素合成相关基因ca具有促进作用, 而随着时间的延长, 这种促进作用有所减缓; 玉米素处理组ca基因的表达量与对照组呈现相同的趋势, 且与对照组基因表达量无显著差异, 这表明外施玉米素对雨生红球藻细胞中ca基因表达无显著影响。水杨酸处理组基因表达量在24h后显著高于其他两组, 表明高光胁迫下水杨酸提高虾青素含量主要是通过促进胁迫下ca基因表达来完成的。
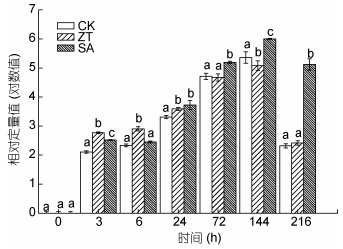 |
| 图 10 玉米素和水杨酸处理条件下雨生红球藻ca基因表达量的变化 Fig. 10 Changes of ca gene expression of H. pluvialis under zeatin and salicylic acid treatments |
如图 11所示, 对照组bkt基因的表达量先低再升后降, 在72h时达到最大值, 72h后表达量逐渐降低; 玉米素和水杨酸组中bkt表达变化同样呈现一定的波动。玉米素处理组中bkt基因的表达变化呈先上升后下降, 再升高后降低的波动趋势, 在72h时达到最大值。水杨酸处理组中, 3h时bkt基因表达量急剧升高, 并达到最大值, 然后随着处理时间的延长, 表达量降低, 并且24—72h时低于对照组。
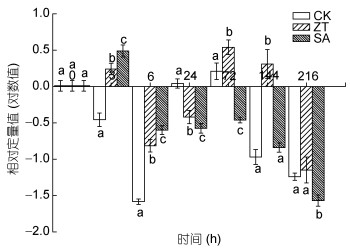 |
| 图 11 玉米素和水杨酸处理条件下雨生红球藻bkt基因表达量的变化 Fig. 11 Changes of bkt gene expression of H. pluvialis under zeatin and salicylic acid treatments |
玉米素是一种人工合成的细胞分裂素, 可促进细胞分裂, 调控营养物质运输。提高葡萄中果实转化酶活性和蔗糖含量, 促进胚乳细胞分裂、增加胚乳细胞数目, 从而提高产量, 通过提高过氧化氢酶、抗坏血酸过氧化物酶与叶光合色素的含量减少盐胁迫给葡萄带来的不利影响(Liao et al, 1997)。玉米素能显著促进江篱属海藻(Gracilaria caudata)分枝的形成, 有利于江篱的养殖(Souza et al, 2016); 本文结果显示不同浓度玉米素均能提高藻细胞的密度, 可能是由于玉米素促进了藻细胞的分裂。同时, 玉米素能有效提高虾青素含量, 且浓度为0.05mg/L时效果最明显。4条基因转录表达水平结果显示, 玉米素提高雨生红球藻虾青素含量的机制与bkt基因表达关系不大, 而与光合作用、碳转运基因表达似乎更相关。研究表明, 生长素和细胞分裂素明显促进雨生红球藻细胞生长和虾青素累积, 这两类激素对虾青素含量的提高是通过增加细胞数量和细胞内虾青素积累的协同作用结果, 并以细胞数量的增加为主(韩春梅等, 2009)。
3.2 水杨酸对雨生红球藻的影响水杨酸是一种酚类植物激素, 在植物生长发育等生理过程的和抗逆防御反应中起着重要作用。目前, 水杨酸在雨生红球藻中的研究日益增多。Gao等(2015)研究表明, 水杨酸通过调节雨生红球藻虾青素合成基因的转录表达来促进虾青素的合成, 且50mg/L水杨酸对八种胡萝卜素基因的影响最大。与其他植物激素类似, 水杨酸的作用也受其浓度的影响, 仅在适宜浓度下才能发挥其促进作用(高政权等, 2007; 孟雪娇等, 2010)。本研究结果表明25mg/L水杨酸对雨生红球藻虾青素含量影响最大。与已有文献结果比较, 虾青素的产量可能因藻种、培养条件等的不同, 水杨酸最适浓度有所差异。
3.3 植物激素对3种碳代谢相关酶的影响Rubisco是光合作用的关键酶, 在卡尔文循环中起固定CO2的作用。外界逆境如高温、高盐、干旱等非生物胁迫均能降低植物体Rubisco酶的活性(Crafts-Brandner et al, 2000)。而外源添加水杨酸则能提高逆境胁迫下植物体的Rubisco活性, 并能缓解逆境对其活化状态的降低(Wang et al, 2010); 徐晓昀等, 2016)。本研究发现, 在高光胁迫前期, 外源添加水杨酸和玉米素均能减缓高光胁迫引起藻体内rbcL基因的下调, 且玉米素的促进效果更为显著, 而水杨酸则在胁迫后期无此作用。
Rubisco活化酶是一种核基因编码的叶绿体酶。研究表明rca的活性和表达对植物光合作用非常重要(Whitney et al, 2001)。rca不耐高温, 所以高温或高光强下光合效率降低的一个重要原因是RCA蛋白失活而使Rubisco钝化(Barta et al, 2010)。另一方面, 高温等产生的氧化胁迫也能使Rubisco降解, 如Ayala-Ochoa等(2004)发现, 玉米Rubisco和RCA两种酶基因表达的调控是转录后水平调控, 且在白天和夜晚具有不同的表达模式, 这一结果在DeRidder等(2007)的研究中再次得到证实。在臭氧胁迫下, 莴苣光合效率的降低是由于Rubisco大亚基(rbcL)和小亚基基因(rbcSl), 以及rca基因(racl和rca2)表达量的减少造成的(Goumenaki et al, 2010)。本实验表明, 外源添加玉米素能减缓高光胁迫引起的Rubisco活化酶基因下调表达, 短时间内外源添加水杨酸也能缓解高光胁迫引起的Rubisco活化酶基因下调表达, 但随着胁迫时间的延长, 水杨酸对rca基因表现出一定的抑制作用, 这与邓意龙等(2012)研究表明不同浓度水杨酸的添加对小球藻rca基因表现出一定的抑制作用的结果相吻合。
碳酸酐酶是一种含Zn2+的金属酶, 在HCO3–和CO2的相互转化中起作用(Smith et al, 2000)。CA在维持光合碳代谢稳定方面具有重要作用, 但其活性易受温度、pH值、CO2和光照等环境因素的调控。如蛋白核小球藻的CA活性和基因表达受盐度和无机碳浓度等环境因子的影响(王玮蔚等, 2014)。植物激素对CA影响的研究比较少。如100μmol/L水杨酸能促进龙须菜CA蛋白和转录水平的表达, 但茉莉酸甲酯则起抑制作用(王重彬等, 2015)。本文研究结果显示, 在胁迫初期, 玉米素和水杨酸均诱导了ca基因的表达, 但随着时间的延长, 水杨酸促进效果逐渐减弱, 而玉米素的促进效果呈波动性。这就表明了高光胁迫下, 水杨酸和玉米素对ca基因的影响具有时效性, 和波动性。
3.4 雨生红球藻中虾青素合成酶的相关研究β-胡萝卜素酮化酶是虾青素合成途径中的关键酶之一(Grünewald et al, 2001)。该酶能够以β-胡萝卜素和玉米黄素为底物, 合成角黄质(canthanxanthin)和虾青素(Kajiwara et al, 1995; Fraser et al, 1998)。在高光、盐胁迫、缺氮等多种非生物胁迫条件下, 植物体内虾青素的关键酶基因包括β-胡萝卜素羟化酶(crtR-B)、bkt和八氢番茄红素合成酶的mRNA水平在胁迫后数小时内迅速提高, 说明虾青素合成调控发生在虾青素合成酶基因的转录水平上(Steinbrenner et al, 2001; Huang et al, 2006)。Li等(2010)研究表明经高光处理后bkt等基因在转录水平上有了较大的提高; Hu等(2008)研究表明高光、硫酸亚铁、乙酸钠胁迫培养条件下雨生红球藻中bkt等基因表达量上升。有研究表明虾青素合成酶bkt和crtR-B基因的5’上游侧翼序列中可能包含水杨酸调控相关的顺式反应元件TCA-element, 适量浓度的水杨酸可能会激活此反应元件, 从而诱导这两个关键酶基因的大量表达, 从而提高藻细胞中虾青素含量(Meng et al, 2005, 2006)。本文结果也表明外源添加水杨酸能显著诱导bkt基因的表达, 在胁迫初期(24h前), 玉米素有一定的促进效果, 但随着处理时间的增加, 玉米素表现出一定的抑制作用, 但水杨酸仍显著促进了bkt基因表达。
4 结论本文研究表明0.05mg/L玉米素或25mg/L水杨酸对雨生红球藻虾青素积累具有重要的促进作用, 虾青素含量最高可达对照组的1.9倍。该浓度的玉米素和水杨酸在高光胁迫下都可以减缓逆境胁迫对红球藻细胞生长的影响, 促进虾青素的积累玉米素和水杨酸组的藻细胞密度分别达3.4×105cell/mL和3.0× 105cell/mL, 虾青素含量最高达到细胞干重的1.7%和1.6%, 比对照组分别增加29.2%和25.6%。基因转录水平分析表明玉米素可以有效缓解光合作用和碳代谢相关基因的下调表达, 而水杨酸则显著上调了β-胡萝卜素酮化酶基因的表达。综上可知, 水杨酸和玉米素促进雨生红球藻虾青素合成的机理有所不同。相关研究可为雨生红球藻的生产提供科学依据和理论参考。
| 王玮蔚, 孙雪, 王冬梅, 等, 2014. 盐度和无机碳对蛋白核小球藻生长、胞外碳酸酐酶活性及其基因表达的影响. 水产学报, 38(7): 920–928 |
| 王重彬, 邹同雷, 孙雪, 等, 2015. 水杨酸和茉莉酸甲酯对高温龙须菜(Gracilariopsis lemaneiformis)理化及基因表达的影响. 海洋与湖沼, 46(5): 1132–1138 |
| 王鑫威, 王丽丽, 龚一富, 等, 2011. 茉莉酸甲酯对雨生红球藻虾青素含量和dxs基因表达的影响. 水产学报, 35(12): 1822–1828 |
| 邓意龙, 孙雪, 徐年军, 等, 2012. 蛋白核小球藻(Chlorella pyrenoidosa) Rubisco活化酶基因的克隆与表达分析. 海洋与湖沼, 43(1): 41–46 DOI:10.11693/hyhz201201006006 |
| 吕亭亭, 葛声, 2015. 虾青素抗肿瘤作用的研究进展. 肿瘤代谢与营养电子杂志, 2(4): 58–62 |
| 张睿钦, 管斌, 孔青, 等, 2011. 雨生红球藻异养转化产虾青素的条件研究. 浙江大学学报(农业与生命科学版), 37(6): 624–630 |
| 孟雪娇, 邸昆, 丁国华, 2010. 水杨酸在植物体内的生理作用研究进展. 中国农学通报, 26(15): 207–214 |
| 徐晓昀, 郁继华, 颉建明, 等, 2016. 水杨酸和油菜素内酯对低温胁迫下黄瓜幼苗光合作用的影响. 应用生态学报, 27(9): 3009–3015 |
| 高政权, 孟春晓, 刁英英, 2007. 施用水杨酸对雨生红球藻中虾青素积累的影响. 水产科学, 26(7): 377–380 |
| 崔宝霞, 钟方旭, 2008. 植物生长调节剂对雨生红球藻细胞增殖及虾青素积累的影响. 水产科学, 27(9): 478–482 |
| 韩春梅, 刘建国, 张勇, 2009. 不同激素配伍对雨生红球藻(Haematococcus pluvialis)细胞生长和虾青素累积的调节作用、藻株差异及应用. 海洋与湖沼, 40(4): 430–436 DOI:10.11693/hyhz200904007007 |
| Ayala-Ochoa A, Vargas-Suárez M, Loza-Tavera H, et al, 2004. In maize, two distinct ribulose 1, 5-bisphosphate carboxylase/oxygenase activase transcripts have different day/night patterns of expression. Biochimie, 86(7): 439–449 DOI:10.1016/j.biochi.2004.06.007 |
| Barta C, Dunkle A M, Wachter R M, et al, 2010. Structural changes associated with the acute thermal instability of Rubisco activase. Archives of Biochemistry and Biophysics, 499(1-2): 17–25 DOI:10.1016/j.abb.2010.04.022 |
| Boussiba S, 2000. Carotenogenesis in the green alga Haematococcus pluvialis:cellular physiology and stress response. Physiologia Plantarum, 108(2): 111–117 DOI:10.1034/j.1399-3054.2000.108002111.x |
| Boussiba S, Fan L, Vonshak A, 1992. Enhancement and determination of astaxanthin accumulation in green alga Haematococcus pluvialis. Methods in Enzymology, 213: 386–391 DOI:10.1016/0076-6879(92)13140-S |
| Crafts-Brandner S J, Salvucci M E, 2000. Rubisco activase constrains the photosynthetic potential of leaves at high temperature and CO2. Proceedings of the National Academy of Sciences of the United States of America, 97(24): 13430–13435 DOI:10.1073/pnas.230451497 |
| DeRidder B P, Salvucci M E, 2007. Modulation of Rubisco activase gene expression during heat stress in cotton (Gossypium hirsutum L.) involves post-transcriptional mechanisms. Plant Science, 172(2): 246–254 DOI:10.1016/j.plantsci.2006.08.014 |
| Fraser P D, Shimada H, Misawa N, 1998. Enzymic confirmation of reactions involved in routes to astaxanthin formation, elucidated using a direct substrate in vitro assay. European Journal of Biochemistry, 252(2): 229–236 DOI:10.1046/j.1432-1327.1998.2520229.x |
| Gao Z Q, Meng C X, Chen Y C, et al, 2015. Comparison of astaxanthin accumulation and biosynthesis gene expression of three Haematococcus pluvialis strains upon salinity stress. Journal of Applied Phycology, 27(5): 1853–1860 DOI:10.1007/s10811-014-0491-3 |
| Gao Z Q, Meng C X, Zhang X W, et al, 2012a. Induction of salicylic acid (SA) on transcriptional expression of eight carotenoid genes and astaxanthin accumulation in Haematococcus pluvialis. Enzyme and Microbial Technology, 51(4): 225–230 DOI:10.1016/j.enzmictec.2012.07.001 |
| Gao Z Q, Meng C X, Zhang X W, et al, 2012b. Differential expression of carotenogenic genes, associated changes on astaxanthin production and photosynthesis features induced by JA in H. pluvialis. PLoS One, 7(8): e42243 DOI:10.1371/journal.pone.0042243 |
| Goumenaki E, Taybi T, Borland A, et al, 2010. Mechanisms underlying the impacts of ozone on photosynthetic performance. Environmental and Experimental Botany, 69(3): 259–266 DOI:10.1016/j.envexpbot.2010.04.011 |
| Grünewald K, Hirschberg J, Hagen C, 2001. Ketocarotenoid biosynthesis outside of plastids in the unicellular green alga Haematococcus pluvialis. Journal of Biological Chemistry, 276(8): 6023–6029 DOI:10.1074/jbc.M006400200 |
| He P, Duncan J, Barber J, 2007. Astaxanthin accumulation in the green alga Haematococcus pluvialis:effects of cultivation parameters. Journal of Integrative Plant Biology, 49(4): 447–451 DOI:10.1111/jipb.2007.49.issue-4 |
| Hu Z Y, Li Y T, Sommerfeld M, et al, 2008. Enhanced protection against oxidative stress in an astaxanthin-overproduction Haematococcus mutant (Chlorophyceae). European Journal of Phycology, 43(4): 365–376 DOI:10.1080/09670260802227736 |
| Huang J C, Chen F, Sandmann G, 2006. Stress-related differential expression of multiple β-carotene ketolase genes in the unicellular green alga Haematococcus pluvialis. Journal of Biotechnology, 122(2): 176–185 DOI:10.1016/j.jbiotec.2005.09.002 |
| Hussein G, Nakagawa T, Goto H, et al, 2007. Astaxanthin ameliorates features of metabolic syndrome in SHR/NDmcr-cp. Life Sciences, 80(6): 522–529 DOI:10.1016/j.lfs.2006.09.041 |
| Kajiwara S, Kakizono T, Saito T, et al, 1995. Isolation and functional identification of a novel cDNA for astaxanthin biosynthesis from Haematococcus pluvialis, and astaxanthin synthesis in Escherichia coli. Plant Molecular Biology, 29(2): 343–352 DOI:10.1007/BF00043657 |
| Kang C D, Lee J S, Park T H, et al, 2007. Complementary limiting factors of astaxanthin synthesis during photoautotrophic induction of Haematococcus pluvialis:C/N ratio and light intensity. Applied Microbiology and Biotechnology, 74(5): 987–994 DOI:10.1007/s00253-006-0759-x |
| Lee Y K, Soh C W, 2010. Accumulation of astaxanthin in Haematococcus lacustris (Chlorophyta). Journal of Phycology, 27(5): 575–577 |
| Li Y T, Sommerfeld M, Chen F, et al, 2010. Effect of photon flux densities on regulation of carotenogenesis and cell viability of Haematococcus pluvialis (Chlorophyceae). Journal of Applied Phycology, 22(3): 253–263 DOI:10.1007/s10811-009-9453-6 |
| Liao X R, He P C, Zhu X C, 1997. Effect of zeatin on H2O2 scavenging system of Vitis vulpina leaf disks under salt stress. Journal of Integrative Plant Biology, 39(7): 641–646 |
| Livak K J, Schmittgen T D, 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method. Methods, 25(4): 402–408 DOI:10.1006/meth.2001.1262 |
| Meng C X, Liang C W, Su Z L, et al, 2006. There are two 5'-flanking regions of bkt encoding beta-carotene ketolase in Haematococcus pluvialis. Phycologia, 45(2): 218–224 DOI:10.2216/04-74.1 |
| Meng C X, Teng C Y, Jiang P, et al, 2005. Cloning and characterization of β-carotene ketolase gene promoter in Haematococcus pluvialis. Acta Biochimica et Biophysica Sinica, 37(4): 270–275 DOI:10.1111/abbs.2005.37.issue-4 |
| Raman V, Ravi S, 2011. Effect of salicylic acid and methyl jasmonate on antioxidant systems of Haematococcus pluvialis. Acta Physiologiae Plantarum, 33(3): 1043–1049 DOI:10.1007/s11738-010-0623-6 |
| Seabra L M A J, Pedrosa L F C, 2010. Astaxanthin:structural and functional aspects. Revista de Nutrição, 23(6): 1041–1050 DOI:10.1590/S1415-52732010000600010 |
| Sheikhzadeh N, Panchah I K, Asadpour R, et al, 2012. Effects of Haematococcus pluvialis in maternal diet on reproductive performance and egg quality in rainbow trout (Oncorhynchus mykiss). Animal Reproduction Science, 130(1-2): 119–123 DOI:10.1016/j.anireprosci.2011.12.010 |
| Smith K S, Ferry J G, 2000. Prokaryotic carbonic anhydrases. FEMS Microbiology Reviews, 24(4): 335–366 DOI:10.1111/j.1574-6976.2000.tb00546.x |
| Souza J M C, Yokoya N S, 2016. Effects of cytokinins on physiological and biochemical responses of the agar-producing red alga Gracilaria caudata (Gracilariales, Rhodophyta). Journal of Applied Phycology, 28(6): 3491–3499 DOI:10.1007/s10811-016-0885-5 |
| Steinbrenner J, Linden H, 2001. Regulation of two carotenoid biosynthesis genes coding for phytoene synthase and carotenoid hydroxylase during stress-induced astaxanthin formation in the green alga Haematococcus pluvialis. Plant Physiology, 125(2): 810–817 DOI:10.1104/pp.125.2.810 |
| Tominaga K, Hongo N, Karato M, et al, 2012. Cosmetic benefits of astaxanthin on humans subjects. Acta Biochimica Polonica, 59(1): 43–47 |
| Vidhyavathi R, Venkatachalam L, Sarada R, et al, 2008. Regulation of carotenoid biosynthetic genes expression and carotenoid accumulation in the green alga Haematococcus pluvialis under nutrient stress conditions. Journal of Experimental Botany, 59(6): 1409–1418 DOI:10.1093/jxb/ern048 |
| Wang L J, Fan L, Loescher W, et al, 2010. Salicylic acid alleviates decreases in photosynthesis under heat stress and accelerates recovery in grapevine leaves. BMC Plant Biology, 10: 34 DOI:10.1186/1471-2229-10-34 |
| Whitney S M, Andrews T J, 2001. Plastome-encoded bacterial ribulose-1, 5-bisphosphate carboxylase/oxygenase (RubisCo) supports photosynthesis and growth in tobacco. Proceedings of the National Academy of Sciences of the United States of America, 98(25): 14738–14743 DOI:10.1073/pnas.261417298 |
| Yokoyama A, Miki W, 1995. Composition and presumed biosynthetic pathway of carotenoids in the astaxanthin-producing bacterium Agrobacterium aurantiacum. FEMS Microbiology Letters, 128(2): 139–144 DOI:10.1111/fml.1995.128.issue-2 |
 2018, Vol. 49
2018, Vol. 49


