
中国海洋湖沼学会主办。
文章信息
- 马细兰, 郑陆威, 叶超霞, 陈勇智, 周立斌, 王安利. 2018.
- MA Xi-Lan, ZHENG Lu-Wei, YE Chao-Xia, CHEN Yong-Zhi, ZHOU Li-Bin, WANG An-Li. 2018.
- 胃促生长素Ghrelin在不同盐度胁迫下对黑鲷(Acanthopagrus schlegelii)部分免疫指标的影响
- EFFECTS OF GHRELIN ON IMMUNE INDEXES OF BLACK SEABREAM ACANTHOPAGRUS SCHLEGELII UNDER DIFFERENT SALINITY STRESS
- 海洋与湖沼, 49(3): 692-699
- Oceanologia et Limnologia Sinica, 49(3): 692-699.
- http://dx.doi.org/10.11693/hyhz20180100014
-
文章历史
- 收稿日期:2018-01-22
- 收修改稿日期:2018-02-24
2. 华南师范大学生命科学学院 广州 510631;
3. 中山大学生命科学学院 广州 510275
2. College of Life Science, South China Normal University, Guangzhou 510631, China;
3. School of Life Sciences, Sun Yat-Sen University, Guangzhou 510275, China
盐度是水生生物重要的环境影响因子, 对鱼类呼吸代谢、生长存活和免疫防御影响显著(Howell et al, 1998)。养殖环境受到许多自然因素和人为因素的影响, 养殖区域的盐度会产生一些变化, 而盐度的变化会导致鱼类代谢加速、耗氧率升高、能量需求增加, 严重时会造成生理机能的失常。除此外, 盐度变化还可促使鱼体产生较多的自由基, 造成体内蛋白和脂质的氧化、DNA损伤, 最终因细胞膜的损伤和酶活力的丧失影响细胞的正常机能(Livingstone, 2001; Choi et al, 2008)。若长期处于这种氧化压力下, 将会导致鱼体免疫防御能力和抗病力的下降, 从而影响鱼类的正常生长(孙鹏等, 2010)。目前, 国内外针对鱼类盐度胁迫的生理生化等方面开展了一些相关的研究。赵峰等(2008)比较了施氏鲟在盐度变化时不同组织的抗氧化酶活性, 发现过氧化氢酶和超氧化物歧化酶在肝脏中含量最高; 随着盐度升高, 超氧化物歧化酶的活力下降, 明显低于对照组; 心脏等组织中的过氧化氢酶活性无显著变化; 高盐度处理条石鲷, 幼鱼肝脏中的过氧化氢酶和超氧化物歧化酶活力都受到较显著的影响, 最终达到新的平衡(孙鹏等, 2010); 10盐度处理可导致银鲳的肾脏谷胱甘肽S-转移酶活性显著下降(Yin et al, 2011); 12和18盐度处理后, 斜带石斑鱼的特定生长率明显高于6盐度组和高盐度处理组, 其血清溶菌酶活性和超氧化物歧化酶活力亦明显高于其他组, 提示适当降低盐度有可能提高斜带石斑鱼的养殖效益(王素久等, 2011)。因此, 研究盐度变化对鱼类生理功能的影响不但有利于阐明盐度变化时鱼生理学的变化规律, 而且还能应用于养殖生产实践, 以改善养殖环境, 提高养殖效益。
Ghrelin是一种多功能的小肽, 它在动物的摄食、能量平衡、免疫、生殖、体重、心血管等各方面都显示出直接或间接的调节作用(Kojima et al, 1999)。Ghrelin在鱼类上的研究主要集中在其对鱼类摄食和生长方面的影响, 对鱼类免疫方面的研究甚少。黑鲷(Acanthopagrus schlegelii)是我国东南沿海增殖放流的优良品种, 具有许多适合人工养殖的生物特征, 是集约化养殖的对象之一。本研究初步探究了在盐度胁迫下Ghrelin对黑鲷血清免疫指标的影响, 为Ghrelin可否成为一种新型的免疫添加剂提供实验依据。
1 材料与方法 1.1 材料 1.1.1 实验动物该实验在广东省大亚湾水产试验中心完成。实验用鱼为该中心人工育苗、养殖的黑鲷, 体重(246.8±24.7)g, 体长(21.5±2.0)cm。黑鲷先暂养于室外大型塑料桶中, 每天定时投喂2次。选取180尾个体相近的黑鲷, 随机放入9个体积为1m3的塑料桶中, 20尾/桶, 充气增氧, 日换水量为三分之一, 在此实验条件下驯化一周时间。实验中使用经沉淀和沙滤后的海水, 盐度约为30;淡水采用曝气后的自来水, 然后用海盐调成盐度为的20和10两个低盐组。实验温度为26.5—30.0℃, 光照周期为12L:12D。
1.1.2 药品及试剂Ghrelin由吉尔生化(上海)有限公司合成, 纯度大于99.8%, 鱼用生理盐水(physiological saline, PS)为实验室配置, 配方为: NaCl 5.9g、KCl 0.25g、CaCl 20.28g、MgSO4·7H2O 0.29g、NaHCO3 2.1g及KH2PO4 1.6g, 加蒸馏水至1L。Ghrelin用鱼用生理盐水溶解, 注射剂量为10ng/100g鱼体重。
检测黑鲷超氧化物歧化酶活性和丙二醛含量的试剂盒购于上海碧云天生物技术有限公司; 检测黑鲷溶菌酶活性浓度、免疫球蛋白M含量、补体3浓度的试剂盒购于安迪生物科技(上海)有限公司。
1.1.3 仪器设备751-GD紫外可见分光光度计, 上海欣益仪器有限公司; VIS-723G可见光分光光度计, 北京瑞利分析仪器公司; JY92-Ⅱ型超声波细胞粉碎机, 宁波新芝科器研究所; iMark酶标仪, 美国BIO-RAD。
1.2 方法 1.2.1 实验设计实验前随机取6尾鱼作为空白对照组, 设10盐度处理组、20盐度处理组和正常海水(盐度30)组, Ghrelin按10ng/100g鱼体重的剂量对黑鲷进行腹腔注射, 对照组注射等量鱼用生理盐水, 分别于注射后1、2、3、6、12h取样。每次取6尾鱼, 经尾静脉抽血, 测量体重和体长, 血液在4℃静置4h后, 在22R台式冷冻离心机(德国, Eppendorf) 4℃下5000r/min离心10min, 收集血清, 保存于–20℃冰箱待测。
1.2.2 免疫指标测定(1) 总超氧化物歧化酶活性(SOD)的测定
原理:通过黄嘌呤和黄嘌呤氧化酶反应系统产生超氧阴离子自由基, 水溶性四唑盐WST-1可以与黄嘌呤氧化酶催化产生超氧化物阴离子, 反应产生水溶性甲臜染料, 这个反应可以被SOD抑制。通过对WST-1产物的比色分析即可计算SOD的酶活力。测定方法见碧云天试剂盒的使用说明。
(2) 鱼溶菌酶(LYS)活性的测定
原理:用双抗体夹心法测定标本的鱼LYS水平。用纯化鱼LYS抗体来包被微孔板, 制成固相抗体, 然后往包被单抗的微孔中加入LYS, 再与HRP标记的LYS抗体结合, 形成抗体-抗原-酶标抗体复合物, 经彻底洗涤后加底物3, 3', 5, 5'-四甲基联苯胺(TMB)显色。TMB在辣根过氧化物酶(horse radish peroxidase, HRP)的催化下转化成蓝色, 并在酸的作用下转化成黄色。颜色的深浅与样品中LYS活性呈正相关。应用酶标仪在波长450nm下测定吸光度(即OD值), 最后通过标准曲线计算样品中鱼LYS的活性。测定方法见安迪生物科技公司试剂盒的使用说明。
(3) 鱼补体3(C3)含量的测定
原理:用纯化的C3抗体包被微孔板, 制成固相抗体, 然后往包被单抗的微孔中依次加入C3, 再与HRP标记的C3抗体结合, 形成抗体-抗原-酶标抗体复合物, 经彻底洗涤后加底物TMB显色。TMB在HRP酶的催化下转化成蓝色, 在酸的作用下转化成黄色。颜色的深浅和样品中的C3正相关。酶标仪在450nm波长下测定OD值, 通过标准曲线计算样品中鱼C3浓度。测定方法见安迪生物科技公司试剂盒的使用说明。
(4) 鱼免疫球蛋白M(IgM)含量的测定
原理:用双抗体夹心法测定标本中鱼IgM水平。用纯化的鱼IgM抗体包被微孔板, 制成固相抗体, 然后往包被单抗的微孔中加入IgM, 再与HRP标记的IgM抗体结合, 形成抗体-抗原-酶标抗体复合物, 经彻底洗涤后加底物TMB显色。TMB在HRP酶的催化下转化成蓝色, 在酸的作用下转化成最终的黄色。颜色的深浅和样品中的IgM呈正相关。用酶标仪在450nm波长下测定OD值, 通过标准曲线计算样品中鱼IgM浓度。测定方法见安迪生物科技公司试剂盒的使用说明。
(5) 丙二醛(MDA)含量的测定
原理:用一种基于MDA和硫代巴比妥酸(thiobarbituric acid, TBA)反应产生红色产物的显色反应, 用比色法对血清、尿液、动植物组织或细胞裂解液中MDA进行定量检测。测定方法见碧云天试剂盒的使用说明。
1.2.3 数据分析用SPSS18.0对数据进行单因素方差分析(Duncan)以判断各个处理组之间的差异性; 用SigmaPlot 12.0软件作图。结果都以平均值±标准差表示, P<0.05认为差异显著。
2 结果 2.1 对超氧化物歧化酶(SOD)活性的影响在正常盐度(盐度30)下, Ghrelin组与对照组SOD活性无显著差异(图 1A)。在轻度盐度胁迫(盐度为20)下, Ghrelin组SOD活性在1h、2h、3h、6h时均显著高于对照组(P<0.05);对照组中, 0h组显著高于其他组(P<0.05)(图 1B)。在重度盐度胁迫(盐度10)下, Ghrelin组SOD活性在6h时显著高于对照组(P<0.05) (图 1C)。
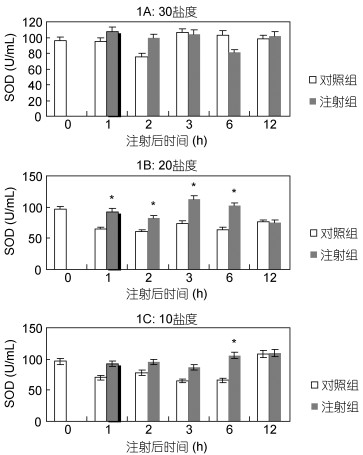 |
| 图 1 Ghrelin对黑鲷血清SOD活性的影响(n=6) Fig. 1 The effect of Ghrelin on SOD in serum of black seabream (n=6) |
在盐度30下, 在2h时, 对照组的LYS活性均高于Ghrelin组(P<0.05)(图 2A)。在盐度20下, 在1h、6h、12h时Ghrelin组LYS活性均显著高于对照组(P<0.05)(图 2B)。在盐度10下, 在1h时Ghrelin组LYS活性显著高于对照组(P<0.05)(图 2C)。
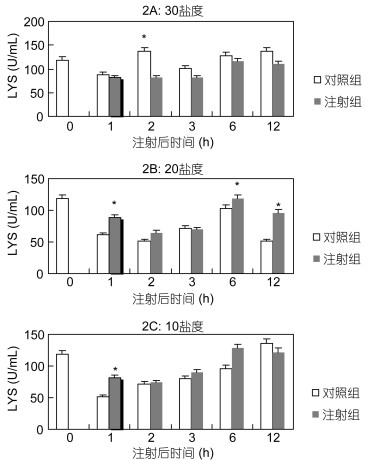 |
| 图 2 Ghrelin对黑鲷血清LYS活性的影响(n=6) Fig. 2 The effect of Ghrelin on LYS in serum of black seabream (n=6) |
在盐度为30下, Ghrelin组与对照组C3含量均无显著差异(P>0.05)(图 3A)。在盐度20下, 在1h、2h、6h、12h时, Ghrelin组C3含量均显著高于对照组(P<0.05)(图 3B)。在盐度10下, 在1h和2h时, Ghrelin组C3含量均显著高于对照组(P<0.05)(图 3C)。
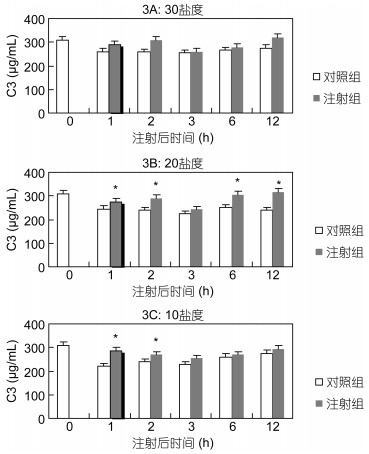 |
| 图 3 Ghrelin对黑鲷血清C3的影响(n=6) Fig. 3 The effect of Ghrelin on C3 in serum of black seabream (n=6) |
在盐度30下, 在1h时, 注射组的IgM含量高于对照组(P<0.05)(图 4A)。在盐度20下, 注射组的IgM含量与对照组无显著性差异(P>0.05)(图 4B)。在盐度为10下, 在1h、3h、12h时注射组的IgM含量均显著高于对照组(P<0.05)(图 4C)。
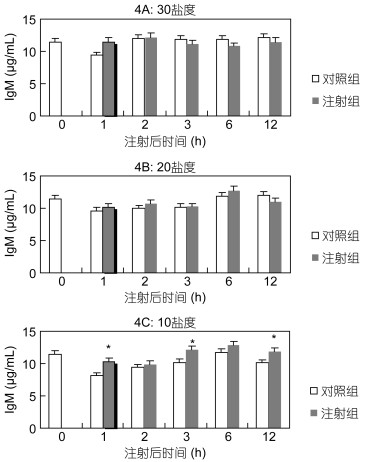 |
| 图 4 Ghrelin对黑鲷血清IgM的影响(n=6) Fig. 4 The effect of Ghrelin on IgM in serum of black seabream (n=6) |
在盐度为30下, 在2h, 对照组的MDA含量显著高于注射组外(P<0.05)(图 5A)。在盐度为20下, 对照组的MDA含量均高于注射组, 且在3h、6h和12h时有显著性差异(P<0.05)(图 5B)。在盐度10下, 在3h和6h时对照组的丙二醛含量均高于注射组, 且有显著性差异(P<0.05)(图 5C)。
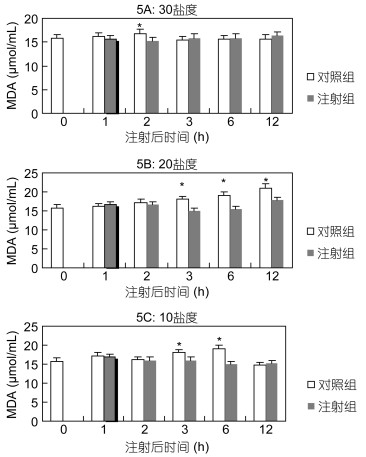 |
| 图 5 Ghrelin对黑鲷血清MDA的影响(n=6) Fig. 5 The effect of Ghrelin on MDA in serum of black seabream (n=6) |
有关Ghrelin对SOD活性影响的研究鱼类不多, 主要集中在鼠科动物。用10–11mol/L和10–8mol/L Ghrelin对鼠的3T3 L1前脂肪细胞培养24h后发现10–8mol/L浓度组SOD活性显著高于10–11mol/L浓度组, 说明Ghrelin可以显著提高SOD活性, 降低细胞内ROS含量, 并呈剂量依赖关系(Zwirska-Korczala et al, 2007)。用2nmol Ghrelin连续14天注射雌性白鼠, 在第9天和第14天发现其卵巢内的SOD活性显著高于对照组(Kheradmand et al, 2010)。以上结果说明Ghrelin可有效降低鼠细胞内ROS含量, 提高SOD活性。生物面临胁迫时会升高体内SOD活性, 以抵抗不良环境(姜景腾等, 2010; 蒋玫等, 2010)。本研究中, 低盐度胁迫时, 对照组(注射生理盐水)血清SOD活性均低于起始组(0h), 呈先降后升的趋势, 这与斜带石斑鱼(Epinephelus coioides)在盐度胁迫后SOD活性在前6天下降而在第9天升高情况相似(余德光等, 2011), 推测前期SOD活性的下降是因为鱼受到盐度胁迫后不适, 盐度刺激导致了代谢酶生理功能的破坏, 鱼的SOD活性受到抑制甚至失活, 抗氧化能力也明显减弱; 实验组(注射Ghrelin)则在较短时间内就出现血清SOD活性的回升, SOD活性均大于对照组, 表明Ghrelin能在环境胁迫下促进黑鲷SOD酶的活性以应对环境变化。在鼠科动物的研究中也得出相似结果, Ghrelin不仅明显提高因胆道梗阻而导致肝脏慢性损害的雄白鼠体内的SOD活性(Iseri et al, 2005), 而且可提高由戊撑四唑(pentylenetetrazole, PTZ)处理的白鼠体内的CuZn- SOD活性, 且呈现明显的剂量-效应关系(Obay et al, 2008)。另外, Ghrelin还能显著提高由四氯化碳(CCl4)处理引起肝脏损伤的白鼠体内的SOD活性(Çetin et al, 2011)。由以上结果我们可以推断Ghrelin对生物体内抗氧化酶SOD有促进作用, 并呈剂量-效应关系。
3.2 对溶菌酶活性(LYS)的影响硬骨鱼类的血液中包含了溶菌酶、C-激活蛋白和补体因子等多种保护性蛋白, 这些蛋白在鱼类感染期间的特异性和非特异性防御系统中起重要作用。溶菌酶由淋巴细胞分泌, 为碱性溶解酶, 主要作用于革兰氏阳性菌, 可溶解细胞壁中的粘多糖(王树芹等, 2004)。有学者认为, 在一定环境胁迫条件下, 鱼类通过升高血清中溶菌酶活性做出免疫防御机制, 如红鲷(Pagrus pagrus)在受到环境胁迫后16天溶菌酶含量显著升高并持续到第23天(Rotllant et al, 1997); 将在正常海水中养殖的牙鲆放入40、20盐度的水体中, 其血清的溶菌酶活性先缓慢升高, 在第5天达到峰值后逐渐降低(魏然等, 2003); 许氏平鲉在急性盐度胁迫初期溶菌酶活性升高, 在24h达到最高, 此后开始下降(王晓杰等, 2005); 军曹鱼在盐度降低后第7天溶菌酶活性上升, 其中盐度20组的活性最高, 对照组与盐度5组的相似, 但与10和30组差异显著, 实验结束时各组溶菌酶活性都下降, 各组间无显著差异(冯娟等, 2007)。日本鳗鲡(Anguilla japonica)在盐度胁迫后第7天, 20和25盐度组的溶菌酶活性均显著高于0、5、10、15盐度组, 并在盐度胁迫后12天仍保持在一定水平(胡利华等, 2011)。在本实验中, 盐度10时, 对照组与注射组的溶菌酶活性均呈现上升趋势; 盐度20时, 对照组与注射组的溶菌酶活性变化呈先升高后降低的趋势, 说明鱼体遭受急性盐度胁迫后, 初期的溶菌酶活性上升, 产生应激和保护反应, 以提高其机体的免疫力, 而溶菌酶活性持续升高的时间长短则依胁迫的方法和强度而定(Fevolden et al, 1993)。国内外关于Ghrelin对生物体溶菌酶活性影响的报道甚少。在本次实验中, 盐度胁迫下(盐度10组和20组), 在注射后的同一个时间点, Ghrelin实验组的溶菌酶活性高于对照组, 说明在低盐条件下Ghrelin可以促进黑鲷血清中溶菌酶活性, 以应对盐度胁迫。
3.3 对补体3(C3)含量的影响补体是用以抵抗微生物感染的重要组成部分之一, 有独特的理化活性, 激活之后可以溶解、吸附细胞、调节免疫、介导炎症反应、中和毒素、溶解和清除免疫复合物等重要的生物学功能(Tort et al, 2004)。补体系统是天然免疫的重要组分, 其活化的途径有经典、凝集和旁路途径三种。经典活化途径由C1、C4、C2和C3构成; 凝集活化途径与经典途径类似, 不同之处在于:凝集途径中的甘露聚糖结合外源凝集素及其相关的丝氨酸蛋白激酶复合体取代了经典途径中的C1;而旁路激活途径则必须有C3激活剂前体的转化酶(D因子)和C3激活剂前体(B因子)的存在, 才可活化C3 (Holland et al, 2002; Nakao et al, 2003)。C3通过以上任何一种途径活化后, 都可裂解成活性片段, 引发C5—C9组成的溶血途径的激活(Nakao et al, 2003)。在三种途径中C3起中枢作用, 3条补体途径的激活都要通过活化C3才得以实现。鱼类的C3往往比哺乳动物具有更多的活性形式(Tort et al, 2004)。因此, 本实验选择了C3作为一个免疫检测指标。从实验结果来看, 正常盐度下, 腹腔注射不同浓度的Ghrelin可使黑鲷C3浓度下降, 说明单独注射Ghrelin能使黑鲷产生胁迫, 降低补体系统中C3活性。盐度胁迫实验中, 对照组C3含量都低于起始对照组, 即盐度胁迫有可能造成补体活性的降低, 或者是引起补体中某些蛋白组份的失活, 因而阻断补体的激活途径(童燕, 2007)。这一结果与施氏鲟的一致, 但与牙鲆的不同。牙鲆在盐度增加(40)或减少(20)的胁迫初期, C3含量均比对照组高(正常盐度组), 但最后都趋于对照组, 体现出对盐度胁迫的良好适应性(魏然等, 2003)。在盐度12、38(正常海水)、55的水体中养殖乌颊鱼14天, 盐度12组的补体旁路活性显著高于其他两组; 而在盐度6、12、38的水体养殖100天, 盐度38组的补体旁路活性最高, 并与盐度6组差异显著(Cuesta et al, 2005)。以上研究均表明盐度对补体活性有显著影响。注射Ghrelin后, 对黑鲷进行低盐度胁迫, 结果发现实验组黑鲷血清中的C3含量均高于对照组, 这表明Ghrelin可以通过某种机制提高鱼体C3的含量, 但具体作用机制有待进一步研究。
3.4 对免疫球蛋白M(IgM)含量的影响IgM是B淋巴细胞产生的一类能特异识别和中和相应抗原的、具有免疫作用的球蛋白, 对脊椎动物的免疫应答起重要作用, IgM具有高特异性、高亲和性特点(张福淼等, 2005)。最早产生免疫球蛋白的动物是鱼类, 软骨鱼可产生两种大小不一的抗体, 分别相当于哺乳动物的IgM和IgG, 而真骨鱼类只有一种抗体, 类似于IgM的免疫球蛋白(Kunihiko et al, 1988; Hirotoshi et al, 1991; 张永安等, 1998)。无论将虹鳟(Oncorhynchus mykiss)直接从淡水分别置于盐度12或盐度29的水中, 还是将莫桑比克罗非鱼(Oreochromis mossambicus)直接从淡水转移至盐度21或盐度35的水中, 其体内IgM含量均无显著变化(Yada et al, 2001, 2002)。本实验中黑鲷直接从海水(30)转移至盐度10或盐度20时, IgM含量显著下降, 与尼罗罗非鱼(Oreochromis niloticus)的研究结果相反, 将尼罗罗非鱼直接从淡水转移至盐度12或盐度24时, IgM含量显著上升(Dominguez et al, 2004)。以上几种鱼互相不一致的研究结果可能是因为海水鱼和淡水鱼对盐度胁迫的应激机制不同而致。
处于繁殖季节的虹鳟, 其IgM含量随着体内性类固醇激素的上升而降低(Suzuki et al, 1997); 脑垂体切除后虹鳟血清IgM含量下降, 通过脑腔注射PRL或GH又可使其含量恢复至对照组水平(Yada et al, 1999)。将切除脑垂体的虹鳟养在淡水中, 其IgM含量显著下降, 但LYS活性没有改变(Yada et al, 1999)。本实验中, 黑鲷腹腔注射Ghrelin后进行盐度应激, 在相同时间点, 实验组IgM含量均高于对照组。以上这些结果表明一些激素可直接或间接的参与IgM的分泌, 其中Ghrelin在盐度胁迫下可促进黑鲷IgM的释放。
3.5 对丙二醛(MDA)含量的影响生物体通过酶系统和非酶系统产生活性氧, 具有杀菌、杀灭癌细胞、调节细胞生长和信号传导等多种生物功能。但当活性氧浓度过高时, 则会对DNA、蛋白质和脂质等生物大分子造成伤害。但当活性氧浓度过高时, 则会对DNA、蛋白质和脂质等生物大分子造成伤害。活性氧攻击生物细胞膜中的多不饱和脂肪酸时, 会引起脂质的过氧化, 从而形成一些脂质过氧化物, 如:醛基(丙二醛)、酮基、羟基、羰基、氢过氧基等。这是典型的自由基连锁反应, 包括启动、延伸和终止三个阶段, 在延伸阶段产生脂过氧基、脂氧基和氢过氧脂等多种活性氧, 在终止阶段生成多种如丙二醛和烃类小分子产物的醛类, 这些产物可能引起多种细胞的功能损伤, 引发多种疾病(Halliwell, 2001)。丙二醛作为一种最重要的脂质过氧化产物, 是油脂中多元不饱和脂肪酸的过氧化产物, 可以反映了机体脂质的过氧化水平高低, 是衡量机体脂质过氧化程度的重要指标之一(Lepage et al, 1991)。
南美白对虾仔虾进行盐度骤降后, 血清丙二醛含量在16h与24h均较0h有显著性增加(季延滨等, 2008)。随着盐度胁迫程度的增加, 盐生隐杆藻的丙二醛含量也不断增加(周亚维等, 2010)。本研究盐度胁迫实验结果也表明, 低盐度胁迫会显著升高黑鲷血清丙二醛含量。以上结果说明水生生物在盐度骤变时, 其体内的丙二醛含量均会显著上升, 可能造成生物体的脂质过氧化。
有关Ghrelin对生物丙二醛影响的研究不多。Ghrelin以剂量信赖的方式降低3T3 L1前脂肪细胞内的丙二醛含量(Lotfi et al, 2012)。给小鸡受精卵注射Ghrelin, 由此孵出的小鸡胚胎中血清丙二醛含量显著低于对照组(Şehirli et al, 2008)。本实验中, 黑鲷腹腔注射Ghrelin后丙二醛含量显著下降, 这与前人的研究结果一致。另外, 比较注射Ghrelin后不同时间点黑鲷血清丙二醛含量, 发现黑鲷血清丙二醛含量在注射后6h降至最低, 因此, 可以推断Ghrelin对黑鲷血清丙二醛的最佳作用时间应在6h左右。
研究表明Ghrelin能有效缓解环境胁迫对生物机体的损伤。Ghrelin可缓解白鼠因烫伤引起的体内丙二醛含量的增加, 以降低细胞功能的损伤(Sehirli et al, 2008); 在MES23.5细胞的培养基中仅加入1-甲基-4-苯基吡啶离子(1-methyl-4-phenylpyridinium, MPP+)后, 其体内细胞丙二醛含量较对照组有显著增加, 而同时加入Ghrelin和MPP+组的丙二醛含量则与对照组相同(Liu et al, 2010)。对因CCl4导致肝脏损伤的白鼠连续注射10ng/kg的Ghrelin 5天后, 注射Ghrelin组血清丙二醛含量显著低于仅注射CCl4组(Cetin et al, 2011)。本实验中, 在低盐度胁迫下, 黑鲷注射Ghrelin后其体内丙二醛含量也都显著低于对照组, 说明Ghrelin可降低因盐度胁迫而引起的丙二醛含量的增加幅度, 缓解盐度胁迫对黑鲷的损伤。Ghrelin实验组的溶菌酶活性高于对照组, 说明在低盐条件下Ghrelin可以促进黑鲷血清中溶菌酶活性, 以应对盐度胁迫。
4 结论综上可知, 在低盐肋迫下, Ghrelin可显著提高海水鱼黑鲷血清中SOD、LYS、C3和IgM水平, 降低MDA水平, 提高黑鲷的免疫水平, 以缓解盐度胁迫对黑鲷的损伤。因此, Ghrelin在海鱼的淡化驯养中具有潜在的应用前景, 有望开发为一种海鱼淡化驯养的饲料添加剂。
| 王树芹, 周洪琪, 2004. 壳聚糖对异育银鲫溶菌酶和白细胞吞噬活性的影响. 上海水产大学学报, 13(2): 121–125 |
| 王素久, 张海发, 赵俊, 等, 2011. 不同盐度对斜带石斑鱼幼鱼生长和生理的影响. 广东海洋大学学报, 31(6): 39–44 |
| 王晓杰, 张秀梅, 李文涛, 2005. 盐度胁迫对许氏平鲉血液免疫酶活力的影响. 海洋水产研究, 26(6): 17–21 |
| 冯娟, 徐力文, 林黑着, 等, 2007. 盐度变化对军曹鱼稚鱼相关免疫因子及其生长的影响. 中国水产科学, 14(1): 120–125 |
| 孙鹏, 尹飞, 彭士明, 等, 2010. 盐度对条石鲷幼鱼肝脏抗氧化酶活力的影响. 海洋渔业, 32(2): 154–159 |
| 余德光, 杨宇晴, 王海英, 等, 2011. 盐度变化对斜带石斑鱼生理生化因子的影响. 水产学报, 35(5): 719–728 |
| 张永安, 聂品, 1998. 鳜血清免疫球蛋白的分离纯化及其亚单位分子量的测定. 水生生物学报, 22(2): 192–194 |
| 张福淼, 袁金铎, 安利国, 等, 2005. 鱼类免疫球蛋白多样性产生机制的研究进展. 水产科学, 24(9): 45–48 |
| 季延滨, 于雯雯, 孙金辉, 等, 2008. 盐度骤降对南美白对虾仔虾抗氧化机能的影响. 天津农学院学报, 15(4): 19–23 |
| 周亚维, 焉婷婷, 李朋富, 等, 2010. 盐度胁迫下盐生隐杆藻抗氧化防御系统的变化. 海洋科学, 34(9): 30–35 |
| 赵峰, 庄平, 章龙珍, 等, 2008. 施氏鲟不同组织抗氧化酶对水体盐度升高的响应. 海洋水产研究, 29(5): 65–69 |
| 胡利华, 闫茂仓, 郑金和, 等, 2011. 盐度对日本鳗鲡生长及非特异性免疫酶活性的影响. 台湾海峡, 30(4): 528–532 |
| 姜景腾, 吴雄飞, 蒋宏雷, 2010. 低氧胁迫对真鲷(♀)与黑鲷(♂)杂交子一代体内酶活力的影响. 宁波大学学报(理工版), 23(4): 10–14 |
| 蒋玫, 黄世林, 伦凤霞, 等, 2010. 微小亚历山大藻对黑鲷仔鱼的抗氧化酶和ATPase的胁迫影响. 海洋通报, 29(4): 427–431 |
| 童燕, 2007. 盐度、pH和捕捞胁迫对施氏鲟(Acipenser schrenckii)生理生化影响的初步研究. 上海: 华东师范大学硕士学位论文 |
| 魏然, 张士璀, 王长法, 等, 2003. 盐度对牙鲆非特异性免疫功能的影响. 海洋科学进展, 21(2): 209–213 |
| Çetin E, Kanbur M, Çetin N, et al, 2011. Hepatoprotective effect of ghrelin on carbon tetrachloride-induced acute liver injury in rats. Regulatory Peptides, 171(1-3): 1–5 DOI:10.1016/j.regpep.2011.05.010 |
| Choi C Y, An K W, An M I, 2008. Molecular characterization and mRNA expression of glutathione peroxidase and glutathione S-transferase during osmotic stress in olive flounder (Paralichthys olivaceus). Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 149(3): 330–337 |
| Cuesta A, Laiz-Carrión R, de lRío M P M, et al, 2005. Salinity influences the humoral immune parameters of gilthead seabream (Sparus aurata L.). Fish & Shellfish Immunology, 18(3): 255–261 |
| Dominguez M, Takemura A, Tsuchiya M, et al, 2004. Impact of different environmental factors on the circulating immunoglobulin levels in the Nile tilapia, Oreochromis niloticus. Aquaculture, 241(1-4): 491–500 DOI:10.1016/j.aquaculture.2004.06.027 |
| Fevolden S E, Røed K H, 1993. Cortisol and immune characteristics in rainbow trout (Oncorhynchus mykiss) selected for high or low tolerance to stress. Journal of Fish Biology, 43(6): 919–930 DOI:10.1111/jfb.1993.43.issue-6 |
| Halliwell B, 2001. Vitamin C and genomic stability. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 475(1-2): 29–35 DOI:10.1016/S0027-5107(01)00072-0 |
| Hirotoshi F, Kiyoshi S, Fumio Y, et al, 1991. Serum immunoglobulin M (IgM) during early development of masu salmon (Oncorhynchus masou). Comparative Biochemistry and Physiology Part A:Physiology, 99(4): 637–643 DOI:10.1016/0300-9629(91)90143-Z |
| Holland M C H, Lambris J D, 2002. The complement system in teleosts. Fish & Shellfish Immunology, 12(5): 399–420 |
| Howell B R, Day O J, Ellis T et al, 1998. Early life stages of farmed fish. In: Black K D, Pickering A D eds. Biology of Farmed Fish. Sheffield: Sheffield Academic Press, 27-66 |
| Iseri S Ö, Şener G, Yüksel M, et al, 2005. Ghrelin against alendronate-induced gastric damage in rats. Journal of Endocrinology, 187(3): 399–406 DOI:10.1677/joe.1.06432 |
| Kheradmand A, Alirezaei M, Birjandi M, 2010. Ghrelin promotes antioxidant enzyme activity and reduces lipid peroxidation in the rat ovary. Regulatory Peptides, 162(1-3): 84–89 DOI:10.1016/j.regpep.2010.02.008 |
| Kojima M, Hosoda H, Date Y, et al, 1999. Ghrelin is a growth-hormone-releasing acylated peptide from stomach. Nature, 402(6762): 656–660 DOI:10.1038/45230 |
| Kunihiko K, Susumu T, 1988. The second immunoglobulin class is commonly present in cartilaginous fish belonging to the order Rajiformes. Molecular Immunology, 25(2): 115–120 DOI:10.1016/0161-5890(88)90058-2 |
| Lepage G, Munoz G, Champagne J, et al, 1991. Preparative steps necessary for the accurate measurement of malondialdehyde by high-performance liquid chromatography. Analytical Biochemistry, 197(2): 277–283 DOI:10.1016/0003-2697(91)90392-7 |
| Liu L, Xu H M, Jiang H, et al, 2010. Ghrelin prevents 1-methyl-4-phenylpyridinium ion-induced cytotoxicity through antioxidation and NF-κB modulation in MES23.5 cells. Experimental Neurology, 222(1): 25–29 DOI:10.1016/j.expneurol.2009.11.009 |
| Livingstone D R, 2001. Contaminant-stimulated reactive oxygen species production and oxidative damage in aquatic organisms. Marine Pollution Bulletin, 42(8): 656–666 DOI:10.1016/S0025-326X(01)00060-1 |
| Lotfi A, Shahryar H A, Ebrahimnezhad Y, et al, 2012. Effect of in ovo ghrelin administration on serum malondialdehyde level in newly-hatched chickens. Asian Pacific Journal of Tropical Biomedicine, 2(1): 47–49 DOI:10.1016/S2221-1691(11)60188-3 |
| Nakao M, Mutsuro J, Nakahara M, et al, 2003. Expansion of genes encoding complement components in bony fish:biological implications of the complement diversity. Developmental & Comparative Immunology, 27(9): 749–762 |
| Obay B D, Taşdemir E, Tümer C, et al, 2008. Dose dependent effects of ghrelin on pentylenetetrazole-induced oxidative stress in a rat seizure model. Peptides, 29(3): 448–455 DOI:10.1016/j.peptides.2007.11.020 |
| Rotllant J, Pavlidis M, Kentouri M, et al, 1997. Non-specific immune responses in the red porgy Pagrus pagrus after crowding stress. Aquaculture, 156(3-4): 279–290 DOI:10.1016/S0044-8486(97)00075-6 |
| Şehirli O, Şener E, Şener G, et al, 2008. Ghrelin improves burn-induced multiple organ injury by depressing neutrophil infiltration and the release of pro-inflammatory cytokines. Peptides, 29(7): 1231–1240 DOI:10.1016/j.peptides.2008.02.012 |
| Suzuki Y, Otaka T, Sato S, et al, 1997. Reproduction related immunoglobulin changes in rainbow trout. Fish Physiology and Biochemistry, 17(1-6): 415–421 |
| Tort L, Balasch J C, MacKenzie S, 2004. Fish health challenge after stress. Indicators of immunocompetence. Contributions to Science, 2(4): 443–454 |
| Yada T, Azuma T, 2002. Hypophysectomy depresses immune functions in rainbow trout. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 131(1): 93–100 |
| Yada T, Azuma T, Takagi Y, et al, 2001. Stimulation of non-specific immune functions in seawater-acclimated rainbow trout, Oncorhynchus mykiss, with reference to the role of growth hormone. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 129(2-3): 695–701 DOI:10.1016/S1096-4959(01)00370-0 |
| Yada T, Nagae M, Moriyama S, et al, 1999. Effects of prolactin and growth hormone on plasma immunoglobulin M levels of hypophysectomized rainbow trout, Oncorhynchus mykiss. General and Comparative Endocrinology, 115(1): 46–52 DOI:10.1006/gcen.1999.7282 |
| Yin F, Peng S M, Sun P, et al, 2011. Effects of low salinity on antioxidant enzymes activities in kidney and muscle of juvenile silver pomfret Pampus argenteus. Acta Ecologica Sinica, 31(1): 55–60 DOI:10.1016/j.chnaes.2010.11.009 |
| Zwirska-Korczala K, Adamczyk-Sowa M, Sowa P, et al, 2007. Role of leptin, ghrelin, angiotensin Ⅱ and orexins in 3T3 L1 preadipocyte cells proliferation and oxidative metabolism. Journal of Physiology and Pharmacology, 58(S1): 53–64 |
 2018, Vol. 49
2018, Vol. 49

