中国海洋湖沼学会主办。
文章信息
- 赵斌, 胡炜, 李成林, 韩莎. 2018.
- ZHAO Bin, HU Wei, LI Cheng-Lin, HAN Sha. 2018.
- 温度和盐度对紫刺参(Apostichopus japonicus Selenta)稚参存活、生长和着色的影响
- EFFECTS OF TEMPERATURE AND SALINITY ON SURVIVAL, GROWTH, AND COLORATION OF JUVENILE APOSTICHOPUS JAPONICUS SELENTA
- 海洋与湖沼, 49(3): 700-706
- Oceanologia et Limnologia Sinica, 49(3): 700-706.
- http://dx.doi.org/10.11693/hyhz20170800211
-
文章历史
- 收稿日期:2017-08-22
- 收修改稿日期:2018-03-05
刺参Apostichopus japonicus Selenta属棘皮动物门Echinodermata、海参纲Holothroidea、是我国北方海域具有重要经济价值的棘皮动物, 已成为北方沿海渔业经济的支柱产业, 而关于刺参新品种、新品系的产业化开发仍进展缓慢(李成林等, 2010)。目前有关刺参选育的目标性状主要为快速生长、耐低盐、耐高温、抗病等生长相关的数量性状(赵欢等, 2014; 于姗姗等, 2015; 侯西坦等, 2016), 针对表观与体色等质量性状的选育一直未有突破性进展。近年来, 挖掘表观独特、性状稳定的新品系已成为水产生物遗传育种领域的重要研究方向之一(和飞, 2016; 李成林等, 2017)。自然界刺参体色可随生长环境的变化而改变, 多呈青色、黄色、褐色, 偶有白色(张春云等, 2004; 纪婷婷, 2009; 张鹏等, 2013), 而通体紫色刺参极为罕见, 极具市场开发潜力。本研究团队于2007年率先对通体纯紫色刺参开展了一系列高强度选育及其生长、发育、营养等相关基础生物学研究工作, 建立了系统的紫刺参选育技术路线与工艺, 紫色性状遗传稳定性达90%以上。
研究发现, 刺参幼体的生长发育除了受苗种质量条件限制外, 还受温度、盐度、溶氧、pH等多种环境因子的影响(陈勇等, 2007; Ji et al, 2008; 胡炜等, 2012), 而温度和盐度是其中影响刺参生长发育的关键环境因子。研究表明, 温度的改变能够明显地影响刺参的生长和代谢(董云伟等, 2009), 而盐度变化能显著影响刺参的呼吸代谢、能量转换和生长等(袁秀堂等, 2006; 薛素燕等, 2009)。目前, 国内外关于环境因子对紫刺参品系影响的相关研究报道尚不多见。因此, 本实验针对选育紫刺参品系, 以普通刺参为对照, 系统分析研究了温度和盐度对刺参稚参期存活、生长及体表颜色转变的影响, 旨在为紫刺参优良品系推广与苗种规模化繁育技术的完善提供科学依据与基础资料。
1 材料与方法 1.1 材料紫刺参稚参来自本课题组选育的紫刺参苗种, 选择30日龄的健康稚参个体用于实验。同时选取课题组繁育的同日龄普通刺参苗种(体色呈青、黄、褐色等)作为对比。实验刺参苗种暂养于山东省海洋生物研究院种质资源研究中心鳌山卫实验室水槽中, 以波纹板作为附着基, 暂养水体盐度31±0.4, pH为8.3±0.2, 水温22±1.5℃。
1.2 方法 1.2.1 分组设计温度实验设置6个温度梯度组(14℃、18℃、22℃、26℃、30℃和34℃), 在64cm×48cm×50cm塑料整理箱中进行, 实验开始前采取逐渐过渡的方式, 将实验刺参的养殖水温调控至各实验组设定值。
盐度实验设置5个盐度梯度组(23, 27, 31, 35, 39), 容器同上, 实验开始前采取逐渐过渡的方式, 以自然暴晒的淡水和海水素将实验刺参的养殖盐度调配至各实验组设定值。
1.2.2 测定方法实验期间每5天随机抽取实验刺参样本测定体长和体重, 同时每天用肉眼观察并记录稚参体色变化情况。测定方法分别如下:
体长测定:采用韩莎等(2016)方法并加以改进, 以0.05mol/L硫酸镁溶液浸泡5min, 待参苗自然伸展后以电子游标卡尺进行测量。
体重测定:取一定数量待测稚参, 放置在滤纸上待水分排干后, 用电子天平进行测量。称重完成后将稚参放回水中统计数量, 测算出平均体重。
稚参体色变化统计:以观察到稚参背部着色为变色开始时间, 以观察到80%个体背部完成变色时为变色完成时间。
1.2.3 数据处理与统计分析刺参体重特定生长率(SGR)采用以下公式计算:
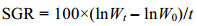
式中, W0为体重初始值(g), Wt为测定值(g), t为实验时间(d)。
数据采用SPSS13.0、Microsoft Office Excel 2013软件进行统计学分析, 先做方差齐性检验, 利用单因素方差分析(one-way ANOVA)比较分析不同处理之间差异显著性。以P<0.05为差异显著。
1.2.4 日常管理每日17:00投喂自制配合饲料1次, 自配饲料主要成分为:海带粉40%, 鼠尾藻干粉30%, 马尾藻干粉10%, 虾糠8%, 螺旋藻5%, 水产酵母3%, 诱食酵母2%, 电解多维与免疫多糖各1%。同时按照饲料与海泥重量之比为1 : 3的比例进行混合投喂, 投喂后停止充气0.5h。每日全量换水, 换水时将整理箱底的排泄物与残饵清除干净。换水后以控温仪维持各处理组设定水温, 波动幅度为<0.5℃/d, 同时测定并调节各处理组海水盐度, 每日波动幅度小于0.4个盐度单位。实验期间光照周期为14L:10D。存活与生长实验持续30d, 期间连续观察刺参体色变化情况。
2 结果与分析 2.1 温度对不同体色刺参存活、生长的影响30d实验期间, 紫刺参和普通刺参稚参的成活率如表 1所示。水温22℃实验组的紫刺参和普通刺参成活率均为最高, 分别为87.0%和87.5%, 两组之间无显著差异。其他水温实验组刺参成活率均低于22℃实验组, 最低为34℃实验组的普通刺参, 成活率为43.6%。在水温18℃和34℃试验组的紫刺参成活率显著高于普通刺参, 分别为85.8%和58.9%。
| 组别 | 成活率(%) | |||||
| 14℃ | 18℃ | 22℃ | 26℃ | 30℃ | 34℃ | |
| 紫刺参 | 69.2 | 85.8 | 87.0 | 84.5 | 69.4 | 58.9 |
| 普通刺参 | 67.3 | 81.2 | 87.5 | 80.6 | 68 | 43.6 |
实验中观察发现, 刺参稚参在水温条件下体态伸展有所差别, 随温度降低刺参身体逐渐收缩, 身体略显僵硬, 在水温14℃时摄食率较低, 残饵较多。在水温30℃、34℃时, 刺参的摄食率随水温升高而降低, 活动能力减弱, 直至脱板死亡。在高水温环境下, 紫刺参的生活状态普遍好于普通刺参。
水温对紫刺参与普通刺参稚参生长的影响如表 2所示。在14℃、18℃、22℃、26℃、30℃、34℃ 6个水温条件下, 紫刺参与普通刺参在实验30d内体长均有增长。水温22℃实验组的紫刺参与普通刺参生长最快, 终末平均体长分别为10.70mm和11.83mm, 且紫刺参体长显著高于普通刺参(P<0.05)。在水温14℃、18℃实验组中, 刺参体长增长随着水温降低显著下降, 30d时紫刺参与普通刺参在14℃水温下平均体长仅为6.34mm和6.41mm, 相同水温下紫刺参与普通刺参的体长在实验30d内无显著差异(P>0.05)。在水温26℃、30℃、34℃实验组中, 刺参体长增长随着水温增长也呈现显著下降趋势, 其中水温34℃实验组的普通刺参体长增长最少, 实验30d内平均体长为4.87mm, 而相同水温组中紫刺参平均体长为6.31mm, 显著高于普通刺参(P<0.05), 水温26℃和30℃实验组的两种刺参体长增长呈现类似的变化规律。
| 组别 | 体长(mm) | ||||||
| 实验天数(d) | 温度(℃) | ||||||
| 14 | 18 | 22 | 26 | 30 | 34 | ||
| 紫刺参 | 5 | 2.45±0.12 | 2.45±0.12 | 2.45±0.12 | 2.45±0.12 | 2.45±0.12 | 2.45±0.12 |
| 10 | 2.80±0.17 | 2.85±0.16 | 3.56±0.14 | 3.21±0.14 | 2.84±0.15 | 2.81±0.18 | |
| 15 | 3.18±0.25 | 3.97±0.23 | 4.79±0.20 | 4.75±0.22 | 4.01±0.28 | 3.17±0.26 | |
| 20 | 4.02±0.33 | 5.86±0.32 | 6.72±0.27 | 6.41±0.32 | 5.75±0.31 | 4.02±0.35 | |
| 25 | 5.16±0.38 | 7.38±0.36 | 8.65±0.34 | 8.66±0.38 | 7.78±0.37* | 5.08±0.42* | |
| 30 | 6.34±0.48 | 9.66±0.47 | 11.83±0.58* | 11.46±0.49* | 10.73±0.52* | 6.31±0.53* | |
| 普通刺参 | 5 | 2.45±0.12 | 2.45±0.12 | 2.45±0.12 | 2.45±0.12 | 2.45±0.12 | 2.45±0.12 |
| 10 | 2.76±0.18 | 2.86±0.16 | 3.18±0.18 | 3.07±0.17 | 2.82±0.19 | 2.59±0.23 | |
| 15 | 3.22±0.23 | 4.08±0.25 | 4.69±0.22 | 4.65±0.25 | 3.77±0.27 | 2.87±0.36 | |
| 20 | 4.03±0.38 | 5.77±0.37 | 6.68±0.32 | 6.23±0.37 | 4.54±0.43 | 3.25±0.57 | |
| 25 | 5.21±0.40 | 7.46±0.33 | 8.25±0.38 | 7.91±0.42 | 6.20±0.44 | 4.16±0.58 | |
| 30 | 6.41±0.54 | 9.89±0.44 | 10.70±0.47 | 10.18±0.43 | 9.32±0.45 | 4.87±0.63 | |
| 注:同一列中“*”表示紫刺参与普通刺参在同一水温条件下的体长存在差异显著(P<0.05) | |||||||
水温对紫刺参与普通刺参稚参体重特定生长率(SGR)的影响如图 1所示。在14℃、18℃、22℃、26℃、30℃、34℃ 6个水温条件下, 紫刺参与普通刺参在实验30d内的SGR随实验水温的升高均呈现先上升后下降的变化趋势, 以水温22℃实验组最高, 紫刺参与普通刺参的SGR分别为6.75%/d和6.45%/d。普通刺参最低SGR出现在34℃水温组, 为4.17%/d, 紫刺参最低SGR出现在14℃水温组, 为4.63%/d。在相同水温条件下, 紫刺参与普通刺参的体重特定生长率无显著差异(P>0.05)。
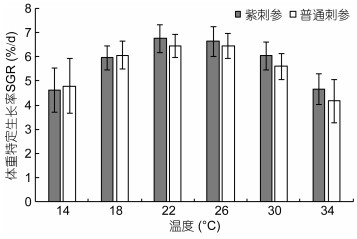 |
| 图 1 温度对紫刺参与普通刺参稚参体重特定生长率的影响 Fig. 1 Effect of different temperature on the SGR of a different juvenile sea cucumber |
在30d实验期间, 紫刺参和普通刺参稚参的成活率如表 3所示。在不同盐度条件下, 各处理组刺参成活率最高为盐度31实验组的普通刺参, 达到87.4%, 紫刺参同样在盐度31实验组的成活率为最高, 达到86.3%。盐度23、27实验组, 2种刺参的成活率均随盐度降低而下降。盐度35、39实验组中, 2种刺参的成活率均随盐度升高而下降, 且紫刺参成活率高于普通刺参, 分别为85.1%和67.4%。
| 组别 | 成活率(%) | ||||
| 23 | 27 | 31 | 35 | 39 | |
| 紫刺参 | 64.5 | 84.1 | 86.3 | 85.1 | 67.4 |
| 普通刺参 | 61.2 | 85.5 | 87.4 | 79.7 | 53.7 |
盐度对紫刺参与普通刺参稚参生长的影响如表 4所示。在盐度23、27、31、35、39的实验组中, 紫刺参与普通刺参在实验30d内体长均有增长。其中盐度31实验组的紫刺参与普通刺参体长增长最大, 分别为12.11mm和11.02mm, 且紫刺参体长显著高于普通刺参(P<0.05)。盐度23、27实验组的刺参体长, 在30d内的增长随着盐度降低显著下降, 紫刺参与普通刺参在盐度23时平均体长仅为7.46mm和6.73mm, 相同水温下紫刺参的体长高于普通刺参, 但无显著差异(P>0.05)。盐度为35、39实验组的刺参体长在30d内的增长随盐度升高而下降, 在盐度39实验组中, 紫刺参平均体长为9.47mm, 显著高于普通刺参(P<0.05)。
| 组别 | 体长(mm) | |||||
| 实验天数(d) | 盐度 | |||||
| 23 | 27 | 31 | 35 | 39 | ||
| 紫刺参 | 5 | 2.48±0.13 | 2.48±0.13 | 2.48±0.13 | 2.48±0.13 | 2.48±0.13 |
| 10 | 3.02±0.17 | 3.74±0.18 | 3.88±0.15 | 3.53±0.16 | 3.03±0.20 | |
| 15 | 3.63±0.26 | 5.39±0.23 | 5.36±0.21 | 5.11±0.18 | 3.85±0.26 | |
| 20 | 4.67±0.34 | 7.25±0.26 | 7.34±0.27 | 6.98±0.32 | 4.68±0.31 | |
| 25 | 5.71±0.39 | 9.19±0.33* | 9.60±0.36* | 9.25±0.40* | 6.94±0.53* | |
| 30 | 7.46±0.53 | 11.35±0.47* | 12.11±0.57* | 11.78±0.56* | 9.47±0.64* | |
| 普通刺参 | 5 | 2.48±0.13 | 2.48±±0.13 | 2.48±±0.13 | 2.48±±0.13 | 2.48±±0.13 |
| 10 | 2.87±0.16 | 3.86±0.17 | 4.07±0.16 | 3.63±0.18 | 2.99±0.17 | |
| 15 | 3.4±0.21 | 5.12±0.22 | 5.43±0.19 | 5.18±0.24 | 3.58±0.26 | |
| 20 | 4.16±0.28 | 6.69±0.31 | 7.06±0.32 | 6.83±0.29 | 4.37±0.30 | |
| 25 | 5.36±0.38 | 8.35±0.36 | 8.67±0.35 | 8.27±0.34 | 5.87±0.43 | |
| 30 | 6.73±0.61 | 10.51±0.46 | 11.02±0.51 | 10.35±0.52 | 7.84±0.64 | |
| 注:同一列中“*”表示紫刺参与普通刺参在同一盐度条件下的体长存在差异显著(P<0.05) | ||||||
盐度对紫刺参与普通刺参稚参体重特定生长率(SGR)的影响如图 2所示。在盐度23、27、31、35、39实验组中, 紫刺参与普通刺参在实验30d内的SGR随实验盐度的升高均呈现先上升后下降的趋势, 在盐度31时分别达到最高值, 紫刺参与普通刺参的SGR分别为6.77%/d和6.53%/d。普通刺参和紫刺参的最低SGR均出现在盐度21时, 分别为4.69%/d和4.46%/d。除盐度39实验组外, 在相同盐度条件下, 紫刺参与普通刺参体重特定生长无显著差异(P>0.05)。在盐度39实验组中, 紫刺参SGR为5.47%/d, 显著高于普通刺参(P<0.05)。
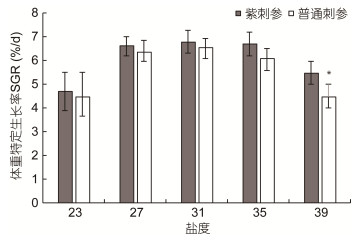 |
| 图 2 盐度对紫刺参与普通刺参稚参体重特定生长率的影响 Fig. 2 Effect of different salinity on SGR of a different juvenile sea cucumber 注:同一盐度条件下“*”表示紫刺参与普通刺参SGR存在差异显著(P<0.05) |
在刺参稚参生长发育过程中, 体色从乳白色逐渐过渡变化到成体颜色, 本实验观察发现, 刺参不同群体的着色时间有明显差异, 在不同环境条件下开始着色到变色完成的时间为7—23d不等, 如表 5所示。紫刺参开始变色的日龄早于普通刺参, 实验中观察到最早开始着色的紫刺参为28日龄。当水温为22℃、盐度为31时, 紫刺参的着色时间为32—48日龄, 随着盐度或水温的改变, 变色时间逐渐从16d延长至22d。
| 温度(℃) | 盐度 | 着色日龄(d) | |
| 紫刺参 | 普通刺参 | ||
| 14 | 31 | 36—58 | 39—55 |
| 18 | 31 | 33—52 | 36—48 |
| 22 | 31 | 32—48 | 35—42 |
| 26 | 31 | 33—49 | 37—45 |
| 30 | 31 | 33—50 | 36—45 |
| 34 | 31 | 35—53 | 36—48 |
| 22 | 23 | 34—52 | 38—49 |
| 22 | 27 | 32—48 | 36—45 |
| 22 | 35 | 33—49 | 35—47 |
| 22 | 39 | 34—54 | 39—56 |
当水温为22℃、盐度为31时, 普通刺参在35—42日龄期间完成变色, 随着盐度或水温的改变, 进入变色的起始日龄出现2—4d的延迟, 同时完成变色的时间也逐渐延长, 随着盐度或水温向偏离适宜范围的方向改变, 变色时间逐渐从8d延长至17d。在水温和盐度较适宜的实验组中, 普通刺参完成变色的时间比紫刺参短, 在盐度35、39实验组中, 两种刺参完成变色的时间差减小, 仅为2—3d。
3 讨论 3.1 水温对不同体色刺参存活、生长的影响温度是影响变温动物生长、生理状况(Dong et al, 2008)以及地理分布(Helmuth et al, 2002)的最重要环境因素之一。刺参作为潮间带物种, 受温度的昼夜变化和季节变化影响较大(Dong et al, 2006), 因此水温是影响到刺参存活与生长的重要环境因子。在本实验中, 不同体色刺参的成活率与生长速度受水温影响均较显著, 其原因是刺参属变温动物, 在适温范围内, 水温的高低直接影响其新陈代谢的强度。当水温18—28℃范围变动时, 刺参稚参生长较快, 本研究结果与胡利华等(2015)的报道一致。
关于刺参不同生长阶段受水温影响的研究, 于东祥等(1999)认为成参适宜温度范围为10—15℃, 超过20℃则进入夏眠状态(刘永宏等, 1996), 水温变化对刺参幼体发育时间也有很大的影响(隋锡林, 1989), 在适宜的温度范围内提高温度, 刺参幼虫生长速度更快, 而极端的温度将阻碍幼虫的生长和发育(Liu et al, 2010)。本实验研究了刺参稚参阶段在不同水温条件下的生长情况, 结果表明水温34℃实验组的紫刺参平均体长增长显著高于普通刺参, 其适温范围比普通刺参更广, 且有偏向适应高温的特性, 相对于白刺参幼体的最适宜温度19℃ (朱厚祥等, 2013), 紫刺参在不同体色刺参中具有更好的高温耐受性。
3.2 盐度对不同体色刺参存活、生长的影响盐度能够通过调节渗透压的方式来影响水生动物的生理功能。刺参等棘皮动物缺乏专门的盐度调节器官, 体内的渗透压会随着环境盐度的变动而迅速改变(Talbot et al, 2002)。研究表明, 刺参的最适生长盐度为28—34, 低盐环境可显著影响刺参生长, 盐度低于22时可造成刺参大量死亡(Kashenko, 1992a, b; 胡炜等, 2012)。本实验盐度梯度设置在刺参的适应范围内, 随着盐度的升高, 不同体色刺参的存活率和生长速度均呈现先上升后下降的变化趋势, 在盐度31实验组达到峰值。
盐度变化会影响刺参受精卵极体排放、卵裂和胚胎发育以及幼体变态的时间(胡利华等, 2015)。Tettelbach等(1981)认为, 温度和盐度是影响海洋动物生长发育的关键因素, 当二者中的一个接近动物的耐受极限时, 二者才显示出明显的联合效应。本实验通过将水温和盐度中的一个因子控制在安全范围内时, 通过单因子实验反应温度和盐度对刺参的影响, 当水温在14—34℃, 盐度在23—39范围时, 稚参成活率有所下降, 而体长和体重仍可保持增长, 活动、摄食和生长并不停止, 说明此条件范围下, 稚参仍可通过摄食、消化吸收等生理作用提供维持生命功能的能量, 当某一因子过低或过高, 达到胁迫范围时, 会逐渐抑制稚参的正常生长。
研究发现, 在青、白、紫刺参等不同色型仿刺参群体中, 紫色刺参的成参在高温和高盐条件下表现出比普通刺参更好的耐受性(Bai et al, 2015), 在本实验中紫色稚参也存在类似现象, 同时本实验进一步发现, 稚参阶段的紫刺参在环境条件最优时与普通刺参生长无显著差异, 而当环境因子偏离正常适宜范围时, 紫刺参稚参较普通刺参适应能力更强。
3.3 水温和盐度对不同体色刺参着色的影响自然界中, 单一物种的种群中经常存在多种表型上具有差异显著的个体, 通常是由基因、环境因素或者发育对策的不同导致(Leimar, 2005)。刺参可根据其背腹不同颜色分为青色、黑色、白色、紫色等多种表型, 其形态差异在稚参体色发生阶段即可区分(Bai et al, 2015)。本实验研究发现, 当温度与盐度条件的设置超出刺参生存适宜范围较大时, 稚参变色时间会显著延长, 普通刺参在35—42日龄期间完成变色, 随着盐度或水温的改变, 进入变色的起始日龄出现2—4d的延迟, 同时完成变色的时间也逐渐延长。紫刺参开始变色的日龄早于普通刺参, 而变色时间较普通刺参长, 其变色过程均从背部开始, 逐渐过渡到腹部, 且颜色、深浅均有个体间的差异。有关紫刺参着色过程中的着色部位、次序、显色过程及其与体长、体重的相关性等规律还有待继续深入研究。
| 于东祥, 宋本祥, 1999. 池塘养殖刺参幼参的成活率变化和生长特点. 中国水产科学, 6(3): 109–110 |
| 于姗姗, 王青林, 董云伟, 2015. 亲本高温驯化和囊胚期热应激对刺参幼体生长、发育影响的初步研究. 南方水产科学, 11(4): 46–52 |
| 朱厚祥, 孔令锋, 李琪, 等, 2013. 盐度、温度和培育密度对白刺参幼虫生长及存活的影响. 中国海洋大学学报, 43(7): 34–39 |
| 刘永宏, 李馥馨, 宋本祥, 等, 1996. 刺参(Apostichopus japonicus Selenka)夏眠习性研究Ⅰ——夏眠生态特点的研究. 中国水产科学, 3(2): 42–49 |
| 纪婷婷, 2009. 刺参(Apostichopus japonicus)对温度变化的生态生理学响应机制. 青岛: 中国海洋大学博士学位论文, 22-23 |
| 李成林, 宋爱环, 胡炜, 等, 2010. 山东省刺参养殖产业现状分析与可持续发展对策. 渔业科学进展, 31(4): 126–133 |
| 李成林, 胡炜, 2017. 我国刺参产业发展状况、趋势与对策建议. 见: 孙吉亭主编. 中国海洋经济. 北京: 社会科学文献出版社, 3-20 |
| 张鹏, 董双林, 2013. 温度对青色系与红色系仿刺参生长和能量分配的影响. 中国海洋大学学报, 43(8): 24–30, 48 |
| 张春云, 王印庚, 荣小军, 等, 2004. 国内外海参自然资源、养殖状况及存在问题. 海洋水产研究, 25(3): 89–97 |
| 陈勇, 高峰, 刘国山, 等, 2007. 温度、盐度和光照周期对刺参生长及行为的影响. 水产学报, 31(5): 687–691 |
| 和飞, 2016. 刺参(Apostichopus japonicus)重要经济性状遗传力估计及高密度遗传连锁图谱的构建. 上海: 上海海洋大学硕士学位论文, 3-4 |
| 赵欢, 刘石林, 杨红生, 等, 2014. 刺参高温定向选育群体子一代耐温性状的分析. 海洋科学, 38(9): 1–6 DOI:10.11759/hykx20121105001 |
| 胡炜, 李成林, 赵斌, 等, 2012. 低盐胁迫对刺参存活、摄食和生长的影响. 渔业科学进展, 33(2): 92–96 |
| 胡利华, 周朝生, 吴洪喜, 等, 2015. 温度和盐度对南移养殖刺参(Apostichopus japonicus)胚胎和幼体发育的影响. 宁波大学学报(理工版), 28(1): 8–14 |
| 侯西坦, 廖梅杰, 李彬, 等, 2016. 刺参4个不同选育品系幼参对低盐胁迫的耐受及生理生化响应. 海洋科学, 40(5): 19–28 DOI:10.11759/hykx20151030001 |
| 袁秀堂, 杨红生, 周毅, 等, 2006. 盐度对刺参(Apostichopus japonicus)呼吸和排泄的影响. 海洋与湖沼, 37(4): 348–354 |
| 隋锡林, 1989. 影响刺参幼体发育与存活率的主要因子. 海洋与湖沼, 20(4): 314–321 |
| 董云伟, 董双林, 2009. 刺参对温度适应的生理生态学研究进展. 中国海洋大学学报, 39(5): 908–912 |
| 韩莎, 胡炜, 李成林, 等, 2016. 硫酸镁对仿刺参幼参麻醉效果的研究. 海洋湖沼通报,(4): 105–110 |
| 薛素燕, 方建光, 毛玉泽, 等, 2009. 高温下不同盐度对刺参幼参和1龄参呼吸排泄的影响. 中国水产科学, 16(6): 975–980 |
| Bai Y C, Zhang L B, Liu S L, et al, 2015. The effect of salinity on the growth, energy budget and physiological performance of green, white and purple color morphs of sea cucumber, Apostichopus japonicus. Aquaculture, 437: 297–303 DOI:10.1016/j.aquaculture.2014.12.020 |
| Dong Y W, Dong S L, 2006. Growth and oxygen consumption of the juvenile sea cucumber Apostichopus japonicus (Selenka) at constant and fluctuating water temperatures. Aquaculture Research, 37(13): 1327–1333 DOI:10.1111/are.2006.37.issue-13 |
| Dong Y W, Dong S L, Ji T T, 2008. Effect of different thermal regimes on growth and physiological performance of the sea cucumber Apostichopus japonicus Selenka. Aquaculture, 275(1-4): 329–334 DOI:10.1016/j.aquaculture.2007.12.006 |
| Helmuth B, Harley C D G, Halpin P M, et al, 2002. Climate change and latitudinal patterns of intertidal thermal stress. Science, 298(5595): 1015–1017 DOI:10.1126/science.1076814 |
| Ji T T, Dong Y W, Dong S L, 2008. Growth and physiological responses in the sea cucumber, Apostichopus japonicus Selenka:Aestivation and temperature. Aquaculture, 283(1-4): 180–187 DOI:10.1016/j.aquaculture.2008.07.006 |
| Kashenko S D, 1992a. Effect of salinity decrease on the development of the sea cucumber Stichopus japonicus. Biol Morya/Mar Biol, 34: 43–52 |
| Kashenko S D, 1992b. Desalination effects on the development of the Japanese Sea Cucumber. Biologiya Morya, 3(4): 43–52 |
| Leimar O, 2005. The evolution of phenotypic polymorphism:randomized strategies versus evolutionary branching. The American Naturalist, 165(6): 669–681 DOI:10.1086/429566 |
| Liu G B, Yang H S, Liu S L, 2010. Effects of rearing temperature and density on growth, survival and development of sea cucumber larvae, Apostichopus japonicus (Selenka). Chinese Journal of Oceanology and Limnology, 28(4): 842–848 DOI:10.1007/s00343-010-9092-4 |
| Talbot T D, Lawrence J M, 2002. The effect of salinity on respiration, excretion, regenerationand production in Ophiophragmus lograneus (Echinodermata:Ophiuroidea). Journal of Experimental Marine Biology and Ecology, 275(1): 1–14 DOI:10.1016/S0022-0981(02)00208-3 |
| Tettelbach S T, Rhodes E W, 1981. Combined effects of temperature and salinity on embryos and larvae of the northern bay scallop Argopecten irradians irradians. Marine Biology, 63(3): 249–256 DOI:10.1007/BF00395994 |
 2018, Vol. 49
2018, Vol. 49


