中国海洋湖沼学会主办。
文章信息
- 谭婷婷, 刘春颖, 刘涛, 许高宾, 张磊, 邓雪, 陆小兰. 2018.
- TAN Ting-Ting, LIU Chun-Ying, LIU Tao, XU Gao-Bin, ZHANG Lei, DENG Xue, LU Xiao-Lan. 2018.
- 环境因子对浒苔生长及生源硫释放的影响
- INFLUENCE OF ENVIRONMENTAL FACTORS ON GROWTH OF ULVA PROLIFERA AND ITS BIOGENIC SULFUR RELEASE
- 海洋与湖沼, 49(4): 793-801
- Oceanologia et Limnologia Sinica, 49(4): 793-801.
- http://dx.doi.org/10.11693/hyhz20171200314
-
文章历史
- 收稿日期:2017-12-14
- 收修改稿日期:2018-05-12
2. 中国海洋大学生命学院 青岛 266071;
3. 青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室 青岛 266071
2. College of Marine Life Sciences, Ocean University of China, Qingdao 266071, China;
3. Laboratory for Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China
绿潮是海洋中大型绿藻大规模繁殖导致其在潮间带和浅海区生物量大量积累而形成的一种异常的生态现象(Charlier et al, 2007)。近年来, 中国黄海海域所暴发的绿潮被认为是世界上规模最大的藻华现象, 而浒苔则被确认为绿潮中具有明显优势的藻种(汪文俊等, 2008; Liu et al, 2010; Ye et al, 2011)。浒苔对光强、温度和盐度等环境因素具有非常强的适应能力(Luo et al, 2011), 使其在富营养化的水体中能够出现暴发性增长。一定范围内, 温度增加能提高藻内酶活性, 促进光合作用, 从而促进浒苔增长及生长状态的变化。海水中盐度的变化使得藻类细胞外部压力改变, 细胞内溶液浓度发生改变, 进一步影响到浒苔的新陈代谢等过程。而营养盐是影响海水中植物生长的重要因素, 充足的营养盐有利于藻类生长, 其中, NO3–-N和NH4+-N是影响浒苔生长的最主要氮源(田千桃等, 2010)。
二甲基硫(DMS)是海水中占有明显优势地位、含量最为丰富的挥发性生源有机硫化物, 同时也是海洋向大气中排放的最为重要的硫化物(杨桂朋等, 2004; Lana et al, 2011)。海洋所排放的DMS作为大气中硫化物的主要来源, 其在大气中可以被迅速氧化并最终形成硫酸盐气溶胶。因此, DMS在海洋硫循环及全球气候变化中发挥着不可忽视的作用。DMS的前体物质β-二甲基巯基丙酸内盐(DMSP)主要存在于海洋浮游植物体内, 是藻类一种主要的硫代谢产物, 在藻类细胞中可以起到调节渗透压的作用(Karsten et al, 1996; Sunda et al, 2002)。DMSP在裂解酶作用下释放DMS并生成丙烯酸(AA)。浒苔作为海洋中的大型绿藻类, 可以从海水中吸收硫酸盐, 在藻体内通过同化作用生成大量的DMSP (Steinke et al, 1996; Van Alstyne et al, 2001), 从而影响海水中的硫循环, 而这一过程受到营养盐等环境因子的限制(Sunda et al, 2007; Spielmeyer et al, 2012)。
近年来, 绿潮在世界范围内发生的频率和规模越来越大, 而其对海洋硫循环的影响尚未有深入研究。本研究通过对浒苔进行实验室模拟培养, 探讨在不同温度、盐度和营养盐条件下浒苔生长和海水中有机硫代谢产物的变化, 从而了解绿潮暴发过程中生源硫的迁移转化和对海洋生态系统的影响。
1 材料与方法 1.1 材料与仪器2015年3月, 于江苏省如东市近海的紫菜棚架上采集附着在棚架和绳梗上的绿藻, 经生物鉴定确定为浒苔。从中挑选生理状态较好的浒苔, 实验前将其置于经过0.22μm醋酸纤维滤膜过滤后的自然海水中黑暗条件下饥饿培养3天。
培养所用海水取自于青岛近海崂山海域。用0.45μm醋酸纤维滤膜过滤去除颗粒物, 随后用酸泡洗净后的5L锥形瓶为容器用高压灭菌锅(LDZX-50KBS, 上海申安医疗器械厂)高压灭菌20min (0.15MPa), 待冷却后充分摇动来恢复溶解气体含量, 调节pH为8.10±0.05待用。
用分析天平(Mettller Toledo, 瑞士)准确称取NaNO3(分析纯, 上海国药化学试剂公司)和NH4Cl(分析纯, 上海国药化学试剂公司), 配制浓度均为0.16mol/L的母液备用。
1.2 实验设计 1.2.1 不同温盐条件下的培养首先, 根据f/2配方(Guillard et al, 1962)添加营养盐, 配制成培养液, 根据文献报道的可能影响浒苔生长的温盐范围(姚雪, 2011), 设置4种不同的温盐条件:第Ⅰ组温度T=20℃, 盐度S=25;第Ⅱ组T=20℃, S=30;第Ⅲ组T=20℃, S=35;第Ⅳ组T=25℃, S=30。每组条件设立三组平行样, 每组培养体积为4L, 初始生物量密度为1.0g/L。培养条件:培养温度参照方案设计, 光暗比为12h:12h, 光照强度为8000lx。取样采集:每隔5天取一次样, 5天为一个周期连续培养5个周期, 培养期间不换水。
1.2.2 不同氮源下的培养根据文献报道, 与浒苔生长关系密切的无机氮是NO3–-N和NO4+-N(王婷等, 2011), 故进行了添加NO3–-N和NO4+-N的培养实验。两组添加浓度梯度均为0(对照)、5、10、20、40和200μmol/L。每个梯度浓度设立4组平行样, 每组培养体积为3L, 初始生物量密度为0.4g/L。培养条件:培养室中的培养温度为(20±0.5)℃, 光暗比为12h:12h, 光照强度为8000lx。取样采集:每隔5天取一次样并重新换水添加NO3–-N和NO4+-N, 5天为一个周期连续培养6个周期。
1.3 样品的采集与测定浒苔的湿重:将浒苔用200目的滤网进行过滤, 再用吸水纸吸干藻体上的水后, 使用分析天平进行称重, 并记录培养过程中浒苔湿重变化。
DMS样品的采集与测定:用移液枪分别取2mL海水样品至两个干燥的10mL血清瓶中并迅速加盖密封, 取样完毕后立即进行测定。用高纯氮气(≥99.999%, 青岛豪森新能源有限公司)将血清瓶内海水中的DMS以20mL/min流速吹出, 富集于浸泡在液氮冷阱中的捕集管中。3.5min后用热水进行加热解析, 释放的DMS随载气进入气相色谱仪(GC-6850, 美国安捷伦公司), 经过火焰光度检测器检测记录峰面积, 最后利用工作曲线计算样品中DMS浓度, 检测限为0.4nmol/L。
DMSP样品的采集与测定:移液枪移取4mL海水样品于4mL离心管中, 添加40μL 50%的浓硫酸进行酸化后, 密封冷藏保存, 实验结束后进行测定。加入200μL浓度为10mol/L的KOH浓溶液, 在密封冷藏条件下碱解24小时, 将DMSP转化为等摩尔量的DMS然后进行测定(Yang et al, 2008)。
AA样品的采集与测定:从培养液中取4mL海水样品于4mL离心管中, 4℃下避光保存, 培养结束后统一测定。将待测海水样品使用0.2μm Whatman玻璃纤维重力滤器过滤(除去海水样品中颗粒物的同时防止细胞在过滤的过程中破裂)后, 使用高效液相色谱仪(L-2000, 日本日立)进行测定, 检出限为4nmol/L(刘春颖等, 2013)。
1.4 浒苔平均生长速率的计算浒苔在生长阶段其重量的增加并不是恒定的, 本文使用公式(1)计算其一个培养周期的平均生长速率(李瑞香等, 2009):
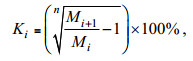 (1)
(1)式中, Ki表示第i个周期内的平均生长速率, Mi+1表示第i+1次测量的浒苔的湿重, Mi表示第i次浒苔的湿重, n表示一个周期的天数。
1.5 数据分析使用Origin7.5软件进行作图分析, 用SPSS16.0进行显著性讨论分析。
2 结果与分析 2.1 不同温盐条件下浒苔生长及DMSP和DMS的释放 2.1.1 浒苔的生长变化不同温度和盐度条件下浒苔在各阶段的湿重变化和相对平均增长率如图 1所示。培养周期内4组浒苔均表现出不断增长的趋势, 且前期的相对平均增长率明显高于后期, 增长速度较快, 而在后期增长较为缓慢。从图 1a中可以看出, 在前15天, 浒苔的生长较快, 后期增长速度较慢; 且在盐度为30, 温度为25℃下的浒苔湿重增加较快, 在第五天时达到了6.52g, 比前三组的5.91、5.22和6.13g分别高了10.3%、24.9%和6.4%。将第Ⅳ组与前三组浒苔湿重做单因素方差分析(P=0.002, P=0.008, P=0.001, one-way ANOVA), 表明第Ⅳ组与前三组浒苔湿重存在显著性差异。此外, 其在前5天相对平均增长率达到最大值7.13%, 在后期该条件下浒苔的增长速率则低于其他组。此外, 本实验室在浒苔的营养盐动力学探究实验中发现, 浒苔对NO3–-N和PO43–-P的吸收速率和时间呈现出幂函数的关系, 这与王阳阳等(2011)的研究结果一致。在NO3–-N的初始浓度为200mol/L, PO43–-P的初始浓度为20mol/L时, 浒苔对NO3–-N和PO43–-P的吸收速率最高可达22.79和1.72μmol/(g·h), 因此在培养后期营养盐不足可能是浒苔生长速率降低的主要因素。由图 1b可知, 在前5天, 四组的相对平均增长率均高于5%, 而在第20-25天, 平均增长率降到1%以下。第Ⅰ、Ⅱ、Ⅲ组浒苔的增长趋势较为一致, 均呈现出前期增长速度快后期慢的特点, 平均增长率分别为2.77%、2.74%和2.65%, 这说明在研究的温度和盐度范围内, 增加温度可以一定程度促进浒苔的生长, 而盐度变化对浒苔生长的影响较小。
 |
| 图 1 在不同温盐条件下浒苔的湿重变化(a)和相对平均增长率(b) Fig. 1 Variation in wet weight (a) and average growth rates (b) of Ulva prolifera under a different temperature-salinity condition |
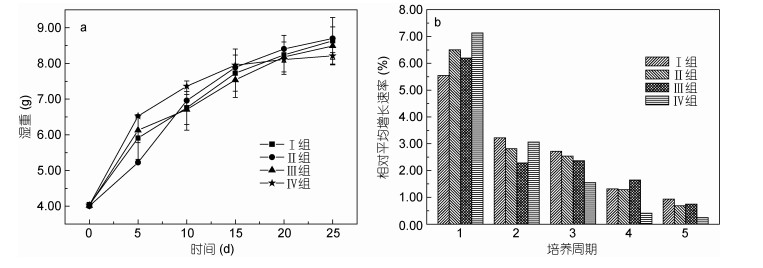
四种条件下培养周期内培养液中DMS和DMSP及相关比值变化范围与平均值如表 1所示。在整个培养周期内DMS的变化如图 2a所示。整体而言, DMS在初始阶段有一个低值, 第Ⅰ、Ⅲ、Ⅳ组DMS浓度变化趋势一致, 表现出先增大后减少的变化趋势, 并在第10-15天释放达到最大值。第Ⅲ组在第15天出现一个明显的DMS高值(33.58nmol/L), 而第Ⅱ组则表现出持续增加的趋势且在第25天时达到40.11nmol/L的高值。总体上来讲, 在S=30, T=20℃下DMS的释放达到最大; 而在低温低盐即S=25, T=20℃时DMS浓度明显低于其他三组, 说明低温低盐不利于浒苔对DMS的产生和释放。
 |
| 图 2 在不同温盐条件下浒苔释放DMS (a)和DMSP (b)的变化趋势 Fig. 2 Changes in the concentrations of DMS (a) and DMSP (b) releases from Ulva prolifera under different temperature-salinity conditions |
| 实验组 | 温度(℃) | 盐度 | DMS (nmol/L) | DMSP (nmol/L) | DMS/DMSP (%) | AA/(AA+DMSP) (%) |
| Ⅰ | 20 | 25 | 7.32-22.41 (13.47) | 123.56-404.97 (287.71) | 2.7-6.6 (4.7) | 16.5-45.0 (29.1) |
| Ⅱ | 20 | 30 | 6.23-40.11 (22.18) | 162.21-365.73 (295.43) | 3.2-8.3 (6.1) | 9.8-46.0 (29.4) |
| Ⅲ | 20 | 35 | 7.63-33.58 (19.51) | 134.52-454.05 (364.85) | 2.7-8.2 (5.3) | 11.3-40.0 (27.9) |
| Ⅳ | 25 | 30 | 8.01-27.07 (17.33) | 156.24-410.25 (311.14) | 4.3-7.4 (5.6) | 14.1-52.0 (36.4) |
| 注: DMS:二甲基硫; DMSP: β-二甲基巯基丙酸内酯; AA:丙烯酸 | ||||||
培养过程中各组DMSP的变化如图 2b所示, 培养过程中DMSP的浓度较初始值有明显的提高。与其他三组相比, DMSP的浓度在盐度最高(S=35)时最大且一直维持在一个较高的水平。这一结果与Van Alstyne等(2005)的研究结果一致。他们使用不同盐度的人工海水对大型绿藻石莼培养并对DMSP产量进行测定。培养4周以后, 石莼内DMSP含量最高值出现在盐度最高的一组中, 比标准人工海水培养的高了23%。而在本研究中, 盐度为35时的DMSP浓度比盐度为30的高6%-60%, 这可能是由于随着海水中盐度的升高, 藻体细胞外部所受压力增大, 促使藻细胞吸收海水中硫酸盐经同化还原作用合成更多的DMSP以调节维持细胞内的渗透压(Yoch et al, 1997; Stefels, 2000)。在盐度均为30时, DMSP释放量在25℃时较高, 表明温度适当升高有利于DMSP的合成。
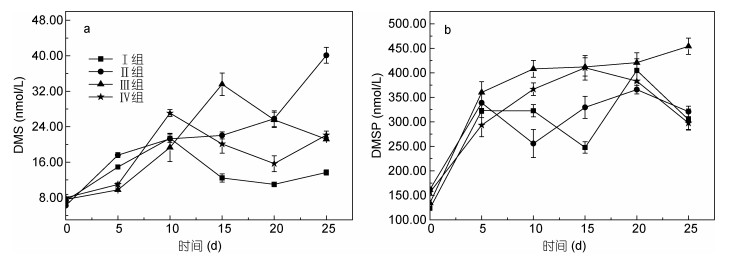
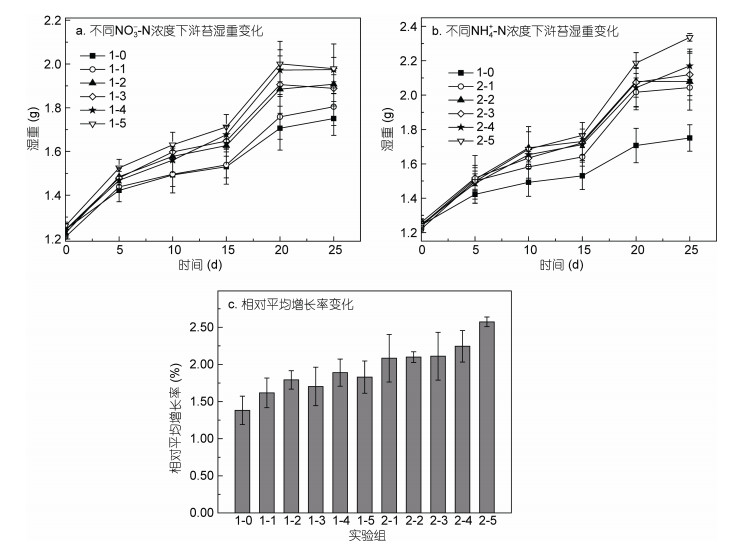
2.2 不同形态的无机氮对浒苔生长和硫代谢产物的影响 2.2.1 浒苔的生长变化已有研究表明, 一般大型藻类对氮的吸收速率要高于磷的吸收速率, 其中, 浒苔对氮有很高的需求, 氮对浒苔的生长限制作用也比磷高(李瑞香等, 2009), 与浒苔生长密切相关的无机氮主要是NH4+-N和NO3–-N。因每个周期初期都更换海水并添加相应浓度的无机氮, 因此培养液中磷及其他营养盐浓度均接近正常海水浓度, 影响实验组之间浒苔生长及硫释放的变量为无机氮的添加浓度。海水中PO43–-P、NO3–-N、NH4+-N和NO2–-N初始浓度分别为0.09、4.74、8.75和0.25μmol/L; 添加不同浓度的NH4+-N和NO3–-N后浒苔的湿重变化及平均增长率如图 3所示, 整个培养周期中DMS和DMSP变化如表 2所示。以NaNO3为外加氮源时, 在前20天, 浒苔的湿重随着时间增长而增加, 且在第1个和第4个周期的增长速度较快。而在第20-25天, 浒苔的湿重趋于平稳甚至是出现负增长, 这说明浒苔进入衰亡期。以NH4Cl为外加氮源时, 5组实验组也表现出相同的增长趋势。总体而言, 浒苔的湿重随着添加NO3–-N或NH4+-N浓度的升高而增加, 且生长状况都优于空白组。在整个培养阶段, 浒苔湿重增加了40.8%-88.3%, 实验组浒苔的平均增长速率均大于1.5%, 而对照组的平均增长速率只有1.4%。此外, 添加NH4+-N的浒苔其平均增长速率要明显高于添加同浓度的NO3–-N的浒苔, 这表明NH4+状态的无机氮更容易被浒苔吸收利用并促进其自身生长。对于大型藻类而言, 其对NH4+-N的吸收速率大于对NO3–-N的吸收速率, 这主要是由于藻体可以直接吸收NH4+-N来加以利用(Dortch, 1990; 李靖等, 2012)。
 |
| 图 3 浒苔在两种氮源下的湿重变化和平均增长率 Fig. 3 Changes in wet weight and average growth rate of Ulva prolifera cultured in the two nitrogen sources a: NO3–-N; b: NH4+-N; c: the relative changes of all groups注: 1-0:对照(无外加氮源); 1-1: NO3–-N (5μmol/L); 1-2: NO3–-N (10μmol/L); 1-3: NO3–-N (20μmol/L); 1-4: NO3–-N (40μmol/L); 1-5: NO3–-N (200μmol/L); 2-1: NH4+-N (5μmol/L); 2-2: NH4+-N (10μmol/L); 2-3: NH4+-N (20μmol/L); 2-4: NH4+-N (40μmol/L); 2-5: NH4+-N (200μmol/L)图c为浒苔5个培养周期相对平均增长率的平均值, 代表浒苔整个培养周期平均每天的相对增长率 |
| 实验组 | 添加NO3–-N (μmol/L) | 添加NH4+ (μmol/L) |
实测NO3–-N (μmol/L) | 实测NH4+ (μmol/L) |
DMS (nmol/L) |
DMSP (nmol/L) |
| 1-0 | 0 | 0 | 2.537 | 14.608 | 4.83-8.49 (6.76) |
190.97-462.59 (303.10) |
| 1-1 | 5 | 0 | 9.589 | 15.469 | 6.00-12.85 (8.73) |
211.72 -436.25 (339.47) |
| 1-2 | 10 | 0 | 18.869 | 15.274 | 5.33-11.86 (8.76) |
221.54-527.85 (407.35) |
| 1-3 | 20 | 0 | 27.558 | 21.147 | 6.16-13.09 (8.86) | 193.91-550.68 (411.39) |
| 1-4 | 40 | 0 | 37.832 | 10.176 | 5.50-15.01 (11.57) |
195.73-437.17 (329.98) |
| 1-5 | 200 | 0 | 241.263 | 17.807 | 6.46-14.90 (10.14) |
194.95-494.95 (407.18) |
| 2-1 | 0 | 5 | 4.843 | 17.938 | 7.71-16.09 (11.05) |
220.63-462.59 (409.35) |
| 2-2 | 0 | 10 | 5.577 | 27.151 | 5.64-13.88 (9.09) |
212.96-490.43 (375.89) |
| 2-3 | 0 | 20 | 7.052 | 29.529 | 5.72-13.05 (8.04) |
215.40-455.86 (391.52) |
| 2-4 | 0 | 40 | 8.963 | 48.703 | 4.98-13.54(8.54) | 191.21-530.38 (349.26) |
| 2-5 | 0 | 200 | 1.699 | 115.069 | 5.67-14.60 (9.69) |
210.82-421.64 (323.46) |
添加不同浓度氮源后培养液中DMS和DMSP的平均浓度如图 4所示(平均浓度:每组培养至第5天每个周期DMS和DMSP增加的平均浓度)。以NO3–-N和NH4+-N为添加氮源时, DMS的浓度分别为8.73-11.38nmol/L和8.04-11.05nmol/L。添加氮源后DMS的平均浓度均高于无添加对照组的6.76nmol/L。添加NO3–-N后, DMS平均浓度随着添加浓度的升高而增大。而添加NH4+-N的浒苔培养中则随添加浓度的升高呈现出先减小后增加的趋势。DMSP随添加浓度的变化不明显但一直维持在一个较高的水平, 浓度在300-500nmol/L, 这表明浒苔在生长过程中会合成并释放大量的DMSP。添加氮盐各实验组中DMS和DMSP的浓度均高于对照组。添加NO3–-N实验组中DMS和DMSP的最高含量分别超出空白组68.3%和34.9%, 而添加NH4+-N组DMS和DMSP的最高含量分别超出空白组63.5%和34.2%, 这说明氮盐对浒苔生长过程中合成释放DMSP和DMS具有明显的促进作用。
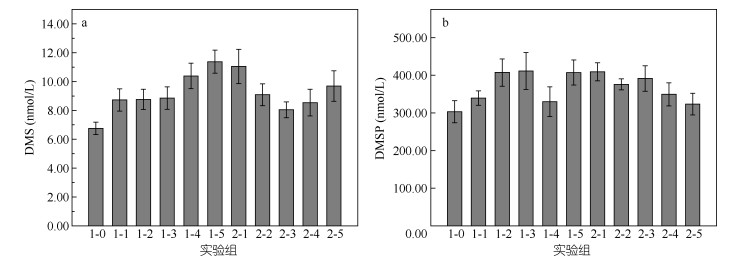 |
| 图 4 不同氮源条件下DMS (a)和DMSP (b)的平均浓度 Fig. 4 Average concentrations of DMS (a) and DMSP (b) in different nitrogen forms and concentrations of all groups |
在海水中, DMS的前体物质DMSP是藻类活动的代谢产物, 已有研究表明, 约有95%的DMS来源于海洋中的浮游植物(Charlson et al, 1987)。浒苔作为DMSP和DMS的高产藻种, 其在海水中大规模的暴发、生长等过程势必会引起海水中DMSP和DMS的增加和积累。而高浓度的DMS会通过海气交换等途径释放到大气中, 进一步氧化对环境造成重要的影响。Nguyen等(1992)提出DMS的氧化产物SO2对酸雨酸度的贡献可达40%, 是其主要的物质来源。Zhang等(2008)于2006年未有浒苔暴发前测得黄海海域表层海水中DMS和DMSP的平均浓度只有5.42和26.72nmol/L。而在本研究中, 浒苔初始生物量密度仅为1.0g/L时, 培养液中的DMS含量就达到20nmol/L左右, DMSP的浓度更是高于正常海水的数十倍。因此, 对绿潮期间海水中生源硫的研究具有重要意义。在培养实验中, 浒苔的生物密度会随实验推进而逐步增加, 而生理状态会逐渐变差, 造成生长率下降。研究表明, 藻类在衰亡期会向水体中释放更多的DMSP, 并进一步分解释放DMS(杨桂朋等, 2004)。随着培养过程中生物密度的增加, 水体中的DMSP浓度升高。实验结果表明单位生物量对应的DMSP量在培养初期明显增加, 第Ⅲ组即盐度最高的一组DMSP由最初的33.46nmol/(g·h)增加至第15天的60.81nmol/(g·h), 而在后期这一数值趋于稳定状态。水温的变化可以改变生物的生理状态和生物量, 从而影响其向海水中释放DMSP的量。海水温度的升高会促进浒苔的生长和DMSP裂解酶活性的增加, 进而促进DMS的生成。由于浒苔是一种广温广盐的大型藻类, 盐度变化对其生长的影响并不明显。但盐度增加会促使藻细胞合成更多的DMSP来维持渗透压。此外, 由于培养前5天浒苔生长较快, 生物量增加迅速, 水体中硫酸盐被快速吸收同化并在藻体内合成DMSP, 水体中DMSP含量在前5天有大幅度的提升, 而DMS作为DMSP的分解产物, 表现出一定的滞后性。田千桃等(2010)通过实验研究发现, 当NH4+-N浓度大于1μmol/L时, 浒苔对NO3–-N的吸收接近为零。且随着培养液中NH4+-N和NO3–-N浓度的增加, 浒苔依然优先吸收NH4+-N。该结果与本研究中浒苔在以NH4+-N为营养物质的培养液中生长较快相吻合。这主要是因为NO3–-N的吸收过程比NH4+-N的吸收需要更多的能量(Flynn, 1991)。
基于DMSP的两种主要降解途径--酶裂解和去甲基化过程, 只有前者会释放等摩尔量的DMS, 故DMS/DMSP可以间接地反映出培养液中DMSP降解生成DMS的能力, 该比值可以粗略地估算实验过程中DMSP以酶裂解途径降解所占的比例。培养过程中, Ⅰ-Ⅳ组DMS/DMSP值均在10%以内, 说明只有一小部分的DMSP通过酶裂解作用分解生成DMS。已有研究表明, DMS只是DMSP降解生成的一个副产物, 通常只占5%-10%, 而75%左右的DMSP通过去甲基化作用生成AA和甲硫醇(Ledyard et al, 1996; Van Duyl et al, 1998; Kiene et al, 2000)。本文中DMS/DMSP值在5%左右, 与该研究结果一致。由于DMSP的两种主要降解途径都会生成AA, 故百分比AA/(AA+DMSP)可以间接地反映出藻液中DMSP降解生成DMS和AA的能力, 该比值可以粗略地估算实验过程中DMSP的表观降解的百分数。Ⅰ-Ⅳ组AA/(AA+DMSP)的变化范围分别为16.5%-45.0%、9.8%-46.0%、11.3%-40.0%和14.1%-52.0%, 平均值分别为29.1%、29.4%、27.9%和36.4%。该比值在25℃时该比值明显高于20℃下培养的3组, 这说明温度升高可以促进DMSP的降解。总体上, 4个条件下DMSP的表观降解比例均低于40%。
以NO3–-N和NH4+-N为添加氮源时, 在培养周期内海水中DMS/DMSP比值变化范围分别为2.2%- 3.1%和2.1%-3.0%, 平均值分别为为2.6%和2.5%, 两组外加氮源的培养液中DMS/DMSP比值均高于2%, 而未添加任何氮源的对照组只有1.7%。这说明仍然只有一小部分DMSP通过酶裂解释放DMS, 且添加无机氮会促进DMSP的降解。Webb等(2015)在微藻赫氏圆石藻培养过程中测得该值在培养前20天低于2%, 而之后高值可达到6%, 平均值在4%左右, 该值略高于本实验的结果值, 这主要是藻体之间的差异造成的。表观降解比AA/(AA+DMSP)分别为16.4%-29.3%和14.5%-33.0%, 均大于对照组的11.2%。两种氮源添加方式下DMSP的表观降解能力相近, 且随着添加浓度的增大而增大, 但DMSP的表观降解比例不超过40%。
4 结论(1) 浒苔对温度和盐度具有较强的适应能力, 在温度为20-25℃、盐度为25-35的范围内, 表现出基本一致的生长趋势。
(2) 在实验条件下, 培养体系中盐度的升高会促使浒苔吸收硫酸盐同化生成并释放更多的DMSP; 培养体系释放DMS量在S=30, T=20℃时达到最大值, 而在S=25, T=20℃时出现最小值。
(3) 添加NH4+-N的浒苔的平均增长速率大于添加同浓度的NO3–-N的浒苔, 即NH4+-N更容易被浒苔吸收利用, 对浒苔的生长影响更为明显。对于两种形态无机氮, 随着添加无机氮浓度的增加, DMS的释放量增加, 而DMSP一直维持在一个较高的水平。
(4) 两组实验中DMS/DMSP的值在10%以内变化, 表明酶裂解途径只占DMSP降解的一小部分。总体上, 代表DMSP表观降解比的AA/(AA+DMSP)的值低于40%。
| 王婷, 石晓勇, 张传松, 等, 2011. 2008年黄海浒苔绿潮暴发区营养盐浓度变化及分布特征. 海洋通报, 30(5): 578–582 |
| 王阳阳, 霍元子, 田千桃, 等, 2011. 浒苔对NO3--N和PO4-P吸收动力学特征. 上海海洋大学学报, 20(1): 121–125 |
| 田千桃, 霍元子, 王阳阳, 等, 2010. 浒苔对NH4+-N与NO3--N吸收的相互作用. 海洋科学, 34(7): 41–45 |
| 刘春颖, 王莉莉, 杨桂朋, 等, 2013. 海水中丙烯酸的高效液相色谱法建立及应用. 海洋学报, 35(1): 172–176 |
| 李靖, 李宁云, 敖新宇, 等, 2012. 剑湖湿地水生植物金鱼藻与茭草对环境氮素的响应. 贵州农业科学, 40(4): 143–145 |
| 李瑞香, 吴晓文, 韦钦胜, 等, 2009. 不同营养盐条件下浒苔的生长. 海洋科学进展, 27(2): 211–216 |
| 杨桂朋, 景伟文, 陆小兰, 2004. 海洋中DMSP的研究进展. 中国海洋大学学报(自然科学版), 34(5): 854–860 |
| 汪文俊, 王飞久, 陈松林, 等, 2008. 浒苔ITS区的扩增和分析. 海洋水产研究, 29(5): 124–129 |
| 姚雪, 2011. 浒苔种群世代研究与大型海洋藻类基因序列分析. 青岛: 中国海洋大学硕士学位论文 |
| Charlier R H, Morand P, Finkl C W, et al, 2007. Green tides on the Brittany coasts. Environmental Research, Engineering and Management, 3(41): 52–59 |
| Charlson R J, Lovelock J E, Andreae M O, et al, 1987. Oceanic phytoplankton, atmospheric sulphur, cloud albedo and climate. Nature, 326(6114): 655–661 DOI:10.1038/326655a0 |
| Dortch Q, 1990. The interaction between ammonium and nitrate uptake in phytoplankton. Marine Ecology Progress Series, 61: 183–201 DOI:10.3354/meps061183 |
| Flynn K J, 1991. Algal carbon-nitrogen metabolism:a biochemical basis for modelling the interactions between nitrate and ammonium uptake. Journal of Plankton Research, 13(2): 373–387 DOI:10.1093/plankt/13.2.373 |
| Guillard R R L, Ryther J H, 1962. Studies of marine planktonic diatoms:Ⅰ. Cyclotella nana hustedt, and detonula confervacea (cleve) gran. Canadian Journal of Microbiology, 8(2): 229–239 DOI:10.1139/m62-029 |
| Karsten U, Kück K, Vogt C et al, 1996. Dimethylsulfoniopropionate production in phototrophic organisms and its physiological functions as a cryoprotectant. In: Kiene R P, Visscher P T, Keller M D et al eds. Biological and Environmental Chemistry of DMSP and Related Sulfonium Compounds. Boston, MA: Springer, 143-153 |
| Kiene R P, Linn L J, 2000. Distribution and turnover of dissolved DMSP and its relationship with bacterial production and dimethylsulfide in the Gulf of Mexico. Limnology and Oceanography, 45(4): 849–861 DOI:10.4319/lo.2000.45.4.0849 |
| Lana A, Bell T G, Simó R, et al, 2011. An updated climatology of surface dimethlysulfide concentrations and emission fluxes in the global ocean. Global Biogeochemical Cycles, 25(1): GB1004 |
| Ledyard K M, Dacey J W H, 1996. Microbial cycling of DMSP and DMS in coastal and oligotrophic seawater. Limnology and Oceanography, 41(1): 33–40 DOI:10.4319/lo.1996.41.1.0033 |
| Liu D Y, Keesing J K, Dong Z J, et al, 2010. Recurrence of the world's largest green-tide in 2009 in Yellow Sea, China:Porphyra yezoensis aquaculture rafts confirmed as nursery for macroalgal blooms. Marine Pollution Bulletin, 60(9): 1423–1432 DOI:10.1016/j.marpolbul.2010.05.015 |
| Luo M B, Liu F, 2011. Salinity-induced oxidative stress and regulation of antioxidant defense system in the marine macroalga Ulva prolifera. Journal of Experimental Marine Biology and Ecology, 409(1-2): 223–228 DOI:10.1016/j.jembe.2011.08.023 |
| Nguyen B C, Mihalopoulos N, Putaud J P, et al, 1992. Covariations in oceanic dimethyl sulfide, its oxidation products and rain acidity at Amsterdam Island in the Southern Indian Ocean. Journal of Atmospheric Chemistry, 15(1): 39–53 DOI:10.1007/BF00053608 |
| Spielmeyer A, Pohnert G, 2012. Daytime, growth phase and nitrate availability dependent variations of dimethylsulfoniopropionate in batch cultures of the diatom Skeletone mamarinoi. Journal of Experimental Marine Biology and Ecology, 413: 121–130 DOI:10.1016/j.jembe.2011.12.004 |
| Stefels J, 2000. Physiological aspects of the production and conversion of DMSP in marine algae and higher plants. Journal of Sea Research, 43(3-4): 183–197 DOI:10.1016/S1385-1101(00)00030-7 |
| Steinke M, Kirst G O, 1996. Enzymatic cleavage of dimethylsulfoniopropionate (DMSP) in cell-free extracts of the marine macroalga Enteromorpha clathrata (Roth) Grev. (Ulvales, Chlorophyta). Journal of Experimental Marine Biology and Ecology, 201(1-2): 73–85 DOI:10.1016/0022-0981(95)00207-3 |
| Sunda W G, Hardison R, Kiene R P, et al, 2007. The effect of nitrogen limitation on cellular DMSP and DMS release in marine phytoplankton:climate feedback implications. Aquatic Sciences, 69(3): 341–351 DOI:10.1007/s00027-007-0887-0 |
| Sunda W, Kieber D J, Kiene R P, et al, 2002. An antioxidant function for DMSP and DMS in marine algae. Nature, 418(6895): 317–320 DOI:10.1038/nature00851 |
| Van Alstyne K L, Pelletreau K N, Rosario K, 2005. The effects of salinity on dimethylsulfoniopropionate production in the green alga ulva fenestrata Postels et Ruprecht (Chlorophyta). Botanica Marina, 46(4): 350–356 |
| Van Alstyne K L, Wolfe G V, Freidenburg T L, et al, 2001. Activated defense systems in marine macroalgae:evidence for an ecological role for DMSP cleavage. Marine Ecology Progress Series, 213: 53–65 DOI:10.3354/meps213053 |
| Van Duyl F C, Gieskes W W C, Kop A J, et al, 1998. Biological control of short-term variations in the concentration of DMSP and DMS during a Phaeocystis spring bloom. Journal of Sea Research, 40(3-4): 221–231 DOI:10.1016/S1385-1101(98)00024-0 |
| Webb A L, Malin G, Hopkins F E, et al, 2015. Ocean acidification has different effects on the production of dimethylsulfide and dimethylsulfoniopropionate measured in cultures of Emiliania huxleyi and a mesocosm study:a comparison of laboratory monocultures and community interactions. Environmental Chemistry, 13(2): 314–329 |
| Yang G P, Jing W W, Kang Z Q, et al, 2008. Spatial variations of dimethylsulfide and dimethylsulfoniopropionate in the surface microlayer and in the subsurface waters of the South China Sea during springtime. Marine Environmental Research, 65(1): 85–97 DOI:10.1016/j.marenvres.2007.09.002 |
| Ye N H, Zhang X W, Mao Y Z, et al, 2011. 'Green tides' are overwhelming the coastline of our blue planet:taking the world's largest example. Ecological Research, 26(3): 477–485 DOI:10.1007/s11284-011-0821-8 |
| Yoch D C, Ansede J H, Rabinowitz K S, 1997. Evidence for intracellular and extracellular dimethylsulfoniopropionate (DMSP) lyases and DMSP uptake sites in two species of marine bacteria. Applied and Environmental Microbiology, 63(8): 3182–3188 |
| Zhang H H, Yang G P, Zhu T, 2008. Distribution and cycling of dimethylsulfide (DMS) and dimethylsulfoniopropionate (DMSP) in the sea-surface microlayer of the Yellow Sea, China, in spring. Continental Shelf Research, 28(17): 2417–2427 DOI:10.1016/j.csr.2008.06.003 |
 2018, Vol. 49
2018, Vol. 49


