中国海洋湖沼学会主办。
文章信息
- 蒙蕊, 宋秀贤, 刘淑雅, 姜文彬, 俞志明. 2018.
- MENG Rui, SONG Xiu-Xian, LIU Shu-Ya, JIANG Wen-Bin, YU Zhi-Ming. 2018.
- 球形棕囊藻对不同氮源的吸收利用机制
- ABSORPTION AND UTILIZATION OF DIFFERENT NITROGEN SOURCES BY PHAEOCYSTIS GLOBOSA
- 海洋与湖沼, 49(4): 802-808
- Oceanologia et Limnologia Sinica, 49(4): 802-808.
- http://dx.doi.org/10.11693/hyhz20180100003
-
文章历史
- 收稿日期:2018-01-05
- 收修改稿日期:2018-03-23
2. 青岛海洋科学与技术国家实验室 海洋生态与环境科学功能实验室 青岛 266071;
3. 中国科学院大学 北京 100049
2. Laboratory of Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
氮是海洋微藻生长所必需的重要生源要素, 是浮游植物细胞蛋白质、酶、核酸、磷酸、叶绿素等的基本组成元素。海洋环境中氮具有多种形式, 可分为无机氮及有机氮, 主要无机氮包括NO3--N、NO2--N和NH4+-N, 有机氮包括溶解性有机氮及颗粒态有机氮, 其中尿素及各种氨基酸等为重要的溶解性有机氮(Ryther et al, 1971; Lobban et al, 1994)。研究表明, 不同海洋微藻对不同氮源的吸收利用及其响应机制存在较大差异。例如:蓝藻在尿素作为单一氮源条件下生长良好(Berman et al, 1999), 原绿球藻的一些株系不能利用NO3--N维系其生长(Moore et al, 2002)。胡章喜等(2010)的研究结果显示, 赤潮异弯藻、凯伦藻、球形棕囊藻和角毛藻虽然都能有效利用无机氮NO3--N和NH4+-N进行生长, 但均更偏好于NO3--N。海洋微藻对不同氮源的吸收利用能力是影响海洋中浮游植物的分布及组成的重要影响因素(Dyhrman et al, 2003), 亦即不同海域各种氮源含量、组成的差异也会影响着海域浮游植物的群落结构和组成。因此, 研究浮游植物对不同氮源的吸收利用机制具有重要的科学意义。
球形棕囊藻(Phaeocystis globosa)是海洋中分布最为广泛的浮游植物之一, 是一种广温广盐的藻类, 在南北极及热带的海洋中均有分布(Smith et al, 1991), 其具有复杂的异性生活史, 具有群体和游离单细胞两种不同的生活形态(沈萍萍等, 2000)。近年来, 球形棕囊藻在我国邻近海域多次暴发藻华, 导致大量养殖鱼类死亡(李波等, 2015; Liu et al, 2010), 甚至危害核电安全。氮源作为海洋微藻生长所必须的生源要素, 研究球形棕囊藻对氮源的吸收利用对解释球形棕囊藻藻华的暴发具有重要的科学意义。本文选取球形棕囊藻单细胞作为实验藻种, 研究了分别以NaNO3、NH4Cl及尿素为氮源条件下, 球形棕囊藻生长、营养盐利用及相关酶的活性, 从多种角度上分析球形棕囊藻对不同氮源的吸收利用机制, 研究结果可为球形棕囊藻赤潮的预测及防治工作提供理论基础。
1 材料与方法 1.1 实验材料本文所用藻种为球形棕囊藻(Phaeocystis globosa), 由本实验室藻种室提供。培养实验所用的海水为经0.45μm混合纤维膜过滤后于121℃灭菌30min的天然海水。藻种在f/2培养基(Guillard et al, 1962), 温度(18±1)℃, 光照度5000lx, 光暗比L:D = 12:12的条件下培养至指数生长期后用于实验。
1.2 实验方法取指数生长期的球形棕囊藻液, 以1:20的比例使用过滤灭菌后的天然海水进行稀释, 而后进行饥饿培养, 使其在饥饿培养结束后的藻密度达到5.0×105cells/mL。将藻液分为四组:对照组、NaNO3、NH4Cl以及尿素添加组。考虑现场环境氮源的实际浓度以及保证藻细胞快速生长, 实验选择添加后培养基中NaNO3、NH4Cl及尿素浓度均为50μmol/L。
在处于氮饥饿状态的藻细胞培养基中分别添加氮源为NaNO3、NH4Cl及尿素的f/2培养基, 对照组添加不含氮源的f/2培养基。将添加完营养液作为实验开始时刻, 分别在0、2、4、8、24、28、32、48h 8个时间点取样, 用于测定各参数。各组实验均设置三组平行。
1.3 各参数的测定方法 1.3.1 培养基中氮浓度的测定在各时间点分别取100mL藻液, 使用GF/F膜过滤分离, 加入一滴CHCl3固定后于-20℃保存, 样品中NO3--N、NO2--N及NH4+-N浓度采用SKALAR全自动营养盐分析仪(Skalar Ltd, Netherland)进行分析测定; 尿素浓度参照(GB/T 18204.29-2000), 采用二乙酰一肟—安替比林分光光度法进行测定。
1.3.2 藻密度使用血球计数板和奥林巴斯倒置相差显微镜(Olympus CKX53)计数不同时间点的藻密度, 并采用实验室荧光仪(Turner Designs Trilogy)测定活体荧光值, 根据计数及荧光数据进行线性拟合后得到藻密度。
1.3.3 叶绿素a取一定体积的藻液经25mmGF/F膜过滤分离, 向滤膜中加入90%的丙酮后4℃黑暗萃取24h, 使用美国Turner Designs公司Trilogy实验室多功能荧光仪进行测定。
1.3.4 可溶性蛋白采用考马斯亮蓝G-250法(王学奎, 2006)测定。称取100mg考马斯亮蓝G-250溶解于50mL95%乙醇中, 加入100mL85%(w/v)的磷酸, 用水定容至1000mL, 过滤后即为考马斯亮蓝G-250反应液。向离心收集的藻细胞中加入1mL 0.1mol/L的磷酸缓冲溶液后, 冰浴下超声破碎2min, 离心后取100μL提取液并加入500μL反应液, 放置5min后使用酶标仪(EnSight Multimode Plate Reader, PerkinElmer)在595nm波长下比色测定。测定的吸光值与使用牛血清蛋白绘制的标准曲线比对后, 得到藻细胞中可溶性蛋白浓度。
1.3.5 硝酸盐还原酶活性参照Berges等(1995)的研究报道, 通过测定反应产物NO2-浓度换算得到硝酸盐还原酶的活性。样品离心后贮存于液氮中, 加入500μL的提取液于冰浴下超声破碎2min, 再次离心后向两个5mL的离心管中各加入200μL的酶提取液, 100μL黄素腺嘌呤二核苷酸(FAD)溶液, 100μL还原型辅酶Ⅰ(NADH)溶液及200μL磷酸缓冲液, 加入200μL KNO3使反应开始。向其中一只离心管立刻加入2mL醋酸锌终止液, 作为反应时间为0时刻的参照, 另一支离心管于培养箱中培养45min加入2mL醋酸锌终止液。反应终止后在4000g下离心10min, 并加入20μL吩嗪硫酸甲酯(PMS)溶液。最后通过奈乙二胺分光光度法测定亚硝酸盐浓度。
1.3.6 脲酶活性通过靛芬蓝分光光度法检测反应产物中NH4+的浓度得到。样品离心后贮存于液氮中, 加入600μL磷酸盐提取液(pH=7.0), 冰浴超声破碎2min, 离心后分别向两支2mL的离心管中加入200μL的提取液、750μL 200mmol/L的磷酸缓冲溶液、50μL的尿素开始反应, 立即将其中一只离心管置于100℃水浴5min使酶失活, 作为反应时间为0时刻的参照。另一只在25℃下反应两个半小时后在100℃下水浴5min使酶失活。最后通过靛芬蓝分光光度法测定反应液中铵盐浓度。
1.4 数据处理比生长速率(μ)的计算公式为:
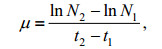
式中, N为细胞密度, t为时间, 本文中取的时间间隔为1天。
采用SPSS20.0和Origin9.0对数据进行统计分析与图表绘制。
2 结果与讨论 2.1 不同氮源对球形棕囊藻生长的影响首先考察了经过氮饥饿处理后的球形棕囊藻在三种氮源条件下的生长情况(图 1)。从图中可以看出, 在氮源初始浓度为50μmol/L的条件下, 三种氮源均能有效促进球形棕囊藻快速生长。结果显示, 实验期间处于氮饥饿状态的对照组藻细胞密度保持在初始密度5.4×105cells/mL基本不变, 三个实验组藻细胞密度在实验开始后的前24h增长缓慢, NaNO3、NH4Cl及尿素添加组24h时细胞密度从起始密度5.4×105cells/mL分别增加至7.49×105、8.57×105、8.65×105cells/mL, 比生长速率分别为0.30、0.45和0.44/d (表 1)。实验组藻细胞在24—48h快速分裂生长, 48h时NaNO3、NH4Cl和尿素添加组的藻细胞密度分别达到1.58×106、1.37×106和2.09×106cells/mL, 比生长速率分别为0.75、0.47和0.89/d (表 1)。单位体积的叶绿素a浓度与藻细胞密度呈现相同的变化趋势, 回归分析显示两者呈现出显著线性相关(P<0.01, R2>0.9)。
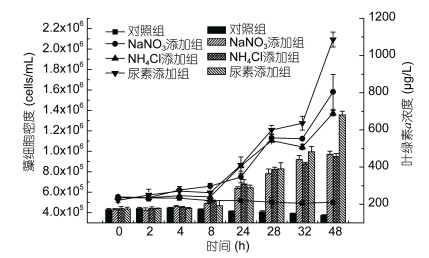 |
| 图 1 不同氮源对球形棕囊藻生长的影响 Fig. 1 Effects of different nitrogen sources on the growth of Phaeocystis globosa 注:折线图为不同氮源条件下藻细胞的生长曲线, 柱状图表示叶绿素a浓度的变化情况 |
| 实验组 | 比生长速率μ (24 h) | 比生长速率μ (48 h) |
| NaNO3添加组 | 0.30±0.05 | 0.75±0.04 |
| NH4Cl添加组 | 0.45±0.01 | 0.47±0.01 |
| 尿素添加组 | 0.44±0.02 | 0.89±0.07 |
从上述结果可见, 处于氮饥饿状态的球形棕囊藻添加NaNO3或尿素后24h内的比生长速率仅为48h的一半左右, 说明前24h吸收的氮源并不能立即用于快速分裂生长中, 而NH4Cl添加组24h和48h的生长速率基本不变, 且24h时的生长速率高于另外两组实验组, 这说明藻细胞吸收的NH4+可能被立即用于其自身的分裂生长中。产生这种结果的原因与浮游植物对不同氮源的吸收利用方式相关, 浮游植物吸收的NH4+可直接在谷氨酰胺合成酶和谷氨酸合成酶(GS/GAGOT)酶的作用下合成氨基酸, 而所吸收的NO3-则需经过硝酸盐还原酶(NR)、亚硝酸盐还原酶(NiR)还原成NH4+, 吸收的尿素需经过脲酶(urease)还原成NH4+后才能被利用(Berges et al, 1995)。
2.2 球形棕囊藻在不同氮源下的吸收利用氮源是浮游植物生长所必需的生源要素, 不同氮源条件下球形棕囊藻细胞的生长结果显示, 在48h时尿素组的细胞密度和叶绿素a浓度均高于NaNO3及NH4Cl添加组(图 1), 说明实验条件下尿素更适合球形棕囊藻的生长。在不同氮源对球形棕囊藻生长影响的相关研究中, 已有类似的研究报道(胡章喜等, 2010; 秦俊莲等, 2012)。
本实验发现, 当培养基中氮源浓度低于1μmol/L时, NO3-和NH4+基本不能被球形棕囊藻吸收利用。培养基中各氮源浓度的变化情况显示(图 2a), NH4+首先被快速的吸收耗尽, 8h时其浓度已低至1.5μmol/L, 24h时培养基内NH4+浓度低于1μmol/L; 其次是NO3-被快速消耗, 32h时培养基内NO3-浓度已低于1.0μmol/L, 尿素被消耗的最慢, 在48h时培养基中其浓度为3.0μmol/L。
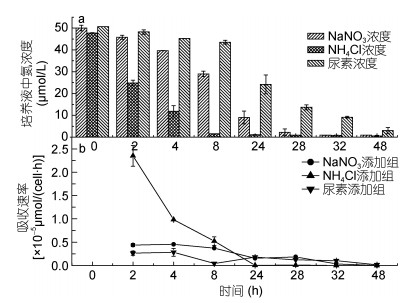 |
| 图 2 不同氮源条件下实验组培养基中氮源浓度(a)及吸收速率(b)的变化 Fig. 2 Variations of nitrogen concentration (a) and uptake rate (b) in the Phaeocystis globosa culture in different nitrogen sources |
单个藻细胞在单位时间内对不同氮源的吸收速率显示(图 2b), 在氮源初始浓度为50μmol/L的条件下, 球形棕囊藻对各氮源的吸收速率随时间的延长而降低。实验结果还显示藻细胞对氮源的吸收速率与培养基中氮源浓度呈线性关系(R2>0.88, 图 3), 且相关性分析结果表明, 不同氮源条件下培养基中氮源浓度与藻细胞对氮源的吸收速率之间呈显著相关关系(P<0.01)。此外由图 2b可见, 藻细胞对NH4+的初始吸收速率显著高于对NO3-及尿素, 约为对NO3-初始吸收速率的5倍、尿素初始吸收速率的10倍。上述结果表明, 经过饥饿处理后, 球形棕囊藻对不同氮源的吸收速率受氮源浓度的调控, 吸收速率与氮源浓度呈正比关系, 且NH4+浓度的变化对球形棕囊藻吸收速率的影响显著高于NO3-及尿素浓度变化的影响。Dortch等(1982)的研究发现, 经过氮饥饿处理后的强壮前沟藻(Amphidinium carterae)、杜氏盐藻(Dunaliela tertiolecta)、中肋骨条藻(Skeletonema costatum)及伪矮海链藻(Thalassiosira pseudonana)在分别添加NH4Cl和NaNO3后, 藻细胞对NH4+的初始吸收速率远远高于对NO3-的吸收速率, 本实验结果与此研究结果一致。
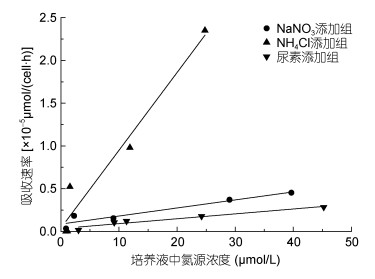 |
| 图 3 培养基中氮源浓度与吸收速率之间的关系 Fig. 3 Relationship between culture nitrogen concentration and uptake rate |
可溶性蛋白不仅是浮游植物参与代谢的各种酶类, 也是浮游植物体内氮源的重要储库, 可以在外界环境中氮源缺乏的时候供浮游植物利用(Rosenberg et al, 1982), 因此, 可溶性蛋白含量的变化可作为藻细胞生长状态及氮源利用的参考指标。图 4为不同氮源条件下球形棕囊藻单个藻细胞内可溶性蛋白含量的变化情况。由图可见, 实验期间对照组单个藻细胞内可溶性蛋白的含量基本保持不变, 约为2.7×10-2μg/cell, 实验组可溶性蛋白的含量均高于对照组, 且均呈现先升高后降低的趋势, NH4Cl添加组藻细胞内的可溶性蛋白含量升高的最快, 在8h时达到最大值4.2× 10-2μg/cell, 而后呈下降趋势, 48h时含量降至3.2× 10-2μg/cell; NaNO3添加组藻细胞内可溶性蛋白含量在24h升至最高值3.8×10-2μg/cell, 48h时为3.4× 10-2μg/cell; 尿素添加组在8h时可溶性蛋白含量达到最高值, 约为3.7×10-2μg/cell, 而后基本保持不变, 维持在3.4×10-2μg/cell。
 |
| 图 4 不同氮源条件下球形棕囊藻可溶性蛋白含量的变化 Fig. 4 Variation of soluble protein content in Phaeocystis globosa cells in the culture of different nitrogen sources |
由于氮饥饿处理使藻细胞内无机氮和氨基酸被耗尽, 细胞内的蛋白含量也降低到低值(Dortch et al, 1982), 所以对照组可溶性蛋白含量较低且相对稳定。实验组添加氮源后与氮同化吸收及细胞生长相关的代谢活动开始活跃, 与氮吸收及代谢活动相关酶的含量也开始升高, 所以可溶性蛋白含量升高。本研究结果显示, 氮源添加后被藻细胞快速吸收, 但前24h藻细胞的比生长速率低于后24h的比生长速率, 说明由于处于氮饥饿状态的球形棕囊藻细胞内氮库亏空, 添加入营养盐后, 藻细胞快速吸收的氮源首先用于补足体内的氮库, 因此初始阶段可溶性蛋白的含量上升, 随后由于氮源浓度及吸收速率降低、比生长速率升高的原因, 单个藻细胞内的可溶性蛋白含量下降, 所以可溶性蛋白含量变化与培养基内氮源浓度变化呈负相关关系。NH4Cl添加组培养基内的NH4+浓度在8h时被消耗低至1.5μmol/L, 可溶性蛋白含量达到最高值, 随后其生长速率基本保持不变, 可溶性蛋白含量下降, 说明可溶性蛋白可为球形棕囊藻体内累积的氮, 在外界环境中氮源亏缺时用于维持藻细胞的生长(Chapman et al, 1977)。
2.4 不同氮源对球形棕囊藻硝酸盐还原酶和脲酶活性的影响氮源在海洋中是影响浮游植物生长的一个重要影响因子, 近海水体中硝酸盐是无机氮的主要存在形式, 浮游植物对硝酸盐的吸收利用能力影响着近海初级生产力水平和浮游植物群落的结构组成(王艳等, 2006)。随着现代农业的快速发展, 尿素作为一种有机肥被大量使用, 致使近海海域尿素浓度升高(Glibert et al, 2006), 研究发现许多浮游植物可利用尿素作为唯一的氮源生长(Bekheet et al, 1977; Peers et al, 2000)。硝酸盐还原酶(NR)与脲酶(urease)均为氮同化酶。NR是浮游植物同化吸收硝酸盐的主要调节酶(Touchette et al, 2000)。Solomonson等(1990)认为植物对硝酸盐的同化机理如下:
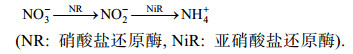
脲酶是将尿素转化为能被浮游植物可吸收利用氮源所需的重要水解酶, 能够催化尿素水解为氨及氨基甲酸酯, 氨基甲酸酯进一步水解为氨和碳酸(Mobley et al, 1989)。因此, NR与脲酶活性影响微藻对NO3-及尿素的同化吸收及生长速率。
图 5为不同氮源下NR活性随时间的变化曲线。结果显示, 氮饥饿及不同氮源条件下均对NR活性产生影响, 48h时各实验组的酶活性均在最低值。对照组随着饥饿时间的延长NR活性呈上升趋势, 由开始的10.4×10-5pgN/(cell·h)升高至48h的15.5×10-5pgN/ (cell·h); NaNO3添加组NR活性在2h内由9.6×10-5 pgN/(cell·h)快速升高至15.38×10-5pgN/(cell·h), 随后基本保持稳定, 24h酶活开始快速降低, 48h时NR活性降至最低值2.3×10-5pgN/(cell·h); NH4Cl及尿素添加组NR活性总体呈下降趋势, NH4Cl添加组NR活性开始时快速下降, 4h后酶活性基本稳定在5.5×10-5pgN/(cell·h); 尿素添加组NR活性在前8h活性基本保持不变, 而后呈下降趋势, 48h时NR活性降至最低值, 为3.5×10-5pgN/(cell·h)。
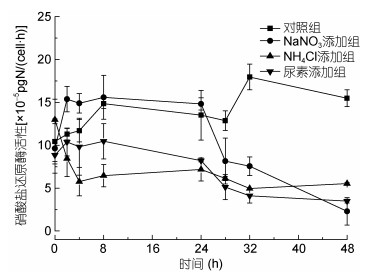 |
| 图 5 不同氮源对球形棕囊藻硝酸盐还原酶活性的影响 Fig. 5 Effects of different nitrogen sources on nitrate reductase activity of Phaeocystis globosa cells |
目前, 关于硝酸盐还原酶活性的研究发现, 一些浮游植物无论在氮饥饿还是不同氮源条件下均可检测到较高的NR活性(Dortch et al, 1982; Lomas et al, 2004), 并且短时间内浮游植物的NR活性随着氮饥饿时间的延长而升高(Morris et al, 1965; Thomas et al, 1985)。Thomas等(1985)发现氮饥饿环境中, 在Porphyra perforate细胞内已经检测不到硝酸盐的条件下, NR仍保持着较高的活性, 认为氮饥饿刺激NR活性的表达。本研究也显示处于氮饥饿的对照组NR活性呈逐渐增强的趋势, 与文献报道一致。另外, 有研究报道生长环境中一定浓度的NO3-能够调控浮游植物的NR活性升高, 而环境中NH4+的存在可导致NR活性迅速降低(Morris et al, 1965; Thomas et al, 1985; Lomas, 2004), 产生这种结果的原因可能是硝酸盐还原酶是一种底物诱导酶, 因环境中存在硝酸盐而诱导产生。本研究中球形棕囊藻NR活性的变化与上述报道相似, NaNO3添加组NR初始阶段具有更高活性, 随着培养基中NO3-被消耗, NR活性逐渐降低, 相关性分析显示NR活性与培养基中NO3-浓度呈显著正相关(P<0.05), 此外, NaNO3添加组NR活性在第28h降低, 而同时刻培养基中NO3-浓度已降至2.3μmol/L, 这也证实了硝酸盐还原酶的活性受到硝酸盐浓度的调控, 培养环境中的硝酸盐浓度降低使其活性下降。实验过程中NH4Cl和尿素添加组NR活性总体呈下降趋势, 表明NH4+和尿素能够抑制酶活的表达。
图 6为在不同氮源条件下脲酶活性的检出随时间的变化情况。实验期间以尿素为氮源球形棕囊藻的脲酶活性高于对照组及另外两个实验组。对照组脲酶活性在48h内均较低, 约保持在8.8×10-3pgN/(cell·h), 各实验组添加氮源后, 脲酶活性均呈现先升高后降低的趋势, 尿素、NaNO3及NH4Cl添加组的脲酶活性最高可达31.1×10-3、23.5×10-3和22.0×10-3pgN/(cell·h)。
 |
| 图 6 不同氮源对球形棕囊藻脲酶活性的影响 Fig. 6 Effects of nitrogen from different sources on urease activity of Phaeocystis globosa cells |
上述结果表明, 以NaNO3、NH4Cl或尿素为单一氮源以及处于氮饥饿状态的对照组, 球形棕囊藻的脲酶活性均可表达, 但不同氮源条件下其表达活性有差异, 以NaNO3或NH4Cl为氮源条件下脲酶活性低于以尿素为氮源。在以往的报道中, 研究者考察了不同氮源条件下亚历山大藻(Alexandrium fundyense)、抑食金球藻(Aureococcus anophagefferens)、微小原甲藻(Prorocentrum minimum)及威氏海链藻(Thalassiosira weissflogii)的脲酶活性(Dyhrman et al, 2003; Fan et al, 2003), 得到与本文一致的结论。相关分析发现, 以NaNO3或尿素为氮源的藻细胞脲酶活性与培养基内氮源浓度呈显著的正相关关系(P<0.05), 这意味着脲酶活性受环境中氮源浓度的调控。上述结果也可能是受藻细胞内氮源浓度的调控, 本研究以饥饿处理后的球形棕囊藻为实验材料, 其胞内的氮库降至低值, 添加氮源后被藻细胞首先迅速吸收进入细胞内补充氮库, 诱导酶活性升高, 随着培养基中氮源浓度和吸收速率降低, 细胞内的氮库中氮浓度必将降低, 酶活性也相应的降低, 在未来的研究中将进一步测定细胞内氮源浓度进行验证。
由上述结果可知球形棕囊藻在分别以NaNO3和尿素氮源条件下, NR及脲酶分别表达出最大活性, 约为14.68×10-5及33.83×10-3pgN/(cell·h)。且结果显示NR的最大酶活低于脲酶的最大酶活性两个数量级, 这可能是在本研究的中尿素组球形棕囊藻密度高于另外两个实验组的主要原因。
3 结论分析本研究的实验结果可以看出, 处于氮饥饿的球形棕囊藻在NaNO3、NH4Cl及尿素作为单一氮源的条件下均可生长, 但尿素更适合其生长。产生这种结果的原因主要是由于球形棕囊藻具有较高的脲酶活性, 能使吸收进入藻细胞内尿素更快速的同化利用。NH4+虽被认为是最容易被浮游植物同化吸收的氮源, 但本研究结果显示, NH4Cl添加组快速吸收的氮源首先被储存在细胞内, 当培养基中氮源耗尽后用于维持细胞的增长。研究还发现球形棕囊藻在不同氮源或无氮条件下, 细胞内的NR和脲酶均可表达, 说明球形棕囊藻在不同氮源条件下具有一定的竞争优势, 可更好的适应野外的环境。
| 王艳, 唐海溶, 蒋磊, 等, 2006. 硝酸盐对球形棕囊藻生长和硝酸还原酶活性的影响. 植物学通报, 23(2): 138–144 |
| 王学奎, 2006. 植物生理生化实验原理和技术. 北京: 高等教育出版社, |
| 李波, 蓝文陆, 李天深, 等, 2015. 球形棕囊藻赤潮消亡过程环境因子变化及其消亡原因. 生态学杂志, 34(5): 1351–1358 |
| 沈萍萍, 王艳, 齐雨藻, 等, 2000. 球形棕囊藻的生长特性及生活史研究. 水生生物学报, 24(6): 635–643 |
| 胡章喜, 徐宁, 段舜山, 2010. 不同氮源对4种海洋微藻生长的影响. 生态环境学报, 19(10): 2452–2457 DOI:10.3969/j.issn.1674-5906.2010.10.033 |
| 秦俊莲, 俞梦洁, 李璇, 等, 2012. 不同氮源对球形棕囊藻生长的影响. 生态科学, 31(3): 273–277 |
| Berman T, Chava S, 1999. Algal growth on organic compounds as nitrogen sources. Journal of Plankton Research, 21(8): 1423–1473 DOI:10.1093/plankt/21.8.1423 |
| Bekheet I A, Syrett P J, 1977. Urea-degrading enzymes in algae. British Phycological Journal, 12(2): 137–143 DOI:10.1080/00071617700650151 |
| Berges J A, Harrison P J, 1995. Nitrate reductase activity quantitatively predicts the rate of nitrate incorporation under steady state light limitation:a revised assay and characterization of the enzyme in three species of marine phytoplankton. Limnology and Oceanography, 40(1): 82–93 DOI:10.4319/lo.1995.40.1.0082 |
| Chapman A R O, Craigie J S, 1977. Seasonal growth in Laminaria longicruris:relations with dissolved inorganic nutrients and internal reserves of nitrogen. Marine Biology, 40(3): 197–205 DOI:10.1007/BF00390875 |
| Dyhrman S T, Anderson D M, 2003. Urease activity in cultures and field populations of the toxic dinoflagellate Alexandrium. Limnology and Oceanography, 48(2): 647–655 DOI:10.4319/lo.2003.48.2.0647 |
| Dortch Q, Clayton J R Jr, Thoreson S S, et al, 1982. Response of marine phytoplankton to nitrogen deficiency:decreased nitrate uptake vs enhanced ammonium uptake. Marine Biology, 70(1): 13–19 DOI:10.1007/BF00397291 |
| Fan C, Glibert P M, Alexander J, et al, 2003. Characterization of Urease activity in three marine phytoplankton species, Aureococcus anophagefferens, Prorocentrum minimum, and Thalassiosira weissflogii. Marine Biology, 142(5): 949–958 DOI:10.1007/s00227-003-1017-8 |
| Glibert P M, Harrison J, Heil C, et al, 2006. Escalating worldwide use of urea-a global change contributing to coastal eutrophication. Biogeochemistry, 77(3): 441–463 DOI:10.1007/s10533-005-3070-5 |
| Guillard R R L, Ryther J H, 1962. Studies of marine planktonic diatoms:Ⅰ.Cyclotella nana hustedt, and detonula confervacea (CLEVE) gran. Canadian Journal of Microbiology, 8(2): 229–239 DOI:10.1139/m62-029 |
| Liu J S, Van Rijssel M, Yang W D, et al, 2010. Negative effects of Phaeocystis globosa on microalgae. Chinese Journal of Oceanology and Limnology, 28(4): 911–916 DOI:10.1007/s00343-010-9061-y |
| Lobban C S, Harrison P J, 1994. Seaweed Ecology and Physiology. 2nd ed. Cambridge: Cambridge University Press, 8 |
| Lomas M W, 2004. Nitrate reductase and urease enzyme activity in the marine diatom Thalassiosira weissflogii (Bacillariophyceae):interactions among nitrogen substrates. Marine Biology, 144(1): 37–44 DOI:10.1007/s00227-003-1181-x |
| Mobley H L, Hausinger R P, 1989. Microbial ureases:significance, regulation, and molecular characterization. Microbiological Reviews, 53(1): 85–108 |
| Moore L R, Post A F, Rocap G, et al, 2002. Utilization of different nitrogen sources by the marine cyanobacteria Prochlorococcus and Synechococcus. Limnology and oceanography, 47(4): 989–996 DOI:10.4319/lo.2002.47.4.0989 |
| Morris I, Syrett P J, 1965. The effect of nitrogen starvation on the activity of nitrate reductase and other enzymes in Chlorella. Microbiology, 38: 21–28 |
| Peers G S, Milligan A J, Harrison P J, 2000. Assay optimization and regulation of Urease activity in two marine diatoms. Journal of Phycology, 36(3): 523–528 DOI:10.1046/j.1529-8817.2000.99037.x |
| Ryther J H, Dunstan W M, 1971. Nitrogen, phosphorus, and eutrophication in the coastal marine environment. Science, 171(3975): 1008–1013 DOI:10.1126/science.171.3975.1008 |
| Rosenberg C, Ramus J, 1982. Ecological growth strategies in the seaweeds Gracilaria foliifera (Rhodophyceae) and Ulva sp. (Chlorophyceae):soluble nitrogen and reserve carbohydrates. Marine Biology, 66(3): 251–259 |
| Smith W O Jr, Codispoti L A, Nelson D M, et al, 1991. Importance of Phaeocystis blooms in the high-latitude ocean carbon cycle. Nature, 352(6335): 514–516 DOI:10.1038/352514a0 |
| Solomonson L P, Barber M J, 1990. Assimilatory nitrate reductase:functional properties and regulation. Annual Review of Plant Biology, 41(1): 225–253 DOI:10.1146/annurev.pp.41.060190.001301 |
| Thomas T E, Harrison P J, 1985. Effect of nitrogen supply on nitrogen uptake, accumulation and assimilation in Porphyra perforata (Rhodophyta). Marine Biology, 85(3): 269–278 DOI:10.1007/BF00393247 |
| Touchette B W, Burkholder J A M, 2000. Review of nitrogen and phosphorus metabolism in seagrasses. Journal of Experimental Marine Biology and Ecology, 250(1-2): 133–167 DOI:10.1016/S0022-0981(00)00195-7 |
 2018, Vol. 49
2018, Vol. 49


