中国海洋湖沼学会主办。
文章信息
- 葛建龙, 孟乾, 陈四清, 刘琨, 刘长琳, 谭杰, 边力. 2018.
- GE Jian-Long, MENG Qian, CHEN Si-Qing, LIU Kun, LIU Chang-Lin, TAN Jie, BIAN Li. 2018.
- 氨氮对海月水母螅状体和碟状体的急性及慢性毒性作用
- ACUTE AND CHRONIC TOXICITY OF AMMONIA NITROGEN TO THE POLYPS AND EPHYRAE OF MOON JELLYFISH AURELIA COERULEA
- 海洋与湖沼, 49(4): 809-814
- Oceanologia et Limnologia Sinica, 49(4): 809-814.
- http://dx.doi.org/10.11693/hyhz20171100286
-
文章历史
- 收稿日期:2017-11-10
- 收修改稿日期:2018-03-30
2. 海洋渔业科学与食物产出过程功能实验室 青岛海洋科学与技术国家实验室 青岛 266237
2. Laboratory for Marine Fisheries Science and Food Production Process, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China
水母是一类重要的海洋生物, 近年来连年暴发更是引起了国际社会的普遍关注。水体富营养化被认为是水母暴发原因之一(Purcell et al, 2007), 而氨氮含量升高是造成水体富营养化的重要因素。水体氨氮由处于平衡态的非离子氨(NH3, 也称分子氨)和离子铵(NH4+)两部分组成, 离子铵对于水生动物毒性较小, 而非离子氨不带电荷, 具有较高脂溶性, 能穿透细胞膜, 毒害动物细胞组织, 具有较强的毒性作用(Selvan, 2011)。目前, 关于氨氮对鱼类、虾类等水生生物的毒性已有较多研究(Lemarié et al, 2004; 梁俊平等, 2012; 蒋玫等, 2014; 邹李昶等, 2015; 韩枫等, 2016; Kir et al, 2016; 钱佳慧等, 2016), 而氨氮对于水母生物的毒性作用仅在海蜇中有初步的报道(陈炜等, 1997), 水体富营养化中氨氮含量升高对于水母旺发种类种群数量变动的影响仍有待研究。
海月水母(Aurelia spp.)是一种世界性分布的近岸水母生物, 广泛分布于70°N—40°S, 同时也是我国近海海域水母暴发的优势种之一(Dong et al, 2010; Sun et al, 2015)。海月水母有着世代交替生活史, 由营底栖生活的水螅体世代和营浮游生活的水母体世代组成。水母体世代通过有性生殖产生浮浪幼虫, 并附着变态为螅状体; 水螅体世代具有无性繁殖能力, 不仅可以通过出芽生殖、匍匐茎生殖、纵向分裂等无性繁殖方式生成新螅状体, 扩充螅状体数量, 并且在条件适宜时通过横裂生殖释放碟状体, 进而发育为水母体。因此, 无性繁殖是水母扩增种群的重要阶段(Willcox et al, 2007; Liu et al, 2009)。迄今, 大量研究报道了温度、盐度、光照以及食物水平等环境因子对海月水母生长繁殖的影响(Willcox et al, 2007; Liu et al, 2009; 王彦涛等, 2012; Wang et al, 2015a, 2015b; Pascual et al, 2015; 石岩等, 2016), 关于氨氮这一环境因子对海月水母生长以及繁殖的影响, 国内外还未见相关报道。
本研究以我国黄海北部获得的海月水母(Aurelia coerulea)为材料, 分析氨氮对海月水母螅状体和碟状体的急性毒性效应, 并探讨了慢性氨氮胁迫对螅状体繁殖子代螅状体的影响, 以期为环境变化下海月水母种群数量变动研究提供一定参考依据。
1 材料与方法 1.1 实验材料海月水母(Aurelia coerulea)螅状体由中国科学院海洋研究所获得, 实验前从附有螅状体的波纹板中选取大小相似的16触手螅状体, 将其剥离并重新布置在培养皿中, 待其附着于培养皿底部, 用于后续实验; 采用降温诱导螅状体横裂获得碟状体, 选取同批次释放的活力较好的碟状体(释放时间~96h)为实验对象。
实验所用水为二级砂滤海水, 水温18—21℃, 盐度30±0.5, pH 8.10±0.16, 氨氮<0.02mg/L, 实验过程在恒温光照培养箱进行, 保持水温稳定于(21.0±0.5)℃。
1.2 实验方法实验采用静水实验法, 不同浓度氨氮用NH4Cl (分析纯)配置, NH4Cl母液现用现配, 配置时准确称取一定质量的NH4Cl, 用少量海水溶解并转移至1000mL的容量瓶中定容至标线。实验时按比例用海水将母液稀释至实验所需氨氮浓度, 相应体积的母液和海水采用量筒和移液枪量取。实验容器为1000mL玻璃烧杯, 加入500mL相应氨氮浓度的海水, 每24h更新实验液以保证其氨氮浓度稳定。
1.2.1 氨氮对螅状体和碟状体的急性毒性试验预实验获得24h 100%死亡最小质量浓度和96h 0%死亡最大质量浓度, 确定正式实验氨氮浓度范围。根据预实验, 按等氨氮浓度对数间距, 螅状体实验设置9个氨氮浓度梯度, 分别为16.90、24.90、36.96、54.67、80.87、119.61、176.92、261.68和387.06mg/L, 碟状体实验设置8个氨氮浓度梯度, 分别为17.01、21.00、25.92、32.00、39.50、48.76、60.19和73.74mg/L。设置自然海水为对照组, 每组设置三个重复, 螅状体实验每个重复9—10个螅状体, 碟状体实验每个重复10个碟状体。实验前一天停止投喂, 实验期间不投喂。分别在24、48、72、96h时显微镜下观察螅状体和碟状体的状态, 记录死亡个体数。
1.2.2 氨氮对螅状体无性生殖的影响实验根据螅状体氨氮急性毒性实验结果, 设置氨氮浓度梯度为15%、30%、45%和60% 96h LC50, 即3.82、7.63、11.45和15.26mg/L, 以自然海水为对照组, 每组设三个重复。随机选取附有9—10个螅状体的培养皿用于本实验, 实验前停止投喂3天, 并清除暂养期间形成的螅状体。实验期间保持黑暗条件, 每天换水和投饵一次, 换水时将培养皿装满海水取出, 用吸管定向投喂新孵化的卤虫无节幼体, 饱食投喂后将培养皿中海水及剩余饵料去除, 并放回新配置的相应氨氮浓度海水中, 每三天统计一次新生成的螅状体数, 新个体以脱离母体为标准, 并立即将其清除。
1.3 数据处理根据总氨氮(NH4++ NH3, TAN)浓度, 按公式(1)计算非离子氨(NH3)浓度(Emerson et al, 1975):
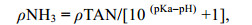 (1)
(1)式中, ρNH3为非离子氨含量(mg/L), ρTAN为总氨氮含量(mg/L), pKa为NH4+-N表观电离常数的负对数: pKa = 0.09018 + 2729.92/T (T为开氏温度, T = 273 + t, t为实验时海水温度℃)。
利用Excel进行数据整理, 利用SPSS 16.0软件的Probit回归分析计算24、48、72、96h半致死浓度(LC50); 安全浓度(SC)计算方法: SC = 0.1 × 96h LC50 (Sprague, 1971)。利用方差分析以及Duncan多重比较分析氨氮对螅状体繁殖子体数的影响, 显著性水平为P<0.05。
2 结果 2.1 海月水母的氨氮急性毒性表现在毒性预实验中, 螅状体对氨氮反应敏感, 氨氮浓度越大, 螅状体触手收缩的越快, 收缩的越短; 较高氨氮浓度条件下, 部分螅状体脱离附着基, 整个螅状体收缩变小, 严重者显微镜下可见螅状体表面裂解, 最终解体死亡。
碟状体对氨氮毒性表现为缘瓣不能完全伸展, 整个碟状体缩成一团, 缘瓣收缩活动变慢, 收缩力度变弱, 沉于烧杯底部, 随时间延长, 碟状体收缩的越来越小, 最终缘瓣失去收缩活动, 逐渐解体死亡。
2.2 氨氮对海月水母螅状体和碟状体的急性毒性作用急性毒性实验结果显示, 对照组中螅状体、碟状体始终无死亡; 实验组同一时间, 随着氨氮浓度增加, 螅状体、碟状体死亡率均增加; 同一氨氮浓度组, 随时间延长, 螅状体、碟状体死亡率逐渐增大(图 1, 图 2)。
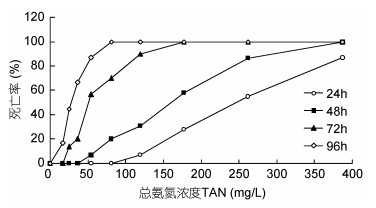 |
| 图 1 氨氮对海月水母螅状体的急性毒性 Fig. 1 The acute toxicity of ammonia nitrogen in the A. coerulea polyp |
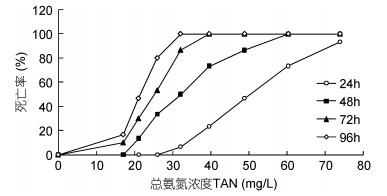 |
| 图 2 氨氮对海月水母碟状体的急性毒性 Fig. 2 The acute toxicity of ammonia nitrogen in the A. coerulea ephyra |
由死亡率数据计算可得总氨氮和非离子氨对螅状体和碟状体的半致死浓度, 见表 1。结果显示, 氨氮对螅状体24、48、72、96h半致死浓度分别为225.60、164.26、62.67和25.44mg/L, 非离子氨对螅状体半致死浓度分别为11.36、8.27、3.16和2.18mg/L, 螅状体的总氨氮和非离子氨安全浓度分别为2.54和0.13mg/L; 氨氮对碟状体24、48、72、96h半致死浓度分别为49.96、31.53、24.54和21.43mg/L, 非离子氨对碟状体半致死浓度分别为12.62、8.27、3.16和2.18mg/L, 碟状体的总氨氮和非离子氨安全浓度分别为2.14和0.11mg/L。
| 氨氮 | 时期 | 半致死浓度LC50 (mg/L) | 安全浓度SC (mg/L) | |||
| 24h | 48h | 72h | 96h | |||
| 总氨氮TAN | 螅状体Polyp | 225.60 | 164.26 | 62.67 | 25.44 | 2.54 |
| 碟状体Ephyra | 49.96 | 31.53 | 24.54 | 21.43 | 2.14 | |
| 非离子氨NH3 | 螅状体Polyp | 11.36 | 8.27 | 3.16 | 1.28 | 0.13 |
| 碟状体Ephyra | 2.52 | 1.59 | 1.24 | 1.08 | 0.11 | |
本实验中, 海月水母繁殖子代螅状体的主要繁殖方式是出芽生殖和匍匐茎生殖, 未观察到纵向分裂和足囊生殖的发生。整个实验过程中, 对照组每个螅状体繁殖的平均子体数始终高于氨氮胁迫实验组, 而且氨氮浓度越高, 生成的子体数越少(图 3)。经过24天胁迫实验, 对照组平均每个螅状体平均繁殖新螅状体数为7.8个, 氨氮3.82、7. 63、11.45和15.26mg/L组平均每个螅状体繁殖子体数分别为7.7、7.5、6.5和5.9个。方差分析显示, 氨氮3.82和7.63mg/L组, 累积繁殖子体数始终小于对照组, 但差异不显著(P>0.05);氨氮11.45mg/L组, 第6、9天时累积子体数显著小于对照组(P<0.05), 随后其它时间点差异不显著(P>0.05);氨氮15.26mg/L组, 第18天以前子体数显著小于对照组(P<0.05), 而21、24天时, 与对照组差异不显著(P>0.05)。
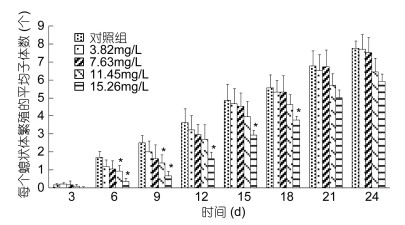 |
| 图 3 不同氨氮浓度对海月水母螅状体产生的平均子体数的影响 Fig. 3 Effect of ammonia nitrogen on average number of daughter polyps 注: *表示该实验组与对照组相比差异显著(P<0.05)。 |
进一步分析发现, 氨氮7.63mg/L组, 前3天的繁殖子体速率(单位统计时间内每个螅状体繁殖的子代螅状体数量)与对照组一致, 第6天时繁殖子体速率为对照组的59%, 随后恢复到对照组水平; 氨氮11.45和15.26mg/L实验组在第3、6、9天时繁殖子体速率小于对照组, 第12天开始恢复到对照组水平(图 4)。
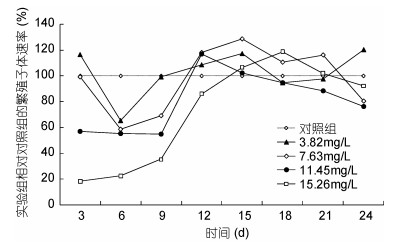 |
| 图 4 不同氨氮浓度对海月水母螅状体繁殖子体速率的影响 Fig. 4 Effect of ammonia nitrogen on daughter polyp production rate of A. coerulea scyphistoma |
氨氮对水生生物的毒性机理较为复杂, 不带电荷且具有脂溶性非离子氨, 容易通过被动扩散进入细胞内部, 是氨氮毒性的主要因子(Selvan, 2011)。氨氮胁迫对生物体有着众多有害影响, 包括干扰中枢神经系统(Randall et al, 2002)、损伤水生生物的细胞和组织结构(张武肖等, 2015; 钱佳慧等, 2016)、抑制氨氮排泄和破坏渗透平衡(Selvan, 2011; Liew et al, 2013)以及破坏抗氧化酶系统导致氧化损伤(钱佳慧等, 2016)等等。本研究首次分析了氨氮对于海月水母螅状体和碟状体的急性毒性, 结果显示随着氨氮浓度升高和胁迫时间延长, 氨氮对于螅状体和碟状体的毒性作用增强, 该结果与大多数水生动物的氨氮急性毒性实验结果相一致(梁俊平等, 2012; 韩枫等, 2016; 钱佳慧等, 2016)。推测可能随着氨氮浓度升高和胁迫时间延长, 氨氮在海月水母细胞内蓄积, 导致了细胞结构和功能损伤, 最终个体死亡。
3.2 螅状体与碟状体的氨氮耐受力比较急性毒性实验结果显示, 螅状体与碟状体的96h半致死浓度基本一致, 说明了螅状体与碟状体氨氮耐受能力相近, 然而24、48、72h螅状体氨氮半致死浓度远大于碟状体相应半致死浓度, 这可能与碟状体营浮游生活, 能量代谢旺盛, 并且仍处于变态发育过程有关。在水生动物中, 由于发育时期、个体大小的差异, 氨氮的耐受能力往往不同。如刺参耳状幼体的非离子氨半致死浓度为0.07mg/L, 小于稚参的半致死浓度l.65mg/L(庞军辉等, 1993); 脊尾白虾幼虾的总氨氮96h LC50为80.40mg/L, 小于成虾(120.86mg/L)(梁俊平等, 2012); 日本对虾无节幼体对氨氮的耐受性强于蚤状幼体, 小于糠虾幼体和仔虾的耐受性(李建等, 2007)。
3.3 不同生物氨氮耐受能力的比较分析本实验结果显示在水温21℃、盐度30、pH 8.1条件下, 海月水母螅状体与碟状体非离子氨96h LC50分别为1.28和1.08mg/L, 与相近条件下的其它水生动物非离子氨96h LC50相比, 接近大西洋白姑鱼(1.0mg/L; Kir et al, 2016)、红鳍东方鲀(1.20mg/L; 杨晶晶等, 2013), 高于文昌鱼(0.318—0.499mg/L; 武玉强等, 2012)、大黄鱼(0.17mg/L; 阮成旭等, 2014)、暗纹东方鲀(0.46mg/L; 孙侦龙等, 2015)以及军曹鱼(0.68mg/L; Barbieri et al, 2012), 而低于花鲈(1.95mg/L; 韩枫等, 2016)、脊尾白虾(2.57—4.95mg/L; 梁俊平等, 2012)、克氏原螯虾(1.91mg/L; 罗静波等, 2006)等水生动物。由此可知, 海月水母螅状体、碟状体的氨氮耐受能力居于正常水平, 与多数海水动物一样有着较高的水质要求, 氨氮不是海月水母耐受的环境因子, 富营养化水体一方面是增加了饵料生物丰度和水体浑浊度而促进了水母种群的暴发(Purcell et al, 2007), 另一方面, 富营养化水体中氨氮含量的升高, 可能会对水母种群的生存繁衍产生不利影响。
3.4 海月水母对慢性氨氮胁迫的适应性慢性氨氮胁迫实验结果显示, 氨氮胁迫初期, 氨氮实验组螅状体繁殖子代螅状体速率低于对照组, 随着氨氮胁迫时间延长, 螅状体繁殖子体的速率恢复至正常水平, 推测可能海月水母具有一定的适应氨氮胁迫的自我调节能力。在一些鱼类的慢性氨氮胁迫实验中也有着类似的结果, 如在大西洋鳕鱼, 胁迫实验第一阶段时(0—28天), 中高浓度氨氮组生长速率相对于对照组降低了11%和23%, 而最后阶段时(57—96天), 实验组与对照组生长速率无显著差异(Foss et al, 2004); 在欧洲鲈鱼, 当非离子氨浓度高于0.43mg/L时, 氨氮胁迫的前13天幼鱼表现为体重下降或生长停滞的现象, 而13天之后体重有所增加(Lemarié et al, 2004)。研究认为鱼类的氨氮胁迫适应性可以通过多种途径实现, 如减少氨氮代谢产物、增加排氨作用以及将氨氮转化为毒性较小的产物等(Chew et al, 2014), 然而关于海月水母对于慢性氨氮胁迫的适应性机制还有待进一步研究。
4 结论实验表明了氨氮对海月水母具有毒性作用, 海月水母螅状体与碟状体的总氨氮安全浓度分别为2.54和2.14mg/L, 非离子氨安全浓度分别为0.13和0.11mg/L; 海月水母螅状体和碟状体有着较高的水质要求, 富营养化水体中氨氮含量升高不是海月水母暴发的直接原因; 此外, 根据慢性氨氮胁迫实验, 实验组螅状体繁殖子体速率在胁迫初期时低于对照组, 随着氨氮胁迫时间延长, 螅状体繁殖子体的速率恢复至正常水平, 推测海月水母螅状体具有一定的适应慢性氨氮胁迫的自我调节能力。
| 王彦涛, 孙松, 李超伦, 等, 2012. 温度、投饵频次对海月水母(Aurelia sp.1)水螅体生长和繁殖的影响. 海洋与湖沼, 43(5): 900–904 DOI:10.11693/hyhz201205004004 |
| 石岩, 米铁柱, 王建艳, 等, 2016. 温度和食物水平对海月水母螅状体无性繁殖的影响. 生态学报, 36(3): 786–794 |
| 孙侦龙, 朱永祥, 刘大勇, 等, 2015. 非离子氨氮和亚硝酸盐氮对暗纹东方鲀稚鱼的急性毒性试验. 水产科学, 34(3): 135–139 |
| 阮成旭, 袁重桂, 吴德峰, 等, 2014. 氨氮和亚硝态氮对大黄鱼幼鱼的急性毒性效应. 福州大学学报(自然科学版), 42(2): 333–336 DOI:10.7631/issn.1000-2243.2014.02.0333 |
| 张武肖, 孙盛明, 戈贤平, 等, 2015. 急性氨氮胁迫及毒后恢复对团头鲂幼鱼鳃、肝和肾组织结构的影响. 水产学报, 39(2): 233–244 |
| 李建, 姜令绪, 王文琪, 等, 2007. 氨氮和硫化氢对日本对虾幼体的毒性影响. 上海海洋大学学报, 16(1): 22–27 |
| 杨晶晶, 孟祥科, 王鑫, 等, 2013. 非离子氨对红鳍东方鲀的急性毒性研究. 现代农业科技,(6): 253–254 |
| 邹李昶, 任夙艺, 王志铮, 等, 2015. 氨氮急性胁迫对日本沼虾(Macrobrachium nipponensis)死亡率、耗氧率及窒息点的影响. 海洋与湖沼, 46(1): 206–211 |
| 陈炜, 雷衍之, 蒋双, 1997. 离子铵和非离子氨对海蜇螅状幼体和碟状幼体的毒性研究. 大连水产学院学报, 12(1): 8–14 |
| 庞军辉, 韩家波, 高象贤, 等, 1993. 氨对刺参的毒性影响. 水产科学, 12(9): 8–11 |
| 武玉强, 陈学豪, 张孝杰, 等, 2012. 非离子氨对文昌鱼的急性毒性影响. 水产科学, 31(12): 745–748 DOI:10.3969/j.issn.1003-1111.2012.12.010 |
| 罗静波, 曹志华, 蔡太锐, 等, 2006. 氨氮对克氏原螯虾幼虾的急性毒性研究. 长江大学学报(自科版), 3(4): 183–185 |
| 钱佳慧, 栗志民, 刘建勇, 等, 2016. 氨氮对墨吉明对虾的急性毒性及对其免疫因子的影响. 应用海洋学学报, 35(2): 211–216 |
| 梁俊平, 李健, 李吉涛, 等, 2012. 氨氮对脊尾白虾幼虾和成虾的毒性试验. 水产科学, 31(9): 526–529 |
| 蒋玫, 李磊, 沈新强, 等, 2014. 慢性氨氮胁迫对鲻鱼(Mugil cephalus)幼鱼组织细胞免疫指标的影响研究. 海洋与湖沼, 45(3): 529–535 DOI:10.11693/hyhz20130300010 |
| 韩枫, 黄杰斯, 温海深, 等, 2016. 不同盐度条件下亚硝酸态氮与非离子氨对花鲈幼鱼的毒性实验. 海洋科学, 40(10): 8–15 DOI:10.11759//hykx20150920001 |
| Barbieri E, Doi S A, 2012. Acute toxicity of ammonia on juvenile cobia (Rachycentron canadum, Linnaeus, 1766) according to the salinity. Aquaculture International, 20(2): 373–382 DOI:10.1007/s10499-011-9467-3 |
| Chew S F, Ip Y K, 2014. Excretory nitrogen metabolism and defence against ammonia toxicity in air-breathing fishes. Journal of Fish Biology, 84(3): 603–638 DOI:10.1111/jfb.2014.84.issue-3 |
| Dong Z J, Liu D Y, Keesing J K, 2010. Jellyfish blooms in China:Dominant species, causes and consequences. Marine Pollution Bulletin, 60(7): 954–963 DOI:10.1016/j.marpolbul.2010.04.022 |
| Emerson K, Russo R C, Lund R E, et al, 1975. Aqueous ammonia equilibrium calculations:effect of pH and temperature. Journal of the Fisheries Research Board of Canada, 32(12): 2379–2383 DOI:10.1139/f75-274 |
| Foss A, Siikavuopio S I, Sæther B S, et al, 2004. Effect of chronic ammonia exposure on growth in juvenile Atlantic cod. Aquaculture, 237(1-4): 179–189 DOI:10.1016/j.aquaculture.2004.03.013 |
| Kir M, Topuz M, Sunar M C, et al, 2016. Acute toxicity of ammonia in Meagre (Argyrosomus regius Asso, 1801) at different temperatures. Aquaculture Research, 47(11): 3593–3598 DOI:10.1111/are.2016.47.issue-11 |
| Lemarié G, Dosdat A, Covès D, et al, 2004. Effect of chronic ammonia exposure on growth of European seabass (Dicentrarchus labrax) juveniles. Aquaculture, 229(1-4): 479–491 DOI:10.1016/S0044-8486(03)00392-2 |
| Liew H J, Sinha A K, Nawata C M, et al, 2013. Differential responses in ammonia excretion, sodium fluxes and gill permeability explain different sensitivities to acute high environmental ammonia in three freshwater teleosts. Aquatic Toxicology, 126: 63–76 DOI:10.1016/j.aquatox.2012.10.012 |
| Liu W C, Lo W T, Purcell J E, et al, 2009. Effects of temperature and light intensity on asexual reproduction of the scyphozoan, Aurelia aurita (L.) in Taiwan. Hydrobiologia, 616(1): 247–258 DOI:10.1007/s10750-008-9597-4 |
| Pascual M, Fuentes V, Canepa A, et al, 2015. Temperature effects on asexual reproduction of the scyphozoan Aurelia aurita s.l.:differences between exotic (Baltic and Red seas) and native (Mediterranean Sea) populations. Marine Ecology, 36(4): 994–1002 DOI:10.1111/maec.12196 |
| Purcell J E, Uye S I, Lo W T, 2007. Anthropogenic causes of jellyfish blooms and their direct consequences for humans:a review. Marine Ecology Progress Series, 350: 153–174 DOI:10.3354/meps07093 |
| Randall D J, Tsui T K N, 2002. Ammonia toxicity in fish. Marine Pollution Bulletin, 45(1-2): 17–23 |
| Selvan D S, 2011. Study on acute ammonia toxicity at different pH levels in fish Cyprinus carpio. Asian Journal of Biochemical and Pharmaceutical Research, 1(4): 231–238 |
| Sprague J B, 1971. Measurement of pollutant toxicity to fish-Ⅲ:Sublethal effects and "safe" concentrations. Water Research, 5(6): 245–266 DOI:10.1016/0043-1354(71)90171-0 |
| Sun S, Sun X X, Jenkinson I R, 2015. Preface:Giant jellyfish blooms in Chinese waters. Hydrobiologia, 754(1): 1–11 DOI:10.1007/s10750-015-2320-3 |
| Wang N, Li C L, 2015a. The effect of temperature and food supply on the growth and ontogeny of Aurelia sp. 1 ephyrae. Hydrobiologia, 754(1): 157–167 DOI:10.1007/s10750-014-1981-7 |
| Wang N, Li C L, Liang Y, et al, 2015b. Prey concentration and temperature effect on budding and strobilation of Aurelia sp. 1 polyps. Hydrobiologia, 754(1): 125–134 DOI:10.1007/s10750-014-1978-2 |
| Willcox S, Moltschaniwskyj N A, Crawford C, 2007. Asexual reproduction in scyphistomae of Aurelia sp.:Effects of temperature and salinity in an experimental study. Journal of Experimental Marine Biology and Ecology, 353(1): 107–114 DOI:10.1016/j.jembe.2007.09.006 |
 2018, Vol. 49
2018, Vol. 49


