中国海洋湖沼学会主办。
文章信息
- 袁世鹏, 唐学玺, 于琪, 臧宇, 李泽民, 周斌. 2018.
- YUAN Shi-Peng, TANG Xue-Xi, YU Qi, ZANG Yu, LEE T M, ZHOU Bin. 2018.
- 急性UVB辐射对粉叶马尾藻过氧化损伤和主要抗氧化酶的影响
- EFFECT OF ACUTE UVB RADIATION ON THE ANTIOXIDANT SYSTEM IN SARGASSUM GLAUCESCENS
- 海洋与湖沼, 49(4): 821-828
- Oceanologia et Limnologia Sinica, 49(4): 821-828.
- http://dx.doi.org/10.11693/hyhz20180200031
-
文章历史
- 收稿日期:2018-02-07
- 收修改稿日期:2018-04-10
2. 台湾中山大学 高雄 000800;
3. 青岛海洋科学与技术国家实验室 海洋生态与环境科学功能实验室 青岛 266000;
4. 青岛海洋科学与技术国家实验室 深蓝渔业装备与工程联合实验室 青岛 266000
2. National Sun Yat-sen University, Gaoxiong 000800, China;
3. Laboratory of Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266000, China;
4. Qingdao National Laboratory for Marine Science and Technology Joint Laboratory for Deep Blue Fishery Engineering, Qingdao 266000, China
平流层臭氧层的发生是20亿年前生命诞生的关键, 臭氧层吸收了紫外线, 削弱了紫外线辐射(Ultraviolet radiation B, UVB)对生命的损伤。然而剩余抵达地表的UVB对生物体仍然有伤害, UVB引起的损害的前提是生物分子的吸收, 植物中潜在的紫外吸收团主要包括核酸和蛋白质(Ruhland et al, 2007)。UVB通过改变和破坏这些吸收团, 进一步影响个体、种群和生态系统的结构和功能(Vass et al, 2005)。由于含氯氟烃的物质的大量使用, 过去的几十年中臭氧层被严重破坏, UVB呈现出明显的增强(Weatherhead et al, 2006)。虽然蒙特利尔协议通过了减少含氯氟烃产品制造和使用的条例(UNEP et al, 2010), Manney等(2011)也观测到了北极臭氧层气溶胶呈现缓慢恢复现象, 但大气化学和温度变化导致的促进臭氧消耗的其他化学物质的释放, 仍然是一个不能确定的因素, 因此不足以支撑未来UVB会减弱的论点。氯氟烃类物质的稳定性高, 在大气中运动缓慢, 可能40—50年才能达到的平流层, 因此这种效果仍将持续存在几十年(Weatherhead et al, 2006)。增强的UVB将继续对未来数十年的海洋生物产生影响, 因此研究UVB辐射增强对于陆地和水生脆弱群体的影响仍具有重要意义(Häder et al, 2007)。
马尾藻科植物是地球热带和亚热带地区的植物区系海洋重要组成部分(de Széchy et al, 2000), 由于深受海参鲍鱼喜爱, 因此常被用于养殖饵料, 此外由于其具有丰富的多糖多酚, 也常做临床药物提取的原材料(Kalidass et al, 2010)。UVB辐射增强使马尾藻科植物正面临着前所未有的生存挑战, UVB对生物的严重损伤作用能够产生明显的环境生态学效应(Rodil et al, 2015)。生活于水淹干露交替作用下的潮间带大型海藻是海洋生态系统中对UVB辐射增强最直接的响应者, 当前针对大型海藻对于急性UVB辐射增强的研究还比较少, 因此马尾藻科植物的研究能够为准确估计大型海藻在全球变化中的作用和揭示大型海藻的生活史对策提供理论依据(李丽霞等, 2009)。
同所有的好氧生物一样, 植物受益于氧也同样受制于着维持内部氧化环境条件的生理和发育需求的挑战(Surget et al, 2015)。植物对外界环境条件的控制有限, 因此活性氧(ROS)作为一种强大和灵活的信号调节机制来匹配环境的变化(Kim et al, 2010)。植物拥有大量的ROS生成和清除途径, 这些途径被紧密地嵌入到植物的生长和发育过程中, 其中针对ROS途径研究最多的是其清除途径。因为ROS清除途径中存在着大量的抗氧化物质, 它们能有效的降低有害的ROS, 并将细胞维在正常的理化环境当中。鉴于这个原因, 它们已经成为控制植物发展和对环境作出反应的调控的重要参照依据(Noctor et al, 2017)。大型海藻同水生维管束植物相似, 具有复杂的抗氧化机制, 其中包括抗氧化酶(超氧化物歧化酶、过氧化物酶、谷胱甘肽还原酶、过氧化氢酶等)和抗氧化吸收物质(多酚、类胡萝卜素、磷脂、类菌胞素氨基酸等) (Ruprez et al, 2002)。以往的研究表明, 紫外线辐射对大型海藻抗氧化防御具有提升作用(Aguilera et al, 2002), 但是也有研究证明长期的紫外辐射能够降低大型海藻的抗氧化防御作用(李丽霞, 2009)。
粉叶马尾藻(Sargassum glaucescens)隶属于褐藻门、圆子纲、墨角藻目、马尾藻科(曾呈奎, 2000), 是我国台湾地区潮间带的重要大型海藻, 具有重要的生态学和经济学价值, 但是迄今为止, 尚无研究关注其对紫外线增强的生理响应特征。本研究关注粉叶马尾藻在急性UVB辐射下的生理指标变化, 探索了粉叶马尾藻抗氧化系统的瞬时反应过程。初步揭示了粉叶马尾藻对于急性UVB辐射的增强的生理响应特征, 研究结果能够为进一步研究UVB辐射增强的生态学效应提供参考。
1 材料和方法 1.1 样品的采集及急性UVB辐照体系的设定本实验所采用的粉叶马尾藻采集于台湾屏东枫港(22°18′N, 120°68′E)。挑选健康藻体, 除去表面附着物, 试验前在台湾中山大学海科院室内水族箱中暂养1周, 暂养期水温(20±0.5)℃, 盐度30, 光照强度100μmol/(m2·s), 光周期为12L:12D, 每次试验均选取相同部位的藻体进行实验。
UVB辐照体系采用Philips UVB灯管, 外包以醋酸纤维脂滤膜。UVB辐照体系参考全球紫外线辐照强度Häder等(2007)和Shiu等(2005)的实验强度设定, 采用UVB急性毒理进行实验, 设置强度为0.5W/(m2·s)(低强度组)和2W/(m2·s)(高强度组), 辐照时间设定为0、1、2、3、6、12和24h, 实验根据丙二醛(MDA)含量判断其脂膜受氧化损伤程度, 根据2, 3, 5-Triphenyltetrazolium chloride (TTC)活力测定结果判断其存活情况。
1.2 粉叶马尾藻损伤情况测定脂质过氧化作用以脂质过氧化(TBARS)含量作为检测指标。其测定根据Heath等(1986)方法进行改进。取藻体0.050g冷冻干燥样品, 以0.5mL 5%三氯乙酸(TCA)将样品均质化, 在4℃ 1200×g离心10min, 收集上清液。取上清液0.25mL与1mL硫代巴比妥酸(5%溶于20% TCA中)于95℃水溶30min, 取出上清液置于室温20min, 使用分光光度计(U-8000)测定波长532和600nm之吸光值, 每组3次重复。空白试验以0.25mL三氯乙酸取代藻体萃取液。
1.3 粉叶马尾藻活力情况测定TTC活力测定依据Glazener等(1991)改进, 选取新鲜藻体叶片称重记录, 用蒸馏水清除其表面的杂质并置于10mL试管中, 加入6mL 0.8%的TTC溶液, 真空减压法30秒, 重复3次, 然后室温黑暗处理18h, 取出后清洗三次, 加入5mL 95%的乙醇100℃水浴20min 2次, 收集两次水浴后的溶液10mL, 测定其在530nm波长的吸光度。每组实验重复三次, 空白试验以等重藻体直接进行酒精水浴处理。
1.4 CAT酶活性测定CAT酶活性分析采用Nakano等(1981)的方法改进, 取冷冻干燥藻体0.0125g, 于液氮下研磨成粉, 加入1mL萃取缓冲液, 进行萃取, 在4℃以12000×g离心20min, 所得上清液为酶的萃取液。取100μL萃取液, 利用Bradford(1976)方法测定蛋白质含量。
另外取上清液100μL加入比色皿中, 再依次加入0.8mL萃取缓冲液混合均匀, 最后加入0.1mL (10mmol/L H2O2)启动反应。测量温度30℃下, 波长290nm, 于五分钟观察吸光度变化值(ΔA 240), 并得到斜率(ΔA 240/5s)。每组实验重复三次, 空白试验则以0.1mL萃取缓冲液取代酶的萃取液进行反应。每一单位酶的活性(U, unit)用每分钟消耗1mol的过氧化氢表示。反应后产物之消光系数为2.8mmol/(L·cm)。
1.5 APX酶活性测定APX酶活性分析采用Nakano等(1981)的方法改进。取冷冻干燥藻体0.0125g, 于液氮下研磨成粉, 加入1mL 0.1mol/L pH值为6.8的磷酸萃取缓冲液, 缓冲液包含1% (w/v)交联聚维酮(PVPP)和0.5mL 2.8mmol/(L·cm)现配维生素C (ASC), 在4℃以12000×g离心20min, 所得上清液为酶的萃取液。
取上清液100μL加入比色皿中, 再依次加入0.5mL 0.1mol/L pH值为6.0的磷酸缓冲液, 缓冲液包含0.1mL (5mmol/L ASC)、0.2mL 0.5mol/L的乙二胺四乙酸二钠(Na2EDTA)混合均匀, 最后加入0.1mL (10mmol/L H2O2)启动反应, 于30℃下监测波长290nm于5min观察吸光度变化值(ΔA 290), 并得到斜率(ΔA 290/5s)。每组实验重复3次空白试验则以0.1mL萃取缓冲液取代酶的萃取液进行反应。每一单位酶的活性(U, unit)用每分钟消耗1mol的ASC表示。反应后产物之消光系数为2.8mmol/(L·cm)。
1.6 SOD酶活性测定Superoxide dismutase(SOD)酶活性分析采用Beauchamp等(1971)的方法修改而来。取冷冻干燥藻体0.0125g, 液氮下研磨成粉, 加入1mL 0.1mol/L pH值为7的磷酸萃取缓冲液进行萃取, 在4℃以12000×g离心20min, 所得之上清液为酶的萃取液。
取上清液0.1mL加入玻璃试管中, 加入0.25mL磷酸萃取缓冲液震荡5秒钟, 再依次加入0.25mL 0.15mol/L pH值为7.8的磷酸缓冲液、0.075mL 130mmol/L的L-甲硫氨酸、0.075mL (1mmol/L Na2EDTA)、0.075mL 0.63mmol/L的四唑氮蓝(NBT)与0.15mL 7.5μmol的维生素B2 (riboflavin)混合均匀, 并于室温下以日光灯管(FL40D, 广州市百明汇电光源技术有限公司)给予(125±25)μmol/(m2·s)之光照强度, 持续光照10min。反应结束后, 置于黑暗终止反应, 利用分光光度计(U-8000), 于560nm处检测吸光度, 每组实验重复3次, 空白试验以0.1mL萃取缓冲液取代酶的萃取缓冲液进行反应。每一单位酶的活性(U, unit)为抑制50%NBT表示。
1.7 分析方法采用SPSS 20分析中的ANOVA分析中LSD检验对实验结果进行检验并进行显著性分析, 若P<0.05则认定为差异显著。
2 结果与分析 2.1 脂质氧化反应和活力测定结果粉叶马尾藻对UVB辐射的脂质过氧化反应结果如图 1。粉叶马尾藻在100μmol/(m2·s)光照培养下, 外源增加0.5W/(m2·s)的UVB辐照, 没有出现显著氧化损伤; 外源增加2W/(m2·s)的UVB辐照后, 3h开始出现氧化损伤, 此时2与0.5W/(m2·s)的辐照组之间差异显著(P=0.023), 6h后MDA含量较对照组显著升高(P=0.03), 随着时间增长, 差异显著性越高, 说明粉叶马尾藻在急性UVB辐照下, 脂质过氧化反应强烈, 3h后藻体受到严重伤害。
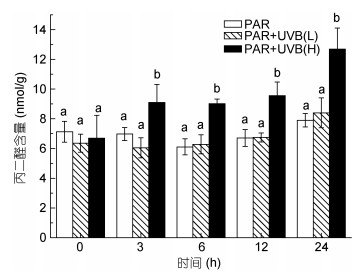 |
| 图 1 急性UVB照射对细胞脂质过氧化丙二醛(MDA)含量的影响 Fig. 1 Effects of acute UVB exposure on MDA 注: PAR代表对照组, PAR+UVB(L)代表添加0.5W/(m2·s) UVB的低强度组, PAR+UVB(H)代表添加2W/(m2·s) UVB的高强度组, 不同字母代表组间差异显著P<0.05, 全文同 |
活力测定时选取了粉叶马尾藻叶片进行测定, 结果如图 2和图 3所示, 随着UVB辐射增强, 提取液的吸光度逐渐降低, 2W/(m2·s)强度UVB辐射下, 6h时出现极显著降低(P=0.003), 且为最低活力一半; 在0.5W/(m2·s)强度下, 12h时出现极显著活力降低(P=0.001), 24h后两个强度下的藻体活力都达到最低。随着UVB增强, 粉叶马尾藻的活力逐渐降低, 叶片颜色逐渐变淡。
 |
| 图 2 急性UVB照射对细胞活力(TTC)的影响 Fig. 2 Effects of acute UVB exposure on TTC |
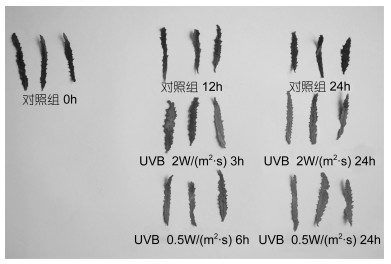 |
| 图 3 粉叶马尾藻叶片细胞活力(TTC)染色变化 Fig. 3 The dye of TTC on leaves of Sargassum glaucescens |
总蛋白质含量测定结果如图 4, 在急性2W/(m2·s)的UVB辐照下辐照下, 6h蛋白质含量出现显著下降(P=0.023), 24h蛋白质含量达到最低。而0.5W/(m2·s) UVB辐照下, 蛋白质含量与对照组始终没有显著差异。
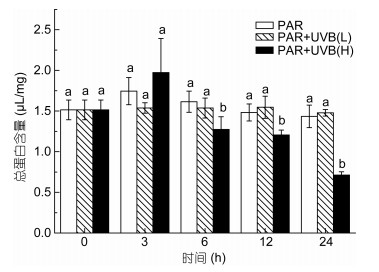 |
| 图 4 UVB照射对总蛋白质含量的影响 Fig. 4 Effects of acute UVB exposure on total protein content |
SOD的酶活性结果如图 5, 在处理的6h前没有明显差异, 在2W/(m2·s)的UVB辐照下12h后出现显著降低(P=0.001)。24h时, 0.5W/(m2·s)强度下, SOD酶的活性降显著(P=0.024), 2W/(m2·s)的辐照强度下SOD酶的活性降极其显著(P=0.010)。
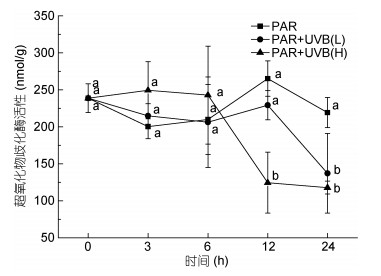 |
| 图 5 UVB照射对超氧化物歧化酶(SOD)活性的影响 Fig. 5 Effects of acute UVB exposure on SOD |
CAT酶和APX酶活性测定结果如下(图 6、图 7)在高强度下处理3h后, 两种酶的活性都出现了不同程度的升高。2W/(m2·s)UVB辐照下, 3h时, APX酶活性显著升高(P=0.006), CAT酶活性也显著升高(P=0.008), 在6h后, 细胞活力下降, 两组酶活性随之下降, 12h时CAT酶和APX酶都出现了显著降低(PCAT=0.001, PAPX=0.001)。由于藻体活力降低, 酶活性随之下降, 蛋白质含量和酶的活性在12—24h内均无显著变化; 在0.5W/(m2·s)强度的UVB辐射下, 随着UVB的累积, 粉叶马尾藻在前12h出现明显活力升高(PCAT=0.003, PAPX=0.001), 12—24h期间, 藻体较12h呈现显著活力下降。
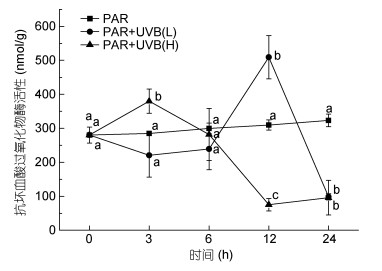 |
| 图 6 UVB照射对抗坏血酸过氧化物酶(APX)活性的影响 Fig. 6 Effects of acute UVB exposure on APX |
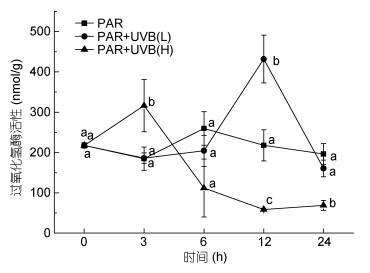 |
| 图 7 UVB照射对过氧化氢酶(CAT)活性的影响 Fig. 7 Effects of acute UVB exposure on CAT |
粉叶马尾藻存在于海洋潮间带的重要位置, 受到太阳光的辐射和潮汐的严重影响, 辐照胁迫不仅仅是剂量的增加, 也是强度的改变。由于当前针对全球UVB强度变化的研究仍然较少, 大部分相关研究都以日平均剂量的增强以及自然UVB的增补进行实验, 但是这两种剂量法存在着很多弊端, 不能控制生物有效辐射, 也不能够及时反映受辐射生物体的瞬时生理状况(Rousseaux et al, 2004)。Shiu等(2005)辐照实验中以及本实验的预实验中, 相同剂量不同强度辐照显现的结果具有差异性。因此根据自然界实测UVB强度瞬时变化及预实验结果, 设定本实验的高强度为2W/(m2·s)。
粉叶马尾藻在PAR+UVB辐照下显示出脂膜与蛋白活力的变化揭示了急性紫外辐射引起了藻体的抗氧化系统的反应过程。在本实验中, 高强度处理组中的蛋白含量出现了先上升后下降的过程, 进而影响了三种酶的单位活性变化, 这与Nedunchezhian等(1992)认为UVB可以促进蛋白质合成的结论是一致的。在之后的辐照中, 随着时间增加, 蛋白含量逐渐降低, 原因是某些芳香族氨基酸残基(如酪氨酸、苯丙氨酸, 色氨酸)对UVB存在吸收作用, 蛋白质中的半胱氨酸残基之间的二硫键也可吸收紫外线辐射(Bischof et al, 2006)。李元等(2006)认为UVB会引起肽链断裂, 从而引起蛋白或者酶的失活, 因此, 可以认为UVB在生物体中对蛋白质分子的主要作用是破坏。由于抗氧化过程中蛋白含量减少, 紫外线辐射诱导能够产生活性氧(ROS)并由此产生氧化损伤。当藻类受到环境胁迫时, 氮抑制和脂类的合成是可以被检测到的(Holzinger et al, 2009)。这些现象的发生是因为包括结构蛋白在内的蛋白质合成通路收到了抑制(Schmidt et al, 2009)。但是由于目前马尾藻科的分子进展比较困难和缓慢, 因此对于其各部分基因及对应的蛋白质结构和功能仍然有待于进一步探究。
本实验改进了TTC方法并将其应用于藻体活力测定上, 这是首次将活力验证用于褐藻门藻体上, 通过染色的结果使得藻体活力情况更清晰地通过宏观色彩表现出来, 同时采用浸出液体的吸光度对藻体进行活力判定, 保证实验的准确性。在辐照实验过程中, 藻体叶片颜色先变深再变浅, 这可能与UVB可以增加胡萝卜素含量有关。Döhler(1998)通过观测大型红藻Leptosomia simplex发现UVB可以引起类胡萝卜素的增多, Altamiran等(2000)也通过揭示UVB辐照下胡萝卜素活化机制, 进一步解释了藻体如何通过类胡萝卜素抵御UVB的损伤, 进一步验证了该说法, 这说明在色素在抵御UVB辐射过程中起了很大程度的作用。
粉叶马尾藻在接受UVB辐照后, SOD酶的活性呈现前期无显著变化, 后期显著下降现象, 这种现象与李丽霞等(2009)实验中马尾藻科鼠尾藻中SOD轻度及中度剂量下前中期酶活性比对照有不同程度增加的趋势不同。本实验结果表明, UVB对过氧化氢的合成速度可能存在一定影响, 因此初期单位SOD酶的活性不发生改变, 随着细胞损伤, 蛋白合成受抑制, 单位SOD酶的活性也呈现下降趋势, 这与其后面结果呈现趋势是一致的。李丽霞等(2009)等人实验中, 可能由于低剂量的长期辐照导致藻体产生了一定的适应性, 并且提升了活性氧转化的能力, 朱琳(2014)等人的实验也相继验证了其对于UVB的适应性, 不过在UVB强度的设定中, 其设定相对较小, 时间设定相对较长。大型海藻可能存在着一定的氧化修复能力, 包括类菌孢素氨基酸(MAAS)类物质和多酚类物质等, 这些物质的不同程度的存在, 使粉叶马尾藻在抵御外界环境胁迫时候具有更强的适应性(Ruhland et al, 2007)。
在APX酶和CAT酶活性检测中, Shiu等(2005)检测Ulva fasciata中APX酶活性大幅度提高, 但剂量继续增大后, 酶活性呈下降趋势但仍然显著高于对照, 该过程与粉叶马尾藻实验中的反应过程具有相似性, UVB诱导CAT酶活性的增加同样在绿藻Chlorella pyrenoidosa中被证实(Chen et al, 2003)。但是24h时不论高低强度, 粉叶马尾藻的APX酶活性都接近为0, 低于对照组。这说明在急性UVB辐射下, 粉叶马尾藻产生急性的应激反应, 急性UVB激活了抗氧化系统, SOD酶通过歧化反应转化产生较多过氧化氢, 为了清除过氧化氢, 需要产生较多的CAT和APX酶; 但是由于两种酶的分解能力有限, ROS仍然出现大量累积, 当累积程度达到一定程度, 藻体细胞受到损伤, 因此在第3h之后到第6h, 氧化损伤后细胞内两种酶活性降低显著, 辐照24h后藻体酶的活性降至最低。
实验中采用Sgherri等(1994)的方法在测定GR酶活性时, 加入启动液时, 吸光度呈现上升趋势, 不能测定其GR活性。生物体的酶的活性平衡对控制细胞内ROS的水平非常重要, 改变这些酶的平衡就会诱发补偿机制并揭示ROS清除系统的各组分之间存在共调节机制, 这些抗氧化酶在功能方面相互协调补充, 一个酶的活性变化会影响相关酶的活性(Shigeoka et al, 2002)。而活性氧的清除包括一系列细胞代谢和酶促反应过程, 仅仅分析其中的任何一种酶的活性高低, 均不能对生物体的抗氧化能力作出全面而准确的判断评价, 必须综合分析才能得出正确结论(Foyer et al, 2017)。
4 结论本文对粉叶马尾藻进行急性三种不同强度的UVB辐射的处理, 研究了粉叶马尾藻对UVB辐射增强的24h内过氧化氢损伤及抗氧化酶的响应过程。采用SPSS中的LSD检验, 分析了粉叶马尾藻在UVB辐射增强的情况下, 几种抗氧化系统相关化合物的差异显著性。结果显示:低强度[0.5W/(m2·s)]UVB辐射对粉叶马尾藻的影响相对较小, 表明粉叶马尾藻对UVB辐射具有一定耐受性; 而高强度[2W/(m2·s)] UVB辐射的影响较为显著, 意味着UVB辐射的持续增强将超出粉叶马尾藻的耐受限度, 进而造成不利影响。本研究结果初步揭示了粉叶马尾藻对于急性UVB辐射增强的生理响应特征, 为进一步研究UVB辐射增强的生态学效应提供参考依据。
| 朱琳, 2014. 龙须菜(Gracilariopsis lemaneiformis)生活史不同发育阶段对UV-B辐射的响应特征及机理研究. 青岛: 中国海洋大学博士学位论文 http://cdmd.cnki.com.cn/Article/CDMD-10423-1014369524.htm |
| 李元, 何永美, 祖艳群, 2006. 增强UV-B辐射对作物生理代谢、DNA和蛋白质的影响研究进展. 应用生态学报, 17(1): 123–126 |
| 李丽霞, 赵妍, 周斌, 等, 2009. UV-B辐射对大型海藻鼠尾藻抗氧化酶活性及同工酶谱的影响. 中国海洋大学学报(自然科学版), 39(6): 1246–1250 |
| 曾呈奎, 2000. 中国海藻志(第三卷). 北京: 科学出版社, 218-226 |
| Aguilera J, Bischof K, Karsten U, et al, 2002. Seasonal variation in ecophysiological patterns in macroalgae from an Arctic fjord.Ⅱ. Pigment accumulation and biochemical defence systems against high light stress. Marine Biology, 140(6): 1087–1095 DOI:10.1007/s00227-002-0792-y |
| Altamirano M, Flores-Moya A, Figueroa F L, 2000. Long-term effects of natural sunlight under various ultraviolet radiation conditions on growth and photosynthesis of intertidal Ulva rigida (Chlorophyceae) cultivated in situ. Botanica Marina, 43(2): 119–126 |
| Beauchamp C, Fridovich I, 1971. Superoxide dismutase:improved assays and an assay applicable to acrylamide gels. Analytical Biochemistry, 44(1): 276–287 DOI:10.1016/0003-2697(71)90370-8 |
| Bischof K, Gómez I, Molis M, et al, 2006. Ultraviolet radiation shapes seaweed communities. Reviews in Environmental Science and Bio/Technology, 5(2-3): 141–166 DOI:10.1007/s11157-006-0002-3 |
| Bradford M M, 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, 72(1-2): 248–254 DOI:10.1016/0003-2697(76)90527-3 |
| Chen K, Feng H, Zhang M, et al, 2003. Nitric oxide alleviates oxidative damage in the green alga Chlorella pyrenoidosa caused by UV-B radiation. Folia Microbiologica, 48(3): 389–393 DOI:10.1007/BF02931372 |
| de Széchy M T M, de Paula É J, 2000. Padrões estruturais quantitativos de bancos de Sargassum (Phaeophyta, Fucales) do litoral dos estados do Rio de Janeiro e São Paulo, Brasil. Revista Brasileira de Botânica, 23(2): 121–132 |
| Döhler G, 1998. Effect of UV radiation on pigments of the Antarctic macroalga Leptosomia simplex L. Photosynthetica, 35(3): 473–476 DOI:10.1023/A:1006932922895 |
| Foyer C H, Ruban A V, Noctor G, 2017. Viewing oxidative stress through the lens of oxidative signalling rather than damage. Biochemical Journal, 474(6): 877–883 DOI:10.1042/BCJ20160814 |
| Glazener J A, Orlandi E W, Harmon G L, et al, 1991. An improved method for monitoring active oxygen in bacteria-treated suspension cells using luminol-dependent chemiluminescence. Physiological and Molecular Plant Pathology, 39(2): 123–133 DOI:10.1016/0885-5765(91)90023-B |
| Häder D P, Kumar H D, Smith R C, et al, 2007. Effects of solar UV radiation on aquatic ecosystems and interactions with climate change. Photochemical & Photobiological Sciences, 6(3): 267–285 |
| Heath R L, Packer L, 1968. Photoperoxidation in isolated chloroplasts:Ⅰ.Kinetics and stoichiometry of fatty acid peroxidation. Archives of Biochemistry and Biophysics, 125(1): 189–198 DOI:10.1016/0003-9861(68)90654-1 |
| Holzinger A, Roleda M Y, Lütz C, 2009. The vegetative arctic freshwater green alga Zygnema is insensitive to experimental UV exposure. Micron, 40(8): 831–838 DOI:10.1016/j.micron.2009.06.008 |
| Kalidass C, Jayarani S, Glory M, 2010. Effect of seaweed liquid fertilizer on growth and biochemical constituents of Brassica nigra Linn. International Journal of Agriculture, Environment and Biotechnology, 3(3): 307–311 |
| Kim J A, Kong C S, Kim S K, 2010. Effect of Sargassum thunbergii on ROS mediated oxidative damage and identification of polyunsaturated fatty acid components. Food and Chemical Toxicology, 48(5): 1243–1249 DOI:10.1016/j.fct.2010.02.017 |
| Manney G L, Santee M L, Rex M, et al, 2011. Unprecedented Arctic ozone loss in 2011. Nature, 478(7370): 469–475 DOI:10.1038/nature10556 |
| Nakano Y, Asada K, 1981. Hydrogen peroxidePeroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts. Plant & Cell Physiology, 22(5): 867–880 |
| Nedunchezhian N, Annamalainathan K, Kulandaivelu G, 1992. Induction of heat shock-like proteins in Vigna sinensis seedlings growing under ultraviolet-B (280-320nm) enhanced radiation. Physiologia Plantarum, 85(3): 503–506 DOI:10.1111/ppl.1992.85.issue-3 |
| Noctor G, Reichheld J P, Foyer C H, 2018. ROS-related redox regulation and signaling in plants. Seminars in Cell & Developmental Biology, in press, 80(8): 50–64 |
| Rodil I F, Lucena-Moya P, Olabarria C, et al, 2015. Alteration of macroalgal subsidies by climate-associated stressors affects behavior of wrack-reliant beach consumers. Ecosystems, 18(3): 428–440 DOI:10.1007/s10021-014-9836-7 |
| Rousseaux M C, Julkunen-Tiitto R, Searles P S, et al, 2004. Solar UV-B radiation affects leaf quality and insect herbivory in the southern beech tree Nothofagus antarctica. Oecologia, 138(4): 505–512 DOI:10.1007/s00442-003-1471-5 |
| Ruhland C T, Fogal M J, Buyarski C R, et al, 2007. Solar ultraviolet-B radiation increases phenolic content and ferric reducing antioxidant power in Avena sativa. Molecules, 12(6): 1220–1232 DOI:10.3390/12061220 |
| Rupérez P, Ahrazem O, Leal J A, 2002. Potential antioxidant capacity of sulfated polysaccharides from the edible marine brown seaweed Fucus vesiculosus. Journal of Agricultural and Food Chemistry, 50(4): 840–845 DOI:10.1021/jf010908o |
| Schmidt É C, Scariot L A, Rover T, et al, 2009. Changes in ultrastructure and histochemistry of two red macroalgae strains of Kappaphycus alvarezii (Rhodophyta, Gigartinales), as a consequence of ultraviolet B radiation exposure. Micron, 40(8): 860–869 DOI:10.1016/j.micron.2009.06.003 |
| Sgherri C L M, Loggini B, Bochicchio A, et al, 1994. Antioxidant system in Boea hygroscopica:Changes in response to desiccation and rehydration. Phytochemistry, 37(2): 377–381 DOI:10.1016/0031-9422(94)85063-1 |
| Shigeoka S, Ishikawa T, Tamoi M, et al, 2002. Regulation and function of ascorbate peroxidase isoenzymes. Journal of Experimental Botany, 53(372): 1305–1319 DOI:10.1093/jexbot/53.372.1305 |
| Shiu C T, Lee T M, 2005. Ultraviolet-B-induced oxidative stress and responses of the ascorbate-glutathione cycle in a marine macroalga Ulva fasciata. Journal of Experimental Botany, 56(421): 2851–2865 DOI:10.1093/jxb/eri277 |
| Surget G, Stiger-Pouvreau V, Le Lann K, et al, 2015. Structural elucidation, in vitro antioxidant and photoprotective capacities of a purified polyphenolic-enriched fraction from a saltmarsh plant. Journal of Photochemistry and Photobiology B:Biology, 143: 52–60 DOI:10.1016/j.jphotobiol.2014.12.018 |
| UNEP, Environmental Effects Assessment Panel, 2010. Environmental effects of ozone depletion and its interactions with climate change:progress report.2009. Photochemical & Photobiological Sciences, 9(3): 275–294 |
| Vass I, Szilárd A, Sicora C, 2005. Adverse effects of UV-B light on the structure and function of the photosynthetic apparatus. In: Pessarakli M ed. Handbook of Photosynthesis, 2nd ed. New York: Marcel Dekker, Inc., 827-843 |
| Weatherhead E C, Andersen S B, 2006. The search for signs of recovery of the ozone layer. Nature, 441(7089): 39–45 DOI:10.1038/nature04746 |
 2018, Vol. 49
2018, Vol. 49


