中国海洋湖沼学会主办。
文章信息
- 李优迈, 韩留玉, 陈绵润, 佟蒙蒙. 2018.
- LI You-Mai, HAN Liu-Yu, CHEN Mian-Run, TONG Meng-Meng. 2018.
- 大亚湾中型浮游动物群落结构和植食性
- THE MESOZOOPLANKTON COMMUNITY STRUCTURE AND THEIR HERBIVORY IN DAYA BAY
- 海洋与湖沼, 49(4): 839-850
- Oceanologia et Limnologia Sinica, 49(4): 839-850.
- http://dx.doi.org/10.11693/hyhz20180100020
-
文章历史
- 收稿日期:2018-01-28
- 收修改稿日期:2018-03-21
2. 国家海洋局南海规划与环境研究院 广州 510300
2. South China Sea Institute of Planning and Environmental Research, Guangzhou 510300, China
中型浮游动物(Mesozooplankton, 0.2—20mm)是海洋浮游生物食物网中最高营养级, 它们既是初级消费者也是次级消费者, 是海洋食物网中的关键组分(Vargas et al, 2007)。海洋中型浮游动物包括桡足类、枝角类、毛颚类、被囊类等, 其中桡足类的平均丰度占其中的80% (Turner, 2004)。作为海洋食物链的重要营养级, 中型浮游动物通过捕食小型浮游动物(Microzooplankton, 20—200μm), 有助于物质和能量向高营养级传递, 同时也有效地连接着经典食物链(Classic Food Chain)和微生物环(Microbial Loop)。
中型浮游动物在海洋生物泵进程中起到关键的作用, 通过摄食一定数量的初级生产力后, 将产生的粪球排出体外, 即将生物性碳从海水表层固定到海底(Ducklow et al, 2001; Steinberg et al, 2017)。为满足自身生长繁殖和营养的需求, 中型浮游动物显示出对食物的适应性选择摄食特性, 且这种选择性具有一定的主动性(Chen et al, 2012)。中型浮游动物的摄食率与浮游植物的生物量呈功能性相关(Frost, 1972)。在食物较少时, 中型浮游动物通过提高摄食作用来获得所需能量; 而在食物较多时, 中型浮游动物会一定程度地降低摄食作用。因此, 结合对食物的主动选择性及食物的浓度, 在自然条件下, 中型浮游动物会更多地摄食粒径大小较合适或者营养条件更好的食物, 从而表现出对食物的选择性。例如, Liu等(2010)发现中型浮游动物在硅藻占优势的河口和近岸海域, 会优先选择摄食生物量较低的甲藻。
然而在某些近岸海域, 中型浮游动物的生物量并未随着浮游植物生物量的升高而升高(Vadstein et al, 2004; Hong et al, 2013)。相反, 由于二者生物量的不耦合, 常导致浮游植物大量增长而发生藻华(Rose et al, 2017)。一旦藻华发生, 桡足类将较难从水体中获取足够的必需脂肪酸, 其产卵率和孵化成功率也将受到一定程度的影响。对于捕食能力较差的中型浮游动物, 如滤食性浮游动物, 会因为长期摄食低营养的食物而难以维持其种群规模。因此, 在近岸富营养化条件下, 中型浮游动物与浮游植物的相互作用关系显得尤为复杂, 需要精确的野外摄食实验和研究对中型浮游动物生态功能的重要性进行探讨。
近几年来, 对中国南海大亚湾海域浮游动物方面的研究多集中于种群分布、群落结构等(黄道建等, 2010; 连喜平等, 2011; 杜飞雁等, 2013)。然而, 目前关于大亚湾中型浮游动物的生态功能, 特别是其与浮游植物之间的摄食关系研究较少。若忽视这方面研究将会对大亚湾海域食物链的认识不全, 生物泵的研究缺少较重要的一环。同时, 随着大亚湾海域富营养化程度不断加深(Wu et al, 2016), 海域的生物多样性不断下降(Wang et al, 2008), 致使有害藻华频发(Liu et al, 2012), 了解中型浮游动物在大亚湾海域的生态功能, 对减缓大亚湾海域生态平衡压力, 调节其健康发展有重要意义。为此, 本文以大亚湾为研究海域, 以中型浮游动物成体为研究对象, 通过为期两年的季节性实验研究, 对中型浮游动物群落结构和摄食特性进行调查。研究中型浮游动物群落结构与浮游植物之间的关系, 及其对浮游植物粒径大小和类群的选择性, 以探讨近岸中型浮游动物对浮游植物的下行控制作用。
1 材料与方法 1.1 调查实验站位本研究于2015年5月至2017年4月在大亚湾实验站附近一个采样点(22°33′48.6″N, 114°35′0.6″E)进行(图 1)。将1—3月划分为冬季, 4—6月为春季, 7—9为夏季, 10—12为秋季。
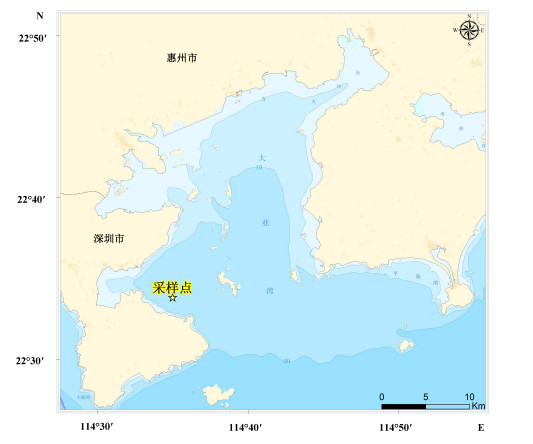 |
| 图 1 大亚湾海域采样点示意图 Fig. 1 The sampling site in Daya Bay |
采样现场的温度、盐度、溶解氧均由美国YSI-556型多参数水质仪测定。中型浮游动物的采集、处理、保存以及计数均遵照中华人民共和国国家质量监督检验检疫总局等(2008)中提供的方法执行, 具体步骤如下:
1.2.1 中型浮游动物群落特征研究采用配有流量计(HYDRO-BIOS, Kiel)的505μm的浅水Ⅰ型浮游生物网(内径0.5m), 在采样点垂直层面上由底层至表层垂直拖网采集中型浮游动物成体样品, 并记录流量计读数。收集到的样品用无颗粒海水定容至500mL, 静置后挑出粒径超过20mm的物质以及一些杂质。取其中100mL用于中型浮游动物野外干重测定, 剩余400mL样品用5%的福尔马林溶液固定, 在体视显微镜(Motic SMZ-168 series)和光学显微镜(Olympus BH-Ⅰ型)下对中型浮游动物进行计数及种类鉴定。中型浮游动物的丰度以单位体积内的个体数(ind./m3)来表示, 种类鉴定主要参照《黄海和东海的浮游桡足类, Ⅰ.哲水蚤目》(陈清潮等, 1965)、《黄海和东海的浮游桡足类, Ⅱ.剑水蚤目和猛水蚤目》(陈清潮等, 1974)、《海洋浮游生物学》(郑重等, 1984)。因为实验站位的中型浮游动物各种类数量不多, 最主要的优势种占据大量的比例, 为了分析更多的物种, 本文将物种丰度≥5%的种类定义为本研究的优势种。
1.2.2 中型浮游动物摄食研究摄食实验在两个采样周年每季度进行一次。
(1) 样品准备
用上述浮游生物网采集足够数量的活体中型浮游动物样品置于保温桶内, 用于进行摄食实验。采用200μm筛绢过滤表层海水, 收集200μm以下的浮游生物(主要是浮游植物和小、微型浮游动物)作为中型浮游动物摄食的食物。
(2) 饵料浓度差减法测定摄食率
实验方法参照张武昌(1998)。摄食实验处理组:将75mL中型浮游动物加到2.4L聚碳酸酯(PC)培养瓶, 同时取三等份同体积的中型浮游动物测定干重; 对照组:不加入中型浮游动物。接着将实验处理组和对照组均加满上述方法过滤的表层海水, 且每个三组平行样。将所有PC培养瓶在自然光条件下放入装有流动的常温自来水的容器内, 从而模拟海上摄食过程。
培养24h后用200μm的筛绢过滤出中型浮游动物, 对滤液进行分级叶绿素以及色素分析。其中, 中型浮游动物对浮游植物的清除率F [L/(mg·d)]采用公式(1)(Frost, 1972)计算:
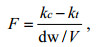 (1)
(1)式中, kc(/d)和kt(/d)分别是实验对照组和处理组浮游植物的生长率, V(L)是培养瓶的体积, dw (mg)是实验处理组中型浮游动物的干重。
其中浮游植物的生长率k(/d)计算过程如公式(2):
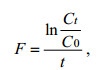 (2)
(2)式中, C0和Ct分别是摄食实验前后叶绿素a(chl a)的浓度(μg/L), t是摄食实验培养的时间。
由上述结果可计算得出中型浮游动物对浮游植物的摄食率I[μg/(mg·d)]:
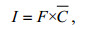 (3)
(3)式中, C是chl a的平均浓度。
单位时间的摄食影响GI (%/d)由公式(4)可计算得出:
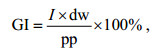 (4)
(4)式中, pp是表层海水浮游植物的现存量(μg/L), 即为C0的值。
1.2.3 样品分析(1) 分级chl a的测定
量取250—500mL摄食前后的表层海水依次过滤于20μm的尼龙滤膜, 2μm的聚碳酸酯滤膜以及0.7μm的GF/F玻璃纤维膜上。分别代表:小型浮游植物(20—200μm)、微型浮游植物(2—20μm)和超微型浮游植物(0.7—2μm)。在滤膜中加入5mL 90%丙酮于4℃避光萃取24h, 采用唐纳荧光仪(Turner Designs Model 7200)测定其荧光值。
(2) 色素测定
量取250—750mL摄食前后的表层海水过滤于0.7μm GF/F玻璃纤维膜上, 滤膜置于低温下保存以测定色素种类和浓度。采用高效液相色谱法(High performance liquid chromatography, HPLC)对色素进行定性定量分析, 用于测定野外和摄食后各色素的种类和浓度。色素提取和分析的方法分别参照陈纪新等(2006)和Zapata等(2000)。本研究主要考虑甲藻、硅藻、定鞭藻(8型, 6型)、绿藻、隐藻、聚球藻、青绿藻这七种浮游植物类群。由于特定的浮游植物类群拥有特定的特征色素, 因此本研究以特征色素来表征其对应的浮游植物类群。通过计算出各色素对chl a的贡献, 再运用CHEMTAX程序分析, 得到各类群浮游植物的生物量和对浮游植物总生物量的相对贡献量。初始色素比例矩阵详见表 1。
| 色素 | peri | 19but | fucox | 19hex | neox | pras | viola | allo | lut | zea | chl b | Dv-chl a | chl a |
| 甲藻 | 1.06 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| 硅藻 | 0 | 0 | 0.75 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| 定鞭藻8型 | 0 | 0.25 | 0.59 | 0.54 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| 定鞭藻6型 | 0 | 0 | 0 | 1.7 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
| 绿藻 | 0 | 0 | 0 | 0 | 0.06 | 0 | 0.06 | 0 | 0.2 | 0.01 | 0.26 | 0 | 1 |
| 隐藻 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0.23 | 0 | 0 | 0 | 0 | 1 |
| 聚球藻 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0.35 | 0 | 0 | 1 |
| 青绿藻 | 0 | 0 | 0 | 0 | 0.15 | 0.32 | 0.06 | 0 | 0.01 | 0 | 0.95 | 0 | 1 |
| 注:各类色素分别代表: peri (peridinin, 多甲藻素), 19but (19’-butanoyloxyfucoxanthin, 19’-丁酰基氧化岩藻黄素), fucox (fucoxanthin, 岩藻黄素), 19hex (19’-hexanoyloxyfucoxanthin, 19’-己酰基氧化岩藻黄素), neox (neoxanthin, 新黄素), pras (prasinoxanthin, 青绿素), viola (violaxanthin, 紫黄素), allo (alloxanthin, 别藻黄素), lut (Lutein, 叶黄素), zea (zeaxanthin, 玉米黄素), chl b(chlorophyll b, 叶绿素b), Dv-chl a(Dv-chlorophyll a, 二乙烯基叶绿素a), chl a(chlorophyll a, 叶绿素a) | |||||||||||||
数据统计采用SPSS 20.0进行, 相关性分析利用Pearson相关性检验, 差异性分析利用单因素方差分析(One-Way ANOVA)。应用Past 3.17软件对中型浮游动物群落与浮游植物的关系进行典型对应分析(CCA, canonical correspondence analysis), 为减少异常值所带来的影响, 将所有数据都进行lg(x+1)转化, 排序结果通过中型浮游动物群落-浮游植物关系的双序图来表示。应用Sigmaplot 12.5及Excel 2016软件进行图表制作。
2 结果 2.1 环境特征 2.1.1 水文环境调查期间, 大亚湾水文环境见图 2。两年平均温度为(23.6±4.2)℃, 总体上, 秋、冬温度较低, 春、夏温度相对较高, 温度变化范围在15.7—29.3℃。盐度的变化平缓, 范围在30.4—33.8, 平均盐度为32.1±1.2。溶解氧变化较大, 在4.3—10.5mg/L波动, 平均浓度为(7.0±1.9)mg/L; 总体上, 夏季溶解氧较低, 冬季较高。
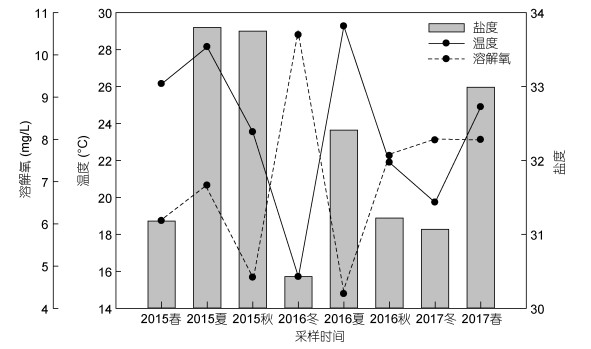 |
| 图 2 大亚湾实验站位温度、盐度和溶解氧的季节性变化 Fig. 2 Temporal variations of temperature, salinity, and dissolved oxygen in the experimental site in Daya Bay |
chl a浓度代表了浮游植物的生物量。表层海水chl a的绝对浓度如图 3a所示, chl a浓度呈现明显的季节性变化。总体上, 大亚湾实验站的浮游植物生物量较高, 范围在0.90—6.45μg/L之间, 年平均值为(3.07±1.91)μg/L, 每年浓度最高值出现在春季(2015, 2017年)。在粒径比例方面, 小型(20—200μm)、微型(2—20μm)和超微型浮游植物(0.7—2μm)的chl a平均占比分别为31.6%、29.9%和38.5%(图 3b)。小型浮游植物主要在春季(2015, 2017年)占优势, 此时chl a浓度较高。而微型浮游植物在2016年秋季占优势, 此时chl a浓度相对较低; 超微型浮游植物主要在2016年夏季和2017年冬季占优势。
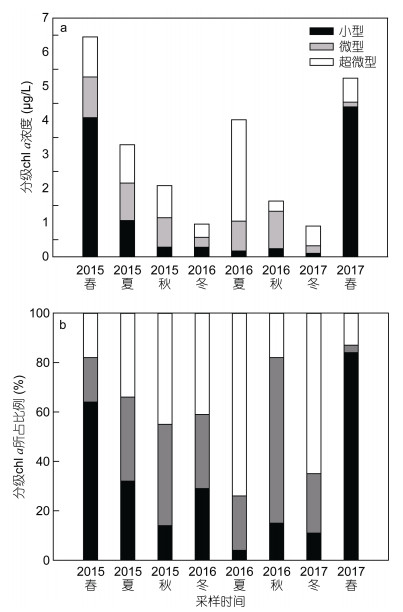 |
| 图 3 表层海水分级chl a浓度(a)和所占比例(b) Fig. 3 The concentration (a) and proportion (b) of size-fractionated chl a in surface water 注:其中小型、微型、超微型分别代表:小型浮游植物、微型浮游植物、超微型浮游植物 |
在为期两年的调查期间, 大亚湾实验站占优势的浮游植物类群是硅藻。硅藻的生物量在春季(2015, 2017年)显著高于其他季节(P<0.01), 平均生物量达(3.75±1.75)μg/L(图 4a), 对浮游植物总的生物量相对贡献量平均为50.0%(图 4b)。其生物量最低为冬季(2016, 2017年), 平均生物量(0.45±0.045)μg/L, 总体趋势:冬<秋<夏<春; 2015年春季硅藻在总浮游植物群落中的比例最高, 达85.3%, 其次是2015年夏季。优势度仅次于硅藻的浮游植物类群是青绿藻, 生物量在2016年夏季最高, 达到了1.23μg/L, 2017年冬季最低为0.31μg/L; 其所占比例最高在2015年秋季(33.2%), 其次是2016年冬季(32.4%)。甲藻在每个季节仅占较小的比例, 但是2017年春季的生物量显著高于其他任何季节(P<0.01), 2016年冬季生物量最小(0.50ng/L)。夏季(2015, 2016年), 除了硅藻外, 聚球藻和定鞭藻这两种浮游植物类群占据一定的优势, 平均生物量分别达到(0.44± 0.06)和(0.25±0.17)μg/L (图 4a), 平均比例分别达到12.0%和7.3%(图 4b)。秋季(2015, 2016年), 除了硅藻、青绿藻外, 隐藻占据一定优势, 对浮游植物总的生物量相对贡献量平均为20.3%。
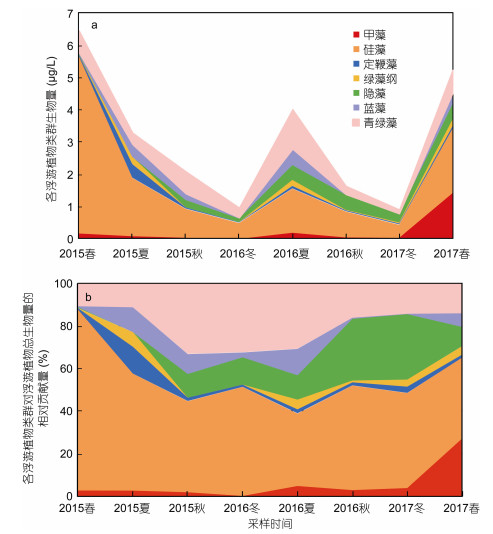 |
| 图 4 表层海水各浮游植物类群生物量(a)和对浮游植物总生物量的相对贡献量(b) Fig. 4 The biomass (a) and relative contribution (b) of different types of phytoplankton group in surface water |
总之, 在营养含量较高的春季(2015, 2017年), 大亚湾的浮游植物群落以硅藻占绝对优势, 其次是青绿藻; 在营养含量较低的夏季, 粒径较小的类群聚球藻、定鞭藻占据一定优势。
2.2 中型浮游动物群落结构 2.2.1 干重与丰度实验期间中型浮游动物的干重范围在5.5—66.1mg/m3(图 5), 呈现冬<秋<夏<春的季节性分布的现象。除了2017年冬季中型浮游动物有异常高的干重, 总体上, 中型浮游动物的干重与丰度呈正相关关系(R=0.718, P=0.003)。
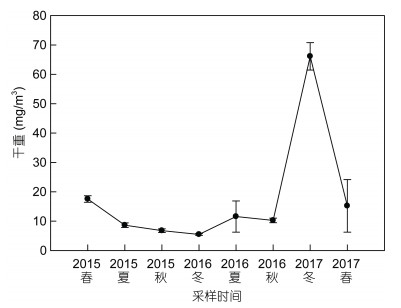 |
| 图 5 中型浮游动物干重的季节性变化 Fig. 5 Seasonal variation in dry weight of mesozooplankton |
中型浮游动物的总丰度为60—5862ind./m3, 在2017年冬季中型浮游动物丰度达最高值5862ind./m3, 2016年夏季丰度最低为60ind./m3(表 2)。总的来说, 大亚湾实验站中型浮游动物的丰度变化趋势:夏<秋<春<冬。通过桡足类丰度和中型浮游动物干重的线性回归关系(R=0.608, P<0.05), 得出桡足类在中型浮游动物干重方面做出了很大贡献, 表明其在大亚湾海域中型浮游动物中占比较重要的地位, 而其他中型浮游动物丰度占比相对较小, 除在春季(2015, 2017年)枝角类占绝对优势。
| 种名 | 拉丁名 | 序号 | 2015春季 | 2015秋季 | 2016冬季 | 2016夏季 | 2016秋季 | 2017冬季 | 2017春季 |
| 桡足类 | |||||||||
| 中华哲水蚤 | Calanus sinicus | S1 | 4 | 0 | 11 | 0 | 0 | 1242 | 0 |
| 微刺哲水蚤 | Canthocalanus pauper | S2 | 4 | 5 | 0 | 0 | 0 | 49 | 1 |
| 亚强次真哲水蚤 | Subeucalanus subcrassus | S3 | 4 | 6 | 1 | 0 | 0 | 111 | 0 |
| 针刺拟哲水蚤 | Paracalanus aculeatus | S4 | 4 | 5 | 0 | 0 | 1 | 57 | 4 |
| 小拟哲水蚤 | Paracalanus parvus | S5 | 4 | 2 | 3 | 1 | 3 | 270 | 7 |
| 强额孔雀哲水蚤 | Parvocalanus crassirostris | S6 | 15 | 19 | 0 | 3 | 4 | 0 | 1 |
| 锥形宽水蚤 | Temora turbinata | S7 | 49 | 29 | 1 | 2 | 37 | 1185 | 1 |
| 红纺锤水蚤 | Acartia erythraea | S8 | 38 | 9 | 2 | 48 | 36 | 57 | 1 |
| 瘦歪水蚤 | Tortanus gracilis | S9 | 15 | 6 | 1 | 1 | 2 | 18 | 0 |
| 平大眼剑水蚤 | Corycaeus dahli | S10 | 8 | 1 | 1 | 0 | 5 | 22 | 1 |
| 枝角类 | |||||||||
| 鸟喙尖头溞 | Penilia avirostris | S11 | 1220 | 0 | 0 | 0 | 0 | 4 | 42 |
| 肥胖三角溞 | Pseudevadne tergestina | S12 | 2 | 0 | 54 | 0 | 0 | 13 | 3 |
| 其他类 | |||||||||
| 小齿海樽 | Doliolum denticulatum | S13 | 212 | 0 | 1 | 0 | 0 | 1746 | 0 |
| 蛇尾纲长腕幼虫 | Ophiopluteus larvae | S14 | 182 | 0 | 0 | 0 | 0 | 0 | 0 |
| 肥胖软箭虫 | Flaccisagitta enflata | S15 | 27 | 4 | 13 | 0 | 0 | 88 | 2 |
| 细颈和平水母 | Eirene menoni | S16 | 0 | 0 | 0 | 0 | 0 | 376 | 0 |
| 住囊虫 | Oikopleura sp. | S17 | 2 | 1 | 1 | 0 | 0 | 40 | 6 |
| 总丰度 | 2033 | 97 | 116 | 60 | 92 | 5862 | 85 | ||
| 注: 2015年夏季中型浮游动物鉴定样品缺失 | |||||||||
大亚湾中型浮游动物在各季节优势种占比如图 6所示。同种类不同季节丰度差异很大, 相同季节不同种类丰度及总丰度也相差很大, 但相同季节优势种存在一定的重叠。总体来说, 桡足类在大亚湾中型浮游动物中所占比例很大。调查期间, 优势种中桡足类有10种, 超过优势种总数的一半, 枝角类2种, 其他类5种。相对地, 2015年秋季优势种种类较多, 2016年夏季优势种种类较少。
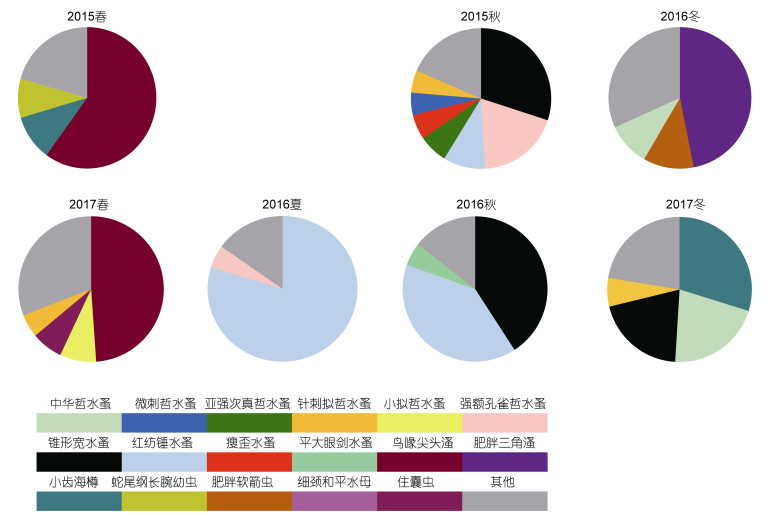 |
| 图 6 大亚湾两个采样周年中型浮游动物优势种及其组成比例 Fig. 6 The proportion of dominant mesozooplankton species in 2015-2017 in Daya Bay 注: 2015年夏季中型浮游动物鉴定样品缺失 |
2017年冬季中型浮游动物干重质量异常高(图 5), 主要是因为中型浮游动物优势种中华哲水蚤、锥形宽水蚤和小齿海樽有较高的丰度, 分别是1242、1185和1746ind./m3。虽然不同季节的优势种种类差异较大, 但是锥形宽水蚤、红纺锤水蚤、小齿海樽等是常出现的优势种。
2.2.3 中型浮游动物群落与浮游植物之间CCA分析CCA分析结果用于表明中型浮游动物群落与不同粒径或类群浮游植物的相关关系(图 7)。轴特征值和轴累计值都表明浮游植物对中型浮游动物群落的解释能力。分析结果显示前两个排序轴特征值分别为0.25和0.19, 且前两个轴累计值占特征值总和的63.9%, 表明这两个轴集中了接近2/3的浮游植物与中型浮游动物群落分布的影响信息。如图 7所示, 与小型浮游植物(20—200μm)关系接近的类群是甲藻和硅藻, 与微型(2—20μm)和超微型(0.7—2μm)浮游植物相接近的则是定鞭藻、青绿藻、聚球藻、隐藻, 这与实际浮游植物类群粒径大小相符合, 说明HPLC色素分析浮游植物类群的方法符合实际情况。
中型浮游动物优势种主要集中于二、三、四象限(图 7), 而在二、三这两个象限内主要的浮游植物类群是甲藻, 其与大多数桡足类优势种的分布存在正相关性, 如丰度较高的鸟喙尖头溞(S11)。硅藻仅与鸟喙尖头溞(S11)和蛇尾纲长腕幼虫(S14)这两种中型浮游动物存在正相关关系, 与其他中型浮游动物的分布呈负相关性。除二、三象限外, 中型浮游动物优势种还主要分布在第四象限, 主要与超微型浮游植物中的聚球藻和隐藻存在正相关关系。图 7中与微型浮游植物关系较近的中型浮游动物相对较少。
在春季(2015, 2017年)藻华期间, 小型浮游植物中硅藻和甲藻提高对这个季节的优势种鸟喙尖头溞(S11)丰度的可能性较大。在秋季(2015, 2016年)和2016年夏季, 超微型浮游植物中的青绿藻、聚球藻和隐藻是对中型浮游动物作用较大的类群。在冬季(2016, 2017年), 主要是小型浮游植物中的甲藻对提高多种中型浮游动物优势种丰度的可能性较大。
2.3 中型浮游动物的摄食 2.3.1 对分级chl a的摄食在清除率方面(图 8a), 中型浮游动物对浮游植物总清除率为负数或较低, 范围在-0.55—0.27L/(mg·d), 仅在2015年秋季较高。中型浮游动物的摄食主要由小型浮游植物贡献, 除春季(2015, 2017年)外, 中型浮游动物对小型浮游植物的清除率均是正数, 波动范围在-0.42—0.80L/(mg·d); 对微型浮游植物的清除率在整个调查期间全为负数, 且在2016年夏季最低, 说明中型浮游动物间接促进了这个粒级的浮游植物的增长; 对超微型浮游植物的清除率除2015年春季和秋季以外, 在其他季节均是负值。
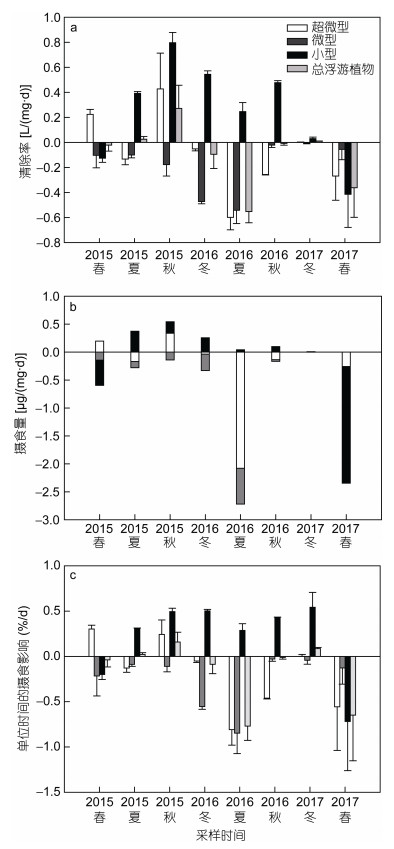 |
| 图 8 中型浮游动物对分级chl a摄食参数:清除率(a), 摄食量(b), 单位时间的摄食影响(c) Fig. 8 Feeding parameters of mesozooplankton on size-fractionated chl a: clearance rate (a), ingestion rate (b), and grazing impact per unit time (c) |
在摄食量方面(图 8b), 中型浮游动物对浮游植物的摄食量较小[-2.68—0.40μg/(mg·d)]。春季(2015, 2017年)小型浮游植物生物量较高(图 3a), 但中型浮游动物对其摄食量却是负值, 说明其促进该粒级浮游植物的生长。虽然在夏季(2015, 2016年)的超微型浮游植物和秋季(2015, 2016年)的微型浮游植物占比较大(图 3a), 但中型浮游动物却选择摄食粒径较大的小型浮游植物。
在摄食影响方面(图 8c), 中型浮游动物的平均日摄食影响是-0.16%/d(波动范围在-0.77—0.16%/d), 对浮游植物总的摄食影响几乎为零或促进作用, 只对小型浮游植物表现出一定的摄食作用, 如在2015年夏秋、2016年夏冬、2017年冬季等。在2015年夏秋和2017年冬季, 中型浮游动物对整体浮游植物有一定的摄食影响。2016年秋季, 中型浮游动物对浮游植物的摄食和促进作用相当。
2.3.2 对不同浮游植物类群的摄食中型浮游动物对不同浮游植物类群的选择性摄食仅分析了第一采样周年的数据, 结果见图 9。中型浮游动物对不同类群的浮游植物摄食有较大的差异。总体上, 中型浮游动物倾向于摄食甲藻和青绿藻, 对这两类浮游植物表现出一定的清除率。除此之外, 春季, 中型浮游动物还倾向于定鞭藻和隐藻; 夏季还倾向于定鞭藻和隐藻, 且对绿藻的清除率达全年最高, 为0.27L/(mg·d); 秋季, 还对硅藻、隐藻和聚球藻具有一定的清除率, 而对绿藻的清除率达到全年最低为-0.21L/(mg·d)。
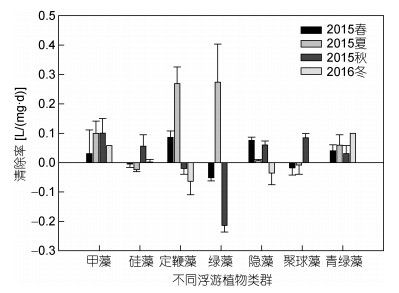 |
| 图 9 中型浮游动物对不同浮游植物类群的清除率 Fig. 9 The clearance rate of mesozooplankton on different types of phytoplankton groups |
在摄食总量上来看(图 10), 尽管硅藻在大亚湾环境中占绝对优势, 但中型浮游动物仅在秋季以摄食硅藻为主, 春季和夏季, 均不以硅藻为主要摄食对象(表现为摄食量为负值)。且由于硅藻在春季的增长量超过甲藻、青绿藻、隐藻等浮游植物类群所贡献的摄食量, 使得中型浮游动物的总摄食量小于0;夏季, 中型浮游动物以摄食定鞭藻、绿藻和青绿藻为主; 秋季, 除硅藻外, 隐藻、聚球藻和青绿藻对中型浮游动物的摄食也具有一定的贡献; 冬季, 则主要由青绿藻和小部分甲藻贡献。
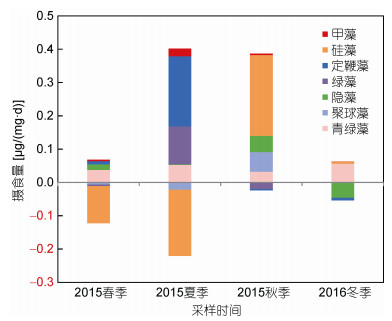 |
| 图 10 中型浮游动物对不同浮游植物类群的摄食量 Fig. 10 The ingestion rate of mesozooplankton on different types of phytoplankton groups |
中型浮游动物是大亚湾浮游生物生态系统中重要的营养级, 选择性摄食特性是其在食物质量不高的条件下获取较好的食物源的生存方式之一。通过选择性摄食, 中型浮游动物, 特别是桡足类, 能显著影响低营养级浮游生物群落的粒级结构和物种组成。
3.1 中型浮游动物群落与浮游植物的关系中型浮游动物优势种呈现出明显的季节性演替(图 6, 7), 展现出其特定的生态位。在丰度较高的冬季(2016, 2017年), 桡足类中华哲水蚤是这个季节的优势种。其次是春季(2015, 2017年), 以枝角类鸟喙尖头溞为优势种。秋季(2015, 2016年)是锥形宽水蚤和红纺锤水蚤占优势。尽管硅藻在各个季节都占据很高的比例, 但中型浮游动物丰度与硅藻无相关性(P>0.05)。秋季(2015, 2016年)和2016年夏季, 小粒径的浮游植物(0.7—2μm)对中型浮游动物群落的摄食贡献较大, 如聚球藻、隐藻等。
总体上, 中型浮游动物对浮游植物的摄食压力较弱, 作用力几乎为零, 甚至间接促进浮游植物的生长(表现为负的摄食率), 这种现象在也发生在其他海域例如东海和黄海(Zhang et al, 2006)。在春季(2015, 2017年)藻华时期, 尽管中型浮游动物对浮游植物的总体摄食率是负值, 但是中型浮游动物的生物量仍然高于其他季节, 说明大亚湾海域的中型浮游动物不是主要依靠摄食浮游植物来满足其营养的需求, 而可能以摄食小型浮游动物, 如纤毛虫、异养鞭毛虫等为主。这样中型浮游动物对浮游植物的摄食压力减小, 其数量将增多。随之, 微食物环内的小型浮游动物数量增加, 最后小型浮游动物被中型浮游动物摄食, 致使中型浮游动物的生物量增加。研究证实中型浮游动物更易于选择小型浮游动物而不是浮游植物作为食物源, 是由于小型浮游动物营养价值更高、个体更大且更容易被中型浮游动物捕获(Calbet et al, 2005; Gifford et al, 2007)。2017年冬季, 中型浮游动物丰度异常高, 但浮游植物的生物量较低, 可能由于中型浮游动物(主要是中华哲水蚤)通过沿岸流从中国东海经过台湾海峡进入南海北部, 并进入大亚湾, 从而带来较高的生物量(Li et al, 2016)。
3.2 中型浮游动物对浮游植物粒径的选择性中型浮游动物对于不同粒径的浮游植物的摄食具有明显的选择性, 选择性摄食有助于其种群获得最大程度的摄食量, 以满足自身新陈代谢的基本要求, 并获取足够的营养完成其生长和发育。本研究在为期两年的调查中发现, 中型浮游动物总体上偏好于粒径更大的小型浮游植物(20—200μm), 这与Liu等(2008)的结果相类似, 而中型浮游动物在微型(2—20μm)或超微型(0.7—2μm)浮游植物占优势的情况下, 均不能有效地摄食。
大亚湾实验站占据优势的中型浮游动物大多是滤食性桡足类, 如在各个季节平均丰度较大的锥形宽水蚤、中华哲水蚤等(Dam et al, 2003; Huo et al, 2008)。以这种方式进行摄食的浮游动物对于食物的选择性取决于食物颗粒的大小。例如, 桡足类的食物体长范围是基于其摄食肢体如颚足之间的刚毛间距决定, 它们通过摆动胸足创造出微型水流, 使水体中的颗粒流向其口部, 然后用颚足将颗粒保持并摄食(Koehl et al, 1981)。大量调查显示, 桡足类无法滤食5μm以下的颗粒, 是由于颗粒太小漏过了其颚足的刚毛间距。相反, 桡足类对大型颗粒的食物表现出较高的清除率(Sommer et al, 2001; Chen et al, 2017)。海洋枝角类则可以摄食粒径2—5μm左右的颗粒, 但是不同种类的枝角类也具有明显不同的颗粒选择范围, Turner等(1988)报道鸟喙尖头溞能有效地滤食2μm左右的颗粒, 因此该种类能显著地影响微食物环的结构。本研究在2015年春季期间, 枝角类鸟喙尖头溞在中型浮游动物中占绝对优势(图 6), 因此, 其结果表明, 相较桡足类而言, 它们可以摄食粒径较小的浮游植物, 如定鞭藻、隐藻等(图 8a, 图 9)。
3.3 中型浮游动物对浮游植物类群的选择除对浮游植物粒径有选择之外, 中型浮游动物对不同浮游植物类群也有相应的偏好。不同类群的浮游植物含有中型浮游动物生长、发育和繁殖等生命过程需要的不同营养成分。
在选择性摄食的实验中发现, 尽管硅藻在大亚湾实验站占绝对优势, 但其并非是中型浮游动物所偏好的食物。即使在2015年硅藻藻华期间, 中型浮游动物也不选择摄食硅藻, 而摄食其他类群浮游植物。研究表明, 由于某些硅藻个体较大, 或形成链状, 导致中型浮游动物难以摄食(Bjærke et al, 2015)。同时, 硅藻在被浮游动物摄食后, 在浮游动物体内形成多不饱和醛类物质, 对其产生毒害作用; 或摄食硅藻后体内仍缺乏必需的营养成分, 如DHA(二十二碳六烯酸, 一种必需脂肪酸)等(Ianora et al, 2004; Shishlyannikov et al, 2018)。甲藻虽然不是浮游植物的优势种群, 但中型浮游动物对于它们的摄食量是比较高的(Liu et al, 2010)。在大亚湾实验站, 中型浮游动物更加喜好摄食甲藻(图 9), 这可能与甲藻中富含DHA从而能满足桡足类生长和繁殖的需要有关(Parrish, 2009)。尽管许多种类甲藻能产生多种毒素, 如麻痹性贝毒素, 桡足类可能通过草率摄食(sloppy feeding)或者回刍(regurgitation)等摄食方式来释放甲藻产生的毒素(Teegarden et al, 2003)从而不受其危害。
4 结论中型浮游动物的摄食特性与其群落的结构相关, 且对所摄食的浮游植物具有粒径和类群的选择性。选择性摄食的特性与中型浮游动物优势种的摄食特性有关, 大亚湾大多数优势种是滤食性桡足类, 故偏好粒径较大的小型浮游植物(20—200μm)。当浮游植物以微型或超微型浮游植物占优势时, 中型浮游动物的营养级可能提高, 上升为次级消费者, 主要摄食小型浮游动物, 对浮游植物生长起促进作用。由于中型浮游动物对浮游植物的摄食压力较弱, 导致整体上对浮游植物的控制作用几乎为零或是促进作用。在大亚湾为期两年的实验中, 硅藻占绝对优势, 但中型浮游动物仍偏爱营养较高的甲藻。
致谢 感谢厦门大学海洋与地球学院的郭东晖副教授、浙江大学的高寒博士等对本论文的指导和建议, 感谢厦门大学环境与生态学院近岸生态学课题组对色素样品测定和分析的支持和帮助。| 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会, 2008. GB/T12763. 6-2007海洋调查规范第6部分: 海洋生物调查. 北京: 中国标准出版社, 1-37 |
| 张武昌, 1998. 浮游动物现场摄食压力的研究方法. 海洋科学, 22(5): 17–19 |
| 杜飞雁, 王雪辉, 贾晓平, 等, 2013. 大亚湾海域浮游动物种类组成和优势种的季节变化. 水产学报, 37(8): 1213–1219 |
| 连喜平, 谭烨辉, 黄良民, 等, 2011. 大亚湾大中型浮游动物的时空变化及其影响因素. 海洋环境科学, 30(5): 640–645 |
| 陈纪新, 黄邦钦, 刘媛, 等, 2006. 应用特征光合色素研究东海和南海北部浮游植物的群落结构. 地球科学进展, 21(7): 738–746 |
| 陈清潮, 章淑珍, 1965. 黄海和东海的浮游桡足类, Ⅰ.哲水蚤目. 海洋科学集刊, 7: 20–131 |
| 陈清潮, 章淑珍, 朱长寿, 1974. 黄海和东海的浮游桡足类, Ⅱ.剑水蚤目和猛水蚤目. 海洋科学集刊, 9: 27–100 |
| 郑重, 李少菁, 许振祖, 1984. 海洋浮游生物学. 北京: 海洋出版社, |
| 黄道建, 郭振仁, 陈菊芳, 等, 2010. 大亚湾代表水域浮游动物生物量的垂直分布与季节动态研究. 海洋环境科学, 29(6): 825–828 |
| Bjærke O, Jonsson P R, Alam A, et al, 2015. Is chain length in phytoplankton regulated to evade predation?. Journal of Plankton Research, 37(6): 1110–1119 |
| Calbet A, Saiz E, 2005. The ciliate-copepod link in marine ecosystems. Aquatic Microbial Ecology, 38(2): 157–167 |
| Chen M R, Liu H B, Chen B Z, 2012. Effects of dietary essential fatty acids on reproduction rates of a subtropical calanoid copepod, Acartia erythraea. Marine Ecology Progress Series, 455: 95–110 DOI:10.3354/meps09685 |
| Chen M R, Liu H B, Chen B Z, 2017. Seasonal variability of mesozooplankton feeding rates on phytoplankton in subtropical coastal and estuarine waters. Frontiers in Marine Science, 4: 186 DOI:10.3389/fmars.2017.00186 |
| Dam H G, Lopes R M, 2003. Omnivory in the calanoid copepod Temora longicornis:feeding, egg production and egg hatching rates. Journal of Experimental Marine Biology and Ecology, 292(2): 119–137 DOI:10.1016/S0022-0981(03)00162-X |
| Ducklow H W, Steinberg D K, Buesseler K O, 2001. Upper ocean carbon export and the biological pump. Oceanography, 14(4): 50–58 DOI:10.5670/oceanog |
| Frost B W, 1972. Effects of size and concentration of food particles on the feeding behavior of the marine planktonic copepod Calanus pacificus. Limnology and Oceanography, 17(6): 805–815 DOI:10.4319/lo.1972.17.6.0805 |
| Gifford S M, Rollwagen-Bollens G, Bollens S M, 2007. Mesozooplankton omnivory in the upper San Francisco estuary. Marine Ecology Progress Series, 348: 33–46 DOI:10.3354/meps07003 |
| Hong Y, Burford M A, Ralph P J, et al, 2013. The cyanobacterium Cylindrospermopsis raciborskii is facilitated by copepod selective grazing. Harmful Algae, 29(4): 14–21 |
| Huo Y Z, Wang S W, Sun S, et al, 2008. Feeding and egg production of the planktonic copepod Calanus sinicus in spring and autumn in the Yellow Sea, China. Journal of Plankton Research, 30(6): 723–734 DOI:10.1093/plankt/fbn034 |
| Ianora A, Miralto A, Poulet S A, et al, 2004. Aldehyde suppression of copepod recruitment in blooms of a ubiquitous planktonic diatom. Nature, 429(6990): 403–407 DOI:10.1038/nature02526 |
| Koehl M A R, Strickier J R, 1981. Copepod feeding currents:food capture at low Reynolds number 1. Limnology and Oceanography, 26(6): 1062–1073 DOI:10.4319/lo.1981.26.6.1062 |
| Li K Z, Yan Y, Yin J Q, et al, 2016. Seasonal occurrence of Calanus sinicus in the northern South China Sea:A case study in Daya Bay. Journal of Marine Systems, 159: 132–141 DOI:10.1016/j.jmarsys.2016.03.014 |
| Liu H B, Chen M R, Suzuki K, et al, 2010. Mesozooplankton selective feeding in subtropical coastal waters as revealed by HPLC pigment analysis. Marine Ecology Progress Series, 407: 111–123 DOI:10.3354/meps08550 |
| Liu H B, Dagg M J, Napp J M, et al, 2008. Mesozooplankton grazing in the coastal Gulf of Alaska:Neocalanus spp.vs. other mesozooplankton. ICES Journal of Marine Science, 65(3): 351–360 DOI:10.1093/icesjms/fsm175 |
| Liu H X, Huang L M, Song X Y, et al, 2012. Using primary productivity as an index of coastal eutrophication:a case study in Daya Bay. Water and Environment Journal, 26(2): 235–240 DOI:10.1111/wej.2012.26.issue-2 |
| Parrish C C, 2009. Essential fatty acids in aquatic food webs. In: Kainz M, Brett M, Arts M eds. Lipids in Aquatic Ecosystems. New York, USA: Springer, 309-326 |
| Rose V, Rollwagen-Bollens G, Bollens S M, 2017. Interactive effects of phosphorus and zooplankton grazing on cyanobacterial blooms in a shallow temperate lake. Hydrobiologia, 788(1): 345–359 DOI:10.1007/s10750-016-3011-4 |
| Shishlyannikov S M, Nikonova A A, Bukin Y S, et al, 2018. Fatty acid trophic markers in Lake Baikal phytoplankton:A comparison of endemic and cosmopolitan diatom-dominated phytoplankton assemblages. Ecological Indicators, 85: 878–886 DOI:10.1016/j.ecolind.2017.11.052 |
| Sommer U, Sommer F, Santer B, et al, 2001. Complementary impact of copepods and cladocerans on phytoplankton. Ecology Letters, 4(6): 545–550 DOI:10.1046/j.1461-0248.2001.00263.x |
| Steinberg D K, Landry M R, 2017. Zooplankton and the ocean carbon cycle. Annual review of marine science, 9(1): 413–444 DOI:10.1146/annurev-marine-010814-015924 |
| Teegarden G J, Cembella A D, Capuano C L, et al, 2003. Phycotoxin accumulation in zooplankton feeding on Alexandrium fundyense-vector or sink?. Journal of Plankton Research, 25(4): 429–443 DOI:10.1093/plankt/25.4.429 |
| Turner J T, 2004. The importance of small planktonic copepods and their roles in pelagic marine food webs. Zoological Studies, 43(2): 255–266 |
| Turner J T, Tester P A, Ferguson R L, 1988. The marine cladoceran Penilia avirostris and the "microbial loop" of pelagic food webs. Limnology and Oceanography, 33(2): 245–255 DOI:10.4319/lo.1988.33.2.0245 |
| Vadstein O, Stibor H, Lippert B, et al, 2004. Moderate increase in the biomass of omnivorous copepods may ease grazing control of planktonic algae. Marine Ecology Progress Series, 270: 199–207 DOI:10.3354/meps270199 |
| Vargas C A, Martínez R A, Cuevas L A, et al, 2007. The relative importance of microbial and classical food webs in a highly productive coastal upwelling area. Limnology and Oceanography, 52(4): 1495–1510 DOI:10.4319/lo.2007.52.4.1495 |
| Wang Y S, Lou Z P, Sun C C, et al, 2008. Ecological environment changes in Daya Bay, China, from 1982 to 2004. Marine Pollution Bulletin, 56(11): 1871–1879 DOI:10.1016/j.marpolbul.2008.07.017 |
| Wu M L, Wang Y S, Wang Y T, et al, 2016. Seasonal and spatial variations of water quality and trophic status in Daya Bay, South China Sea. Marine pollution bulletin, 112(1-2): 341–348 DOI:10.1016/j.marpolbul.2016.07.042 |
| Zapata M, Rodríguez F, Garrido J L, 2000. Separation of chlorophylls and carotenoids from marine phytoplankton:a new HPLC method using reversed phase C8 column and pyridine-containing mobile phases. Marine Ecology Progress Series, 195: 29–45 DOI:10.3354/meps195029 |
| Zhang W C, Li H B, Xiao T, et al, 2006. Impact of microzooplankton and copepods on the growth of phytoplankton in the Yellow Sea and East China Sea. Hydrobiologia, 553(1): 357–366 DOI:10.1007/s10750-005-0857-2 |
 2018, Vol. 49
2018, Vol. 49



