中国海洋湖沼学会主办。
文章信息
- 郑学斌, 张清科, 乐韵, 蒋宏雷, 金珊, 王建平, 竺俊全. 2018.
- ZHENG Xue-Bin, ZHANG Qing-Ke, YUE Yun, JIANG Hong-Lei, JIN Shan, WANG Jian-Ping, ZHU Jun-Quan. 2018.
- 香鱼(Plecoglossus altivelis)精子的超微结构及其与鲤形目及鲑形目其他鱼类精子结构的比较研究
- SCANNING AND TRANSMISSION ELECTRON MICROSCOPIC OBSERVATION OF SPERMATOZOON IN PLECOGLOSSUS ALTIVELIS
- 海洋与湖沼, 49(4): 866-872
- Oceanologia et Limnologia Sinica, 49(4): 866-872.
- http://dx.doi.org/10.11693/hyhz20180100025
-
文章历史
- 收稿日期:2018-01-30
- 收修改稿日期:2018-02-25
2. 宁波市海洋与渔业执法支队 宁波 315020;
3. 宁波市海洋与渔业研究院 宁波 315012
2. Ningbo Enforcing Detachment of Oceanology and Fisheries, Ningbo 315020, China;
3. Ningbo Academy of Oceanology and Fisheries, Ningbo 315012, China
硬骨鱼类的精子结构一般由头部、中段和尾部(鞭毛)三部分组成。精子头部因鱼的种类不同, 呈圆形、卵圆形、椭圆形及长椭圆形等(Mattei, 1991; Fürböck et al, 2009)。多数硬骨鱼类精子无顶体, 头部主要由细胞核组成, 核的后端有一凹窝为植入窝, 不同种鱼类精子核的外形及核内染色的形态及致密程度、植入窝的深浅等特征存在差异(刘雪珠等, 2002; 尹洪滨等, 2005); 精子中段的主要结构为中心粒复合体及袖套, 中心粒复合体一般由近端和远端中心粒组成, 袖套为圆筒状结构, 内部有线粒体, 不同种硬骨鱼类近、远端中心粒的有无及排列方式、袖套的形状和发达程度、线粒体的形态和数目等存在种属差异(刘雪珠等, 2002; Fürböck et al, 2009); 尾部为鞭毛结构, 由轴丝外包质膜组成, 鞭毛侧鳍的有无及发达程度存在种间差异(Mattei, 1988; 尹洪滨等, 2008; Fürböck et al, 2009)。对鱼类精子超微结构的详细了解有助于受精机制的深入研究, 也可为系统分类提供有价值的信息。迄今为止, 鲤形目鱼类精子超微结构的研究报道较多, 如鲤科鱼类(Baccetti et al, 1984; 尤永隆等, 1996; Lee et al, 1998; Hu et al, 2005; Rutaisire et al, 2006; Fürböck et al, 2009; 梁健等, 2013; Fu et al, 2016; Bhatt et al, 2017)、鳅科鱼类(王志坚等, 2009; 李飞等, 2011; 胡雨等, 2016)、胭脂鱼科鱼类(李飞等, 2009)。鲑形目鱼类精子超微结构研究已见川陕哲罗鲑(Hucho bleekeri)(郭威等, 2016)、虹鳟(Salmo gairdneri)(谷伟等, 2014)、白斑红点鲑(Salvelinus leucomaenis)(张永泉等, 2011)、大麻哈鱼(Oncorhynchus keta)(尹洪滨等, 2005)、樱花钩吻鲑(Oncorhynchus masou)(Gwo et al, 1996)、哲罗鱼(Hucho taimen)(尹洪滨等, 2008)等鲑科鱼类中研究报道。
香鱼(P. altivelis)属鲑形目(Salmoniformes)、胡瓜鱼亚目(Osmeroidei)、香鱼科(Plecoglossidae), 国内分布广, 日本、朝鲜也有分布。香鱼作为名贵的经济鱼类及增养殖种类, 其基础研究备受重视, 如遗传多样性(闫松松等, 2014; 宋娜等, 2014)、营养生理(Lee et al, 2002; Yamamoto et al, 2016)、基因(杨智景等, 2015; 赵桐等, 2015)与免疫(Lu et al, 2017; Nie et al, 2017; Chen et al, 2018)等方面的研究均有涉及。香鱼为卵生、体外受精类型, 一年性成熟, 雄鱼性成熟早于雌鱼, 秋季在河口咸淡水交汇处繁殖, 大量亲鱼集群产卵, 一尾雌鱼常有多尾雄鱼追逐, 性比可达10:1以上, 繁殖完成后绝大多数鱼死亡(曹克驹等, 1982)。从香鱼的繁殖特点猜测其精子结构可能具有特异性。本研究采用扫描和透射电镜技术, 观察了香鱼成熟精子的形态与结构, 并与鲤形目、鲑形目等淡水鱼类精子结构进行比较, 旨在了解香鱼精子结构的特点, 积累鱼类精子结构比较研究基础资料。
1 材料与方法 1.1 材料实验用性成熟雄性香鱼于2016年10月取自浙江省宁海大佳河香鱼养殖场, 共10尾, 个体重80—100g, 暂养于水泥池中, 供采精用。
1.2 方法 1.2.1 精液采集及固定轻压鱼腹精液能自然流出者用于采精, 用洁净的注射器将挤出的精液移入离心管中, 用预冷(4℃的2.5%戊二醛固定过夜, 用于后续实验。
1.2.2 扫描电镜样品制备及观察将固定的样品用0.1mol/L PBS漂洗三次, 梯度酒精脱水, 叔丁醇置换, 冷冻干燥, 喷金, 日立S-3400N型扫描电镜观察并拍照。
1.2.3 透射电镜样品制备及观察将固定的样品用0.1mol/L PBS漂洗三次, 用1%锇酸固定1—2h, 0.1mol/L PBS漂洗三次后梯度酒精脱水, 环氧树脂(Epon-812)渗透、包埋, 超薄切片机(LKB-Ⅱ)切片, 醋酸铀及柠檬酸铅双重染色, 日立H-7650型透射电镜观察并拍照。
2 结果 2.1 扫描电镜下香鱼精子的形态结构扫描电镜观察表明, 香鱼精子为典型的鞭毛型, 全长约23.5μm。从前往后由头部、中段和尾部三部分组成(图 1-1)。头部似弹头形, 长约1.8μm, 宽约0.8μm(图 1-1, 2, 3, 4, 5), 其后端中央可见凹窝, 即核后窝(nuclear fossa)或植入窝(implantation fossa)(图 1-4)。中段较短, 长约0.5μm, 为“半袖套”结构, 内部为线粒体(图 1-2, 3, 4, 5), 其外观似“半套筒”, 形状不甚规则(图 1-2, 3, 4)。尾部为从植入窝处延伸出的细长鞭毛, 直径约0.2μm(图 1-1, 4)。香鱼精子结构上十分灵巧, 利于快速运动及在受精过程入卵。
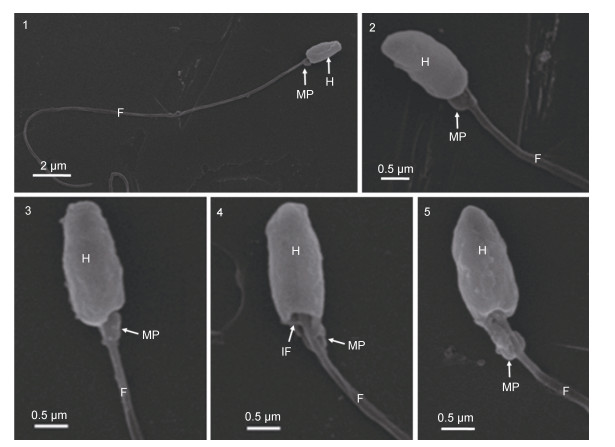 |
| 图 1 香鱼精子的扫描电镜观察 Fig. 1 Scanning electron microscopic observation of the spermatozoon in P. altivelis 注: 1:示弹头形头部、中段及鞭毛; 2:示头部及鞭毛、中段“半袖套”结构; 3:示头部及鞭毛、中段“半袖套”结构; 4:示头部、植入窝及鞭毛、中段“半袖套”结构; 5:示头部及鞭毛、中段“半袖套”结构; H:头部; MP:中段; F:鞭毛; IF:植入窝 |
精子头部的主要结构为细胞核, 核的前端无顶体(图 2-1, 2); 纵切面观显示, 核从后端中央向前深凹至近前端, 形成植入窝, 使核呈倒U字形; 核内染色质呈团块状, 核前端染色质分布较稀疏, 后端分布较密集(图 2-1, 2), 质膜呈波纹状包裹在核膜外, 质膜与核膜之间的细胞质很少(图 2-1)。植入窝内有中心粒复合体及小段起始的鞭毛, 中心粒复合体由近端中心粒和远端中心粒(基体)组成, 两者之间的夹角约135°(图 2-1, 3, 4); 近端中心粒位于植入窝的顶端(图 2-1, 3, 4), 远端中心粒在近端中心粒之后, 由其向后延伸出轴丝(图 2-5, 6)。香鱼精子核的形态呈倒U字形, 植入窝极深, 这种特殊形态的核在硬骨鱼类精子中较少见。
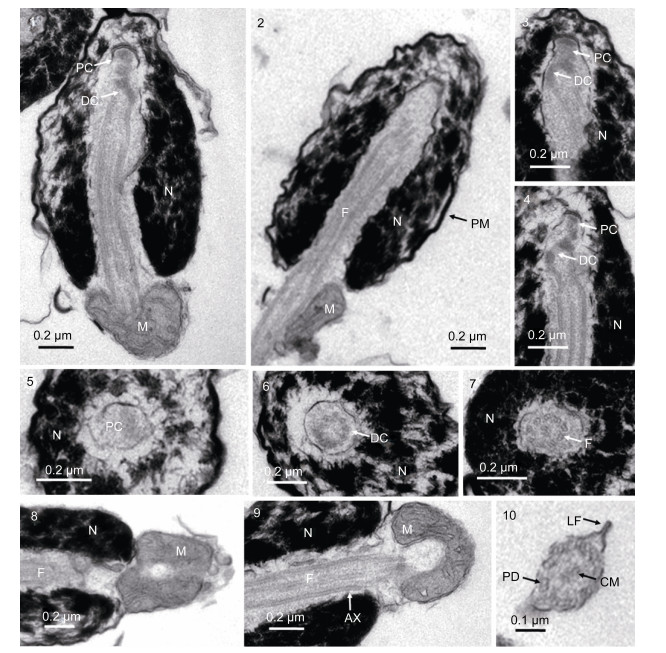 |
| 图 2 香鱼精子的透射电镜观察 Fig. 2 Transmission electron microscopic observation of the spermatozoon in P. altivelis 注: 1:头部及中段纵切, 示细胞核、近端中心粒、远端中心粒、鞭毛及线粒体; 2:头部及中段纵切, 示细胞核、质膜、鞭毛及线粒体; 3:头部前段纵切, 示中心粒复合体结构, 两者夹角约135°; 4:头部前段纵切, 示中心粒复合体结构; 5:头部前段横切, 示近端中心粒及细胞核; 6:头部前段横切, 示远端中心粒及细胞核; 7:头部中后段横切, 示鞭毛“9+2”微管结构及细胞核; 8:头部及中段纵切, 示线粒体; 9:头部及中段纵切, 示鞭毛轴丝及线粒体; 10:尾部横切, 示鞭毛“9+2”微管结构、外周二联管、中央微管及侧鳍。N:细胞核; PC:近端中心粒; DC:远端中心粒; M:线粒体; F:鞭毛; PM:质膜; AX:轴丝; LF:侧鳍; PD:外周二联管; CM:中央微管 |
精子中段结构较为简单, 由质膜包被线粒体形成半包绕鞭毛的“半袖套”结构(图 2-1, 2, 8, 9); 线粒体体积大, 数量只有1个, 呈不太规则的“半套筒”形, 这一大而形态较为特殊的线粒体可能是精子形成过程中数个线粒体相合融合后形变而形成的, 线粒体的內嵴明显可见(图 2-1, 9); 线粒体是精子运动的动力源, 为精子排放到水中后快速运动提供能量。香鱼精子线粒数目单个与多数硬骨鱼类精子至少有数个线粒体不同。
2.2.3 尾部尾部为精子的运动器官, 香鱼精子的尾部为一细长的鞭毛, 由轴丝及外包轴丝的质膜组成, 轴丝由9组外周二联微管和1对中央微管构成, 是典型的“9+2”微管结构(图 2-7, 10)。鞭毛两侧有质膜向外突起形成的侧鳍, 可能在精子运动过程中起一定的平衡作用(图 2-10)。
3 讨论 3.1 香鱼与鲤形目鱼类精子超微结构的比较鲤形目鱼类精子结构研究已涉及较多种类。我们选取部分具有代表性的鲤形目鱼类, 对其精子结构的主要特征进行列表比较(表 1), 并绘制精子结构模式图(图 3-1, 2, 3a, 3b)。
| 分类 | 头部 | 细胞核 | 中心粒 | 袖套 | 线粒体 | 侧鳍 | 全长(μm) |
| 胭脂鱼科Catostomidae | |||||||
| 胭脂鱼M. asiaticus[1] | 圆形 | 浅U形 | 约90° | 对称 | 1个 | 有 | 55.5 |
| 鲤科Cyprinidae | |||||||
| 圆鳍雅罗鱼Leuciscus cephalus [2] | 圆形 | 圆形 | 约120° | 不对称 | 2—3个 | 无 | 50.0 |
| 草鱼Ctenopharyngodon idella [3] | 卵圆形 | 卵圆形 | 约115° | 不对称 | 3—4个 | 无 | 32.8 |
| 欧白鱼Alburnus alburnus [4] | 卵圆形 | 卵圆形 | 约110° | 不对称 | 1—4个 | — | 37.9 |
| 玫瑰无须魮Puntius conchonius[5] | 卵圆形 | 卵圆形 | 钝角 | 不对称 | 2—4个 | 无 | 29.8 |
| Barbus plebejus[6] | 圆形 | 圆形 | 约90° | 不对称 | 2个 | 无 | 60.0 |
| Labeo victorianus[7] | 圆形 | 圆形 | 约130° | 不对称 | 6个 | 无 | — |
| Squalidus gracilis majimae[8] | 圆形 | 圆形 | 约140° | 不对称 | ≥10个 | 无 | 36.6 |
| 横口裂腹鱼Schizothorax plagiostomus[9] | 卵圆形 | 卵圆形 | — | 不对称 | 4—6个 | 无 | 22.3 |
| 青海湖裸鲤G. przewalskii[10] | 椭圆形 | 椭圆形 | 100—120° | 不对称 | 约3个 | 有 | — |
| 鲤鱼Cyorinus carpio[11] | 卵圆形 | 卵圆形 | 约130° | 不对称 | 5—8个 | 无 | 34.8 |
| 鲫鱼Carassius carassius[12] | 圆形 | 圆形 | 约115° | 不对称 | 4—8个 | 无 | 约42.4 |
| 鲢鱼Hypophthalmichthys Molitrix[13] | 卵圆形 | 卵圆形 | 120° | 不对称 | 5—7个 | 无 | 32.4 |
| 鳅科Cobitidae | |||||||
| 长薄鳅Leptobotia elongata [14] | 圆形 | 圆形 | — | 不对称 | — | 有 | — |
| 大鳞副泥鳅Paramisgurnus Dabryanus[15] | 近圆形 | 近圆形 | 钝角 | 不对称 | ≥6个 | 无 | 31.7 |
| 泥鳅Misgurnus Anguillicaudatus[16] | 圆形 | 圆形 | 90° | 不对称 | — | 无 | 30.6 |
| 香鱼科Plecoglossidae | |||||||
| 香鱼P. altivelis(本文) | 弹头形 | 倒U形 | 135° | 不对称 | 1个 | 有 | 23.5 |
| 注: ①表中划“—”栏目表示数据缺失, 下同; ②拉丁名后序号表示参考文献引用, 下同; [1]: 李飞等, 2009; [2]: Baccetti et al, 1984; [3]: Fürböck et al, 2009; [4]: Fürböck et al, 2009; [5]: Hu et al, 2005; [6]: Baccetti et al, 1984; [7]: Rutaisire et al, 2006; [8]: Lee et al, 1998; [9]: Bhatt et al, 2017; [10]: 梁健等, 2013; [11]: 尤永隆等, 1996; Fürböck et al, 2009; [12]: Fürböck et al, 2009; [13]: Fürböck et al, 2009; [14]: 王志坚等, 2009; [15]: 李飞等, 2011; [16]: 胡雨等, 2016 | |||||||
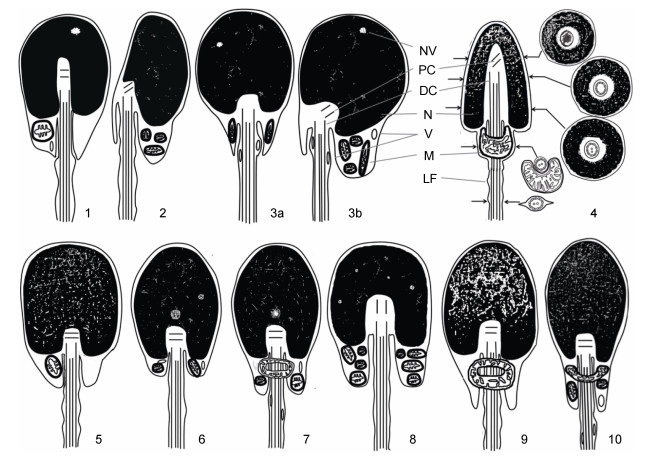 |
| 图 3 部分鲤形目及鲑形目鱼类精子结构模式图 Fig. 3 Diagram of spermatozoon in some Cypriniformes and Salmoniformes 注: 1:胭脂鱼精子结构模式图; 2:青海湖裸鲤精子结构模式图; 3a:典型的鲤形目鱼类精子结构模式图(轴向纵切); 3b:典型的鲤形目鱼类精子结构模式图(径向纵切); 4:香鱼精子结构模式图; 5:川陕哲罗鲑精子结构模式图; 6:虹鳟精子结构模式图; 7:白斑红点鲑精子结构模式图; 8:大麻哈鱼精子结构模式图; 9:樱花钩吻鲑精子结构模式图; 10:哲罗鱼精子结构模式图。NV:核空泡; PC:近端中心粒; DC:远端中心粒; N:细胞核; V:囊泡; M:线粒体; LF:侧鳍 |
从图 3可见, 鲤形目鱼类精子由头部、中段及尾部组成。胭脂鱼科鱼类胭脂鱼(Myxocyprinus asiaticus)精子结构对称, 细胞核呈浅U形, 尾部鞭毛具侧鳍(李飞等, 2009)(图 3-1)。鲤科是鲤形目鱼类中的典型代表, 其精子结构总体不对称, 头部和细胞核呈圆形或卵圆形, 核内染色质非常致密, 近端与远端中心粒之间的夹角在90°—140°之间, 绝大多数无侧鳍; 除此之外, 多数鲤科鱼类精子核内常含有空泡, 袖套及鞭毛内也常有囊泡分布, 袖套内线粒体常集中于一侧(表 1)(图 3-3a, 3b); 鲤科鱼类精子也有特殊类型, 如青海湖裸鲤(Gymnocypris przewalskii)(梁健等, 2013), 其头部及细胞核呈椭圆形, 尾部鞭毛起始端明显偏于细胞核一侧, 且尾部鞭毛有侧鳍分布(图 3-2)。鳅科鱼类精子结构与大多数鲤科鱼类相似(表 1), 其精子结构模式图也可以图 3-3a及3b表示。
本研究的香鱼精子的U形细胞核与胭脂鱼(李飞等, 2009)精子的浅U形细胞核相似, 但两种鱼精子头部形态、袖套结构、线粒体的形态及数目等存在差异(表 1, 图 3); 香鱼精子的弹头形头部及倒U形细胞核与鲤科及鳅科鱼类精子圆形或卵圆形头部及细胞核相比明显不同, 核内染色质致密程度不及鲤科及鳅科鱼类精子; 香鱼精子两中心粒之间的夹角为钝角, 这与多数鲤科及鳅科鱼类精子相似; 香鱼精子中段袖套为较简单的“半袖套”结构, 内只含1个大的“半套筒”形线粒体, 鲤科及鳅科鱼类精子中段袖套结构较为发达, 如玫瑰无须魮(Puntius conchonius) (Hu et al, 2005)精子袖套内含有丰富的线粒体、糖原颗粒等物质, 细胞质较多; 香鱼精子尾部鞭毛轴丝呈典型的“9+2”微管结构, 鲤科及鳅科鱼类精子也是如此, 但香鱼精子的鞭毛具有对称分布的侧鳍, 与多数鲤科及鳅科鱼类精子鞭毛无侧鳍不同(表 1, 图 3)。
3.2 香鱼与其他鲑形目鱼类精子超微结构的比较为比较香鱼与其他鲑形目鱼类精子结构的异同, 将其超微特征进行列表分析(表 2), 并绘制了精子结构的模式图(图 3)。
| 分类 | 头部 | 细胞核 | 中心粒 | 植入窝 | 袖套 | 线粒体 | 侧鳍 | 全长(μm) |
| 川峡哲罗鲑H. bleekeri[1] | 卵圆形 | 马蹄形 | 垂直 | 1/4头长 | 圆筒状 | 1个, 圆球形 | 2个, 不对称 | 41.07 |
| 虹鳟S. gairdneri[2] | 椭球形 | 马蹄形 | 垂直 | 1/4头长 | 套筒形 | ≥2个, 椭球形 | 2个, 对称分布, 大小不同 | — |
| 白斑红点鲑S. leucomaenis[3] | 椭球形 | 马蹄形 | 垂直 | 1/3头长 | 筒状 | 较多, 环形或椭球形 | 2个, 对称分布, 大小不同 | 约24.5 |
| 大麻哈鱼O. keta [4] | 椭球形 | 浅U形 | 平行 | 1/3头长 | 套筒形 | 8—12个 | 2个, 对称分布 | — |
| 樱花钩吻鲑O. formosan [5] | 椭球形 | 马蹄形 | 垂直 | 2/3头长 | 套筒形 | 1个, 环形 | 2个, 对称分布, 大小不同 | — |
| 哲罗鱼H. taimen[6] | 卵圆形 | 马蹄形 | 垂直 | 1/4头长 | 筒状 | 较多, C字形或圆球形 | 2个, 对称分布, 大小不同 | 约15.6 |
| 香鱼P. altivelis (本文) | 弹头形 | 倒U形 | 135° | 接近头长 | “半袖套” | 1个, “半套筒”形 | 2个, 对称分布, 大小相同 | 23.5 |
| 注: [1]: 郭威等, 2016; [2]: 谷伟等, 2014; [3]: 张永泉等, 2011; [4]: 尹洪滨等, 2005; [5]: Gwo et al, 1996; [6]: 尹洪滨等, 2008 | ||||||||
香鱼精子头部似弹头形, 细胞核呈倒U形, 植入窝极深, 而其他6种鲑形目鱼类精子的头部多呈卵圆形或椭球形, 细胞核呈马蹄形或浅U形, 植入窝相对较浅; 香鱼精子核前后端染色质分布不均, 该特点和樱花钩吻鲑(Gwo et al, 1996)较为相似, 而其他5种鲑形目鱼类精子核内染色质致密均布; 虹鳟(谷伟等, 2014)、白斑红点鲑(张永泉等, 2011)及大麻哈鱼(尹洪滨等, 2005)精子核内有空泡分布, 香鱼、川陕哲罗鲑(郭威等, 2016)、樱花钩吻鲑(Gwo et al, 1996)及哲罗鱼(尹洪滨等, 2008)精子核内无空泡结构; 香鱼精子两中心粒之间的角度约135°, 而其他6种鲑形目鱼类中大麻哈鱼(尹洪滨等, 2005)精子两中心粒相互平行, 其余5种鱼均为相互垂直。香鱼精子中段“半袖套”结构及“半套筒”形线粒体较特殊, 其他6种鲑形目鱼类精子中段的袖套结构完整, 内部线粒体多为圆球形或椭球形, 也有的呈圆环形或C字形; 香鱼及樱花钩吻鲑(Gwo et al, 1996)线粒体单个, 其他5种鲑形目鱼类线粒体均在两个或两个以上(表 2)。香鱼和其他6种鲑形目鱼类精子尾部的差异主要体现在侧鳍的大小及对称性上, 大麻哈鱼(尹洪滨等, 2005)的侧鳍发达, 向两侧延伸较长, 香鱼及其他5种鲑形目鱼类侧鳍相对较小, 哲罗鱼(尹洪滨等, 2008)及虹鳟(谷伟等, 2014)精子鞭毛两侧的侧鳍不等大, 有背腹之分; 侧鳍能够增加精子的运动能力(Maricchiolo et al, 2004; Psenicka et al, 2007), 并且侧鳍越大发挥的作用可能越强(Mattei, 1988)。
4 结论香鱼精子头部呈弹头形, 核呈倒U字形, 植入窝极深, 两中心粒之间呈135°夹角; 中段“半袖套”结构内含“半套筒”形线粒体; 尾部轴丝呈典型的“9+2”微管结构, 侧鳍对称分布, 大小相同。香鱼精子与典型的鲤形目鱼类精子卵圆形或圆球形头部及细胞核、不对称的袖套及尾部鞭毛无侧鳍等结构特征不同。香鱼精子与鲑形目鱼类精子卵圆形或椭圆形头部及马蹄形或浅U形细胞核、两中心粒相互平行或垂直、袖套结构完整等结构特征不同。香鱼精子结构具有种的特异性。
| 王志坚, 殷江霞, 张耀光, 2009. 长薄鳅的精巢发育和精子发生. 淡水渔业, 39(1): 3–9 |
| 尤永隆, 林丹军, 1996. 鲤鱼精子超微结构的研究. 动物学研究, 17(4): 377–383 |
| 尹洪滨, 尹家胜, 孙中武, 等, 2008. 哲罗鱼精子的超微结构. 水产学报, 32(1): 27–31 |
| 尹洪滨, 孙中武, 潘伟志等, 2005. 大麻哈鱼(Oncorhynchus keta)精子超微结构的研究. 2005年全国学术年会农业分会场论文专集. 新疆: 中国农学会, 20-22 http://cpfd.cnki.com.cn/Article/CPFDTOTAL-ZGNX200508001005.htm |
| 刘雪珠, 杨万喜, 2002. 硬骨鱼类精子超微结构及其研究前景. 东海海洋, 20(3): 32–37 |
| 闫松松, 苗亮, 李明云, 等, 2014. 香鱼(Plecoglossus altivelis)养殖群体遗传多样性的AFLP分析及性别特异性分子标记筛选. 海洋与湖沼, 45(2): 395–399 |
| 李飞, 万全, 庄永龙, 等, 2009. 胭脂鱼精子结构研究. 安徽农业大学学报, 36(2): 260–266 |
| 李飞, 万全, 黄鲜明, 2011. 大鳞副泥鳅精子结构研究. 生物学杂志, 28(4): 26–30 |
| 杨智景, 李长红, 张浩, 等, 2015. 香鱼(Plecoglossus altivelis)肿瘤坏死因子-α(TNF-α)基因的分子克隆、鉴定及免疫相关性表达. 海洋与湖沼, 46(6): 1380–1389 |
| 谷伟, 张永泉, 户国, 等, 2014. 虹鳟精子的扫描和透射电镜观察. 水产学杂志, 27(5): 24–27 |
| 宋娜, 都基隆, 王志勇, 等, 2014. 香鱼野生群体和养殖群体遗传多样性比较. 水产学报, 38(1): 41–46 |
| 张永泉, 尹家胜, 刘奕, 等, 2011. 白斑红点鲑精子形态和超微结构的研究. 上海海洋大学学报, 20(6): 820–825 |
| 赵桐, 李长红, 陆新江, 等, 2015. 香鱼半乳糖凝集素3基因的克隆、鉴定和功能初探. 中国细胞生物学学报, 37(3): 351–359 |
| 胡雨, 高胜涛, 刘亚秋, 等, 2016. 泥鳅精子和卵子结构及受精过程的细胞学观察. 水生生物学报, 40(5): 942–950 DOI:10.7541/2016.122 |
| 郭威, 厉萍, 杨焕超, 等, 2016. 川陕哲罗鲑精子超微结构及形态学研究. 四川动物, 35(4): 550–555 DOI:10.11984/j.issn.1000-7083.20160047 |
| 曹克驹, 李明云, 1982. 凫溪香鱼繁殖生物学的研究. 水产学报, 6(2): 107–118 |
| 梁健, 李长忠, 史建全, 等, 2013. 青海湖裸鲤精子形态和超微结构的研究. 上海海洋大学学报, 22(1): 42–46 |
| Baccetti P B, Burrini A G, Gibertini G, et al, 1984. Fish germinal cells.Ⅰ. Comparative spermatology of seven Cyprinid species. Gamete Research, 10(4): 373–396 DOI:10.1002/(ISSN)1554-3919 |
| Bhatt G, Singh S, Bahugua V, et al, 2017. Semen quality and sperm ultrastructure of Himalayan snowtrout Schizothorax plagiostomus Heckel.1838. Indian Journal of Fisheries, 64(1): 49–55 DOI:10.21077/ijf.2017.64.1.61169-08 |
| Chen F, Lu X J, Nie L, et al, 2018. Molecular characterization of a CC motif chemokine 19-like gene in ayu (Plecoglossus altivelis) and its role in leukocyte trafficking. Fish & Shellfish Immunology, 72: 301–308 |
| Fu S Y, Jiang J H, Yang W X, et al, 2016. A histological study of testis development and ultrastructural features of spermatogenesis in cultured Acrossocheilus fasciatus. Tissue and Cell, 48(1): 49–62 DOI:10.1016/j.tice.2015.10.005 |
| Fürböck S, Lahnsteiner F, Patzner R A, 2009. A fine structural review on the spermatozoa of Cyprinidae with attention to their phylogenetic implications. Histology and Histopathology, 24(10): 1233–1244 |
| Gwo J C, Lin X W, Gwo H H, et al, 1996. The ultrastructure of Formosan landlocked salmon, Oncorhynchus masou formosanus, spermatozoon (Teleostei, Salmoniformes, Salmonidae). Journal of Submicroscopic Cytology and Pathology, 28(1): 33–40 |
| Hu J H, Zhang Y Z, Fu C L, et al, 2005. Ultrastructure of rosy barb Puntius conchonius spermatozoon. Acta Zoologica Sinica, 51(5): 892–897 |
| Lee S M, Kim D J, Cho S H, 2002. Effects of dietary protein and lipid level on growth and body composition of juvenile ayu (Plecoglossus altivelis) reared in seawater. Aquaculture Nutrition, 8(1): 53–58 DOI:10.1046/j.1365-2095.2002.00195.x |
| Lee Y H, Kim K H, 1998. Spermatozoal ultrastructure and phylogenetic relationships of the subfamily Gobioninae (Cyprinidae, Teleostei):1.Ultrastructure of the spermatozoa of the Korean slender gudgeon Squalidus gracilis majimae. Electron Microscopy, 28(1): 63–71 |
| Lu X J, Chen Q, Chen J, et al, 2017. Molecular identification and functional analysis of KLF2 in Plecoglossus altivelis (ayu):it's regulatory role in monocyte/macrophage activation. Fish & Shellfish Immunology, 62: 257–264 |
| Maricchiolo G, Genovese L, Laurà R, et al, 2004. Fine structure of spermatozoa in the common pandora (Pagellus erythrinus Linnaeus, 1758) (Perciformes, Sparidae). Histology and Histopathology, 19(4): 1237–1240 |
| Mattei X, 1988. The flagellar apparatus of spermatoza in fish. Ultrastructure and evolution. Biology of the Cell, 63(2): 151–158 |
| Mattei X, 1991. Spermatozoon ultrastructure and its systematic implications in fishes. Canadian Journal of Zoology, 69(12): 3038–3055 DOI:10.1139/z91-428 |
| Nie L, Zhou Q J, Qiao Y, et al, 2017. Interplay between the gut microbiota and immune responses of ayu (Plecoglossus altivelis) during Vibrio anguillarum infection. Fish & Shellfish Immunology, 68: 479–487 |
| Psenicka M, Alavi S M H, Rodina M, et al, 2007. Morphology and ultrastructure of Siberian sturgeon (Acipenser baerii) spermatozoa using scanning and transmission electron microscopy. Biology of the Cell, 99(2): 103–115 DOI:10.1042/BC20060060 |
| Rutaisire J, Muwazi R T, Booth A J, 2006. Ultrastructural description of spermiogenesis and spermatozoa in Labeo victorianus, Boulenger, 1901 (Pisces:Cyprinidae). African Journal of Ecology, 44(1): 102–105 DOI:10.1111/j.1365-2028.2006.00594.x |
| Yamamoto T, Suzuki N, Furuita H, et al, 2016. Effects of low fishmeal diets on the growth performance and physiological condition of ayu Plecoglossus altivelis. Fisheries Science, 82(5): 819–826 DOI:10.1007/s12562-016-1009-5 |
 2018, Vol. 49
2018, Vol. 49


