
中国海洋湖沼学会主办。
文章信息
- 刘好真, 李祥付, 刘懂, 李进京, 陈晨, 徐鹏, 孙元, 焦海峰, 王一农, 尤仲杰. 2018.
- LIU Hao-Zhen, LI Xiang-Fu, LIU Dong, LI Jin-Jing, CHEN Chen, XU Peng, SUN Yuan, JIAO Hai-Feng, WANG Yi-Nong, YOU Zhong-Jie. 2018.
- 浙江象山东部海域夏季大型底栖动物优势种群和生态位
- NICHE OF DOMINANT MICROBENTHIC SPECIES IN THE EAST SEA OF XIANGSHAN, ZHEJIANG IN SUMMER
- 海洋与湖沼, 49(4): 873-882
- Oceanologia et Limnologia Sinica, 49(4): 873-882.
- http://dx.doi.org/10.11693/hyhz20180100016
-
文章历史
- 收稿日期:2018-01-24
- 收修改稿日期:2018-03-03
2. 中国科学院南海海洋研究所 热带海洋环境国家重点实验室 广州 510301;
3. 宁波市海洋与渔业研究院 宁波 315103
2. State Key Laboratory of Tropics Oceanography South China Sea Institute of Oceanology Chinese Academy of Sciences, Guangzhou 510301, China;
3. Ningbo Academy of Oceanology and Fisheries, Ningbo 315103, China
大型底栖动物作为海洋生态系统重要的组成部分(Yan et al, 2017), 通过参与生态系统的能量流动、物质循环和信息传递, 维系着生态系统的结构和功能(Yang et al, 2017; 徐小雨等, 2011)。因其特殊的生活史, 形成了对环境变化高度的灵敏性(周然等, 2014; Xie et al, 2016), 常被作为海洋生态环境变化的有效指示生物, 用于海洋生态环境的研究(Officer et al, 1982; 彭欣等, 2011; Yang et al, 2016; 李晓静等, 2017; 张鹏弛等, 2017)。生态位理论自提出以来, 被广泛应用于生物与生物、生物与环境相互作用的研究中, 促进了对生态系统发展规律认识的进程(赵永强等, 2009; Anderson, 2013; Shcheglovitova et al, 2013; 彭松耀等, 2015; 汤雁滨等, 2016)。象山东部海域是宁波市所辖海域的重要组成部分, 是浙江省海洋经济发展的重要海域之一, 目前对于该海域大型底栖动物的研究多集中于生物种类的组成、群落结构的解析以及与环境因子的关系等方面(刘录三等, 2002; 史本泽等, 2015; 求锦津等, 2017), 而对于象山东部海域大型底栖动物的生态位研究还未见报道。
为明确象山东部海域夏季大型底栖动物群落特征及种间相互作用情况, 于2012年8月(夏季)对象山东部海域大型底栖动物进行了调查研究, 使用聚类分析和MDS (Multi-dimensional scaling)排序探讨大型底栖动物优势种生物类群; 采用Levins生态位宽度指数和Pianka重叠指数进行生态位分析, 基于Pianka重叠指数, 使用聚类分析和PcoA (principal coordinates analysis)排序对象山东部海域夏季大型底栖动物优势种进行生态位重叠值差异群划分, 并使用SIMPER (similarity percentage)探究主导象山东部海域夏季大型底栖动物优势种生态位结构的生物特点, 旨在研究象山东部海域大型底栖动物种群间的相互作用, 以期促进象山东部海域大型底栖动物群落结构的研究。
1 材料与方法 1.1 研究区域与站位设置象山港东部海域(29°00′00″—29°36′00″N, 121°44′00″—122°12'00″E)北起象山港入海口、南至三门湾外侧海域, 总面积约4500km2。该海域隶属于亚热带海洋性季风气候, 表层年均水温17.6℃, 8月份水温最高(28.1℃), 2月份水温最低(9.6℃)。海域受大陆沿岸径流、黑潮西侧分支台湾暖流、钱塘江及长江等内陆入海河流径流等水系影响, 多水系的交汇产生多变的温盐水体及多样的生境, 为海域内的生物提供了丰富的饵料与良好的栖息环境。为了解象山东部海域夏季大型底栖动物群落特征及种间相互作用情况, 于2012年8月(夏季)在此海域设置30个站位(图 1), 开展大型底栖动物的调查研究。
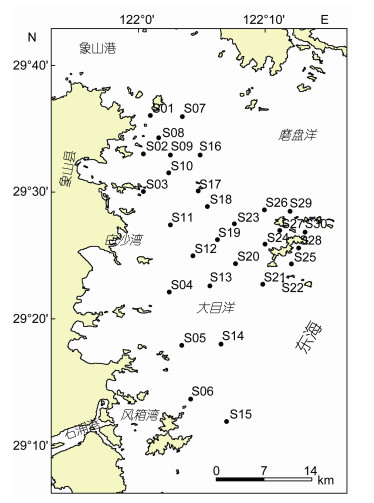 |
| 图 1 研究区域及站点设置 Fig. 1 The study area and site settings |
样本的采集使用定性/半定量阿氏拖网(Agassiz trawl), 网口长1.5m、宽0.5m, 网身长5m, 网囊网目为25mm, 每个站位有效拖网1次, 拖网时间为10min, 船速为2节, 同时采用GPS准确记录拖网到达海底及离开海底的之间拖拽的距离。捕获生物使用0.5mm孔径的网筛冲洗, 后用5%—7%的福尔马林现场固定, 带回实验室进行种类鉴定、计数与分析。所有操作均按《海洋调查规范》(GB/T 12763-2007)执行。
1.3 指标选取 1.3.1 丰度计算按照《海洋调查规范》(GB/T 12763-2007)规定采用阿氏网进行大型底栖动物的采样工作, 将所有生物丰度均标准化为1000m2的统一面积, 单位为ind/1000m2, 具体计算公式如下(Linse et al, 2013):
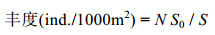
式中, N为大型底栖动物的个体数量; S为拖网拖过水体的面积(网口长×拖拽距离); S0为标准面积(1000m2)。
1.3.2 优势度计算优势度的计算公式如下(徐兆礼等, 1989):
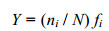
式中, Y为种优势度; ni为第i种生物的个体数; N为研究区域内生物的总个体数的0.5次方; fi为第i种生物在各个站位出现的频率。当Y > 0.02时, 即认定为大型底栖动物优势种(徐晓群等, 2013)。
1.3.3 生态位指标生态位宽度采用Levins指数计量(Levins, 1968), 生态位重叠值采用Pianka重叠指数计量(Pianka, 1973), 计算公式如下:
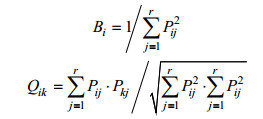
式中, Pij和Pik为种i和种k的个数占j站位个体总数的比例; r为环境位点的总数; Bi为Levins生态位宽度, Bi值越大说明此生物的生态位宽度越宽; Qik为Pianka重叠指数, Qik值越大表明其与其它生物之间的生态位重叠越高, Qik > 0.6, 说明种间生态位重叠较为严重(Wathne et al, 2000)。
1.4 数据分析与处理在计算优势度、Levins生态位宽度和Pianka重叠指数以及后续分析之前, 均先对生物丰度数据进行根方转化, 减小丰度数量级之间的差异。基于转化后的生物丰度数据, 计算Bray-Curtis相异性矩阵, 采用ward.D法进行组间聚类(Murtagh et al, 2014), 并进行MDS排序分析, 用于群落结构分析; 使用PERMANOVA (permutational multivariate analysis of variance)分析检验分组结果的显著性(permutation= 999);采用置换检验法(permutation=999)进行类群间丰度差异的分析。基于Pianka重叠指数, 计算Bray-Curtis相异性矩阵, 采用ward.D法进行组间聚类, 并进行PcoA分析, 实现大型底栖动物优势种生态位重叠差异类群划分; 使用PERMANOVA分析检验分组的显著性(permutation=999);同时使用置换检验分析类群间Pianka重叠指数的差异(permutation= 999)。为明确各大型底栖动物优势种对不同生态位重叠类群的贡献情况, 使用SIMPER法进行各大型底栖动物优势种对距离差异的贡献分析, 并使用置换检验法分析贡献的有效性(permutation=999), 贡献值≥0.03表示此生物为贡献较大的生物(Veiga et al, 2017); 采用Spearman法对生态位宽度与生物丰度及生物捕获频次间的相关性进行分析。以上统计分析均基于R 3.3.2软件进行。
2 结果 2.1 群落结构及优势种本次调查共采集、鉴定出大型底栖动物36种(优势种20种), 隶属于7门8纲24科, 其中节肢动物种类最多(41.7%), 脊索动物次之(19.4%)。优势种包含4个分类群体(节肢动物(11种)、脊索动物(5种)、腔肠动物(1种)、栉水母类(1种)、软体动物(2种))(表 2), 节肢动物在各站位均有出现, 其中S15站位的生物丰度占比最高(100%); 脊索动物在S30站位的丰度占比最高(43.6%); 腔肠动物在S27站位的生物丰度占比最高(60.0%); 栉水母类在S11站位的生物丰度占比最高(81.1%); 软体动物在S11站位的生物丰度占比最高(36.4%)(图 2)。
| 门 | 纲 | 科 | 种 | 优势度 |
| 节肢动物门Arthropoda | Malacostraca | Alpheidae | 日本鼓虾Alpheus japonicus | 0.195 |
| Palaemonidae | 葛氏长臂虾Palaemon gravieri | 0.221 | ||
| Penaeidae | 哈氏仿对虾Parapenaeopsis hardwickii | 0.254 | ||
| 细巧仿对虾Parapenaeopsis tenella | 0.050 | |||
| Porcellanidae | 绒毛细足蟹Raphidopus ciliatus | 0.046 | ||
| Portunidae | 日本蟳Charybdis japonica | 0.036 | ||
| Sergestidae | 中国毛虾Acetes chinensis | 0.040 | ||
| Solenoceridae | 中华管鞭虾Solenocera crassicornis | 0.212 | ||
| Palaemonidae | 脊尾白虾Palaemon carinicauda | 0.109 | ||
| Pasiphaeidae | 细螯虾Leptochela (Leptochela) gracilis | 0.047 | ||
| Squillidae | 东方口虾蛄Oratosquilla oratoria | 0.203 | ||
| 脊索动物门Chordata | Actinopterygii | Synodontidae | 龙头鱼Harpadon nehereus | 0.053 |
| Gobiidae | 红狼牙 虎鱼Odontamblyopus rubicundus 虎鱼Odontamblyopus rubicundus |
0.057 | ||
| Sciaenidae | 棘头梅童鱼Collichthys lucidus | 0.076 | ||
| 黄姑鱼Nibea albiflora | 0.025 | |||
| Cynoglossidae | 半滑舌鳎Cynoglossus semilaevis | 0.071 | ||
| 腔肠动物门Cnidaria | Anthozoa | Veretillidae | 强壮仙人掌Cavernularia obesa | 0.044 |
| 栉水母动物门Ctenophora | Tentaculata | Pleurobrachiidae | 球栉水母Pleurobrachia globosa | 0.139 |
| 软体动物门Mollusca | Bivalvia | Pharidae | 小荚蛏Siliqua minima | 0.030 |
| Gastropoda | Nassariidae | 纵肋织纹螺Nassarius variciferus | 0.040 |
| 优势种 | 平均生态位重叠指数 | 平均贡献值 | |||||||||
| 类群1 | 类群2 | 类群3 | 类群4 | 类群1-2 | 类群1-3 | 类群1-4 | 类群2-3 | 类群2-4 | 类群3-4 | ||
| 半滑舌鳎 | 0.360 | 0.741 | 0.345 | 0.430 | 0.022** | 0.012 | 0.011 | 0.021* | 0.016 | 0.008 | |
| 东方口虾蛄 | 0.464 | 0.787 | 0.623 | 0.584 | 0.018** | 0.011 | 0.009 | 0.008 | 0.010 | 0.004 | |
| 葛氏长臂虾 | 0.218 | 0.560 | 0.303 | 0.677 | 0.019 | 0.007 | 0.030** | 0.013 | 0.011 | 0.021* | |
| 哈氏仿对虾 | 0.432 | 0.782 | 0.516 | 0.548 | 0.020** | 0.009 | 0.009 | 0.014 | 0.012 | 0.006 | |
红狼牙 虎鱼 虎鱼 |
0.423 | 0.536 | 0.591 | 0.416 | 0.010 | 0.015 | 0.010 | 0.010 | 0.008 | 0.013 | |
| 黄姑鱼 | 0.148 | 0.446 | 0.605 | 0.409 | 0.018 | 0.030** | 0.017 | 0.012 | 0.010 | 0.014 | |
| 棘头梅童鱼 | 0.248 | 0.535 | 0.481 | 0.656 | 0.016 | 0.017 | 0.027** | 0.006 | 0.011 | 0.015 | |
| 脊尾白虾 | 0.409 | 0.768 | 0.493 | 0.587 | 0.020 | 0.007 | 0.012 | 0.014 | 0.010 | 0.006 | |
| 龙头鱼 | 0.595 | 0.620 | 0.309 | 0.295 | 0.011** | 0.020* | 0.019* | 0.016 | 0.017 | 0.008 | |
| 强壮仙人掌 | 0.577 | 0.336 | 0.138 | 0.134 | 0.014 | 0.029** | 0.029** | 0.010 | 0.010 | 0.007 | |
| 球栉水母 | 0.510 | 0.316 | 0.197 | 0.204 | 0.015 | 0.021* | 0.022* | 0.007 | 0.010 | 0.008 | |
| 日本鼓虾 | 0.169 | 0.652 | 0.441 | 0.738 | 0.027** | 0.018 | 0.036** | 0.011 | 0.008 | 0.018 | |
| 日本蟳 | 0.057 | 0.448 | 0.391 | 0.706 | 0.022 | 0.022 | 0.042** | 0.007 | 0.015 | 0.020 | |
| 绒毛细足蟹 | 0.129 | 0.441 | 0.625 | 0.463 | 0.017 | 0.032** | 0.021* | 0.011 | 0.007 | 0.012 | |
| 细螯虾 | 0.213 | 0.446 | 0.588 | 0.240 | 0.013 | 0.025** | 0.005 | 0.011 | 0.010 | 0.021** | |
| 细巧仿对虾 | 0.343 | 0.565 | 0.659 | 0.304 | 0.013 | 0.021** | 0.009 | 0.007 | 0.013 | 0.021** | |
| 小荚蛏 | 0.416 | 0.336 | 0.346 | 0.115 | 0.012 | 0.018 | 0.021 | 0.009 | 0.011 | 0.014 | |
| 中国毛虾 | 0.241 | 0.508 | 0.215 | 0.520 | 0.015 | 0.009 | 0.021* | 0.015 | 0.010 | 0.018 | |
| 中华管鞭虾 | 0.391 | 0.801 | 0.458 | 0.553 | 0.023** | 0.010 | 0.014 | 0.018* | 0.013 | 0.007 | |
| 纵肋织纹螺 | 0.568 | 0.447 | 0.267 | 0.185 | 0.013 | 0.022** | 0.025** | 0.010 | 0.013 | 0.009 | |
| 注: “**”: P < 0.01, 置换检验高度显著; “*”: P < 0.05, 置换检验显著 | |||||||||||
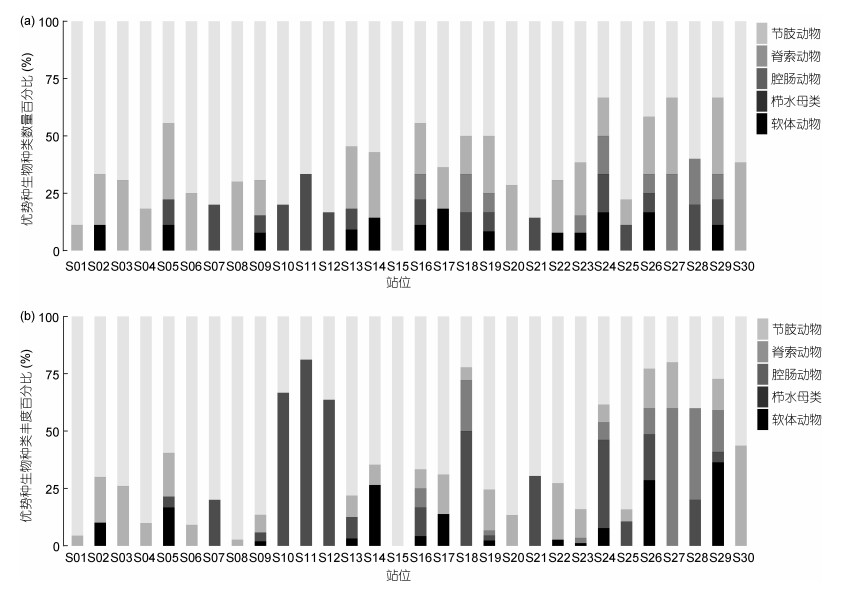 |
| 图 2 各站位生物种类数量比(a)和生物种类丰度比(b) Fig. 2 The relative number of species (a) and the relative abundance of taxonomic groups (b) |
优势种的聚类分析及MDS排序表明可将象山东部海域夏季的大型底栖动物优势种分为4个类群; PERMANOVA检验结果表明, 类群间生物组成差异高度显著(P < 0.01);置换检验表明, 类群间的生物丰度差异高度显著(P < 0.01);其中棘头梅童鱼、日本蟳、黄姑鱼、绒毛细足蟹为类群1, 此类群总丰度最低(2525ind./1000m2), 且所有生物只在40.0%以下的站位有所捕获, 平均捕获站位百分比为30.8%;细螯虾、细巧仿对虾、红狼牙
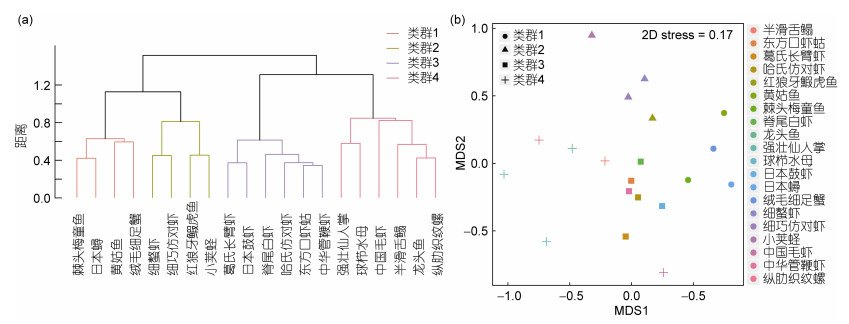 |
| 图 3 基于生物丰度的生物类群聚类分析(a)及MDS排序(b) Fig. 3 Cluster analysis (a) and MDS ordination of macrobenthic assemblages (b) based on abundance at the species level 注:生物丰度数据经开方转换, 计算Bray-Curtis相异性矩阵, 采取ward.D法进行组间聚类 |
对象山东部海域夏季大型底栖动物优势种生态位宽度计算结果表明, 大型底栖动物优势种生态位宽度(Levins)范围为5.22—21.66, 平均值为10.93, 中位数为10.58, 其中55.0%的大型底栖动物优势种生态位宽度大于平均值。生态位宽度最大的生物为东方口虾蛄(21.66), 其在80.0%的站位均有分布, 总生物丰度为462ind./1000m2, 说明东方口虾蛄具有较强的生态适应能力, 对资源的利用范围广泛; 小荚蛏的生态位宽度最小(5.22), 其只在20%的站位有所捕获, 总生物丰度为166ind./1000m2, 说明其生态适应能力相对较差, 对生境的要求相对较高, 对资源的利用具有明显的倾向性, 此生物对环境的变动具有较高的灵敏性(图 4)。类群1的平均生态位宽度为7.22, 极差为2.23;类群2的平均生态位宽度为8.78, 极差为6.55;类群3的平均生态位宽度为14.46, 极差为10.55;类群4的平均生态位宽度为9.77, 极差为6.06。平均生态位宽度, 类群1(7.22) < 类群2(8.78) < 类群4(9.77) < 类群3(14.46);总丰度, 类群1(2525ind./1000m2) < 类群2(3105ind./1000m2) < 类群3(6120ind./1000m2) < 类群4(6415ind./1000m2); 各类群生物平均捕获站位百分比, 类群1(30.8%) < 类群2(33.3%) < 类群4(39.4%) < 类群3(66.7); Spearman相关性分析表明, 生态位宽度与生物丰度间的相关系数为0.60(P < 0.01), 生态位宽度与生物被捕获站位百分比的相关系数为0.96(P < 0.01), 说明生态位宽度的大小与生物分布的范围的大小直接相关。
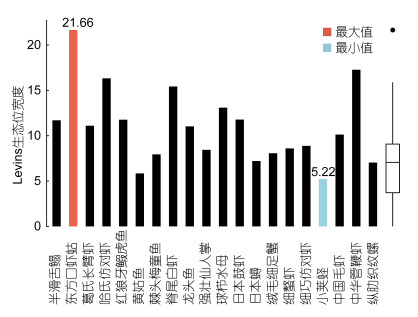 |
| 图 4 各优势种生态位宽度 Fig. 4 The niche breadths of macrobenthic dominant species 注:生态位宽度的计量采用Levins法, 所使用数据为各优势种的丰度数据, 运算前丰度数据均经开方转换 |
象山东部海域夏季大型底栖动物优势种Pianka重叠指数范围为0.00—0.83, 平均值为0.41, 中位数为0.42(图 5)。Pianka重叠指数大于0.50的占37.4%, 大于0.60的占19.5%, 大于0.7的占5.8%, 说明象山东部海域夏季大型底栖动物优势种生态位重叠不明显, 种间竞争不激烈。聚类分析及PcoA排序结果表明, 按照Pianka生态位重叠指数, 可将该海域大型底栖动物优势种分为4个类群, PERMANOVA检验结果表明类群间大型底栖动物优势种的Pianka重叠指数组成差异高度显著(P < 0.01), 其中小荚蛏、龙头鱼、纵肋织纹螺、强壮仙人掌、球栉水母为类群1;半滑舌鳎、东方口虾蛄、中华管鞭虾、哈氏仿对虾、脊尾白虾为类群2;黄姑鱼、绒毛细足蟹、细螯虾、红狼牙
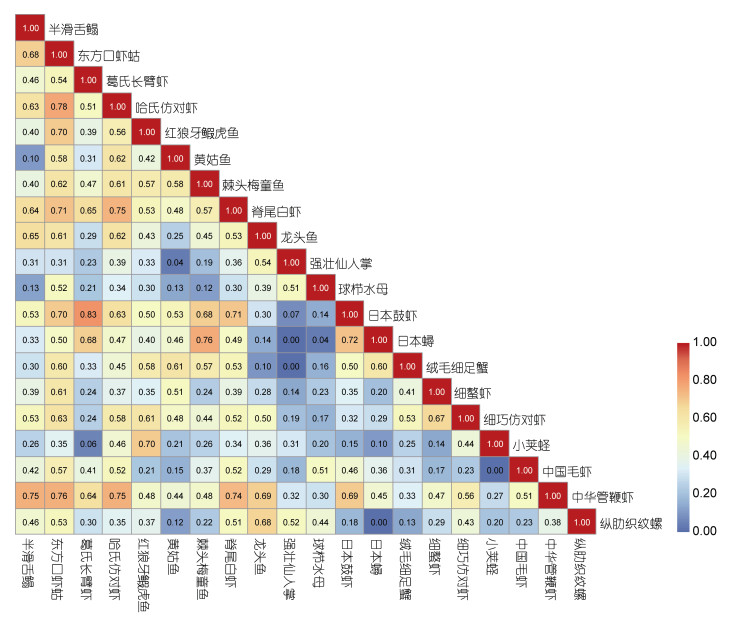 |
| 图 5 优势种生态位重叠值 Fig. 5 Niche overlaps of macrobenthic dominant species 注:生态位重叠值的计量采用Pianka重叠指数, 所使用数据为各优势种的丰度数据, 运算前丰度数据均经开方转换 |
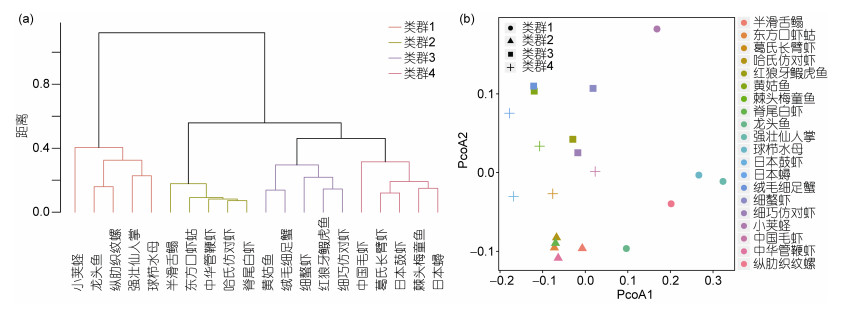 |
| 图 6 基于优势种Pianka重叠指数的聚类分析 Fig. 6 (a) Cluster analysis and (b) PcoA ordination of macrobenthic assemblages based on Pianka niche overlaps of macrobenthic dominant species 注: a.基于Pianka重叠指数, 计算Bray-Curtis相异性矩阵, 采取ward.D法进行组间聚类; b.第一轴解释了Pianka重叠指数变异的46.6%, 拟合度为0.61;第二轴解释了Pianka重叠指数变异的36.4%, 拟合度为0.62 |
2012年8月(夏季)对象山东部海域大型底栖动物的调查结果表明, 共采集鉴定出大型底栖动物36种(优势种20种), 种类数量较少, 且生物分布不均匀, 部分生物丰度数据较小, 其原因在于本次调查采用定性/半定量的阿氏网进行大型底栖动物的采集, 网目较大, 小型底栖动物及底内动物难以采集; 同时, 随着人类活动的干扰, 大型底栖动物数量减少, 群落结构衰退(杜飞雁等, 2008), 莱州湾和长江口海域也存在类似的现象(周红等, 2010; 刘录三等, 2012)。聚类分析及MDS排序结果表明, 该海域大型底栖动物优势种可以分为4个类群, 4个类群的生物组成上存在极显著的差异(P < 0.01), 4个类群生物丰度差异高度显著(P < 0.01)。研究发现, 类群3的大型底栖动物优势种分布广泛, 这主要与其生物组成有关, 此类生物均为虾类, 具有较高的活动能力。
3.2 象山东部海域夏季大型底栖动物优势种生态位宽度生态位宽度反映生物对资源利用的多样性(彭松耀等, 2015), 在研究生物群落结构与演替、生物多样性以及生物与环境相互作用等方面具有重要的作用(赵永强等, 2009)。种群生态位宽度的大小取决于生境的异质性以及生物对环境资源的适应能力和利用能力(徐治国等, 2007)。研究结果表明, 象山港东东部海域大型底栖动物优势种生态位宽度最大值为21.66, 最小值为5.22, 说明研究区域内生态位宽度变化较大, 各优势种群对环境的适应能力的差异较大。分析发现脊尾白虾的生态位较宽(47.66)但其丰度较低(48ind./1000m2), 其在60.0%的站位均有出现, 但各站位的生物丰度多数低于其它生物, 这一现象与生物的分布位点及丰度配置格局有关, 该结果与彭松耀等(2015)的研究结果一致。研究表明, 生物的丰度越大, 占据的资源位点越广, 则生态位越宽(胡知渊等, 2006), Spearman相关性分析表明, 生态位宽度与生物丰度间的相关系数为0.60(P < 0.01), 生态位宽度与生物出现频次的相关系数为0.96(P < 0.01), 但研究中发现红狼牙
研究发现生态位较宽的生物与其它生物之间的重叠也较为明显, 生态位窄的生物与其它生物的重叠较小, 但部分生物生态位较窄, 与其它生物间的生态位重叠值较大, 说明这些生物对资源的利用具有特异性, 其特异性主要体现在, 生物对资源的利用方式及占据的资源位点差异上, 这与葛宝明等(2005)的研究结果一致。日本蟳与棘头梅童鱼之间的生态位重叠值最大, 但本身的生态位较窄, 这些生物的生活型和对资源的利用方式不同, 即使生态位重叠较大, 也可以很好地共存(葛宝明等, 2005; 彭松耀等, 2015)。研究区域内生态位重叠值大于0.60的占19.5%, 表明该区域生物间竞争不激烈。生态位重叠值在0.00—0.83之间, 生物间生态位重叠值差异较大, 部分生物间的生态位重叠值为0.00, 其原因是生物对资源的利用方式不同或生物在资源位点上的分布差异造成(赵永强等, 2009)。基于Pianka重叠指数的聚类分析及PcoA排序表明, 可将各大型底栖动物优势种分为4类, 各类间的Pianka生态位重叠指数差异显著(P < 0.05), 各类群生物组成与基于丰度数据进行的聚类结果存在差异, 说明基于丰度的聚类及排序与生态位重叠值之间没有直接的关系, 而Bindoff等(2007)研究表明, 聚类和排序的结果与生态位重叠值有着密切的关系, 产生以上差异的原因可能是, 生物丰度数据是物种数量大小的反映, 而生态位重叠值则是生物分布的环境位点的重合情况的反映(葛宝明等, 2005; 彭松耀等, 2015), 该海域多样的生境减小了生物分布的环境位点的重合, 弱化了生物丰度与生态位重叠值之间的关系, 这也是该海域生态位重叠值普遍偏小种间竞争不激烈的原因之一。SIMPER分析筛选出对分组具有显著贡献的大型底栖动物优势种17种, 其中贡献值大于0.03的为黄姑鱼、绒毛细足蟹、葛氏长臂虾、日本鼓虾、日本蟳, 这些生物主导着Pianka重叠指数的差异分组, 以上生物生活型相似, 均具有较强的活动能力, 说明该海域夏季大型底栖动物优势种生态位结构的形成与优势种的活动能力有关。
4 结论象山东部海域夏季共采集鉴定大型底栖动物36种(优势种20种), 隶属于7门8纲24科, 其中节肢动物最多(15种), 脊索动物次之(7种)。象山东部海域夏季大型底栖动物优势种可分为4个生态类群, 各类群间生物组成和丰度均具有显著的差异。象山东部海域夏季大型底栖动物优势种群生态位宽度变化较大, 各优势种对环境的适应能力具有较大的差异, 其中东方口虾蛄具有较强的生态适应能力, 对资源的利用范围广泛; 小荚蛏的生态适应能力相对较差, 对生境的要求相对较高, 对资源的利用具有明显的倾向性。多样的生境以及生物本身的适应能力差异, 使该海域大型底栖动物优势种的生态位重叠值偏小, 减小了种间的竞争。该海域大型底栖动物优势种夏季生态位结构的形成与优势种的活动能力有关。
| 史本泽, 于婷婷, 徐奎栋, 2015. 长江口及东海夏季小型底栖动物丰度和生物量变化. 生态学报, 35(9): 3093–3103 |
| 刘录三, 李新正, 2002. 东海春秋季大型底栖动物分布现状. 生物多样性, 10(4): 351–358 |
| 刘录三, 郑丙辉, 李宝泉, 等, 2012. 长江口大型底栖动物群落的演变过程及原因探讨. 海洋学报, 34(3): 134–145 |
| 汤雁滨, 廖一波, 寿鹿, 等, 2016. 南麂列岛潮间带大型底栖动物群落优势种生态位. 生态学报, 36(2): 489–498 |
| 杜飞雁, 张汉华, 李纯厚, 等, 2008. 大亚湾大型底栖动物种类组成及物种多样性. 中国水产科学, 15(2): 252–259 |
| 李晓静, 周政权, 陈琳琳, 等, 2017. 渤海湾曹妃甸围填海工程对大型底栖动物群落的影响. 海洋与湖沼, 48(3): 617–627 |
| 求锦津, 水柏年, 水玉跃, 等, 2017. 浙江6个列岛大型底栖藻类分类多样性. 海洋与湖沼, 48(5): 1004–1013 DOI:10.11693/hyhz20170300053 |
| 张鹏弛, 徐勇, 李新正, 等, 2017. 南黄海冷水中心内外夏季大型底栖动物群落分析. 海洋与湖沼, 48(2): 312–326 |
| 周红, 华尔, 张志南, 2010. 秋季莱州湾及邻近海域大型底栖动物群落结构的研究. 中国海洋大学学报(自然科学版), 40(8): 80–87 |
| 周然, 覃雪波, 彭士涛, 等, 2014. 渤海湾大型底栖动物调查及与环境因子的相关性. 生态学报, 34(1): 50–58 |
| 赵永强, 曾江宁, 高爱根, 等, 2009. 椒江口潮间带大型底栖动物的生态位. 应用生态学报, 20(5): 1176–1183 |
| 胡知渊, 鲍毅新, 葛宝明, 等, 2006. 围垦滩涂潮沟秋季大型底栖动物群落和生态位分析. 动物学报, 52(4): 800–809 |
| 徐小雨, 周立志, 朱文中, 等, 2011. 安徽菜子湖大型底栖动物的群落结构特征. 生态学报, 31(4): 943–953 |
| 徐兆礼, 陈亚瞿, 1989. 东黄海秋季浮游动物优势种聚集强度与鲐鲹渔场的关系. 生态学杂志, 19: 13–15 |
| 徐治国, 何岩, 闫百兴, 等, 2007. 三江平原典型沼泽湿地植物种群的生态位. 应用生态学报, 18(4): 783–787 |
| 徐晓群, 曾江宁, 陈全震, 等, 2013. 浙江三门湾浮游动物优势种空间生态位. 应用生态学报, 24(3): 818–824 |
| 彭欣, 谢起浪, 陈少波, 等, 2011. 乐清湾潮间带大型底栖动物群落分布格局及其对人类活动的响应. 生态学报, 31(4): 954–963 |
| 彭松耀, 李新正, 王洪法, 等, 2015. 南黄海春季大型底栖动物优势种生态位. 生态学报, 35(6): 1917–1928 |
| 葛宝明, 鲍毅新, 郑祥, 等, 2005. 灵昆岛潮间带大型底栖动物群落结构与生态位分析. 生态学报, 25(11): 3037–3043 DOI:10.3321/j.issn:1000-0933.2005.11.034 |
| Anderson R P, 2013. A framework for using niche models to estimate impacts of climate change on species distributions. Annals of the New York Academy of Sciences, 129: 8–28 |
| Bindoff N L, Willebrand J, Artale V, et al. Observations: Oceanic climate change and sea level. 2007: 385-433 |
| Heino J, Mykrä H, Muotka T, 2008. Temporal variability of nestedness and idiosyncratic species in stream insect assemblages. Diversity & Distributions, 15(2): 198–206 |
| Levins R, 1968. Evolution in Changing Environments:Some Theoretical Explorations. New Jersey: Princeton University Press, |
| Linse K, Griffiths H J, Barnes D K, et al, 2013. The macro-and megabenthic fauna on the continental shelf of the eastern Amundsen Sea, Antarctica. Continental Shelf Research, 68: 80–90 DOI:10.1016/j.csr.2013.08.012 |
| Murtagh F, Legendre P, 2014. Ward's Hierarchical Agglomerative Clustering Method:Which Algorithms Implement Ward's Criterion?. Journal of Classification, 31(3): 274–295 DOI:10.1007/s00357-014-9161-z |
| Officer C B, Smayda T J, Mann R, 1982. Benthic filter feeding:a natural eutrophication control. Marine Ecology Progress Series, 9: 203–210 DOI:10.3354/meps009203 |
| Pianka E R, 1973. The structure of lizard communities. Annual Review of Ecology and Systematics, 4: 53–74 DOI:10.1146/annurev.es.04.110173.000413 |
| Shcheglovitova M, Anderson R P, 2013. Estimating optimal complexity for ecological niche models:a jackknife approach for species with small sample sizes. Ecological Modelling, 269: 9–17 DOI:10.1016/j.ecolmodel.2013.08.011 |
| Veiga P, Redondo W, Sousa-Pinto I, et al, 2017. Relationship between structure of macrobenthic assemblages and environmental variables in shallow sublittoral soft bottoms. Marine Environmental Research, 129: 396–407 DOI:10.1016/j.marenvres.2017.07.002 |
| Wathne J A, Haug T, Lydersen C, 2000. Prey preference and niche overlap of ringed seals Phoca hispida and harp seals P. groenlandica in the Barents Sea. Marine Ecology Progress Series, 194: 233–239 DOI:10.3354/meps194233 |
| Xie Z, Zhang J, Cai K, et al, 2016. Temporal and spatial distribution of macrobenthos communities and their responses to environmental factors in Lake Taihu. Acta Ecologica Sinica, 36(1): 16–22 DOI:10.1016/j.chnaes.2015.12.005 |
| Yan J, Xu Y, Sui J X, et al, 2017. Long-term variation of the macrobenthic community and its relationship with environmental factors in the Yangtze River estuary and its adjacent area. Marine Pollution Bulletin, 123(1-2): 339–348 DOI:10.1016/j.marpolbul.2017.09.023 |
| Yang W, Li X X, Sun T, et al, 2017. Macrobenthos functional groups as indicators of ecological restoration in the northern part of China's Yellow River Delta Wetlands. Ecological Indicators, 82: 381–391 DOI:10.1016/j.ecolind.2017.06.057 |
| Yang W, Sun T, Yang Z F, 2016. Effect of activities associated with coastal reclamation on the macrobenthos community in coastal wetlands of the Yellow River Delta, China:A literature review and systematic assessment. Ocean & Coastal Management, 129: 1–9 |
 2018, Vol. 49
2018, Vol. 49


