
中国海洋湖沼学会主办。
文章信息
- 逄雪梅, 魏永伟, 范东东, 李长红, 苗亮, 陈炯. 2018.
- PANG Xue-Mei, WEI Yong-Wei, FAN Dong-Dong, LI Chang-Hong, MIAO Liang, CHEN Jiong. 2018.
- 传染性皮下及造血组织坏死病毒(IHHNV)在双壳贝类中的感染情况研究
- APPLICATION OF THE INFECTIOUS HYPODERMAL AND HEMATOPOIETIC NECROSIS VIRUS (IHHNV) TO BIVALVE SHELLFISH
- 海洋与湖沼, 49(4): 883-888
- Oceanologia et Limnologia Sinica, 49(4): 883-888.
- http://dx.doi.org/10.11693/hyhz20180200041
-
文章历史
- 收稿日期:2018-02-23
- 收修改稿日期:2018-03-31
传染性皮下及造血组织坏死病毒(infectious hypodermal and hematopoietic necrosis virus, IHHNV)是感染对虾的一种重要病原(白丽蓉等, 2012; Chai et al, 2016)。自1980年首次发现以来, IHHNV迅速在全世界的养殖对虾和野生对虾中蔓延, 给对虾养殖业造成了巨大的经济损失(Lightner et al, 1983; Galván-Alvarez et al, 2012; Silva et al, 2014; Encinas-García et al, 2015)。其中, IHHNV对细角滨对虾(Penaeus stylirostris)的致病性较强, 死亡率高达90%, 对南美白对虾(Litopenaeus vannamei)的致死现象不明显, 但可引起生长缓慢和畸形等病状(Kalagayan et al, 1991; Browdy et al, 1993; Lightner, 2011)。
双壳贝类作为一种重要的经济水产品, 其独特的摄食方式使其成为很多病原体传播和扩散的中间载体, 如牡蛎(Ostrea gigas Thunberg)是诺如病毒(Norovirus, NoV)的重要传播载体(Campos et al, 2014)。20世纪80年代上海甲肝病毒(Hepatitis A virus, HAV)的大爆发也是毛蚶(Scapharca subcrenata)携带的甲肝病毒引起的(焦永真等, 1990)。我们的最新研究显示在中国沿海地区取样的贻贝(Mytella Genus, Mytilus edulis Species)中IHHNV检测阳性率高达90%(Wei et al, 2017)。为了进一步研究IHHNV在贝
类中的携带和感染情况, 本研究将检测范围扩展到更多双壳贝类以及螺类软体动物以评估IHHNV在这些生物中的携带情况。同时, 本研究在实验室条件下建立IHHNV在贝类中的人工感染模型, 以研究其对贝类的致病性及其在贝类中携带时间情况。研究结果将为对虾养殖尤其是虾贝混养模式中预防和控制IHHNV的传播提供基础资料。
1 材料与方法 1.1 样品的采集中国蛤蜊(Mactra chinensis)、泥蚶(Tegillarca granosa)、花蛤(Ruditapes philippinarum)、缢蛏(Sinonovacula constricta)、文蛤(Meretrix meretrix)、白蛤(Mactra veneriformis)、螺蛳(Margarya melanioides)和中华圆田螺(Cipangopaludina cahayensis)各20只, 随机采集于浙江宁波商业对虾养殖场。该养殖场的养殖模式为虾贝混养。采集的样品分别用封口袋单独保存, 并通过冰袋运送到实验室, 于–80℃保存备用。
1.2 基因组提取和PCR检测对于双壳贝类, 将每个样品的肝胰腺、闭壳肌、鳃、斧足和外套膜等量混合用于基因组DNA的提取; 对于螺类, 取肝胰腺用于基因组DNA的提取。参照Wei等(2017)的方法, 提取基因组DNA和扩增IHHNV部分基因序列, 扩增片段大小为389bp。采用国际兽医局(Office International des Epizooties, OIE)公布的引物389F: 5′-CGGAACACAACCCGACTTT A-3′和389R: 5′-GGCCAAGACCAAAATACGAA-3′进行扩增。
1.3 克隆及鉴定各个样品的基因组DNA经PCR扩增后, 采用琼脂糖凝胶电泳进行检测, 将对应的目的条带切下, 并按照Gel Extraction Kit (OMEGA, Doraville, 美国)说明书进行回收, 然后将其与pMD19-T simple (TaKaRa, 大连, 中国)载体连接, 连接产物转化大肠杆菌TG1感受态细胞, 涂布于含氨苄青霉素的LB平板上, 过夜培养后, 挑取单克隆扩大培养, 利用EZNA Plasmid mini kit (OMEGA, Doraville, 美国)抽提质粒, 经PCR验证后, 将阳性克隆送测序。
1.4 序列测定和分析采用DNASTAR软件去除载体序列, 将目的序列经BLAST分析后采用BioEdit软件对各物种的代表序列进行核苷酸序列多重比对, 然后选取GenBank中已知核苷酸序列作为参考株采用MEGA5.0构建系统进化树。从Kim等(2012)和Wei等(2017)的报道中, 选择虾源IHHNV参照毒株, 分别为Ⅰ型感染株(GQ475529), Ⅱ型感染株(AY102034、GQ411199、JN616415和AY362547), Ⅲ型感染株(JN377975、AF218266和KJ862253), 非感染株A型(EU675312和DQ228358)和非感染株B型(AY124937)。
1.5 标准曲线制备将从贻贝中获得的Zhejiang(Zhoushan)株IHHNV部分序列(Wei et al, 2017)经T-A克隆构建pMD19-IHHNV重组质粒, 用NanoDrop 2000测定浓度和质量, 并根据拷贝数换算公式: 6.02×1023×(浓度ng/μL× 10–9)/(DNA长度×660)=copies/μL得到pMD19-IHHNV重组质粒的拷贝数, 为7.4×1010copies/μL, 将该重组质粒作为本实验标准品原液, 于–80℃保存。将该质粒标准品进行梯度稀释, 得到1.0×108—1.0× 103copies/μL共6个梯度, 每个梯度3个平行, 进行实时荧光定量PCR。扩增反应体系为25μL, 包括灭菌水9.5μL、SYBR Premix Ex Taq(2×)缓冲液12.5μL、基因组DNA模板1.0μL、上下游引物各(10μmol/L) 1.0μL。扩增反应在ABI StepOne荧光定量PCR仪(美国ABI公司)上进行, 反应条件为: 94℃ 180s(预变性, 1个循环); 94℃ 30s, 58℃ 30s, 72℃ 30s(扩增段, 共40个循环); 94℃ 30s, 72℃ 30s, 95℃ 30s (熔解段, 1个循环)。根据实时荧光定量的结果, 建立质粒标准品拷贝数与循环阈值(Cycle threshold, Ct值)对应的标准曲线。
1.6 动物感染实验将分离自南美白对虾的IHHNV Wenzhou株(KP733862)(本实验室保存)浸泡感染13日龄的南美白对虾, 于感染后30d采集对虾肝胰腺, 充分研磨, 反复冻融, 采用0.22µm滤器除菌后将病毒液于–80℃保存备用。
活体泥蚶购买于浙江宁波另一个商业养殖场, 随机挑选10只泥蚶进行IHHNV检测, 结果为阴性的批次用于动物感染实验。通过浸泡的方式对泥蚶进行感染, 将泥蚶分为实验组和对照组, 实验组浸泡在IHHNV含量为7×106copies的人工海水中(2L), 对照组不含IHHNV, 2h后将实验组泥蚶用人工海水洗涤3次(除去表面的病毒), 然后放到30L人工海水养殖箱内, 于2h、12h、24h、2d、3d、5d、7d、14d、21d和30d每组随机选3只泥蚶, 用人工海水洗涤后取样。取样方法和基因组DNA的提取参照1.2进行。参照Dhar等(2001)建立的实时荧光定量PCR方法对IHHNV在泥蚶体内的拷贝数进行检测, 进一步分析IHHNV在泥蚶体内的增殖情况。
1.7 组织切片观察于攻毒后第5天, 取实验组和对照组泥蚶的肝胰腺, 置于4%福尔马林中固定24h。参考范东东等(2015)的报道, 对肝胰腺进行石蜡包埋, 切片后H.E染色, 光学显微镜下观察肝胰腺组织病理变化。
2 结果 2.1 IHHNV在样品中的检测结果被检样品中IHHNV的检测结果如表 1所示, 在所有采集的贝类样品中均检测到了IHHNV, 其中在泥蚶中的阳性率最高(50%), 在文蛤中的阳性率最低(15%), 在两种螺类中均未检测到IHHNV, 表明IHHNV在双壳贝类中的分布较为广泛。
| 名称 | 阳性个数/总检测数 | 阳性率 |
| 中国蛤蜊 | 4/20 | 20% |
| 泥蚶 | 10/20 | 50% |
| 花蛤 | 6/20 | 30% |
| 缢蛏 | 4/20 | 20% |
| 文蛤 | 3/20 | 15% |
| 白蛤 | 8/20 | 40% |
| 螺蛳 | 0/20 | 0 |
| 中华圆田螺 | 0/20 | 0 |
序列分析表明, 从6种贝类中扩增得到的基因片段均为IHHNV基因组部分序列, 将各序列登陆到GenBank数据库中, 登录号分别为中国蛤蜊: KY927928、花蛤: KY927929、白蛤: KY927927、缢蛏: KY927930、文蛤: KY927931和泥蚶: KY927932。经MEGA5.0绘制的进化树如图 1所示, 来自中国蛤蜊、花蛤和白蛤的IHHNV基因型为Ⅱ型感染株(Kim et al, 2012; Wei et al, 2017), 而来自缢蛏、文蛤和泥蚶的IHHNV在整个进化树中单独成簇, 形成了一个新的分支。
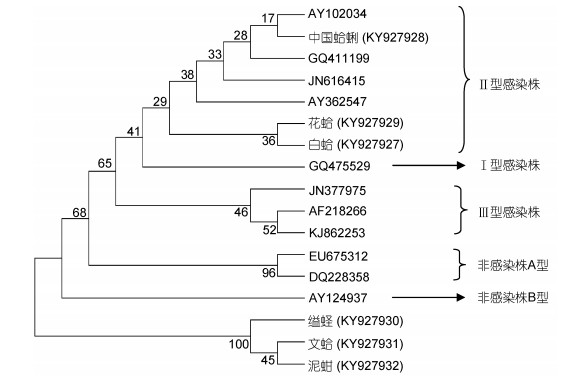 |
| 图 1 采用邻接法构建基于IHHNV部分基因序列的系统进化树 Fig. 1 Phylogenetic tree of partial nucleotide sequences of IHHNV using the neighbor-joining method 注:分叉处数值表示1000次重复抽样所得到的置信度 |
将质粒模板梯度稀释为108—103copies/µL DNA 6个梯度, 绘制重组质粒标准曲线, 通过对其回归曲线分析, 发现其相关性较好, 相关系数R2=0.998, 系统生成的回归方程为: y=-3.274x+34.86(图 2)。
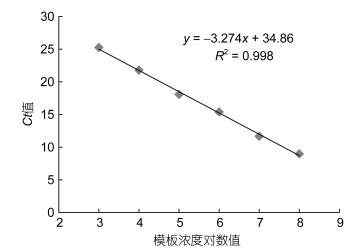 |
| 图 2 IHHNV实时荧光定量PCR标准曲线构建 Fig. 2 Generation of IHHNV real time quantitative PCR standard curve |
采用实时荧光定量PCR对攻毒后不同时间段的泥蚶进行IHHNV检测, 结果显示, 不同感染期内泥蚶体内的病毒含量较攻毒前均有不同程度的增加。通过计算每克泥蚶组织中所含病毒拷贝数发现, 感染最初的2h病毒的拷贝数最低, 为954copies/g, 在感染的第5天泥蚶体内IHHNV达到最高拷贝数1.8×104 copies/g, 随后泥蚶体内的病毒量开始下降, 在感染后第30天, 其体内的病毒含量趋向于感染初期, 为1400 copies/g, 表明IHHNV能够在双壳贝类中进行增殖, 并可在贝中存在较长时间(图 3)。
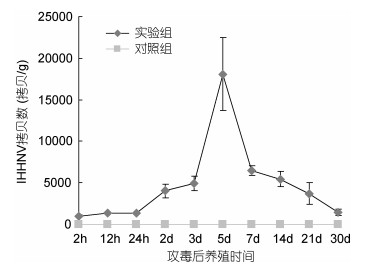 |
| 图 3 IHHNV感染的泥蚶体内IHHNV拷贝数变化 Fig. 3 Changes of IHHNV copies in T. granosa after IHHNV infection |
分别取IHHNV感染的泥蚶和对照组泥蚶的肝胰腺制备组织切片, 结果显示, 与对照组相比, IHHNV感染的泥蚶肝胰腺组织没有显著的病理学变化(图 4)。
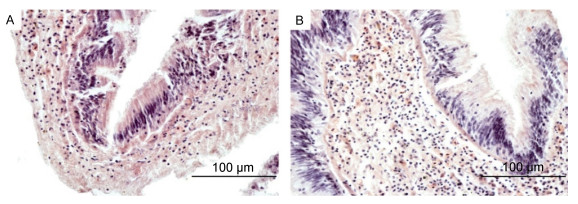 |
| 图 4 泥蚶的肝胰腺组织切片(×400) Fig. 4 Histopathological sections of hepatopancreas from T. granosa 注: A. IHHNV未感染泥蚶肝胰腺; B. IHHNV感染泥蚶肝胰腺 |
IHHNV是危害对虾养殖的重要病害, 严重制约对虾养殖业的发展。以往研究表明, IHHNV可感染多种对虾, 所以大部分研究都集中在IHHNV在对虾中的感染和流行情况(Rai et al, 2012; Vega-Heredia et al, 2012)。我们的最新研究发现, IHHNV在自然界中广泛存在于贻贝当中(Wei et al, 2017), 这一现象给IHHNV的防控带来了新的挑战和困难。如今, 随着养殖业的发展和养殖规模的扩大, 虾贝混养模式已经被广泛的应用在生产实践中(陈萍等, 2016)。因此, 就养殖场自身的环境而言, 除了对虾本身之外, 养殖区内贝类生物中IHHNV的感染情况调查也显得尤为重要。本研究检测了IHHNV在双壳贝类及螺类中的携带情况, 结果显示IHHNV在中国蛤蜊、泥蚶、花蛤、缢蛏、文蛤和白蛤中均存在, 并且在泥蚶的检出率高达50%, 而在作为重要的底栖养殖生物螺类中并没有检测到IHHNV, 揭示双壳贝类很可能是IHHNV感染的一个潜在来源。作者分析, 这可能与贝类的摄食方式有关, 双壳贝类独特的滤食活动使得病毒粒子在体内易于富集(Lees, 2000), 而螺类多半生活在水体较肥沃、水草较多的静水环境中并通过齿舌捕获食物从而使得病毒粒子不易被富集。值得注意的是, 在系统进化树中, 来自泥蚶、缢蛏和文蛤的IHHNV在整个进化树中形成一个全新的分支, 说明这三种贝类中的IHHNV与以往发现的任何毒株都有很大不同。这三种来源的IHHNV毒株对对虾致病性如何有待深入研究。
在人工感染实验中, IHHNV在泥蚶体内的含量从感染初期到养殖后期呈现先上升后下降的趋势, 这可能是由于感染初期IHHNV在贝类中大量增殖, 达到一定拷贝数后启动自我清除机制并将体内病毒释放到体外, 从而使体内的病毒含量趋于稳定。IHHNV感染对虾后主要侵染对虾的肝胰腺, 造成肝胰腺发生组织病理变化, 如嗜酸性核内包涵体以及细胞核肥大等特征(Rai et al, 2012)。本研究中, 泥蚶感染IHHNV后, 没有出现明显的致病症状, 肝胰腺组织切片也未观察到明显的病理变化, 说明IHHNV对泥蚶可能没有致病性。然而, 双壳贝类作为病毒的重要中间载体(Campos et al, 2014; Gao et al, 2015), 在虾贝混养体系中是否作为对虾之间IHHNV传染的媒介还有待进一步研究。
4 结论本研究表明双壳贝类是携带IHHNV的重要载体, 并且IHHNV在贝类生物中可能已经发生变异。人工感染实验表明, 虾源IHHNV可在贝类中增殖并存在较长时间, 但对贝类没有明显的致病性。该研究结果对对虾养殖尤其是虾贝混养模式中预防和控制IHHNV的传播具有重要意义。
| 白丽蓉, 赵志英, 2012. 对虾传染性皮下与造血组织坏死病毒(IHHNV)的研究进展. 中国农学通报, 28(14): 114–119 |
| 陈萍, 王芳芳, 翁歆之, 2016. 海水围塘虾蟹贝生态混养模式研究. 中国水产,(11): 109–112 DOI:10.3969/j.issn.1002-6681.2016.11.054 |
| 范东东, 魏永伟, 苗亮, 等, 2015. 罗氏沼虾(Macrobrachium rosenbergii)传染性皮下和造血器官坏死病毒(IHHNV)的流行病学调查. 海洋与湖沼, 46(5): 1153–1159 |
| 焦永真, 韩剑秋, 王宪明, 等, 1990. 1988年上海甲型肝炎暴发流行中从毛蚶分离到甲型肝炎病毒. 病毒学报, 6(4): 312–315 |
| Browdy C L, Holloway Jr J D, King C O, et al, 1993. IHHN virus and intensive culture of Penaeus vannamei:effects of stocking density and water exchange rates. Journal of Crustacean Biology, 13(1): 87–94 DOI:10.1163/193724093X00462 |
| Campos C J A, Lees D N, 2014. Environmental transmission of human noroviruses in shellfish waters. Applied and Environmental Microbiology, 80(12): 3552–3561 DOI:10.1128/AEM.04188-13 |
| Chai C, Liu Y C, Xia X M, et al, 2016. Prevalence and genomic analysis of infectious hypodermal and hematopoietic necrosis virus (IHHNV) in Litopenaeus vannamei shrimp farmed in Shanghai, China. Archives of Virology, 161(11): 3189–3201 DOI:10.1007/s00705-016-3022-5 |
| Dhar A K, Roux M M, Klimpel K R, 2001. Detection and quantification of infectious hypodermal and hematopoietic necrosis virus and white spot virus in shrimp using Real-Time quantitative PCR and SYBR green chemistry. Journal of Clinical Microbiology, 39(8): 2835–2845 DOI:10.1128/JCM.39.8.2835-2845.2001 |
| Encinas-García T, Mendoza-Cano F, Enríquez-Espinoza T, et al, 2015. An improved validated SYBR green-based real-time quantitative PCR assay for the detection of the Penaeus stylirostris densovirus in penaeid shrimp. Journal of Virological Methods, 212: 53–58 DOI:10.1016/j.jviromet.2014.10.014 |
| Galván-Alvarez D, Mendoza-Cano F, Hernández-López J, et al, 2012. Experimental evidence of metabolic disturbance in the white shrimp Penaeus vannamei induced by the infectious hypodermal and hematopoietic necrosis virus (IHHNV). Journal of Invertebrate Pathology, 111(1): 60–67 DOI:10.1016/j.jip.2012.06.005 |
| Gao S Y, Li D D, Zha E H, et al, 2015. Surveillance of hepatitis E virus contamination in shellfish in China. International Journal of Environmental Research and Public Health, 12(2): 2026–2036 DOI:10.3390/ijerph120202026 |
| Kalagayan H, Godin D, Kanna R, et al, 1991. IHHN virus as an etiological factor in runt-deformity syndrome (RDS) of juvenile Penaeus vannamei cultured in Hawaii. Journal of the World Aquaculture Society, 22(4): 235–243 DOI:10.1111/jwas.1991.22.issue-4 |
| Kim J H, Kim H K, Nguyen V G, et al, 2012. Genomic sequence of infectious hypodermal and hematopoietic necrosis virus (IHHNV) KLV-2010-01 originating from the first Korean outbreak in cultured Litopenaeus vannamei. Archives of Virology, 157(2): 369–373 DOI:10.1007/s00705-011-1155-0 |
| Lees D, 2000. Viruses and bivalve shellfish. International Journal of Food Microbiology, 59(1-2): 81–116 DOI:10.1016/S0168-1605(00)00248-8 |
| Lightner D V, 2011. Virus diseases of farmed shrimp in the Western Hemisphere (the Americas):a review. Journal of Invertebrate Pathology, 106(1): 110–130 DOI:10.1016/j.jip.2010.09.012 |
| Lightner D V, Redman R M, Bell T A, et al, 1983. Detection of IHHN virus in Penaeus stylirostris and P. vannamei imported into Hawaii. Journal of the World Aquaculture Society, 14(1-4): 212–225 |
| Rai P, Safeena M P, Krabsetsve K, et al, 2012. Genomics, molecular epidemiology and diagnostics of infectious hypodermal and hematopoietic necrosis virus. Indian Journal of Virology, 23(2): 203–214 DOI:10.1007/s13337-012-0083-2 |
| Silva D C D, Nunes A R D, Teixeira D I A, et al, 2014. Infectious hypodermal and hematopoietic necrosis virus from Brazil:sequencing, comparative analysis and PCR detection. Virus Research, 189: 136–146 DOI:10.1016/j.virusres.2014.05.008 |
| Vega-Heredia S, Mendoza-Cano F, Sánchez-Paz A, 2012. The infectious hypodermal and haematopoietic necrosis virus:a brief review of what we do and do not know. Transboundary and Emerging Diseases, 59(2): 95–105 DOI:10.1111/jva.2012.59.issue-2 |
| Wei Y W, Fan D D, Chen J, 2017. The mussel Mytilus edulis L. as an important reservoir of infectious hypodermal and hematopoietic necrosis virus (IHHNV). Aquaculture Research, 48(3): 1346–1350 |
 2018, Vol. 49
2018, Vol. 49


