
中国海洋湖沼学会主办。
文章信息
- 孙文静, 王晓艳, 祁鹏志, 张建设, 吴常文. 2018.
- SUN Wen-Jing, WANG Xiao-Yan, QI Peng-Zhi, ZHANG Jian-She, WU Chang-Wen. 2018.
- 苯并[a]芘(BaP)对褐菖鲉(Sebasticus marmoratus)肝CYP1A1酶活性、基因表达及蛋白表达的影响
- EFFECTS OF BENZO[A]PYRENE ON EROD ACTIVITY, mRNA EXPRESSION, AND PROTEIN EXPRESSION OF CYP1A1 IN THE LIVER OF SEBASTICUS MARMORATUS
- 海洋与湖沼, 49(4): 897-903
- Oceanologia et Limnologia Sinica, 49(4): 897-903.
- http://dx.doi.org/10.11693/hyhz20180300055
-
文章历史
- 收稿日期:2018-03-16
- 收修改稿日期:2018-04-17
细胞色素P450酶(CYP450)是生物体内广泛存在的一种重要的代谢酶, 可作为毒理学指标应用于低剂量环境污染物对机体的潜在危害研究, 从而预防慢性中毒(Goksøyr et al, 1992)。CYP1A是细胞色素P450家族中的一员, 普遍存在于鱼类体内, 也是鱼类中研究最多的一个家族, 对多环芳烃类污染的指示表现出较好的特异性, 敏感性和专一性, 对有机污染物的代谢和脱毒起重要作用, 可作为污染造成个体、种群和生态系统危害的监测预警工具。鱼类CYP1A包括CYP1A1和CYP1A2两种亚型。CYP1A1表达的诱导机制属于芳香烃受体介导型, 芳烃化合物通过与芳香烃受体结合对CYP1A1产生诱导作用(Fent, 2004; Chen et al, 2007)。
苯并[a]芘(Benzo[a]pyrene, BaP)是广泛存在的一类多环芳烃, 经生物转化后具有较强的致畸、致突变和致癌作用(Conney, 1982)。作为典型的多环芳烃, BaP常被用来进行化学污染物毒性效应评价方面的研究(Yang et al, 1996; Uno et al, 2001; Liu et al, 2008)。
褐菖鲉(Sebasticus marmoratus Cuvier 1929)隶属鲉形目、鲉科、菖鲉属, 为暖温性底层鱼类, 主要分布于日本、韩国和中国东海岩礁地带, 定居性强, 喜欢居住在洞穴以及礁石间隙, 性情凶猛, 对入侵的敌害或同类有防御行为。其活动范围小, 是常见的钓捕鱼类。因其取材方便、价格便宜, 具较强的抗病能力和高成活率, 一直是实验室研究选择的实验鱼类(吴常文等, 1997; 谢伟, 2015)。
BaP在化学性质上并没有太大的活性, 必须经过多种代谢酶的作用被活化后, 才能转化为在化学性质上活泼的化合物并对机体发挥多种毒害作用。本研究主要通过最佳浓度的BaP对褐菖鲉进行注射染毒, 不同时间后测定褐菖鲉活体EROD活性和蛋白表达变化情况(孙竹筠等, 2005), 并采用实时荧光定量PCR技术对其CYP1A1基因mRNA表达量进行测定(陈君慧, 2006), 将三者相结合, 探讨BaP对CYP1A1的影响及作用机制。
1 材料与方法 1.1 材料 1.1.1 主要试剂与仪器BaP(纯度W≥96%)、玉米油和TEMED为Sigma公司产品; 30% Acr-Bis (29:1)和抗体稀释液购自康为世纪生物公司; 1.5mol/L Tris-HCl (pH 8.8)和1mol/L Tris-HCl (pH 6.8)购自碧云天; DAB购自Fluka公司; PBS、Tris、Glycine和奶粉购自BIO-RAD; 其他试剂均是国产分析纯; 普通PCR试剂盒、SYBR Premix Ex TaqTM Ⅱ (Tli RNaseH Plus)购自TaKaRa公司; 总RNA提取试剂盒购自Omega公司; APS和反转录试剂盒购自Thermo公司; 用于检测EROD酶活性的荧光定量检测试剂盒和蛋白质质量浓度试剂盒购自上海杰美基因医药科技有限公司; 其他ABI7500实时荧光定量PCR仪, 美国ABI公司; 核酸蛋白测定仪; 上海标模高速均质机; 美国Beckman普通台式离心机和超速离心机; 美国BioTek多功能酶标仪; 美国BIO-RAD公司垂直蛋白电泳仪, Trans-Blot SD半干转印槽。
1.1.2 实验动物供试褐菖鲉(Sebasticus marmoratus)幼体购自浙江舟山普陀区东河菜场, 大小体重较为一致, 平均体重25g, 体长10cm, 健康无病。所有的鱼在染毒实验之前都在520cm×700cm× 200cm的塑料牛筋水箱中驯养2周, 且全程不喂食, 保持自然光周期。实验时用次氯酸钠消毒曝气48h以上的海水, 水温(24±1)℃, 盐度22—24, 每天检测记录水温、pH值等常规水质指标, 并及时换水及清理排泄物。
1.1.3 引物根据已有褐菖鲉CYP1A cDNA序列和内参β-actin基因, 以Premier 5.0软件设计特异性扩增引物, 引物合成和cDNA序列测定均委托华大基因完成。
| 引物名称 | 上游引物 | 下游引物 |
| cDNA | 5′-CCTATGACAAGGACAACATTCGTG-3′ | 5′-CATCACTGACCAAGACAGGGCT-3′ |
| β-actin | 5′-AGGGAAATCGTGCGTG-3′ | 5′-ATGATGCTGTTGTAGGTGGT-3′ |
(1) 最佳浓度筛选
剂量-效应实验, 将70尾褐菖鲉随机分为6组, 设5个不同质量浓度的BaP注射组(0.1, 1, 10, 20, 50mg/kg鱼体重量)和一个对照组(0mg/kg), 采用腹腔注射方式(邱郁春, 1992), BaP溶解于玉米油中作为载体溶液, 用医用一次性注射器将此悬浊液注射到褐菖鲉腹腔中, 在染毒1d后每组随机抽取3条活力好的褐菖鲉(Levine et al, 1999), 在冰上迅速活体解剖, 避开胆囊, 取肝脏组织, 将一部分样品放入装有RNA保存液的冻存管中, 做好标记, 迅速放入液氮中速冻4d, 而后取出放入–80℃冰箱中保存。通过后续的提取RNA、反转录和荧光定量PCR实验, 测定出CYP1A1基因RNA相对表达量变化最显著的组别, 筛选出最佳浓度, 即后续时间-效应实验中, 每组褐菖鲉BaP的注射浓度。实验结果(图 1)表明, 20mg/kg为BaP注射的最佳浓度, 即后续的时间-效应实验中, 每组褐菖鲉注射的BaP质量浓度都为此浓度。
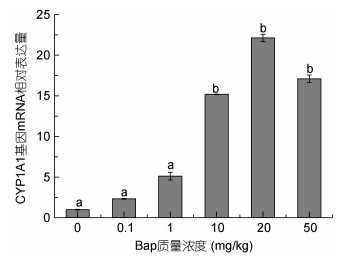 |
| 图 1 剂量-效应实验中, 不同质量浓度的BaP对褐菖鲉CYP1A1 mRNA表达的影响 Fig. 1 Effects of BaP in different concentrations BaPon relative CYP1A1 mRNA level in S. marmoratus 注:相同字母表示没有显著性差异, 不同字母表示有显著性差异(P < 0.05) |
(2) 时间-效应实验
采用腹腔注射方式, 设置BaP注射的质量浓度为20mg/kg鱼体重, BaP溶解于玉米油中作为载体溶液, 用医用一次性注射器将此悬浊液注射到褐菖鲉腹腔中。将80尾褐菖鲉随机分为7组, 分别为0h、6h、12h、1d、3d、7d (7d组分两部分, 一部分注射20mg/kg的BaP, 另一部分注射等量的玉米油, 作为溶剂对照组), 分别在0h、6h、12h、1d、3d、7d时每组随机抽取3条活力较好的褐菖鲉, 在冰上迅速活体解剖, 避开胆囊, 取肝脏组织, 并将样品分为两部分, 一部分放入装有RNA保存液的冻存管中, 另一部分直接放入冻存管, 用于肝脏匀浆液的制备, 以测定酶活和蛋白, 做好标记, 迅速放入液氮中速冻4d, 而后取出放入–80℃冰箱中保存。
1.2.2 肝脏匀浆的制备参照Bente M. Nilsen, Karin Berg的方法, 并做适当修饰(Bente et al, 1998)。将保存于–80℃冰箱中的肝脏从冻存管中取出, 放入50mL离心管中, 每管加7mL Extraction Buffer (0.1mol/L Tris-acetate buffer), 做好标记, 在冰水中用高速分散均质机匀浆。匀浆完毕后配平, 放入离心机匀速6000g, 4℃离心50min, 取10mL上清液于超速离心管中, 配平后放入超速离心机中, 在100000g, 32000r/min离心50min。离心完毕, 用phosphate buffer清洗溶解, 并收集沉淀物质, 做好标记, 分装保存在–80℃冰箱中备用。
1.2.3 蛋白浓度的测定蛋白质质量浓度测定采用Bradford法, 用杰美基因GENMED-Bradford蛋白质浓度定量试剂盒通过比色测定其最大吸收转换来定量蛋白质浓度。试剂盒分为标准液、补充液和反应液三部分。首先按照试剂盒的要求建立标准样品曲线, 求得线性回归方程。将待测样本稀释10倍, 取稀释后样本100μL, 其余同标准曲线制备步骤, 依据线性回归方程计算待测样本中蛋白含量。
1.2.4 细胞色素P450亚酶1A1(EROD)活性测定采用GENMED细胞色素P450亚酶1A1活性荧光定量检测试剂盒荧光法测定酶活性。
(1) 标准曲线的制备
试剂盒分为缓冲液、反应液、底物液和标准液四部分。首先按照试剂盒步骤建立标准曲线。反应在黑色96孔酶标板中进行, 激发和发射波长分别为530nm和590nm。以标准羟异吩噁唑酮浓度(nmol/L)为横坐标, 相对荧光单位(RFU)为纵坐标, 绘制RF标准曲线。
(2) EROD活性测定
按试剂盒要求, 加好标准样品和待测样品, 并做好标记, 轻轻摇动混匀。在37℃温度下孵育10min后, 放入荧光酶标仪获得相对荧光单位。根据标准曲线计算RF浓度, 计算EROD活性[pmol/(min·mg)]。
1.2.5 RNA的提取和cDNA第一链的合成在RNA保存液中保存的肝脏组织按照Total RNA kit Ⅰ试剂盒(OMEGA)推荐的方法提取总RNA, 用2%的琼脂糖凝胶电泳检测RNA的完整性。根据Thermo反转录试剂盒要求取1μg总RNA用于反转录合成cDNA第一链, 反转录产物保存于–20℃冰箱中。
1.2.6 荧光定量PCR荧光定量PCR在ABI7500型实时荧光定量PCR仪上进行, 以1.2.5中合成的cDNA为模板, 扩增体系为20μL: 10μL SYBR PremixEx Taq Ⅱ (Tli RNaseH Plus)(2×), 0.4μL ROX Reference Dye Ⅱ, 0.8μL PCR forward primer, 0.8μL PCR reverse primer, 2μL cDNA, 6μL ddH2O (An et al, 2011)。
反应采用两步法, 扩增条件为: 95℃预变性10s, 94℃变性5s, 60℃退火和延伸34s, 40个循环, 在60℃进行荧光信号采集, 反应结束后对扩增产物进行溶解曲线分析, 以确保特异性扩增。样本和内参分别设3个平行, ROX作为校正荧光, β-actin为内参。采用相对ΔΔCT法(2–ΔΔCT)进行CYP1A1基因在褐菖鲉体内的表达分析(刘春等, 2013)。
1.2.7 CYP1A1表达的蛋白印迹法(Western blot)分析参照Celander等(1991)的方法, 以Western blot方法检测CYP1A1蛋白表达量, 一抗为Abcam公司小鼠抗鱼P450 1A1+1A2单克隆抗体【C10-7】, 稀释浓度为1:100;二抗为辣根过氧化物酶(HRP)标记羊抗小鼠IgG(Solarbio), 稀释浓度为1:1000, 进行DAB显色。
此部分蛋白质质量浓度测定仍采用杰美基因GENMED-Bradford蛋白质浓度定量试剂盒Bradford法。Bradford法进行蛋白质测定, 加入蛋白上样缓冲液和PBS, 沸水浴10min煮沸变性, 取20μg蛋白经过SDS-PAGE电泳分离, 经过转膜, 再用加入PBS的脱脂奶粉在常温下轻微摇动封闭1h, 4℃避光过夜孵育一抗, PBST洗膜3次, 室温1h孵育二抗, PBST洗膜3次(李晗等, 2016), DAB显色(用DAB、30% H2O2、PBS和0.05%的CoCl2配制显色液), 待条带清晰呈现出后放于清水中终止反应, 取出拍照, 用凝胶分析软件Quantity One计算灰度值。
1.2.8 统计分析数据采用SPSS 19.0进行单因素方差分析, 用Origin 8.0软件作图, 比较对照组与染毒组之间的差异, 实验数据采用x±s表示, P < 0.05表示差异有统计学意义。Western blot结果采用Bio-rad公司的1D凝胶分析软件Quantity One分析电泳结果。
2 结果与分析 2.1 肝脏中CYP1A1基因表达水平 2.1.1 最佳浓度筛选由图 1可知, 不同质量浓度的BaP对褐菖鲉CYP1A1 mRNA的表达具有明显的诱导作用, 各实验组的表达水平均高于空白对照组, 总体呈现先上升后下降的趋势, 从0—20mg/kg的浓度范围内mRNA持续稳定上升, 上升幅度明显, 并在20mg/kg时达到最高值, 50mg/kg时又开始下降, 这说明褐菖鲉体内苯并芘的注射浓度为20mg/kg时, CYP1A1 mRNA的表达达到最高水平, 为最佳的质量浓度, 随着苯并芘不断的在褐菖鲉体内富集, CYP1A1mRNA的表达水平在50mg/kg的高浓度下开始出现反弹下调趋势, 但仍远高于空白对照组。
2.1.2 时间-剂量效应由图 2可见, 同一浓度, 不同染毒时间的苯并芘, 能够引起各实验组褐菖鲉CYP1A1基因mRNA表达发生明显的变化, 其中, 6h和12h组与对照组相比CYP1A1 mRNA表达量明显增加, 并在12h时达到最高值。随着苯并芘在褐菖鲉体内不断积蓄, 苯并芘对褐菖鲉CYP1A1 mRNA表达量的抑制不断增加, 1d后mRNA表达量迅速下降, 3d后又开始回升, 7d时略微下降, 溶剂对照组则达到最低水平。由此可知, 各实验组的CYP1A1表达水平随染毒时间的增加呈现先上升后下降再上升的趋势, 存在良好的时间-效应关系, 苯并芘对褐菖鲉肝CYP1A1基因表达先诱导后抑制。
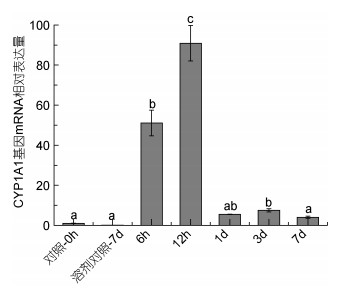 |
| 图 2 最佳质量浓度下的BaP作用于不同时间后对褐菖鲉CYP1A1 mRNA表达的影响 Fig. 2 Effects of BaP in a certain concentration BaPat a different time on relative CYP1A1 mRNA level in S. marmoratus 注:相同字母表示没有显著性差异, 不同字母表示有显著性差异(P < 0.05) |
以蛋白质含量(微克)为横坐标, 吸光值OD595为纵坐标, 得到标准曲线的线性回归方程为Y=0.07197X+0.5257, R2=0.9698。
由图 3标准曲线可知, 采用Bradford法测定蛋白质含量时, 蛋白质含量与吸光值成正相关。
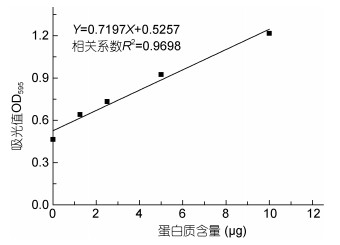 |
| 图 3 EROD对应的蛋白浓度标准曲线 Fig. 3 Protein concentration standard curve of EROD |
以吸光值OD595为纵坐标, 蛋白质含量(μg)为横坐标绘制标准曲线, 其线性回归方程为Y=0.7197X+ 0.5257, R2=0.9698。
由图 4线性回归方程可知, 相对荧光单位与标准羟异吩噁唑酮浓度呈正相关。
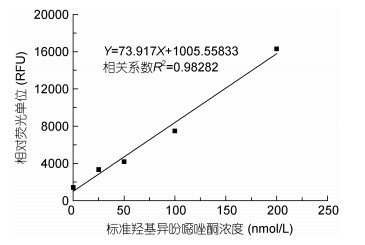 |
| 图 4 EROD活性测定的线性回归方程 Fig. 4 Linear regression equation for the determination of EROD activity |
以相对荧光单位(RFU)为纵坐标, 标准羟基异吩噁唑酮浓度(nmol/L)为横坐标绘制标准曲线, 其线性回归方程为Y=73.917X+1005.55833, R2=0.98282。
2.2.2 不同作用时间对褐菖鲉EROD酶活性的影响由图 5可知, 各实验组中BaP对EROD酶活性的影响与作用时间有关, 其中, 6h、12h和1d组的EROD活性随着时间的延长持续稳定上升, 染毒3d后EROD活性明显下降, 与对照组相比没有明显变化, 但7d后溶剂对照组与染毒组的EROD活性均显著上升。此结果表明, BaP对褐菖鲉EROD酶具有诱导作用, 且这种诱导作用与染毒时间有关, 呈现先上升后下降再上升的趋势, 这与前面BaP对CYP1A1 mRNA表达的影响结果基本一致。
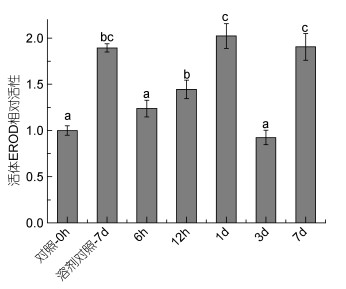 |
| 图 5 一定质量浓度的BaP作用于不同时间后对褐菖鲉EROD酶活性的影响 Fig. 5 Effects of a certain concentration BaP at a different time on relative EROD activity in S. marmoratus 注:相同字母表示没有显著性差异, 不同字母表示有显著性差异(P < 0.05) |
由图 6标准曲线可知, 采用Bradford法测定蛋白质含量时, 蛋白质含量与吸光值呈正相关。
 |
| 图 6 Western blot对应的蛋白质浓度标准曲线 Fig. 6 Protein concentration standard curve of Western blot |
以相吸光值OD595为纵坐标, 蛋白质含量(μg)为横坐标绘制标准曲线, 其线性回归方程为Y= 0.07063X+0.54184, R2=0.96702。
2.3.2 Western blot结果由图 6可知, 注射过苯并芘6h后, 褐菖鲉的蛋白表达量开始明显升高, 在12h时达到最高水平, 1天后下降, 与对照组基本一致, 3天到7天持续上升, 呈现先上升后下降的趋势。这表明苯并芘对褐菖鲉的蛋白表达有显著的诱导作用, 并呈现先诱导后抑制的趋势, 这与前面苯并芘对褐菖鲉mRNA的表达变化基本一致。
3 讨论BaP在化学性质上并没有太大的活性, 必须经过多种代谢酶的作用被活化后, 才能转化为在化学性质上活泼的化合物并对机体发挥多种毒害作用。BaP经过多种代谢酶的作用被活化后, 转化为化学性质活泼的化合物并对机体发挥多种毒害作用(刘春等, 2013)。CYP1A1是BaP活化最重要的代谢酶, 它在生物体内一般呈低水平表达, 但在BaP诱导下, 其表达水平可高度增加, 不同种属、不同组织CYP1A1被BaP诱导的水平不尽相同, 而且, 研究发现即使在体内能被BaP等物质诱导合成CYP1A1的细胞, 一旦离体培养, 可能也会马上失去这种特性(杨进波等, 2003)。
 |
| 图 7 一定质量浓度的BaP作用于不同时间后对褐菖鲉CYP1A1蛋白表达的影响 Fig. 7 Expression of CYP1A1 protein at a different time under a certain concentration |
褐菖鲉是我国海域广泛分布的一种小型底栖穴居鱼类, 是BaP等有机污染物的监测和毒性效应研究适宜的生物材料。肝脏是褐菖鲉体内重要的解毒和代谢器官及场所, 也是褐菖鲉CYP1A1基因表达的重要场所和BaP诱导敏感组织。
本实验室前期的浓度筛选实验结果表明, 不同质量浓度的BaP (0.1, 1, 10, 20, 50mg/kg鱼体重量)对褐菖鲉的CYP1A1基因表达量引起显著诱导作用, 其中BaP体内注射浓度为20mg/kg时, 诱导作用最大。基于此, 本实验中, 每组褐菖鲉的BaP注射浓度均设定为20mg/kg。
本实验用一定剂量的BaP注射于褐菖鲉体内, 分别在0h、6h、12h、1d、3d和7d后对褐菖鲉活体EROD活性进行测定采用Western blot方法对蛋白表达量进行测定, 同时采用实时荧光定量PCR技术对其CYP1A1基因mRNA表达量进行检测。结果发现, 染毒不同时间后褐菖鲉的EROD活性、CYP1A1基因mRNA表达和蛋白表达水平均有显著性升高, 且三者变化趋势基本一致, 都呈现先上升后下降的趋势。这说明苯并芘对褐菖鲉的基因、蛋白及酶活性先诱导后抑制, 由此可推测BaP对褐菖鲉CYP1A1的诱导机制可能是通过诱导CYP1A1基因表达水平, 从而增加蛋白合成提高酶活性(Wang et al, 2008)。但三者的表达变化也具有一定的差异性:各实验组蛋白表达变化与EROD活性变化具有相同的趋势, 但远没有基因表达量变化范围大, 导致差异性的原因可能是酶活性和蛋白的变化滞后于基因表达量变化。
在具体操作中三种检测方法各具有优势, 基因表达量检测方法快速、灵敏, 而蛋白表达量检测方法和酶活性检测直接、稳定, 在污染生物效应的监测研究中, 可将三者结合起来应用, 能有效互补, 拓宽污染生物效应的监测范围, 更加全面地反映污染物对生物的影响。
4 结论本研究发现褐菖鲉肝CYP1A1基因表达、蛋白表达量以及EROD活性随着苯并芘剂量和染毒时间的增加, 呈现先上升后下降的趋势, 说明苯并芘对它们有诱导作用。推测苯并芘对褐菖鲉肝CYP1A1的诱导机制可能通过诱导CYP1A基因表达水平, 从而增加蛋白合成提高酶活性。可将三种指标结合起来, 不仅能够有效的弥补酶活性较易各种等环境因素影响的不足之处, 又能通过蛋白和基因检测的方法更快更稳定地全面反映污染物对生物的影响, 也可为海洋有机物污染的监测与防控提供借鉴。
| 刘春, 李凯彬, 王庆, 等, 2013. 苯并[a]芘诱导阿部鲻虾虎鱼细胞色素P4501A1表达的研究. 安全与环境学报, 13(3): 1–5 |
| 孙竹筠, 周忠良, 李康, 等, 2005. 苯并[a]芘对鲫鱼肝脏EROD活性的影响. 生态学杂志, 24(11): 1295–1298 DOI:10.3321/j.issn:1000-4890.2005.11.010 |
| 李晗, 王宇光, 马增春, 等, 2016. 人参皂苷Rc、Re、Rf和Rg1对药物代谢酶CYP1A1活性诱导作用研究. 中国药理学通报, 32(9): 1217–1223 |
| 杨进波, 蒋长征, 柯磊, 等, 2003. 苯并[a]芘诱导内皮细胞细胞色素P4501 A1表达的研究. 中华劳动卫生职业病杂志, 21(5): 362–364 |
| 吴常文, 王志铮, 王伟洪, 等, 1997. 褐菖鲉Sebastiscus marmoratus增养殖技术研究. 浙江水产学院学报, 16(3): 169–174 |
| 邱郁春, 1992. 水污染鱼类毒性实验方法. 北京: 中国环境科学出版社, |
| 陈君慧, 2006. 苯并[a]芘对养殖黑鲷(Sparus macrocephalus) CYP1A1基因表达及其酶活性的诱导研究. 厦门: 厦门大学硕士学位论文 |
| 谢伟, 2015. 褐菖鲉的发声及发声肌的特性. 上海: 上海海洋大学硕士学位论文 |
| An L H, Hua J Y, Yang M, et al, 2011. CYP1A mRNA expression in redeye mullets (Liza haematocheila) from Bohai Bay, China. Marine Pollution Bulletin, 62(4): 718–725 DOI:10.1016/j.marpolbul.2011.01.019 |
| Celander M, Förlin L, 1991. Catalytic activity and immunochemical quantification of hepatic cytochrome P-450 in β-naphthoflavone and isosafrol treated rainbow trout (Oncorhynchus mykiss). Fish Physiology and Biochemistry, 9(3): 189–197 DOI:10.1007/BF02265140 |
| Chen W P, Bi L, 2007. Exploration on effect and significance of drug metabolic enzyme for studying on compatibility of Chinese herbs. China Journal of Chinese Materia Medica, 32(2): 96–98 |
| Conney A H, 1982. Induction of microsomal enzymes by foreign chemicals and carcinogenesis by polycyclic aromatic hydrocarbons:G. H. A. Clowes Memorial Lecture. Cancer Research, 42(12): 4875–4917 |
| Fent K, 2004. Ecotoxicological effects at contaminated sites. Toxicology, 205(3): 223–240 DOI:10.1016/j.tox.2004.06.060 |
| Goksøyr A, Husøy A M, 1992. The cytochrome P450 1A1 response in fish:application of immunodetection in environmental monitoring and toxicological testing. Marine Environmental Research, 34(1-4): 147–150 DOI:10.1016/0141-1136(92)90099-8 |
| Levine S L, Oris J T, 1999. CYP1A expression in liver and gill of rainbow trout following waterborne exposure:implications for biomarker determination. Aquatic Toxicology, 46(3-4): 279–287 DOI:10.1016/S0166-445X(98)00124-6 |
| Liu Y H, Yu X Y, Han N, 2008. The present study on the toxic effect of benzo[a]pyrene (BAP) and its mechanism. Journal of Inner Mongolia Agricultural University (Natural Science Edition), 29(1): 184–188 |
| Nilsen B M, Berg K, Goksoør A, 1998. Induction of Cytochrome P4501A (CYP1A) in fish a biomarker for environmental pollution. In: Phillips I R, Shephard E A eds. Cytochrome P450 Protocols. Totowa: Humana Press |
| Uno S, Dalton T P, Shertzer H G, et al, 2001. Benzo[a]pyrene-induced toxicity:paradoxical protection in cyp1a1(-/-) knockout mice having increased hepatic BaP-DNA adduct levels. Biochemical and Biophysical Research Communications, 289(5): 1049–1056 DOI:10.1006/bbrc.2001.6110 |
| Wang Y, Zheng R H, Zuo Z H, et al, 2008. Relation of hepatic EROD activity and cytochrome P4501A level in Sebastiscus marmoratus exposed to benzo[a]pyrene. Journal of Environmental Sciences, 20(1): 101–104 DOI:10.1016/S1001-0742(08)60015-7 |
| Yang Z H, Zheng J, Tao J C, et al, 1996. p53 gene mutation in a benzo(a)pyrene-induced human bronchial carcinoma cell line. Laboratory Animal Science and Administration, 13(3): 12–15 |
 2018, Vol. 49
2018, Vol. 49


