
中国海洋湖沼学会主办。
文章信息
- 朱俊杰, 林锋, 王岩, 张海琪. 2018.
- ZHU Jun-Jie, LIN Feng, WANG Yan, ZHANG Hai-Qi. 2018.
- 克氏原螯虾(Procambarus clarkii) CypA基因应答WSSV侵染的表达研究
- EXPRESSION OF CypA AFTER WSSV CHALLENGE IN RED SWAMP CRAYFISH, PROCAMBARUS CLARKII
- 海洋与湖沼, 49(4): 910-918
- Oceanologia et Limnologia Sinica, 49(4): 910-918.
- http://dx.doi.org/10.11693/hyhz20180400091
-
文章历史
- 收稿日期:2018-04-11
- 收修改稿日期:2018-05-09
2. 湖州师范学院 湖州 313000;
3. 浙江省淡水水产研究所 湖州 313001
2. College of Life Sciences, Huzhou University, Huzhou 313000, China;
3. Zhejiang Institute of Freshwater Fisheries, Huzhou 313001, China
亲环素家族(Cyclophiins, Cyps)是一类从原核生物到高等哺乳动物中广泛分布于自然界、高度保守的多功能蛋白家族, 也是免疫抑制剂环孢素A (Cyclophilins, CsA)细胞内受体蛋白, 所以又被称为CsA结合蛋白(Feng et al, 2013)。在高等生物上的大量研究结果显示, 作为一个免疫抑制剂CypA基因参与病毒复制的中间过程, 促进病毒在机体中的复制表达(Franke et al, 1996; Zhou et al, 2012), 比如在HIV侵染过程中, 人体CypA能影响HIV病毒的复制, CypA通过绑定HIV1的蛋白外壳富含脯氨酸的环上的GlyPro位点, 催化Pro肽键顺反异构化, 形成有功能的蛋白外壳, 通过相互作用增加了HIV1病毒在人身上的感染机率(潘克厚等, 2008); 猪瘟病毒(classical swine fever virus, CSFV)感染PK-15细胞后, 细胞中的CypA明显上调表达, 而采用RNA干扰方法下调PK-15细胞中CyPA的表达, 能够抑制CSFV在细胞中的增殖(戴雅娟等, 2012); 传染性脾肾坏死病毒(infectious spleen and kidney necrosis virus, ISKNV)感染鳜鱼实验表明, 宿主的CypA对ISKNV的增殖起着重要的作用, 通过添加其抑制剂CsA能有效抑制病毒的增殖(胡先勤等, 2016)。在近年来在水产动物方面的研究发现, CypA在栉孔扇贝、池蝶蚌以及中华绒螯蟹、斑节对虾、凡纳滨对虾、黄颡鱼、斑点叉尾
白斑综合征病毒(white spot syndrome virus, WSSV)是一种具有囊膜的杆状病毒(Escobedo-Bonilla et al, 2007), 地理分布广、流行范围大、传染性强、发病时间短, 目前尚无有效的药物能够控制疫情, 是中国明对虾(Fenneropenaeus chinensis)、凡纳滨对虾(Litopenaeus vannamei)、拟穴青蟹(Scylla paramamosain)养殖中的主要病原(雷质文等, 2002; Escobedo-Bonilla et al, 2007; Sánchez-Paz, 2010)。研究表明WSSV具有广泛的宿主, 可以感染甲壳纲十足目的大部分动物(Pradeep et al, 2012)。近年来发现WSSV在克氏原螯虾养殖中也广泛流行, 给克氏原螯虾养殖业带来巨大的经济损失(丁正峰等, 2008)。深入理解克氏原螯虾免疫系统的特征是防控克氏原螯虾病害的关键, 挖掘免疫系统的重要功能基因是深入理解克氏原螯虾免疫系统的必经之路。
为探究CypA在克氏原螯虾(Procambarus clarkii)抗病毒免疫调控方面的作用机制, 本研究通过采用实时荧光定量PCR技术结合组织病理分析PcCypA在WSSV感染克氏原螯虾后在各组织中的表达情况, 初步阐明PcCypA在克氏原螯虾抗病毒免疫应答方面的功能, 为揭示克氏原螯虾CypA基因在克氏原螯虾免疫系统中的作用奠定基础。
1 实验材料与方法 1.1 克氏原螯虾克氏原螯虾由浙江省淡水水产研究所浙北公司提供, 平均体长和体重分别为(8.25±0.94)cm和(23.18± 8.99)g, 养殖间的容积为0.5m3的塑料缸中, 水温21—25℃, 每天投喂2次。饲养7d后, 挑取200只健康、有活力的克氏原螯虾用于攻毒实验。
1.2 人工感染实验取200只健康状况良好的克氏原螯虾进行攻毒实验, 分为2步:一是采用腹节注射攻毒, 通过注射不同浓度病毒悬液(100μL, 200μL, 300μL)确定致死浓度; 二是按照致死浓度, 进行攻毒, 攻毒后在0h、6h、12h、24h、36h、48h、72h、96h、120h等不同时间点分别采集样本, 对照组腹节注射相同体积的0.9%的生理盐水。
1.3 组织病理学观察取健康虾和WSSV感染病虾的心脏、肌肉和肝胰腺组织, 用福尔马林固定。经酒精脱水, 石蜡包埋切片(5μm厚度), 再用苏木精-伊红染色, 中性树胶封片后在显微镜(DMLB2, Leica)下观察, 用数码摄像系统(DC300F, Leica)拍照。
1.4 CypA基因转录水平分析采用primer 5.0软件设计荧光定量PCR引物, 如表 1所示。对克氏原螯虾的肝胰腺、腮丝、精巢、卵巢、心脏、肌肉、眼柄、全血等组织在不同时段的CypA基因的表达情况进行分析。
| 引物 | 序列(5′→3′) |
| CypA F | AGGGCAACAGTGGTATCAAC |
| CypA R | GAAAGTGGACCCTTTGTAGC |
| 18S rRNA F | CTGAGAAACGGCTACCACATC |
| 18S rRNA R | CTAGTTAGCTGTTCGGAGCGT |
试验结果表明, WSSV病毒对克氏原螯虾有很强的感染能力, 对照组没有死亡个体, 而注射组均有不同比例的死亡个体。WSSV病毒感染力与注射浓度呈依赖关系(见图 1), 其中注射300μL病毒悬液时, 在12天累计死亡率接近百分百。因此, 为保证实验效果中, 选择注射300μL WSSV病毒悬液(LC=107/μL)攻毒。
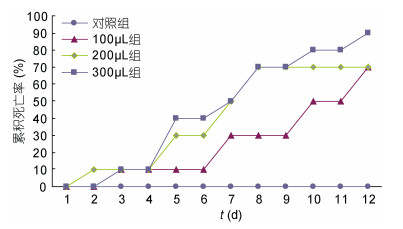 |
| 图 1 WSSV感染后克氏原螯虾的累积死亡率 Fig. 1 Cumulative mortality of P. clarkii after WSSV injection |
病理组织学观察发现, 与健康虾相比, 在感染WSSV的克氏原螯虾心脏(图 2A, 图 2B)和肌肉组织(图 2C, 图 2D)中都出现了肌纤维断裂溶解的现象, 心脏组织中细胞排列由井然有序变得杂乱无章; 在肝胰腺组织(图 2E, 图 2F)中, 出现了脂肪颗粒脱落、细胞空泡化和细胞膜溶解现象, 表明WSSV侵染宿主成功, 对宿主组织有较强的破坏性。
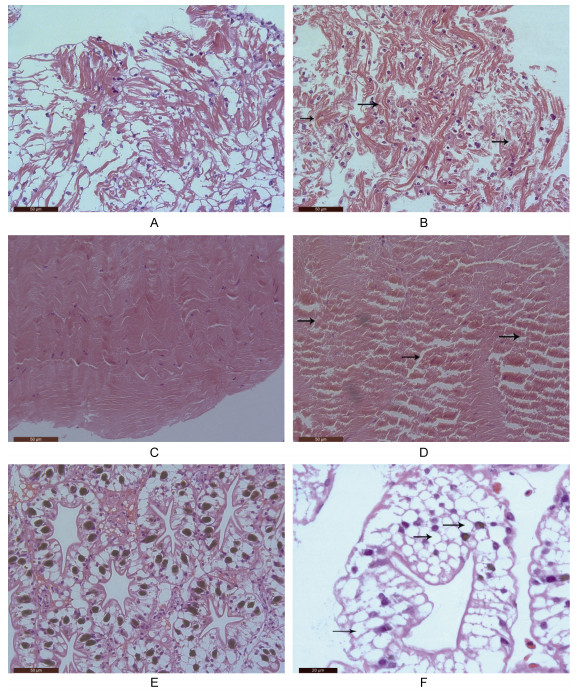 |
| 图 2 WSSV感染前后克氏原螯虾的心、肌肉和肝胰腺的组织学观察 Fig. 2 Heart, muscle, hepatopancreas sections of P. clarkii under a light microscope 注: A:健康虾心脏组织切片(20×); B: WSSV感染虾心脏组织切片(20×); C:健康虾肌肉组织切片(20×); D: WSSV感染虾肌肉组织切片(20×); E:健康虾肝胰腺组织切片(20×); F: WSSV感染虾肝胰腺组织切片(40×) |
利用Real-time PCR方法分别检测了CypA在WSSV感染后克氏原螯虾不同组织的表达水平。
在克氏原螯虾眼柄组织(图 3A)中, 72hpi (hours post injection)的PcCypA的相对表达量最低, 以此为基数(1), 24hpi后PcCypA的相对表达量最高(88.91倍), 其次是0hpi(58.50倍); 48hpi之后的表达量都非常低。
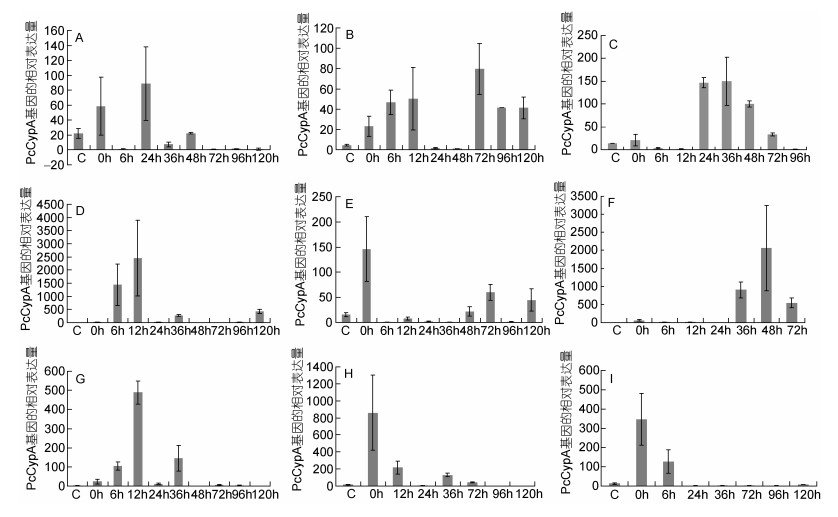 |
| 图 3 WSSV感染后克氏原螯虾不同组织的CypA转录的时序表达模式 Fig. 3 The relative temporal expression levels of PcCypA in different tissues from P. clarkii infected with WSSV 注: A—I分别代表眼柄、鳃丝、心脏、肝胰腺、肠、肌肉、血淋巴、精巢和卵巢 |
在克氏原螯虾鳃丝组织(图 3B)中, 48hpi的PcCypA的相对表达量最低, 以此为基数(1), 72hpi后PcCypA的相对表达量最高(79.82倍), 其次是12hpi(50.24倍); 整个表达图谱显示出前高后高中间低的特征, 推测前期是机体鳃丝组织对注射的应激反应, 后期是鳃丝组织PcCypA基因对WSSV病毒感染的响应。
在克氏原螯虾心脏组织(图 3C)中, 96hpi的PcCypA的相对表达量最低, 以此为基数(1), 36hpi后PcCypA的相对表达量最高(150.17倍), 其次是24hpi(146.70倍); 整个表达图谱显示出高低起伏的表达特征, 与鳃丝中的表达图谱对比分析认为, 心脏CypA对WSSV感染的响应比鳃丝对WSSV感染的响应早24—48h。
在克氏原螯虾肝胰腺组织(图 3D)中, 72hpi的PcCypA的相对表达量最低, 以此为基数(1), 12hpi后PcCypA的相对表达量最高(2452倍), 其次是6hpi(1443倍); 说明在前期的注射应激响应中, 肝脏CypA的超高表达对于克氏原螯虾机体应对注射应激是有重要作用的。中间24—96hpi的相对表达量很低, 120hpi的表达量(421.24倍)再次上升, 说明肝胰腺对WSSV感染的响应比其他的组织都迟。
在克氏原螯虾肠组织(图 3E)中, 6hpi的PcCypA的相对表达量最低, 以此为基数(1), 0hpi后PcCypA的相对表达量最高(145.87倍), 其次是72hpi(59.68倍)和120hpi(44.68倍)。这表明肠对注射行为的应激非常早, 而且应激反应中CypA的表达量也很高, 这可能与腹节注射病毒悬液的行为有关, 在注射过程中, 针头碰到肠组织, 对肠形成了直接的应激行为, 而其他组织则是间接的应激行为。
在克氏原螯虾肌肉组织(图 3F)中, 24hpi的PcCypA的相对表达量最低, 以此为基数(1), 48hpi后PcCypA的相对表达量最高(2065倍), 其次是36hpi (906.07倍)和72hpi(542.34倍)。说明肌肉组织PcCypA对WSSV·的响应大约是从36h开始的。
在克氏原螯虾血淋巴组织(图 3G)中, 48hpi的PcCypA的相对表达量最低, 以此为基数(1), 12hpi后PcCypA的相对表达量最高(489.36倍), 其次是36hpi(144.44倍)。对比心脏、鳃丝和肝胰腺等血液交换较大的组织来看, 血淋巴组织PcCypA基因转录表达对WSSV的响应晚于心脏, 早于鳃丝, 早于肝胰腺。
在克氏原螯虾精巢组织(图 3H)中, 96hpi的PcCypA的相对表达量最低, 以此为基数(1), 0hpi后PcCypA的相对表达量最高(860.62倍), 其次是12hpi(217.00倍)。对比卵巢、肠、肝胰腺等内脏组织, 发现受腹节注射病毒悬液的行为影响, 内脏组织PcCypA均表现出迅速的应激反应, 表达量迅速上调。精巢与卵巢对WSSV感染的响应在24—120h没有明显的响应表达。
在克氏原螯虾卵巢组织(图 3I)中, 96hpi的PcCypA的相对表达量最低, 以此为基数(1), 0hpi后PcCypA的相对表达量最高(346.39倍), 其次是6hpi(125.95倍)。WSSV感染下卵巢PcCypA的时序表达模式基本与精巢表达模式一致。
由此可知, WSSV感染后克氏原螯虾不同组织的CypA转录水平分析, 可以24hpi为界, 0—24hpi为注射应激期, 在此期间, 眼柄、鳃丝、肝胰腺、肠、血淋巴、精巢、卵巢等组织的PcCypA转录表达均有上调; 24—36hpi为应激恢复期, 绝大多数的组织中PcCypA转录表达均出现了下调回落, 但在心脏、肌肉、血淋巴组织中出现了上调, 说明这三个组织对WSSV感染的响应早于其他组织; 48hpi之后为WSSV感染响应阶段, 在此期间鳃和肌肉组织有大量PcCypA转录表达, 肝胰腺和精巢组织表达下调; 96—120hpi为感染响应后期阶段, 肝胰腺和肠组织的PcCypA转录水平再次上调。
2.4 PcCypA基因在WSSV感染后的不同组织中的转录水平比较在对照组(图 4A)中, 肝胰腺PcCypA的相对表达量最低, 以此为基数(1), 表达量从高到底分别为肠(41.63倍)、眼柄(31.38倍)、心脏(6.27倍)、卵巢(5.80倍)、精巢(4.61倍)、鳃、肌肉和血淋巴。
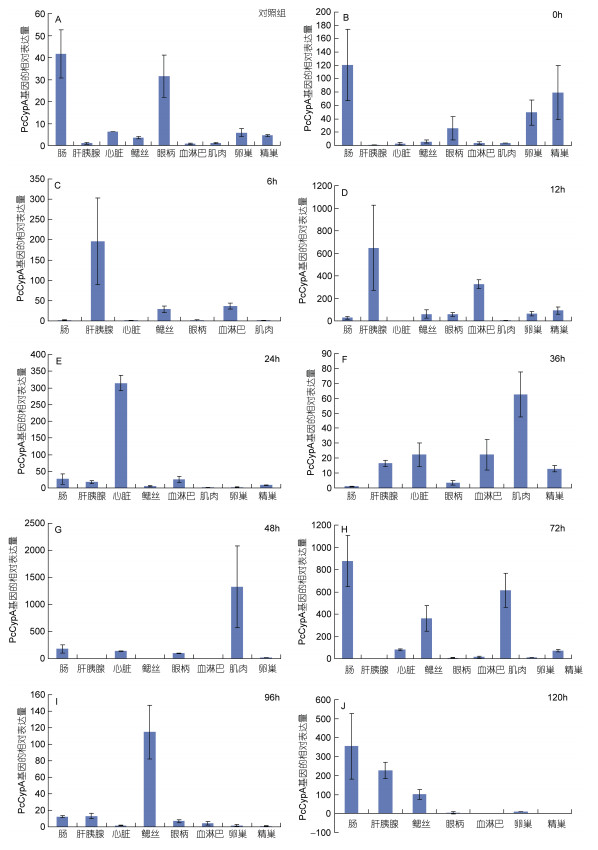 |
| 图 4 WSSV感染后PcCypA基因在不同时间的组织空间转录表达模式 Fig. 4 The tissue expression pattern of PcCypA in different hours post infection with WSSV 注: A代表对照组, B—J分别代表WSSV感染后0、6、12、24、36、48、72、96、120h |
在WSSV感染后0hpi(图 4B), 肝胰腺PcCypA的相对表达量最低, 以此为基数(1), 肠PcCypA的相对表达量最高(120.91倍), 其次是精巢(79.24倍)。与对照组相比, PcCypA在精巢(79.24倍)和卵巢(49.33倍)的表达都有所上调, 眼柄组织的PcCypA(25.84倍)表达显著下调。
在WSSV感染后6hpi(图 4C), 心脏PcCypA的相对表达量最低, 以此为基数(1), 肝胰脏PcCypA的相对表达量最高(196.34倍), 其次是血淋巴组织(36.16倍)和鳃(27.76倍)。与对照组相比, PcCypA在肝胰腺组织的表达上调非常显著, 血淋巴组织也显著上调; PcCypA在眼柄组织(25.84倍)表达下调极显著, 心脏组织中也显著下调。
在WSSV感染后12hpi(图 4D), 心脏PcCypA的相对表达量最低, 以此为基数(1), 肝胰脏PcCypA的相对表达量最高(649.16倍), 其次是血淋巴组织(326.70倍)。与对照组相比, PcCypA在肝胰腺组织的表达上调非常显著, 血淋巴组织也显著上调。说明在腹节注射病毒悬液后的早期应激反应(0—12hpi)中, PcCypA的调控模式以肝胰腺和血淋巴的上调为主。
在WSSV感染后24hpi(图 4E), 肌肉PcCypA的相对表达量最低, 以此为基数(1), 心脏PcCypA的相对表达量最高(314.30倍), 其次是肠(27.38倍)和血淋巴组织(25.86倍)。
在WSSV感染后36hpi(图 4F), 肠PcCypA的相对表达量最低, 以此为基数(1), 肌肉PcCypA的相对表达量最高(62.56倍), 其次是血淋巴组织(16.42倍)。说明在此期间(24—36hpi)肠组织PcCypA显著下调, 而肌肉PcCypA显著上调。
在WSSV感染后48hpi(图 4G), 肝胰腺PcCypA的相对表达量最低, 以此为基数(1), 肌肉PcCypA的相对表达量最高(1328.62倍), 其次是肠(181.84倍)和心脏组织(137.78倍)。说明在24—48hpi期间, 肌肉组织PcCypA持续上调; 在36—48hpi期间, 在肠组织中的表达由下调转为上调。
在WSSV感染后72hpi(图 4H), 肝胰腺PcCypA的相对表达量最低, 以此为基数(1), 肠PcCypA的相对表达量最高(874.99倍), 其次是肌肉(613.72倍)和鳃丝组织(362.54倍)。说明在在48—72hpi期间, 肌肉和肠组织中PcCypA维持高表达水平, 鳃组织表达开始上调。
在WSSV感染后96hpi(图 4I), 精巢PcCypA的相对表达量最低, 以此为基数(1), 鳃PcCypA的相对表达量最高(114.74倍), 其次是血淋巴(13.14倍)和肠组织(12.45倍)。说明在72—96hpi期间, 鳃组织PcCypA维持高表达水平, 精巢组织显著下调。
在WSSV感染后120hpi(图 4J), 精巢PcCypA的相对表达量最低, 以此为基数(1), 肠PcCypA的相对表达量最高(354.31倍), 其次是血淋巴(227.86倍)和鳃(101.12倍)组织(12.45倍)。说明在72—120hpi期间, 鳃组织PcCypA维持高表达水平, 精巢组织显著下调; 96—120hpi期间, 血淋巴组织PcCypA开始上调。
综上所述, WSSV感染后克氏原螯虾各组织CypA基因在不同时间转录水平, 以24hpi为界, 0—24hpi为注射应激期, 在此期间, 肝胰腺(0—12hpi)、心脏(12—24hpi)等组织的PcCypA转录表达均有上调。24—36hpi为应激恢复期, 绝大多数的组织中PcCypA转录表达均出现了回落, 但在心脏、肌肉、血淋巴组织中出现了上调, 说明这三个组织对WSSV感染的响应早于其他组织。48hpi之后为WSSV感染响应阶段, 在此期间鳃和肌肉组织有大量PcCypA转录表达, 肝胰腺和精巢组织表达下调。96—120hpi为感染响应后期阶段, 肝胰腺和肠组织的PcCypA转录水平再次上调。该综述结果与3.3结果基本一致, 说明结果基本可靠。
3 讨论CypA基因广泛分布于从原核生物到高等哺乳动物的各种组织中, 有研究表明CypA基因在水生生物方面具有肽酰脯氨酰顺反异构酶(PPIase)活性(王旭辉, 2014; 罗春, 2015)、免疫疫苗候选分子(陈金桃等, 2015)、趋化作用(Sherry et al, 1992; Allain et al, 2002; Yurchenko et al, 2002; Yeh et al, 2008; Damsker et al, 2009; Wang et al, 2014; Dong et al, 2015; Guo et al, 2015)、抗逆作用(王旭辉, 2014)等多种生理功能。目前, CypA基因在水产动物上的研究的深度和广度都还远远不足, 特别是在克氏原螯虾方面相关报道较少。Zhu等(2017)研究表明克氏原螯虾CypA (Procambarus clarkii Cyclopllilin A, PcCypA)在克氏原螯虾肝胰腺、腮丝、精巢、卵巢、心脏和肌肉等6种组织器官中都有转录表达, 在心脏中表达量最高, 其次是肌肉、腮丝、卵巢和精巢, 肝胰腺中表达量最低。而CypA蛋白在克氏原螯虾的肝胰腺、腮丝、精巢、心脏和肌肉中均有发现, 大小约17kDa, 而在卵巢中未发现相应的蛋白。
在本研究中通过组织病理分析发现, 与健康虾相比, 在感染WSSV的克氏原螯虾心脏和肌肉组织中均出现了肌纤维断裂溶解的现象, 心脏组织中细胞排列由井然有序变得杂乱无章; 在肝胰腺组织中, 出现了脂肪颗粒脱落、细胞空泡化和细胞膜溶解现象。而洪徐鹏等研究了克氏原螯虾WSSV感染后的鳃、肝胰腺和心肌组织病理组织学, 结果发现细胞排列无序、细胞破裂、核仁皱缩等明显的病理变化(洪徐鹏等, 2014), 此结果与本研究结果基本一致, 可以相互印证。此外, 在本研究中注射病毒悬液感染后5—9d出现个体死亡高峰, 此结果与潘子豪等的人工感染实验结果基本相同(潘子豪等, 2013), 进一步佐证克氏原螯虾是白斑综合征病毒的宿主之一, WSSV可以引起克氏原螯虾的大规模死亡。
现有大量研究证明CypA涉及多种病理状态, 包括感染和炎症(Liu et al, 1991; Sherry et al, 1992; Jin et al, 2000; Matsuda et al, 2000; Suzuki et al, 2006)。Qiu等研究发现, 在脂多糖刺激下, 斑节对虾(Penaeus monodon)CypA基因的mRNA在肝胰腺和血液中显著上调(Qiu et al, 2009)。Lu等(2013)研究了环境污染物邻苯二甲酸(Di-2-ethylhexylPhthalate, DEHP)对菲律宾蛤仔CypA等免疫相关基因的影响, 结果发现暴露于4mg/L的DEHP使CypA的mRNA表达上调了4.72倍, 说明CypA可能参与贝类环境应激的免疫应答。Song(2009)用鳗弧菌(V. anguillarum)感染栉孔扇贝(Chlamys farreri)2、4、8、16、24和48h后, 血液中CypAmRNA表达没有显著变化, 但在性腺中却显著上调, 感染后4h和8h CypAmRNA转录表达量分别达到了22.59和7.20倍。Dong等(2015)研究发现黄颡鱼(Pelteobagrus fulvidraco)CypA基因在肾脏中蛋白表达含量较高; 在感染爱德华氏菌(E. ictaluri)后, 肝脏、脾脏、肾脏、头肾中CypA的蛋白表达量均有少量上升。这些研究均显示, CypA在水生生物的先天性免疫系统中发挥重要作用。Xu等(2016)在发现牡蛎(Crassostrea ariakensis)在类立克次体(Rickettsia-like organism, RLO)刺激下, CaCyPA转录表达明显增加, 表明CypA在牡蛎体内参与抗RLO应激免疫防御。与此类似, 在本研究中, WSSV感染后在24—36hpi期间, 心脏、肌肉、血淋巴组织中PcCypA转录表达出现了上调; 48—120hpi期间鳃和肌肉组织有大量PcCypA转录表达, 肝胰腺和精巢组织表达下调。96—120hpi为感染响应后期阶段, 肝胰腺和肠组织的PcCypA转录水平再次上调。研究结果表明, WSSV感染后不同组织CypA基因对感染后的响应有时序差异。
本研究通过WSSV感染下克氏原螯虾CypA基因的表达响应研究, 发现WSSV感染后克氏原螯虾CypA基因表达有不同程度的上调和下调, 不同组织CypA基因对感染后的响应有时序差异。从而可以初步推断CypA在克氏原螯虾中可能参与机体的先天免疫应答, 且由于不同组织中的PcCypA在病毒感染的同一时段表达水平具有明显差异, 同时同一组织的PcCypA在病毒感染不同时段存在显著差别, 表明PcCypA在机体内并非均匀分布, 在抵御病毒侵染过程中的应答也有着明显的时序性。
4 结论综上所述, CypA基因对病毒感染后的响应有时序差异性, 也有组织差异性, 初步判定CypA在克氏原螯虾中可能参与机体的先天免疫系统, 同时参与生物性免疫响应和物理性应激响应, 下一阶段研究将进一步挖掘CypA在克氏原螯虾免疫系统中的作用机制, 为克氏原螯虾病害防控提供基础数据支撑。
| 丁正峰, 薛晖, 夏爱军, 等, 2008. 白斑综合征病毒在养殖克氏原螯虾中感染流行研究. 南京农业大学学报, 31(4): 129–133 |
| 丁兆坤, 辛文伦, 陈秀荔, 等, 2011. 凡纳滨对虾亲环素A基因的克隆及表达分析. 武汉大学学报(理学版), 57(4): 323–328 |
| 王旭辉, 2014. 小球藻亲环蛋白A(CyPA)基因克隆与功能研究. 哈尔滨: 东北林业大学硕士学位论文 |
| 陈金桃, 宋天章, 尹红玲, 等, 2015. 重组日本血吸虫亲环素A的原核表达及免疫保护作用的研究. 热带医学杂志, 15(4): 429–432, 424 |
| 罗春, 徐灵, 何静, 等, 2015. 池蝶蚌CyPA的应激表达及对Hela细胞生长的影响. 水生生物学报, 39(3): 475–481 DOI:10.7541/2015.63 |
| 胡先勤, 付小哲, 董星星, 等, 2016. 鳜亲环蛋白A在传染性脾肾坏死病毒增殖中的作用. 水产学报, 40(1): 100–109 |
| 洪徐鹏, 陆宏达, 张庆华, 等, 2014. 黄芪多糖对克氏原螯虾抗白斑综合征病毒(WSSV)感染的效果研究. 上海海洋大学学报, 23(3): 423–428 |
| 雷质文, 黄倢, 张立敬, 等, 2002. 白斑综合症病毒(WSSV)的宿主调查. 海洋与湖沼, 33(3): 250–258 |
| 潘子豪, 杨政霖, 陆承平, 2013. 安徽地区克氏原螯虾白斑综合征的诊断及朔源. 微生物学报, 53(5): 492–497 |
| 潘克厚, 马晓磊, 石娟, 2008. 亲环素的研究进展与展望. 中国海洋大学学报(自然科学版), 38(3): 371–376 |
| 戴雅娟, 李江南, 郭焕成, 等, 2012. 细胞亲环蛋白A对猪瘟病毒增殖的影响. 中国预防兽医学报, 34(6): 432–435 |
| Allain F, Vanpouille C, Carpentier M, et al, 2002. Interaction with glycosaminoglycans is required for cyclophilin B to trigger integrin-mediated adhesion of peripheral blood t lymphocytes to extracellular matrix. Proceedings of the National Academy of Sciences of the United States of America, 99(5): 2714–2719 DOI:10.1073/pnas.052284899 |
| Damsker J M, Okwumabua I, Pushkarsky T, et al, 2009. Targeting the chemotactic function of CD147 reduces collagen-induced arthritis. Immunology, 126(1): 55–62 DOI:10.1111/imm.2008.126.issue-1 |
| Dong X X, Qin Z D, Hu X Q, et al, 2015. Molecular cloning and functional characterization of cyclophilin A in yellow catfish (Pelteobagrus fulvidraco). Fish & Shellfish Immunology, 45(2): 422–430 |
| Escobedo-Bonilla C M, Wille M, Sanz V A, et al, 2007. Pathogenesis of a Thai strain of white spot syndrome virus (WSSV) in juvenile, specific pathogen-free Litopenaeus vannamei. Diseases of Aquatic Organisms, 74(2): 85–94 |
| Feng W H, Xin Y, 2013. Progress in research on cyclophilin A and malignant tumors. Tumor, 33(10): 928–934 |
| Franke E K, Luban J, 1996. Inhibition of HIV-1 replication by cyclosporine A or related compounds correlates with the ability to disrupt the Gag-cyclophilin A interaction. Virology, 222(1): 279–282 DOI:10.1006/viro.1996.0421 |
| Guo N, Zhang K, Lv M H, et al, 2015. CD147 and CD98 complex-mediated homotypic aggregation attenuates the CypA-induced chemotactic effect on Jurkat T cells. Molecular Immunology, 63(2): 253–263 DOI:10.1016/j.molimm.2014.07.005 |
| He S H, Peng K, Hong Y J, et al, 2013. Molecular properties and immune defense of two ferritin subunits from freshwater pearl mussel, Hyriopsis schlegelii. Fish & Shellfish Immunology, 34(3): 865–874 |
| Jin Z G, Melaragno M G, Liao D F, et al, 2000. Cyclophilin A is a secreted growth factor induced by oxidative stress. Circulation Research, 87(9): 789–796 DOI:10.1161/01.RES.87.9.789 |
| Liu J, Farmer J D Jr, Lane W S, et al, 1991. Calcineurin is a common target of cyclophilin-cyclosporin A and FKBP-FK506 complexes. Cell, 66(4): 807–815 DOI:10.1016/0092-8674(91)90124-H |
| Lu Y L, Zhang P, Li C H, et al, 2013. Characterisation of immune-related gene expression in clam (Venerupis philippinarum) under exposure to di (2-ethylhexyl) phthalate. Fish & shellfish Immunology, 34(1): 142–146 |
| Matsuda S, Koyasu S, 2000. Mechanisms of action of cyclosporine. Immunopharmacology, 47(2-3): 119–125 DOI:10.1016/S0162-3109(00)00192-2 |
| Pradeep B, Rai P, Mohan S A, et al, 2012. Biology, host range, pathogenesis and diagnosis of white spot syndrome virus. Indian Journal of Virology, 23(2): 161–174 DOI:10.1007/s13337-012-0079-y |
| Qiu L H, Jiang S G, Huang J H, et al, 2009. Molecular cloning and mRNA expression of cyclophilin A gene in black tiger shrimp (Penaeus monodon). Fish & Shellfish Immunology, 26(1): 115–121 |
| Sánchez-Paz A, 2010. White spot syndrome virus:an overview on an emergent concern. Veterinary Research, 41(6): 43 DOI:10.1051/vetres/2010015 |
| Sherry B, Yarlett N, Strupp A, et al, 1992. Identification of cyclophilin as a proinflammatory secretory product of lipopolysaccharide-activated macrophages. Proceedings of the National Academy of Sciences of the United States of America, 89(8): 3511–3515 DOI:10.1073/pnas.89.8.3511 |
| Song X Y, 2009. Molecular cloning, characterization and expression of Lectins from Argopecten irradians and Cyclophilin A from Chlamys farreri. Northwest A & F University |
| Suzuki J, Jin Z G, Meoli D F, et al, 2006. Cyclophilin A is secreted by a vesicular pathway in vascular smooth muscle cells. Circulation Research, 98(19): 811–817 |
| Wang C H, Rong M Y, Wang L, et al, 2014. CD147 up-regulates calcium-induced chemotaxis, adhesion ability and invasiveness of human neutrophils via a TRPM-7-mediated mechanism. Rheumatology, 53(12): 2288–2296 DOI:10.1093/rheumatology/keu260 |
| Wang M Q, Zhang D X, Wang L L, et al, 2013. The molecular characterization of a cyclophilin A from Chinese mitten crab Eriocheir sinensis and the antifungal activity of its recombinant protein. Electronic Journal of Biotechnology, 16(2): 230–240 |
| Xu T, Xie J S, Yang S B, et al, 2016. First characterization of three cyclophilin family proteins in the oyster, Crassostrea ariakensis Gould. Fish & Shellfish Immunology, 55: 257–266 |
| Yeh H Y, Klesius P H, 2008. Channel catfish, Ictalurus punctatus, cyclophilin A and B cDNA characterization and expression analysis. Veterinary Immunology and Immunopathology, 121(3-4): 370–377 DOI:10.1016/j.vetimm.2007.09.015 |
| Yurchenko V, Zybarth G, O'Connor M, et al, 2002. Active site residues of cyclophilin A are crucial for its signaling activity via CD147. Journal of Biological Chemistry, 277(25): 22959–22965 DOI:10.1074/jbc.M201593200 |
| Zhou D J, Mei Q, Li J T, et al, 2012. Cyclophilin A and viral infections. Biochemical and Biophysical Research Communications, 424(4): 647–650 DOI:10.1016/j.bbrc.2012.07.024 |
| Zhu J J, Lin F, Li F, et al, 2017. Molecular identification and expression analysis of a novel cyclophilin a gene in the red swamp crayfish, Procambarus clarkii. Fish & Shellfish Immunology, 72: 383–388 |
 2018, Vol. 49
2018, Vol. 49


