
中国海洋湖沼学会主办。
文章信息
- 刘良国, 杨品红, 王文彬, 杨春英, 邹万生, 刘飞, 韩庆. 2018.
- LIU Liang-Guo, YANG Pin-Hong, WANG Wen-Bin, YANG Chun-Ying, ZOU Wan-Sheng, LIU Fei, HAN Qing. 2018.
- 洞庭湖水系五强溪水库光泽黄颡鱼(Pelteobagrus nitidus)遗传多样性的AFLP分析
- ANALYSIS OF GENETIC DIVERSITY OF PELTEOBAGRUS NITIDUS IN WUQIANGXI RESERVOIR OF DONGTING LAKE WATER SYSTEM BY AFLP MARKERS
- 海洋与湖沼, 49(4): 919-924
- Oceanologia et Limnologia Sinica, 49(4): 919-924.
- http://dx.doi.org/10.11693/hyhz20180400092
-
文章历史
- 收稿日期:2018-04-13
- 收修改稿日期:2018-05-11
光泽黄颡鱼(Pelteobagrus nitidus)隶属于鲇形目(Siluriformes)、鲿科(Bagridae)、黄颡鱼属(Pelteobagrus), 是东亚特有鲿科鱼类, 也是我国江河湖泊常见的一类小型底栖经济鱼类, 光泽黄颡鱼在长江流域尤其是洞庭湖水系均有广泛的分布。因其肉味鲜美、营养丰富、无肌间刺而颇受消费者欢迎。近年来, 由于人类活动、自然因素等影响, 包括光泽黄颡鱼在内的洞庭湖水系鱼类资源呈减少趋势(刘良国等, 2013a, b, 2014), 了解洞庭湖水系光泽黄颡鱼的遗传多样性状况, 对于保护和利用这一东亚特有鲿科鱼类资源具有重要意义。
水电梯级开发是人类改造自然的重大活动, 同时也是导致河流水域生态发生变化的重要原因, 它不仅改变河流的水文情势和生境, 而且大坝阻隔还会影响到鱼类的洄游、繁殖和基因交流, 进而影响鱼类的遗传多样性(李陈, 2012)。沅水源自贵州东南部, 东流入洞庭湖, 通长江, 是长江水系的重要支流, 建立在沅水中游的五强溪水库是沅水梯级上最大的水利工程, 水库从1994年建成运行以来, 对沅水鱼类资源的种类组成、分布、渔获物结构等产生了重要影响(向鹏等, 2016)。随着时间的推移, 五强溪大坝的阻隔是否也会导致水库鱼类遗传多样性的变化, 目前还缺少这方面的研究报道。为了了解五强溪大坝阻隔对鱼类遗传多样性的影响, 以及沅水五强溪水库光泽黄颡鱼资源的种群遗传结构现状, 本实验以东亚特有鲿科鱼类光泽黄颡鱼为对象, 首次采用AFLP(Amplified fragment length polymorphism, 扩增片段长度多态性)分子标记技术(Vos et al, 1995; Wang et al, 2004), 分别对五强溪水库库区和沅水下游常德江段的两个光泽黄颡鱼野生群体进行了遗传多样性分析。
1 材料与方法 1.1 材料实验用光泽黄颡鱼(Pelteobagrus nitidus)野生群体分别采自洞庭湖水系沅水五强溪水库库区(水库大坝至泸溪江段)和沅水下游(常德江段)水域, 从库区和沅水下游群体中分别随机挑选15尾个体, 取其背部肌肉组织置于95%的乙醇溶液中保存备用。
1.2 基因组DNA提取将肌肉组织样本从95%的乙醇中取出, 用超纯水多次清洗。按照Sambrook等(1989)的酚-氯仿提取方法, 进行基因组DNA的提取。将提取的DNA加适量TE缓冲液稀释后测量紫外光吸收值, 按1OD260=50μg基因组DNA计算DNA浓度; 以λDNA为标准, 取少量DNA用1.0%琼脂糖凝胶(含0.5μg/mL的溴化乙锭)电泳(5V/cm)2h, 紫外灯下拍照, 确定DNA的完整性。经过以上程序检测并达到要求的DNA模板, 方可用于本实验的PCR扩增。
1.3 AFLP-PCR扩增AFLP-PCR扩增步骤中的酶切、连接、预扩增及其反应程序、选择性扩增及其反应程序、选择性扩增产物及电泳胶图的获得, 均依照Liu等(2009)的方法进行。本实验共选用9对选择性扩增引物, 分别为: E-AAC/M-CAC、E-AAC/M-CAT、E-AAC/M-CTA、E-AAC/M-CTC、E-ACA/M-CAC、E-ACC/M-CAA、E-ACC/M-CAG、E-AGG/M-CAC、E-AGG/M-CTG。
1.4 数据统计用GENESCAN3.1软件打开胶图, 通过Binthere软件提取胶图上各片段大小的结果, 导出片段大小的结果并将结果以XLS格式保存, 将Excel表内数值进行0/1赋值, 表内数值不为0的转换为1, 数值为0的不转换, 从而生成由“l”和“0”组成的原始矩阵。利用Popgene1.32软件进行位点总数和多态位点数统计, 同时计算出多态位点比率、观测等位基因数、有效等位基因数、Nei’s多样性指数和Shannon’s信息指数等遗传参数。利用SPSS软件中的t检验对两个光泽黄颡鱼群体的遗传参数进行差异显著性分析。
群体内、群体间的遗传相似系数和遗传距离依据Lynch(1990)的方法计算。
1.5 聚类分析根据两个群体不同个体样本之间的遗传距离, 用MEGA软件包中的UPGMA (Unweighted pairgroup methods with arithmetic means)程序(West, 1990)进行聚类分析。
2 结果 2.1 AFLP-PCR扩增结果9对选择性引物组合对五强溪水库库区和沅水下游光泽黄颡鱼群体共30尾个体进行PCR扩增和电泳的统计分析, 9对引物组合共扩增出1243个位点, 扩增片段大小分布于70—500bp之间(图 1), 在1243个位点中, 多态性位点达1091个, 多态性位点的比率为87.77%。在两个群体间, 每对引物组合扩增的位点数115—167不等, 多态位点数93—148不等, 多态位点比率均在80%以上, 其中多态位点比率最高的引物组合是E-ACC/M-CAA(92.76%), 最低的引物组合是E-AAC/M-CAT(80.87%)(表 1), 表现出丰富的多态性。
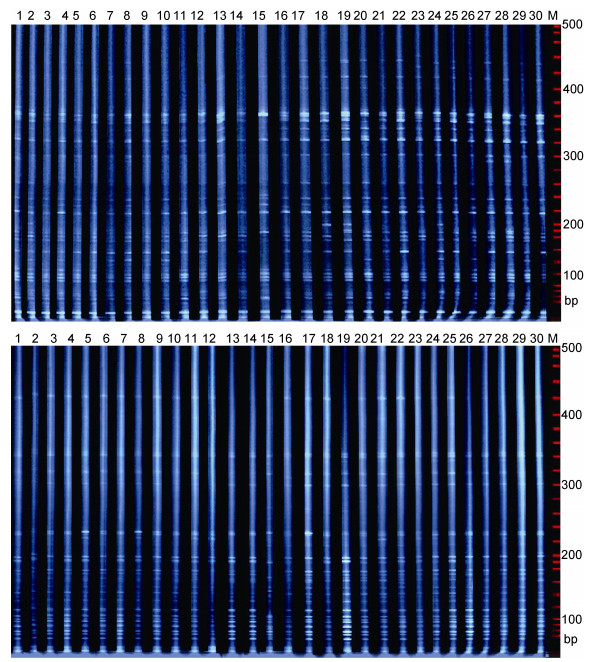 |
| 图 1 引物(E-AAC/M-CTA)和(E-AGG/M-CTG)在两个光泽黄颡鱼群体的扩增图谱 Fig. 1 The AFLP amplified results for two populations of P. nitidus by primer combinations of (E-AAC/M-CTA) and (E-AGG/M-CTG) 注:引物组合E-AAC/M-CTA(上图), E-AGG/M-CTG(下图)。M. ROX1000 Ladder marker; 1—15.库区光泽黄颡鱼; 15—30.沅水下游光泽黄颡鱼 |
| 引物组合 | 总位点数 | 多态位点数 | 多态位点比率(%) |
| E-AAC/M-CAC | 139 | 124 | 89.21 |
| E-AAC/M-CAT | 115 | 93 | 80.87 |
| E-AAC/M-CTA | 135 | 125 | 92.59 |
| E-AAC/M-CTC | 128 | 112 | 87.50 |
| E-ACA/M-CAC | 119 | 97 | 81.51 |
| E-ACC/M-CAA | 152 | 141 | 92.76 |
| E-ACC/M-CAG | 142 | 125 | 88.03 |
| E-AGG/M-CAC | 146 | 126 | 86.30 |
| E-AGG/M-CTG | 167 | 148 | 88.62 |
| 合计 | 1243 | 1091 | 87.77 |
分别对库区和沅水下游光泽黄颡鱼群体的9对引物组合扩增结果进行数据统计, 库区群体扩增出的总位点数为1035个, 多态位点884个; 沅水下游群体扩增出的总位点数为1009个, 多态位点840个。同时计算出库区和沅水下游光泽黄颡鱼群体的多态位点比率分别为85.41%、83.25%, 观测等位基因数分别为1.854±0.592、1.803±0.622, 有效等位基因数分别为1.597±0.381、1.574±0.377, Nei’s多样性指数分别为0.220±0.211、0.207±0.195, Shannon’s信息指数分别为0.330±0.305、0.302±0.338(表 2), 库区群体的遗传参数值略高于沅水下游群体。t检验表明, 两个群体的遗传遗传多样性水平不存在显著差异(P > 0.05)。
| 遗传参数 | 库区群体 | 沅水下游群体 |
| 总位点数 | 1035 | 1009 |
| 多态位点数 | 884 | 840 |
| 多态位点比率 | 85.41 | 83.25 |
| 观测等位基因数 | 1.854±0.592 | 1.803±0.622 |
| 有效等位基因数 | 1.597±0.381 | 1.574±0.377 |
| Nei’s多样性指数 | 0.220±0.211 | 0.207±0.195 |
| Shannon’s信息指数 | 0.330±0.305 | 0.302±0.338 |
| 群体 | 库区群体 | 沅水下游群体 |
| 库区群体 | 0.124±0.072 | |
| 沅水下游群体 | 0.127±0.100 | 0.119±0.057 |
根据Lynch(1990)的方法, 统计出两个光泽黄颡鱼群体共30尾个体之间共有的扩增片段, 以及每个个体的DNA扩增片段, 计算出每2尾个体之间的遗传相似指数和遗传距离, 进一步得到两个光泽黄颡鱼群体内和群体间的遗传距离。在群体内, 五强溪库区光泽黄颡鱼个体间的平均遗传距离为0.124±0.072, 沅水下游光泽黄颡鱼个体间的平均遗传距离为0.119±0.057, 二者平均遗传距离数据较为接近; 在库区和沅水下游光泽黄颡鱼群体之间的平均遗传距离为0.127±0.100。群体间的平均遗传距离与群体内的平均遗传距离非常接近, 不存在明显差异(P > 0.05)。
2.4 聚类分析采用MEGA软件包中的UPGMA程序, 以两个光泽黄颡鱼群体共30尾个体之间的遗传距离数据为依据, 进行聚类分析, 得到两个光泽黄颡鱼群体的分支树状图(图 2), 可见, 光泽黄颡鱼个体不以库区和沅水下游两个群体分别聚类, 没有形成明显的两大分支, 说明群体间无明显的遗传差异而存在明显的基因交流。
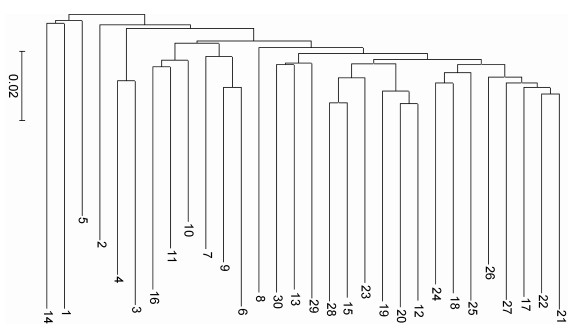 |
| 图 2 光泽黄颡鱼30个体的UPGMA聚类树 Fig. 2 UPGMA dendrogram of 30 individuals of the P. nitidus 注: 1—15表示库区光泽黄颡鱼, 16—30表示沅水下游光泽黄颡鱼 |
AFLP是一种强有力的分子标记技术, 在检测种群的遗传多态性、分辨基因组的微小变化以及稳定可靠性等方面(Vos et al, 1995; 朱伟铨等, 2003)具有比其他分子标记如RAPD、ISSR等更大的优势。因此该技术已广泛应用于动植物物种的遗传多样性与种群遗传结构等方面的研究(Jun et al, 2006; Jin et al, 2006; Meudt et al, 2007; Liu et al, 2009; 杨梅等, 2016)。本实验采用这一分子标记技术, 首次对沅水五强溪水库库区及沅水下游江段两个光泽黄颡鱼群体进行遗传多样性分析, 9对引物组合从两个光泽黄颡鱼群体基因组中共检出1243个位点, 多态位点1091个, 多态位点比率达87.77%, 其中库区和沅水下游群体多态位点比率分别为85.41%、83.25%。与已报道的鱼类AFLP数据比较, 光泽黄颡鱼群体的多态位点比率与同属的黄颡鱼雄性群体(93.35%)(鲁翠云等, 2007)和鲤科鱼类异源四倍体鲫鲤及其原始亲本群体(88.6%)(Liu et al, 2009)接近, 而远高于黄姑鱼青岛(51.70%)与厦门群体(51.99%)(韩志强等, 2006)、松江鲈丹东(50.28%)与秦皇岛群体(50.00%)(徐建荣等, 2008)及翘嘴红鲌的太湖野生群体(57.99%)(刘祥芳等, 2017)。这表明, 五强溪水库无论是库区还是沅水下游江段, 光泽黄颡鱼群体的遗传变异水平均较高, 遗传多态性丰富。说明作为东亚特有鱼类之一的光泽黄颡鱼在洞庭湖水系沅水的遗传资源状况良好。
水电大坝阻隔对鱼类遗传多样性的影响研究, 国内已有诸多报道: 史方等(2018)对泉水鱼长江流域乌江、金沙江、大渡河3个地理群体的遗传结构进行了研究, 发现3个地理群体的遗传多样性丰富, 群体间遗传差异显著, 分析这种遗传差异并非受梯级水电开发影响而是由于群体的历史扩张造成; 方耀林等(2005)对长江中游洞庭湖、涨渡湖和长湖黄颡鱼自然群体的种群遗传结构进行比较分析, 发现阻隔型湖泊(涨渡湖和长湖)与通江湖泊(洞庭湖)间黄颡鱼群体的遗传距离较远, 而阻隔湖泊群体间遗传距离接近。廖小林等(2005)研究发现, 长江水系草鱼四川群体与洞庭湖群体遗传距离较远, 而嘉鱼群体与鄱阳湖群体遗传距离较近, 长江水系草鱼群体分化微弱。杨凡等(2010)研究发现长江中下游岳阳、都昌和崇明的鳊群体间没有显著的遗传分化。陈建武等(2010)对长江重庆、沙市、湖口和常熟4个江段的铜鱼的遗传多样性进行分析, 发现长江水系铜鱼群体分化极小, 可看作为一个群体。本实验通过对沅水五强溪水库库区和沅水下游两个江段光泽黄颡鱼群体的多态位点比率、观测等位基因数、有效等位基因数、Nei’s多样性指数、Shannon’s信息指数等遗传参数(表 2)的比较发现, 尽管库区群体略高于沅水下游群体, 但t检验分析表明, 两个群体间不存在显著的遗传差异(P > 0.05)。遗传距离和聚类分析结果亦表明, 库区和沅水下游两个光泽黄颡鱼的群体内和群体间遗传距离接近, 光泽黄颡鱼个体不以库区和沅水下游两个群体分别聚类, 说明群体间存在明显的基因交流。
五强溪水电大坝的建设, 使水库库区和沅水下游水文情势和生境发生巨大改变, 库区(水库大坝至泸溪江段)水面宽阔、分支河汊众多, 类似静水湖泊; 沅水下游(常德江段)水流流速较快, 与未成水库前的天然河流相似。理论上推测, 由于两个江段存在水文情势和生境的巨大差异, 两个江段的光泽黄颡鱼群体也可能在遗传结构上存在不同。然而, 本实验结果表明, 五强溪水电大坝的修建, 并没有导致库区和沅水下游两个生境明显不同江段的光泽黄颡鱼群体发生遗传多样性的明显变化。这与上述史方等(2018)对泉水鱼的研究结果、杨凡等(2010)对鳊的研究结果、陈建武等(2010)对铜鱼的研究结果非常相似, 即水电大坝阻隔没有对不同江段(水域)鱼类群体的遗传多样性产生显著影响。分析这一共性结果的原因, 可能与研究鱼类仍处于一个连续的水系有关, 也可能与大坝阻隔的时间较短, 尚未形成明显的遗传分化有关。
4 结论综上所述, 沅水五强溪水库光泽黄颡鱼的遗传多样性处于较高水平, 遗传多态性丰富, 水库大坝的阻隔, 没有导致库区和沅水下游两种不同水域生境光泽黄颡鱼遗传多样性的明显变化。
| 方耀林, 汪登强, 刘绍平, 等, 2005. 长江中游湖泊中黄颡鱼线粒体DNA的遗传变异. 中国水产科学, 12(1): 56–61 |
| 史方, 熊美华, 郑海涛, 等, 2018. 泉水鱼长江流域3个地理群体的遗传结构分析. 水生态学杂志, 39(2): 58–63 |
| 朱伟铨, 王义权, 2003. AFLP分子标记技术及其在动物学研究中的应用. 动物学杂志, 38(2): 101–107 |
| 向鹏, 刘良国, 王冬, 等, 2016. 湖南沅水五强溪水库鱼类资源现状及其历史变化. 湖泊科学, 28(2): 379–386 DOI:10.18307/2016.0218 |
| 刘良国, 王文彬, 杨春英, 等, 2014. 洞庭湖水系资江干流鱼类资源现状调查. 南方水产科学, 10(2): 1–10 |
| 刘良国, 杨春英, 杨品红, 等, 2013a. 湖南境内沅水鱼类资源现状与多样性分析. 海洋与湖沼, 44(1): 148–158 |
| 刘良国, 杨品红, 杨春英, 等, 2013b. 湖南境内澧水鱼类资源现状与多样性研究. 长江流域资源与环境, 22(9): 1165–1171 |
| 刘祥芳, 郑建波, 贾永义, 等, 2017. 翘嘴红鲌雌雄基因组差异及太湖野生群体遗传多样性现状的AFLP分析. 水生生物学报, 41(6): 1200–1206 DOI:10.7541/2017.149 |
| 李陈, 2012. 长江上游梯级水电开发对鱼类多样性影响的初探. 武汉: 华中科技大学硕士学位论文, 1-51 |
| 杨凡, 彭博, 赵爽, 等, 2010. 基于线粒体控制区全序列的长江中下游鳊的遗传多样性研究. 广东农业科学, 37(3): 173–175, 181 |
| 杨梅, 徐嘉伟, 王成辉, 等, 2016. 长江口泥螺群体遗传多样性的AFLP分析. 海洋科学, 40(2): 20–25 DOI:10.11759/hykx20141018001 |
| 陈建武, 汪登强, 张燕, 等, 2010. 长江铜鱼种群遗传结构的微卫星分析. 长江流域资源与环境, 19(Z1): 138–142 |
| 徐建荣, 韩晓磊, 李宁, 等, 2008. 松江鲈群体遗传多样性的AFLP分析. 大连水产学院学报, 23(6): 437–441 |
| 韩志强, 高天翔, 王志勇, 等, 2006. 黄姑鱼群体遗传多样性的AFLP分析. 水产学报, 30(5): 640–646 |
| 鲁翠云, 孙效文, 梁利群, 2007. AFLP分析黄颡鱼雌雄个体的遗传差异. 水产学杂志, 20(2): 24–28, 34 |
| 廖小林, 俞小牧, 谭德清, 等, 2005. 长江水系草鱼遗传多样性的微卫星DNA分析. 水生生物学报, 29(2): 113–119 |
| Jin S B, Harold C, Mei S, 2006. Analysis of genetic diversity and relationships in waxy rice (Oryza sativa L.) using AFLP and ISSR markers. Genetic Resources and Crop Evolution, 53(2): 323–330 DOI:10.1007/s10722-004-6145-6 |
| Jun S, Zhao B S, Bi S Y, et al, 2006. Assessing genetic diversity of wild populations of Prenanä9s schizothoracin, Schizothorax prenanti, using AFLP markers. Environmental Biology of Fishes, 77(1): 79–86 DOI:10.1007/s10641-006-9056-x |
| Liu L G, Yan J P, Liu S J, et al, 2009. Evolutionary analysis of allotetraploid hybrids of red crucian carp×common carp, based on ISSR, AFLP molecular markers and cloning of cyclins genes. Chinese Science Bulletin, 54(16): 2849–2861 |
| Lynch M, 1990. The similarity index and DNA fingerprinting. Molecular Biology and Evolution, 7(5): 478–484 |
| Meudt H M, Clarke A C, 2007. Almost forgotten or latest practice? AFLP applications, analyses and advances. Trends in Plant Science, 12(3): 106–117 DOI:10.1016/j.tplants.2007.02.001 |
| Sambrook J, Fritsch E F, Maniatis T, 1989. Molecular Cloning:A Laboratory Manual. 2nd ed. Cold Spring Harbor, N.Y.: Cold Spring Harbor Laboratory Press, 463-470 |
| Vos P, Hogers R, Bleeker M, et al, 1995. AFLP:a new technique for DNA finger-printing. Nucleic Acids Research, 23(21): 4407–4414 DOI:10.1093/nar/23.21.4407 |
| Wang Z Y, Tsoi K H, Chu K H, 2004. Applications of AFLP technology in genetic and phylogenetic analysis of penaeid shrimp. Biochemical Systematics and Ecology, 32(4): 399–407 DOI:10.1016/j.bse.2003.10.006 |
| West G, 1990. Method of assessing ovarian development in fishes:a review. Australian Journal of Marine & Freshwater Research, 41(2): 199–222 |
 2018, Vol. 49
2018, Vol. 49

