
中国海洋湖沼学会主办。
文章信息
- 宋旻鹏, 汪金海, 郑小东. 2018.
- SONG Min-Peng, WANG Jin-Hai, ZHENG Xiao-Dong. 2018.
- 不同饥饿时间和再投喂对长蛸(Octopus minor)生长及肌肉脂肪酸含量的影响
- EFFECTS OF STARVATION DURATION AND RE-FEEDING ON THE GROWTH AND MUSCLE FATTY ACID CONTENT OF OCTOPUS MINOR
- 海洋与湖沼, 49(4): 932-939
- Oceanologia et Limnologia Sinica, 49(4): 932-939.
- http://dx.doi.org/10.11693/hyhz20180200045
-
文章历史
- 收稿日期:2018-02-28
- 收修改稿日期:2018-04-25
自然界中, 由于受到周围环境因素改变、饵料不足、种内/间竞争等因素影响, 动物常会受到不同程度的饥饿胁迫(乐可鑫等, 2016)。当胁迫结束, 食物供给恢复后, 个体会表现出一定程度的快速生长, 这种现象称为补偿生长(Bjørnevik et al, 2017)。补偿生长对研究水生动物的营养生理具有重要意义, 针对不同种类动物适应环境的能力和特点, 在生产中加以合理运用将会获得良好的经济效益。目前, 饥饿耐受性相关研究主要集中于甲壳类(Wu et al, 2001; Chen et al, 2017)、双壳类(His et al, 1992; Cordeiro et al, 2016)、鱼类(Cui et al, 2006; Li et al, 2012; Hidalgo et al, 2017), 鲜有头足类的相关报道。
长蛸(Octopus minor)隶属于软体动物门(Mollusca)、头足纲(Cephalopoda)、八腕目(Octopoda)、蛸科(Octopodidae), 俗称马蛸、八蛸、长腿蛸等, 广泛分布于我国沿海、朝鲜半岛以及日本沿海(Yamamoto, 1942; 董正之, 1988), 其中黄渤海产量较高(张玺, 1962)。长蛸个体较大, 肉质鲜美, 可食用率较高, 广泛出口于韩国、日本等地, 具有广阔的国际市场。近年来, 国内外学者相继开展了长蛸组织学(Iwakoshi et al, 2000)、生理(Seol et al, 2007)、发育(钱耀森等, 2013)、遗传(Bo et al, 2016; Wang et al, 2017; Xu et al, 2018)、营养(钱耀森等, 2010)等方面的研究。近十年来, 国内开展了长蛸全生活养殖研究(刘畅, 2013; Zheng et al, 2014; 薄其康, 2015), 取得了一定成效。作为食肉性动物, 动物性蛋白是头足类自身代谢和生长的重要营养物质(Lee, 1995; Domingues et al, 2005; Solorzano et al, 2009)。目前, 长蛸的人工养殖过程中, 过分依赖于自然饵料, 而自然饵料供应的不稳定性导致养殖个体时常遭受饥饿胁迫。本文通过对暂养的长蛸进行饥饿胁迫及再投喂处理, 研究其存活、生长、摄食以及其肌肉脂肪酸含量的变化, 探讨不同饥饿时间及再投喂对暂养长蛸的影响, 进而制定合理的投喂计划, 旨在为人工规模化养殖提供理论依据。
1 材料与方法 1.1 实验材料实验长蛸于2017年9月采捕于山东荣成月湖, 选取活力旺盛, 体表无损伤的个体180只, 鲜重(127.27± 12.19)g, 胴背长(67.23±6.12)mm, 采用30L泡沫箱低温麻醉运输至荣成马山集团育苗场内暂养。
1.2 实验方法采用长方形水泥池(6m×1m×0.6m), 蛸巢为灰色PVC管(直径90mm, 长度700mm), 水深0.5m。实验用水为砂滤自然海水, 盐度28—30, pH 7.8—8.1, 水温17.2—20.8℃, 自然光照。实验期间, 不间断充气, 长流水, 每5d全换水1次。每日17:00投喂饵料并记录投饵质量(WS1), 次日上午8:00清理残饵并统计残饵质量(WS2)。饵料采用菲律宾蛤仔(Ruditapes philippinarum), 壳长(29.29±0.91)mm, 鲜重(6.30±0.45)g。
实验设置6组不同的饥饿梯度(0, 3, 6, 9, 12, 15d), 每组设定3个平行实验, 每个平行组投放10只长蛸。实验前, 进行5d的驯化暂养, 随后开展饥饿实验, 待每组经过不同的饥饿时间处理后, 分别测定各实验组长蛸的鲜重(Wt)和成活率(SR), 随机抽取三只长蛸解剖取样, 测定肝体比(HSI), 并取腕部肌肉于–80℃的条件下保存。
饥饿实验结束后各组长蛸开始再投喂实验, 实验持续15d, 期间使用菲律宾蛤仔作为饵料。再投喂结束后, 测定各项指标并取样保存。
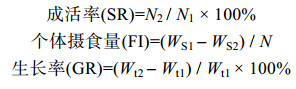
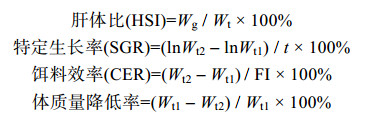
N2为实验结束时存活个体数量, N1为实验开始时个体数量。WS1为投饵质量, WS2为残饵质量, Wg为肝脏鲜重, Wt为个体鲜重。Wt1和Wt2分别为实验开始和结束时个体鲜重。t为实验周期。
1.3 脂肪酸测定取–80℃条件下保存的长蛸肌肉样品, 超低温真空冷冻干燥, 研磨粉碎, 干燥保存待测。乙酰氯甲醇法提取脂肪酸, 然后使用HP6890 PLUS GC型气相色谱仪分析。以SIGMA公司的脂肪酸标品为参照, 通过归一法计算各个脂肪酸组分的百分含量。测定期间, 每实验组取3个样品进行平行测定, 实验结果取平均值。
1.4 数据分析实验数据以平均值±标准差(Mean±SD)方式表示, SPSS 21.0软件进行数据整理, 采用ANOVA单因素方差分析和Tukey多重检验分析, P < 0.05为差异显著。
2 结果与分析 2.1 长蛸生长状况及成活率将实验长蛸称重后, 随机分为6组, 每组3个平行, 每个平行10只。驯化暂养5d后统计各组的鲜重(Wt)、特定生长率(SGR)以及成活率(SR)并未发现显著差异(P > 0.05)(表 1), 即可进行后续饥饿耐受性实验。
| 实验分组 | 初始鲜重 | 终末鲜重 | 特定生长率 (%) |
成活率 (%) |
| 饥饿0d | 129.22±7.64 | 138.36±10.32 | 1.35±0.31 | 100 |
| 饥饿3d | 126.14±12.79 | 135.92±15.04 | 1.48±0.46 | 100 |
| 饥饿6d | 126.55±11.40 | 135.67±10.54 | 1.41±0.36 | 100 |
| 饥饿9d | 129.58±9.18 | 138.94±8.37 | 1.40±0.42 | 100 |
| 饥饿12d | 123.68±15.82 | 132.70±19.40 | 1.37±0.41 | 100 |
| 饥饿15d | 128.92±18.09 | 137.63±19.29 | 1.31±0.37 | 100 |
长蛸成活率随着饥饿时间增长而降低(图 1), 相对于对照组(饥饿0d), 饥饿3d、6d、9d组长蛸的成活率并未表现出显著性差异(P > 0.05);饥饿12d、15d组的成活率显著低于对照组(P < 0.05), 具体排序:饥饿0d(97%) =饥饿3d(97%) > 饥饿6d(93.3%) > 饥饿9d(83.3%) > 饥饿12d(73.3%) > 饥饿15d(56.7%)。长蛸体质量降低率随饥饿时间的增长逐渐升高(图 2), 其中饥饿9d、12d、15d组的体质量降低率显著高于饥饿3d组(P < 0.05)。不同饥饿时间的体质量降低率排序:饥饿3d(5.38%±1.44%) < 饥饿6d(9.54%±1.61%) < 饥饿9d(12.72%±2.06%) < 饥饿12d(15.93%±2.18%) < 饥饿15d(18.15%±4.46%)。长蛸的肝体比随饥饿时间的增加显著降低(图 1), 各饥饿组的肝体比值均显著低于对照组(P < 0.05), 其中饥饿3d肝体比值(4.20%±0.88%)下降最明显。
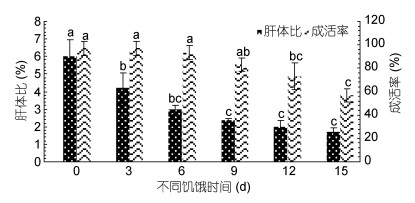 |
| 图 1 不同饥饿时间对长蛸成活率及肝体比的影响 Fig. 1 Effect of different starvation duration on the survival rate and hepatosomatic index of O. minor 不同字母表示差异显著(P < 0.05), 下同 |
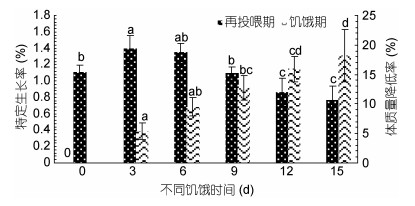 |
| 图 2 饥饿及再投喂对长蛸生长性能的影响 Fig. 2 Effect of starvation and re-feeding on growth performance of O. minor |
再投喂期间长蛸的摄食量随饥饿时间的增长呈现出先上升后下降的趋势(图 3)。其中, 0—3d摄食量呈上升趋势, 3—15d呈下降趋势, 在饥饿15d后摄食量显著降低(P < 0.05)。再投喂期间各组的摄食量排序:饥饿3d组(5.24±0.39g) > 饥饿6d组(4.85±0.54g) > 饥饿0d组(4.23±0.35g) > 饥饿9d组(4.09±0.96g) > 饥饿12d组(3.41±0.57g) > 饥饿15d组(2.81±0.43g)。与其摄食量不同, 各饥饿组长蛸的饵料效率(图 4)均与对照组差异不显著(P > 0.05)。
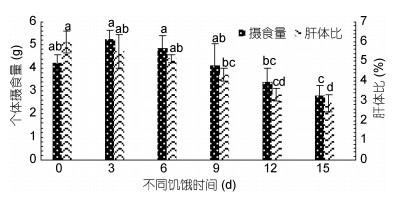 |
| 图 3 再投喂对长蛸个体摄食量及肝体比的影响 Fig. 3 Effect of re-feeding on food intake and hepatosomatic index of O. minor |
 |
| 图 4 再投喂结束后不同饥饿组长蛸鲜重及饵料效率差别 Fig. 4 The difference of wet weight and food conversion efficiency of O. minor in different starvation groups after re-feeding |
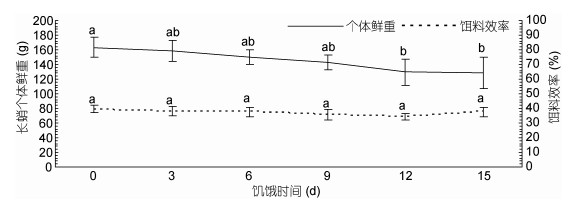
再投喂实验结束后, 饥饿9d后(9d组、12d组和15d组)肝体比值显著低于对照组(P < 0.05), 其中对照组的肝体比值(5.98%±0.54%)最高, 饥饿15d组的肝体比值(2.88%±0.43%)最低。各组的特定生长率随饥饿时间增加呈现出先上升后下降的趋势(图 2), 饥饿3d组的特定生长率显著高于对照组, 饥饿12d、15d组显著低于对照组(P < 0.05), 其中特定生长率值最高的为饥饿3d组(1.40%±0.16%), 最低的为饥饿15d组(0.77%±0.17%)。再投喂实验结束后, 各组长蛸的鲜重随饥饿时间的延长呈现出下降趋势(图 4), 其中饥饿12d后的值显著低于对照组(P < 0.05)。
2.4 饥饿对长蛸个体肌肉脂肪酸含量的影响本试验中共检测出15种脂肪酸(表 2), 起始碳链长度在14碳—22碳之间。其中共检测出饱和脂肪酸(SFA) 5种, 单不饱和脂肪酸(MUFA) 4种, 多不饱和脂肪酸(PUFA) 6种。从对照组来看, C16:0的含量最高(18.12%±0.11%), 而C22:4n-6的含量最低(1.06%± 0.06%)。
| 脂肪酸种类 | 对照组 | 饥饿期间 | ||||
| 饥饿3d | 饥饿6d | 饥饿9d | 饥饿12d | 饥饿15d | ||
| C14:0 | 1.71±0.10a | 1.54±0.09ab | 1.41±0.18ab | 1.37±0.28ab | 1.16±0.18b | 1.14±0.21b |
| C15:0 | 1.43±0.03a | 1.36±0.13a | 1.40±0.17a | 1.38±0.17a | 1.31±0.02a | 1.22±0.02a |
| C16:0 | 18.12±0.11a | 17.21±0.22abc | 17.27±0.53ab | 16.25±1.22abc | 15.18±0.31c | 15.31±1.17bc |
| C16:1n-7 | 1.30±0.12a | 1.15±0.06a | 1.35±0.11a | 1.21±0.13a | 1.12±0.09a | 1.29±0.05a |
| C17:0 | 1.29±0.12a | 1.26±0.12a | 1.18±0.06ab | 1.14±0.06ab | 0.99±0.02bc | 0.87±0.04c |
| C18:0 | 13.79±0.91ab | 10.80±1.34a | 13.27±1.09ab | 12.57±2.02ab | 14.81±1.57b | 11.07±1.37ab |
| C18:1n-7 | 2.12±0.09a | 2.29±0.25a | 2.29±0.07a | 2.15±0.21a | 2.06±0.20a | 1.97±0.25a |
| C18:1n-9 | 4.27±0.54a | 3.50±0.36ab | 2.95±0.13b | 2.49±0.26bc | 2.67±0.60bc | 1.78±0.19c |
| C18:2n-6 | 1.46±0.06a | 1.23±0.06b | 1.24±0.11ab | 1.29±0.11ab | 1.26±0.08ab | 1.44±0.06ab |
| C20:1n-9 | 4.39±0.10a | 5.74±0.37bc | 4.61±0.35ab | 4.69±0.14ab | 5.71±0.86bc | 6.15±0.34c |
| C20:4n-6 | 8.60±0.52a | 9.03±0.05a | 7.99±0.37a | 8.45±0.97a | 8.48±0.28a | 8.75±0.99a |
| C20:5n-3(EPA) | 11.19±0.73a | 12.90±0.55ab | 14.02±0.97bc | 14.08±1.31bc | 15.82±0.50cd | 16.60±1.10d |
| C22:4n-6 | 1.06±0.06a | 1.24±0.13a | 1.21±0.12a | 1.18±0.09a | 1.28±0.05a | 1.17±0.18a |
| C22:5n-3 | 3.23±0.24a | 3.39±0.05a | 3.10±0.09a | 2.79±0.04a | 2.86±0.38a | 3.12±0.65a |
| C22:6n-3(DHA) | 13.68±0.94a | 14.83±0.32ab | 16.25±1.35bc | 16.67±0.34bc | 18.58±1.05cd | 19.38±0.93d |
| SFA | 36.35±0.78a | 32.18±1.00bc | 34.54±0.79ab | 32.71±1.05abc | 33.45±2.03abc | 29.59±2.20c |
| UFA | 51.31±2.26a | 55.29±0.70ab | 54.99±0.31a | 55.00±1.49a | 59.85±1.85bc | 61.66±2.44c |
| MUFA | 12.09±0.48ab | 12.67±0.40a | 11.19±0.63ab | 10.55±0.58b | 11.56±1.11ab | 11.19±0.71ab |
| PUFA | 39.22±1.90a | 42.62±0.91ab | 43.80±0.33b | 44.45±1.85bc | 48.29±1.28cd | 50.47±2.10d |
| Σn-3 PUFA | 28.10±1.38a | 31.12±0.90b | 33.36±0.47b | 33.53±0.5b | 37.26±1.25c | 39.10±1.22c |
| Σn-6 PUFA | 11.12±0.55a | 11.50±0.17a | 10.44±0.37a | 10.92±0.95a | 11.03±0.36a | 11.37±1.06a |
| Σn-9 PUFA | 8.66±0.51ab | 9.23±0.09a | 7.56±0.47ab | 7.19±0.40b | 8.38±1.40ab | 7.93±0.50ab |
| EPA + DHA | 24.87±1.19a | 27.73±0.85b | 30.27±0.40c | 30.74±0.97c | 34.40±1.24d | 35.98±0.57d |
| 注:同一行中不同上标字母表示存在显著性差异(P < 0.05), 下同 | ||||||
从表 2中可发现, 随饥饿时间的增长, 长蛸个体肌肉脂肪酸含量表现出明显的变化。在SFA中, 饥饿3d、15d组的值显著低于对照组(P < 0.05), 其余各实验组的值均与对照组差异不显著(P > 0.05)。SFA中的C14:0、C16:0、C17:0三组, 随饥饿时间的延长, 含量均显著下降。
UFA(不饱和脂肪酸)的整体含量呈上升趋势, 其中MUFA的值均与对照组差异不显著(P > 0.05), PUFA的含量, 饥饿6—15d组均显著高于对照组(P < 0.05)。各实验组Σn-3 PUFA的值均显著高于对照组(P < 0.05), 而Σn-6 PUFA、Σn-9 PUFA的含量各实验组均与对照组差异不显著(P > 0.05)。在EPA+DHA的含量中, 各实验组均显著高于对照组(P < 0.05)。
2.5 再投喂对长蛸个体肌肉脂肪酸含量的影响经过15d的再投喂, 各实验组长蛸肌肉脂肪酸的含量发生变化(表 3)。其中SFA的含量, 受到C14:0、C16:0、C17:0含量影响, 饥饿15d组值显著低于对照组(P < 0.05), 其余各组均与对照组差异不显著(P > 0.05)。UFA的含量中, 饥饿12d、15d组值显著高于对照组(P < 0.05), 其中MUFA的含量各组均与对照组差异不显著(P > 0.05), 饥饿12d、15d组PUFA的值显著高于对照组(P < 0.05)。在Σn-3 PUFA、Σn-6 PUFA、Σn-9 PUFA、EPA+DHA的值中, Σn-3 PUFA和EPA+DHA的含量在饥饿12d、15d组中显著高于对照组(P < 0.05)。
| 脂肪酸种类 | 对照组 | 再投喂期间 | ||||
| 饥饿3d | 饥饿6d | 饥饿9d | 饥饿12d | 饥饿15d | ||
| C14:0 | 1.74±0.08a | 1.72±0.01a | 1.75±0.1a | 1.71±0.13a | 1.59±0.13ab | 1.43±0.02b |
| C15:0 | 1.45±0.13a | 1.24±0.12a | 1.45±0.12a | 1.25±0.31a | 1.42±0.16a | 1.25±0.14a |
| C16:0 | 18.59±0.70ab | 18.32±1.05ab | 19.02±0.49a | 18.55±0.48ab | 16.69±0.43bc | 16.05±0.91c |
| C16:1n-7 | 1.27±0.13a | 1.15±0.06a | 1.09±0.06a | 1.25±0.16a | 1.26±0.12a | 1.27±0.05a |
| C17:0 | 1.27±0.18a | 1.28±0.08a | 1.25±0.12a | 1.25±0.07a | 1.10±0.04ab | 0.95±0.04b |
| C18:0 | 13.46±1.97a | 11.86±0.33a | 11.45±0.41a | 11.58±0.08a | 12.66±0.10a | 12.82±0.86a |
| C18:1n-7 | 2.16±0.36a | 2.09±0.03a | 2.16±0.22a | 2.06±0.31a | 1.95±0.06a | 2.05±0.06a |
| C18:1n-9 | 4.24±0.60a | 4.29±0.32a | 3.45±0.43ab | 3.36±0.27ab | 3.04±0.40b | 2.69±0.16b |
| C18:2n-6 | 1.53±0.17a | 1.42±0.17ab | 1.23±0.08ab | 1.23±0.03ab | 1.19±0.09b | 1.31±0.08ab |
| C20:1n-9 | 4.49±0.36a | 4.52±0.45a | 4.54±0.31a | 5.29±0.31ab | 5.61±0.27b | 5.81±0.32b |
| C20:4n-6 | 8.77±0.28a | 8.26±1.12a | 8.40±1.12a | 8.98±1.42a | 8.76±0.14a | 8.47±0.17a |
| C20:5n-3(EPA) | 11.19±0.73a | 11.44±0.31a | 11.57±0.79a | 12.93±0.87ab | 14.38±0.53b | 14.92±1.75b |
| C22:4n-6 | 1.06±0.14a | 1.32±0.02bc | 1.17±0.04abc | 1.14±0.16ab | 1.29±0.06abc | 1.40±0.03c |
| C22:5n-3 | 3.15±0.13a | 2.95±0.36a | 2.84±0.22a | 2.97±0.34a | 2.86±0.15a | 3.29±0.23a |
| C22:6n-3(DHA) | 13.35±0.61a | 13.25±0.59a | 12.73±0.68a | 14.49±0.53ab | 15.95±0.33bc | 16.71±1.37c |
| SFA | 36.50±2.04a | 34.41±1.00ab | 34.92±0.11ab | 34.36±0.39ab | 33.46±0.99ab | 32.51±1.21b |
| UFA | 51.19±0.95ab | 50.69±0.67ab | 49.17±1.13a | 53.69±1.15bc | 56.30±1.11cd | 57.91±2.70d |
| MUFA | 12.15±0.26a | 12.05±0.72a | 11.23±0.93a | 11.96±0.01a | 11.86±0.60a | 11.82±0.13a |
| PUFA | 39.04±0.84a | 38.64±0.52a | 37.94±1.99a | 41.74±1.16ab | 44.44±0.72bc | 46.09±2.74c |
| Σn-3 PUFA | 27.68±0.66a | 27.64±0.98a | 27.15±0.85a | 30.39±1.05ab | 33.20±0.78bc | 34.92±2.79c |
| Σn-6 PUFA | 11.35±0.36a | 11.00±1.26a | 10.79±1.15a | 11.34±1.55a | 11.25±0.28a | 11.16±0.08a |
| Σn-9 PUFA | 8.73±0.41a | 8.80±0.75a | 7.98±0.74a | 8.65±0.42a | 8.65±0.66a | 8.50±0.17a |
| EPA + DHA | 24.54±0.76a | 24.69±0.81a | 24.30±0.65a | 27.43±1.32ab | 30.33±0.86bc | 31.63±2.86c |
关于鱼类的补偿生长现象, 目前主要分为四类, 即超补偿生长、完全补偿生长、部分补偿生长以及不能补偿生长(谢小军等, 1998)。补偿生长的有无以及补偿生长的程度主要是通过再投喂期间饥饿组的特定生长率和终末鲜重与对照组进行比较得出(王岩, 2001)。在本实验中, 不同饥饿组经过15d再投喂其特定生长率(图 2)中, 饥饿3d、6d、9d组的终末鲜重均与对照组差异不显著(P > 0.05), 表明长蛸经过3d、6d、9d的短期饥饿处理后具备完全补偿生长的能力。这与凡纳滨对虾(Litopenaeus vannamei)、中国明对虾(Fenneropenaeus chinensis)等相似, 短期的饥饿胁迫后可以实现完全补偿生长(吴立新等, 2001; 林小涛等, 2004)。当饥饿时间超过12d, 长蛸的特定生长率及终末鲜重都显著低于对照组(P < 0.05), 分别见图 2和图 4, 此时长蛸个体仅能进行部分补偿生长。
关于动物的补偿生长机制目前主要存在以下3种观点: (1)提高食物转化率(Plavnik et al, 1985; Fang et al, 2017), (2)提高自身的摄食水平(Kim et al, 1995), (3)既提高食物转化率又提高摄食水平(Luquet et al, 1995)。本文再投喂阶段饥饿3d、6d、9d组的饵料效率与对照组相似, 而其摄食量则与对照组组差别较大, 说明饥饿长蛸的补偿生长仅是通过提高自身摄食水平来实现的。
3.2 饥饿胁迫及再投喂对长蛸的影响进入冬季, 由于饵料缺乏, 长蛸遭受饥饿胁迫, 通过自身储备的营养物质来维持生存, 随饥饿时间的增长, 长蛸体质量降低率逐渐升高, 饥饿15d时达到最高值18.15%±4.46%, 这与史氏鲟(Acipenser schrenckii)、点带石斑鱼(Epinephelus malabaricus)幼鱼等的实验结果相似(高露姣等, 2004; 彭志兰等, 2008)。本文中肝体比(图 1)也随饥饿时间延长呈下降趋势, 这与黑鲷(Acanthopagrus schlegeli)幼鱼、尼罗罗非鱼(Oreochromis niloticus)的结果相似(龙章强等, 2008; 田娟等, 2012), 恢复投喂后饥饿时间较长组(9d、12d、15d)的肝体比(图 3)仍显著低于对照组(P < 0.05)与虎斑乌贼(Sepia pharaonis)幼体的实验结果相似(乐可鑫等, 2016), 作者认为这种现象是由饥饿条件下长蛸个体主要利用肝脏内的能源物质来维持代谢平衡造成的, 致使其肝体比逐渐下降, 且饥饿时间越长肝脏受损越严重, 即使恢复投喂短期内也无法恢复至对照组水平。在本次实验中, 长蛸成活率(图 1)随饥饿时间延长呈下降趋势, 至15d成活率下降至56.7%, 这与青蛤(Cyclina sinensis)幼虫的情况相似(杨凤等, 2008)。作者认为饥饿时间过长致使个体虚弱、器官衰竭、代谢紊乱, 进而导致个体成活率迅速下降。
3.3 饥饿及再投喂对长蛸脂肪酸含量的影响饥饿条件下, 鱼类对自身不同类型的脂肪酸的利用存在一定规律, 即首先利用饱和脂肪酸, 其次利用低不饱和脂肪酸, 最后才使用高不饱和脂肪酸(谢小军等, 1998)。本实验中, 长蛸在饥饿状态下利用自身脂肪酸的顺序为首先SFA, 其次是MUFA, 然后是PUFA, 最后才消耗EPA、DHA等高度不饱和脂肪酸(表 2)。这与非洲胡子鲇对脂肪酸的利用顺序:十四烷酸、十六碳烯酸、十八碳烯酸、EPA、DHA (Zamal et al, 1995)的结果相似。
再投喂期间, 由于饵料条件的恢复促使长蛸个体肌肉脂肪酸水平趋于正常。在本实验中, 饥饿3d、6d、9d组经过15d的再投喂, 其SFA、PUFA的值基本恢复至对照组水平(表 3), 但饥饿12d、15d组UFA、PUFA的值显著高于对照组(P < 0.05), 与点带石斑鱼幼鱼, 再投喂后各组SFA、MUFA、PUFA的值与对照组差异不显著(P > 0.05)的结果不同(陈波等, 2008), 可能由于12d、15d组饥饿时间过长, 影响到个体的正常代谢活动即使恢复到正常的饵料条件, 个体肌肉脂肪酸含量也无法恢复到正常的水平, 但具体原因需进一步探索。
4 结论在本实验中, 短期饥饿条件下(3d、6d、9d)并未影响养殖长蛸的生长、存活及肌肉脂肪酸含量, 恢复投喂后, 长蛸个体可以达到完全补偿生长状态。但是, 较长时间的饥饿胁迫(12d、15d), 不仅显著降低长蛸个体的成活率, 同时对生长、肌肉脂肪酸含量均产生不利影响。因此, 在长蛸养殖过程中, 为保证养殖个体的正常存活、生长, 应储备充足饵料以避免其饥饿超过9d。
致谢 马山集团有限公司蔡斌经理、蔡辉厂长提供实验场地; 中国海洋大学海水养殖教育部重点实验室许玮琪助理实验师在脂肪酸测定方面提供了便利, 谨致谢忱。| 王岩, 2001. 海水养残罗非鱼补偿生长的生物能量机制. 海洋与湖沼, 32(3): 233–239 |
| 龙章强, 彭士明, 陈立侨, 等, 2008. 饥饿与再投喂对黑鲷幼鱼体质量变化, 生化组成及肝脏消化酶活性的影响. 中国水产科学, 15(4): 606–614 |
| 田娟, 涂玮, 曾令兵, 等, 2012. 饥饿和再投喂期间尼罗罗非鱼生长、血清生化指标和肝胰脏生长激素、类胰岛素生长因子-Ⅰ和胰岛素mRNA表达丰度的变化. 水产学报, 36(6): 900–907 |
| 乐可鑫, 汪元, 彭瑞冰, 等, 2016. 饥饿和再投喂对虎斑乌贼幼体存活生长和消化酶活力的影响. 应用生态学报, 27(6): 2002–2008 |
| 刘畅, 2013. 长蛸生活史养殖技术研究. 青岛: 中国海洋大学硕士学位论文 |
| 杨凤, 张跃环, 闫喜武, 等, 2008. 饥饿和再投喂对青蛤(Cyclina sinensis)幼虫生长、存活及变态的影响. 生态学报, 28(5): 2052–2059 |
| 吴立新, 董双林, 田相利, 2001. 中国对虾继饥饿后的补偿生长研究. 生态学报, 21(3): 452–457 |
| 张玺, 1962. 中国经济动物志-海产软体动物. 北京: 科学出版社, 213-217 |
| 陈波, 柳敏海, 施兆鸿, 等, 2008. 饥饿和再投饲对点带石斑鱼幼鱼脂肪酸和氨基酸组成的影响. 上海水产大学学报, 17(6): 674–679 |
| 林小涛, 周小壮, 于赫男, 等, 2004. 饥饿对南美白对虾生化组成及补偿生长的影响. 水产学报, 28(1): 47–53 |
| 钱耀森, 郑小东, 王培亮, 等, 2010. 天鹅湖长蛸营养成分的分析及评价. 海洋科学, 34(12): 14–18 |
| 钱耀森, 郑小东, 刘畅, 等, 2013. 人工条件下长蛸(Octopus minor)繁殖习性及胚胎发育研究. 海洋与湖沼, 44(1): 165–170 DOI:10.11693/hyhz201301024024 |
| 高露姣, 陈立侨, 宋兵, 2004. 饥饿和补偿生长对史氏鲟幼鱼摄食, 生长和体成分的影响. 水产学报, 28(3): 279–284 |
| 彭志兰, 陈波, 柳敏海, 等, 2008. 饥饿和补偿生长对点带石斑鱼幼鱼摄食和生长的影响. 海洋渔业, 30(3): 245–249 |
| 董正之, 1988. 中国动物志:软体动物门头足纲. 北京: 科学出版社, 181-182 |
| 谢小军, 邓利, 张波, 1998. 饥饿对鱼类生理生态学影响的研究进展. 水生生物学报, 22(2): 181–188 |
| 薄其康, 2015. 长蛸饵料分子学鉴定与人工繁育研究. 青岛: 中国海洋大学硕士学位论文 |
| Bjørnevik M, Hansen H, Roth B, et al, 2017. Effects of starvation, subsequent feeding and photoperiod on flesh quality in farmed cod (Gadus morhua). Aquaculture Nutrition, 23(2): 285–292 DOI:10.1111/anu.12391 |
| Bo Q K, Zheng X D, Gao X L, et al, 2016. Multiple paternity in the common long-armed octopus Octopus minor (Sasaki, 1920) (Cephalopoda:Octopoda) as revealed by microsatellite DNA analysis. Marine Ecology, 37(5): 1073–1078 DOI:10.1111/maec.2016.37.issue-5 |
| Chen C, Tan Q, Liu M, et al, 2017. Effect of starvation on growth, histology and ultrastructure of digestive system of juvenile red swamp crayfish (Procambarus clarkii Girard). Iranian Journal of Fisheries Sciences, 16(4): 1214–1233 |
| Cordeiro N I S, De Andrade J T M, Montresor L C, et al, 2016. Effect of starvation and subsequent feeding on glycogen concentration, behavior and mortality in the golden mussel Limnoperna fortunei (Dunker, 1857) (Bivalvia:Mytilidae). Journal of Limnology, 75(3): 618–625 |
| Cui Z H, Wang Y, Qin J G, 2006. Compensatory growth of group-held gibel carp, Carassius auratus gibelio (Bloch), following feed deprivation. Aquaculture Research, 37(3): 313–318 DOI:10.1111/are.2006.37.issue-3 |
| Domingues P M, Dimarco P F, Andrade J P, et al, 2005. Effect of artificial diets on growth, survival and condition of adult cuttlefish, Sepia officinalis Linnaeus, 1758. Aquaculture International, 13(5): 423–440 |
| Fang Z H, Tian X L, Dong S L, 2017. Effects of starving and re-feeding strategies on the growth performance and physiological characteristics of the juvenile tongue sole (Cynoglossus semilaevis). Journal of Ocean University of China, 16(3): 517–524 DOI:10.1007/s11802-017-3198-7 |
| Hidalgo M C, Morales A E, Arizcun M, et al, 2017. Regional asymmetry of metabolic and antioxidant profile in the sciaenid fish shi drum (Umbrina cirrosa) white muscle. Response to starvation and refeeding. Redox Biology, 11: 682–687 |
| His E, Seaman M N L, 1992. Effects of temporary starvation on the survival, and on subsequent feeding and growth, of oyster (Crassostrea gigas) larvae. Marine Biology, 114(2): 277–279 DOI:10.1007/BF00349530 |
| Iwakoshi E, Hisada M, Minakata H, 2000. Cardioactive peptides isolated from the brain of a Japanese octopus, Octopus minor. Peptides, 21(5): 623–630 DOI:10.1016/S0196-9781(00)00201-1 |
| Kim M K, Lovell R T, 1995. Effect of restricted feeding regimens on compensatory weight gain and body tissue changes in channel catfish Ictalurus punctatus in ponds. Aquaculture, 135(4): 285–293 DOI:10.1016/0044-8486(95)01027-0 |
| Lee P G, 1995. Nutrition of cephalopods:fueling the system. Marine and Freshwater Behaviour and Physiology, 25(1-3): 35–51 DOI:10.1080/10236249409378906 |
| Li Y, Zhu Z Q, Ortegón O, et al, 2012. Effects of short-term starvation and refeeding on the survival, growth, and RNA/DNA and RNA/protein ratios in rock carp (Procypris rabaudi) larvae. Acta Hydrobiologica Sinica, 36(4): 674–681 |
| Luquet P, Oteme Z J, Cisse A, 1995. Evidence for compensatory growth and its utility in the culture of Heterobranchus longifilis. Aquatic Living Resources, 8(4): 389–394 DOI:10.1051/alr:1995045 |
| Plavnik I, Hurwitz S, 1985. The performance of broiler chicks during and following a severe feed restriction at an early age. Poultry Science, 64(2): 348–355 DOI:10.3382/ps.0640348 |
| Seol D W, Lee J, Im S Y, et al, 2007. Clove oil as an anaesthetic for common octopus (Octopus minor, Sasaki). Aquaculture Research, 38(1): 45–49 DOI:10.1111/are.2007.38.issue-1 |
| Solorzano Y, Viana M T, López L M, et al, 2009. Response of newly hatched Octopus bimaculoides fed enriched Artemia salina:growth performance, ontogeny of the digestive enzyme and tissue amino acid content. Aquaculture, 289(1-2): 84–90 DOI:10.1016/j.aquaculture.2008.12.036 |
| Wang J H, Zheng X D, 2017. Comparison of the genetic relationship between nine cephalopod species based on cluster analysis of karyotype evolutionary distance. Comparative Cytogenetics, 11(3): 477–494 DOI:10.3897/compcytogen.v11i3.12752 |
| Wu L X, Dong S L, Wang F, et al, 2001. The effect of previous feeding regimes on the compensatory growth response in Chinese shrimp, Fenneropenaeus chinensis. Journal of Crustacean Biology, 21(3): 559–565 DOI:10.1163/20021975-99990157 |
| Xu R, Bo Q K, Zheng X D, 2018. A divergent lineage among Octopus minor (Sasaki, 1920) populations in the Northwest Pacific supported by DNA barcoding. Marine Biology Research, 14(4): 335–349 DOI:10.1080/17451000.2018.1427866 |
| Yamamoto T, 1942. On the ecology of Octopus variabilis typicus (Sasaki), with special reference to its breeding habits. The Malacological Society of Japan, 12(1-2): 9–20 |
| Zamal H, Ollevier F, 1995. Effect of feeding and lack of food on the growth, gross biochemical and fatty acid composition of juvenile catfish. Journal of Fish Biology, 46(3): 404–414 DOI:10.1111/jfb.1995.46.issue-3 |
| Zheng X D, Qian Y S, Liu C et al, 2014. Octopus minor. In: Iglesias J, Fuentes L, Villanueva R et al, Cephalopod Culture. New York: Springer, 415-426 |
 2018, Vol. 49
2018, Vol. 49


