中国海洋湖沼学会主办。
文章信息
- 朱明, 刘峰, 陈璐, 刘兆普. 2018.
- ZHU Ming, LIU Feng, CHEN Lu, LIU Zhao-Pu. 2018.
- 低盐在短时间内对绿潮浒苔(Ulva prolifera)氮磷吸收的动态影响
- THE IMPACT OF A SHORT LOWERED SALINITY ON NUTRIENT UPTAKE BY GREEN TIDE-FORMING ALGA ULVA PROLIFERA
- 海洋与湖沼, 49(5): 975-982
- Oceanologia et Limnologia Sinica, 49(5): 975-982.
- http://dx.doi.org/10.11693/hyhz20180200032
-
文章历史
- 收稿日期:2018-02-07
- 收修改稿日期:2018-04-26
2. 中国科学院海洋研究所实验海洋生物学重点实验室 青岛 266071;
3. 青岛海洋科学与技术国家实验室海洋生物学与生物技术功能实验室 青岛 266237;
4. 上海师范大学生命与环境科学学院 植物种质资源开发中心 上海 200234;
5. 南京农业大学资源与环境科学学院 南京 210095
2. CAS Key Laboratory of Experimental Marine Biology, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;
3. Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China;
4. Development Center of Plant Germplasm Resources, College of Life and Environmental Sciences, Shanghai Normal University, Shanghai 200234, China;
5. College of Resources and Environmental Science, Nanjing Agricultural University, Nanjing 210095, China
由大型海藻暴发性营养生长形成的藻类灾害(绿潮和金潮)已经成为一个世界性的海洋生态安全问题(Smetacek et al, 2013)。大型藻类灾害的发生地通常存在大量营养盐的持续输入, 海藻吸收和储存营养盐能力在很大程度上决定着其在沿岸带生态系统中的竞争能力(Runcie et al, 2003; Luo et al, 2012)。研究显示石莼属(Ulva)藻类具有较高的营养盐吸收速率和储存能力, 能够快速响应营养盐的波动式变化(Fong et al, 2000), 在富营养化水域环境中快速生长, 进而形成绿潮(Cohen et al, 2004a, b; Largo et al, 2004)。有研究显示陆源径流以及苏北沿岸流带来的低盐水体中富含氮磷等营养盐, 为浒苔绿潮的暴发提供了重要的物质基础(高嵩等, 2012)。
米氏(Mihcaelis-Menton)方程表示稳态时藻类对氮盐(如NO3--N和NH4+-N)和磷盐(如PO43--P)的吸收理论模型。在这个模型中, Vmax和Ks分别表示对离子的最大吸收速率和在达到最大吸收速率一半时底物浓度(半饱和常数), 而运输系统的亲和力则通过Vmax/Ks获得(Harrison et al, 1989; Berges et al, 1994)。该模型广泛用于描述藻类或大型水生植物对营养盐的吸收特性(刘静雯等, 2004; 温珊珊等, 2008; Luo et al, 2012)。
有关浒苔在室内外实验条件下吸收硝酸盐(NO3--N)和铵氮(NH4+-N)动力学实验, 已经获得了诸多结果。史华明(2009)研究发现在盐度30条件下, 经过2d饥饿处理后的浒苔快速地吸收NO3--N和NH4+-N发生在实验的开始阶段, 表明浒苔具有快速储备营养盐的特征; 在1.5h内对NH4+-N和NO3--N的吸收速率符合米氏动力学方程, 其中浒苔对NH4+-N的半饱和常数小于对NO3--N的半饱和常数, 对NH4+-N的最大吸收速率大于NO3--N (李俭平等, 2010; Luo et al, 2012); 而吴婷(2013)则发现浒苔对NO3--N的最大吸收速率大于NH4+-N。上述研究出现的浒苔对NO3--N和NH4+-N最大吸收速率的差异, 可能与实验材料的发育阶段、生理状态、饥饿处理时间以及实验时间区段的选择有密切关系。研究显示, 在正常盐度(30)条件下经过磷(PO43--P)饥饿处理后的石莼(Ulva lactuca)对PO43--P能够快速和过量的吸收, 并以多聚磷(PolyP)的形式储存在细胞内(Runcie et al, 2001, 2004)。
石莼属绿藻通常生长在半咸水的河口或潮间带水域环境中, 盐度波动或降低会影响藻类对氮磷等营养盐的吸收和同化能力(Cohen et al, 2004b)。在正常盐度(30)的海水中石莼属海藻对氮盐(NO3--N和NH4+-N)吸收特性的研究已有诸多报道, 但对于盐度降低如何影响绿潮浒苔(Ulva prolifera)对营养盐(NO3--N, NH4+-N, PO43--P)吸收还未见相关报道。连续11年在我国黄海出现的绿潮, 发源于黄海南部苏北辐射沙洲紫菜养殖区; 苏北沙洲区濒临的沿岸河网众多, 来自沿岸径流的淡水携带大量氮磷等营养盐间歇性入海, 导致海水的富营养化并伴随着盐度的周期性波动(Luo et al, 2011; Liu et al, 2012, 2013)。本实验通过设置不同盐度(30、15和5)条件, 研究浒苔在24h内吸收NO3--N、NH4+-N和PO43--P的变化规律。
1 材料与方法 1.1 藻样采集与预培养绿潮浒苔藻体于2010年5月在连云港近海采集, 经形态和分子鉴定为Ulva prolifera。将洗净的藻体放入0.2%的KI培养液中浸泡1min, 再用高压灭菌海水冲洗3—4次, 以去除附着的杂质等(叶静等, 2006), 然后通过灭菌的自然海水(盐度32±2, pH 8.0—8.3, 28.5μmol/L NO3--N, 3.54μmol/L PO43--P)进行保种培养。培养过程中添加0.5—1mg/L的二氧化锗(GeO2), 藻体密度不超过5.0g/L, 温度为20±1℃, 光照强度为50—60μmol photons/(m2s), 光照周期为12L : 12D。
取健康的浒苔藻体作为实验材料, 将挑选的具有多分枝的藻体, 在500mL球形培养瓶里连续充气培养, 培养液为400mL抽滤的自然海水, 每天更换一次。藻体密度不超过1.0g/L, 培养温度为20±1℃, 光照强度为100—120μmol photons/(m2s), 光照周期为12L : 12D。
1.2 不同盐度下浒苔对硝酸盐和铵盐的24h连续吸收使用红海盐(Red Sea salt, Israel)充分溶解于蒸馏水, 配置不同盐度的人工海水, 并用1mol/L的NaOH或者HCl调节pH值至8.3。将单根藻丝在盐度30条件下进行7d饥饿培养后, 取0.2g置于250mL锥形瓶中(培养液200mL), 设置3个盐度30、15和5, 每个盐度条件下分别添加25、50、100、200和300μmol/L的NO3--N或NH4+-N, 每个处理设置3个平行组; 在温度20℃、光照100—120μmol photons/(m2s)条件下培养, 并在0、1、3、6、9、12和24h后使用一次性注射器和0.45μm微孔滤膜取培养介质的水样1mL, 于-20℃冷冻保存待测。
1.3 不同盐度下浒苔对磷酸盐24h连续吸收将上述经过7d营养饥饿胁迫的藻体0.2g, 置于250mL锥形瓶中(培养基200mL), 设置3个盐度30、15和5(用蒸馏水和红海盐按比例配置), 每个盐度条件下分别添加60μmol/L PO43--P, 培养条件和取样时间同1.2。
1.4 营养盐分析检测方法硝酸盐含量的测定方法:使用Smartchem自动水质分析仪, 采用镉柱还原法检测水体中的硝酸盐含量, 样品经过一个开放的镀铜镉柱还原器后, 硝酸根还原为亚硝酸根。亚硝酸根通过磺胺处理后与N-1-萘基乙二胺盐酸偶联形成深色的偶氮染料, 然后在550nm或者520nm比色分析。
铵氮含量的测定方法:铵氮的测定采用国标GB 17378.4-2007次溴酸盐氧化法。
磷酸盐含量的测定方法:使用Smartchem自动水质分析仪、采用磷钼蓝显色法磷酸盐含量的测定(Murphy et al, 1958), 钼酸铵与正磷酸盐在酸性条件下反应生成钼酸盐。随后被抗坏血酸还原成钼蓝。反应的催化剂是锑盐, 在880nm检测吸光度。
1.5 数据分析使用Origin 8.0软件进行数据分析, 采用单因素方差分析(one-way AVONA)和T检验(T-test)比较不同处理之间的差异, 设显著水平为P<0.05。
2 实验结果 2.1 三种盐度条件下浒苔对NO3--N的吸收在30、15和5盐度条件下, 经过24h的培养, 培养液中NO3--N的含量呈现持续降低的趋势(P<0.05), 表明不同盐度下浒苔展现出对NO3--N的持续吸收。浒苔对NO3--N的吸收量随着盐度的下降不断增加, 在盐度为15和5时, 吸收主要发生在实验开始后的3h内(图 1)。
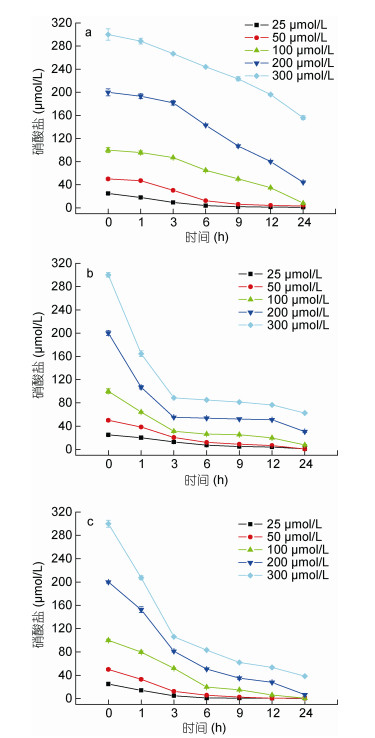 |
| 图 1 不同盐度下浒苔培养液中硝酸盐(NO3--N)浓度变化(差异线显示标准差, n=3) Fig. 1 The change of nitrate (NO3--N) concentration in the couture medium of U. prolifera at a different salinity (Error bars indicate standard error, n=3) 注: a.盐度30; b.盐度15; c.盐度5 |
硝酸盐(NO3--N)浓度在25—300μmol/L范围内, 在盐度30、15和5条件下浒苔对NO3--N的1h内的吸收速率符合米氏方程: V=Vmax·S/(Ks+S) (R2>0.96)(表 1)。与盐度30相比, 在低盐度(15和5)时, 浒苔对NO3--N的1h最大吸收速率(Vmax)和亲和力(Vmax/Ks)分别提高280%和350%左右(P<0.05), 半饱和常数(Ks)下降15%左右(P<0.05), 并能够维持对NO3--N的高效吸收(24h)。Vmax和Vmax/Ks随盐度降低而大幅度提升和Ks的降低, 表明盐度降低提高了浒苔对NO3--N的竞争优势。
| 盐度 | 最大吸收速率(Vmax) (μmol/L NO3-N/(gFW h)) | 半饱和常数Ks(μmol/L) | Vmax/Ks | R2 |
| 30 | 35.40 | 568.18 | 0.0623 | 0.9620 |
| 15 | 131.89 | 485.30 | 0.27 | 0.9694 |
| 5 | 136.64 | 481.93 | 0.2835 | 0.9749 |
| 盐度 | 最大吸收速率(Vmax) (μmol/L NH4+-N/(gFW h)) | 半饱和常数Ks(μmol/L) | Vmax/Ks | R2 |
| 30 | 139.54 | 190.97 | 0.730 | 0.962 |
| 15 | 191.73 | 218.77 | 0.876 | 0.969 |
| 5 | 437.90 | 241.58 | 1.812 | 0.995 |
在盐度30条件下, 浒苔能够对25—300μmol/L铵氮(NH4+-N)实现完全的吸收; 而在盐度15条件下浒苔仍然能够实现对低浓度NH4+-N (25—100μmol/L)的吸收, 但是在NH4+-N浓度为200μmol/L和300μmol/L时分别在12h和6h停止对NH4+-N的吸收, 甚至有少量的释放。而在盐度5条件下, 除了在低浓度25μmol/L时浒苔连续吸收NH4+-N外, 其他浓度条件下都出现了NH4+-N被吸收后、被释放和再吸收的过程。
在NH4+-N浓度25—300μmol/L浓度范围内, 在盐度30、15和5条件下浒苔对NH4+-N的1h吸收速率符合米氏方程, V=Vmax·S/(Ks+S) (R2>0.96)。浒苔对铵氮的1h最大吸收速率Vmax、Ks以及Vmax/Ks都随着盐度的下降而上升(P<0.05);与盐度30相比, 盐度15和5条件下的Vmax分别提高了近40%和200% (P<0.05);半饱和常数(Ks)随盐度下降而升高, 与盐度30相比盐度15和5条件下的Ks分别提高近15%和30%;盐度15和5条件下浒苔对铵氮的亲和力(Vmax/Ks)分别提高近20%和180% (P<0.05)。
虽然盐度下降提高了浒苔对铵氮的Vmax和Vmax/Ks, 提高了浒苔对NH4+-N短时间吸收的竞争能力, 有利于浒苔在应对来源于低盐水体间歇性NH4+-N补充时保持竞争优势; 但其提高幅度远低于对硝酸盐的Vmax和Vmax/Ks。但是低盐度导致半饱和常数的提高, 不利于浒苔在低盐条件下有效利用铵氮, 从实验后期的结果也可以看出, 盐度下降导致浒苔不能维持对NH4+-N的长效吸收, 甚至出现细胞内NH4+-N向细胞外释放的现象。
2.3 盐度下降对浒苔吸收磷酸盐的影响在不同盐度和处理时间段内, 浒苔对PO43--P既有吸收、也有释放。在盐度30条件下浒苔在9h内连续吸收PO43--P, 在9—12h浒苔向介质中缓慢释放少量PO43--P, 在12—24h又继续吸收PO43--P。盐度15条件下, 浒苔在6h内快速吸收PO43--P, 经过6—9h的停滞期后, 浒苔在9—12h之间快速释放PO43--P, 并在12—24h时间段内仍然缓慢释放PO43--P。而在盐度5条件下, 浒苔在1h内缓慢吸收PO43--P后, 在1—6h内持续释放PO43--P, 再经过6—12h的快速吸收后, 介质中PO43--P回到了接近初始的水平, 并在12—24h时间内缓慢吸收PO43--P (图 3)。实验说明低盐(5)能够引起浒苔细胞内部的PO43--P释放, 并阻止藻类对PO43--P的长效吸收。
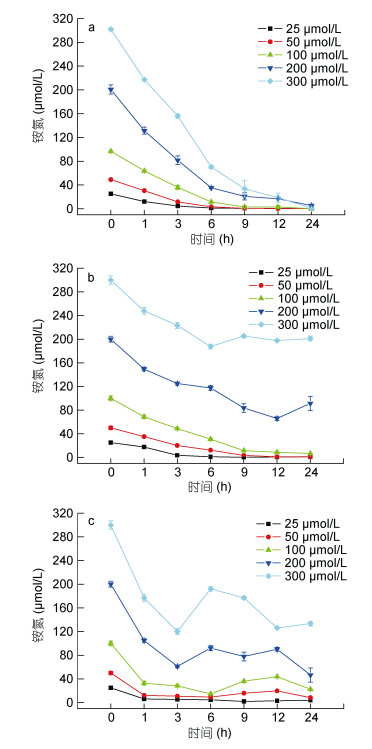 |
| 图 2 不同盐度下浒苔培养液中铵氮(NH4+-N)浓度变化(差异线显示标准差, n=3) Fig. 2 The change of ammonium (NH4+-N) concentration in the culture medium of U. prolifera at a different salinity (Error bars indicate standard error, n=3) 注: a.盐度30; b.盐度15; c.盐度5 |
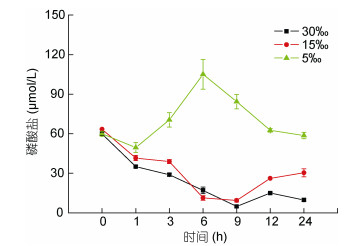 |
| 图 3 在不同盐度下浒苔培养液中磷酸盐(PO43--P)浓度的变化(差异线显示标准差, n=3) Fig. 3 The change of phosphate (PO43--P) concentration in the culture medium of U. prolifera at a different salinity (Error bars indicate standard error, n=3) |
本实验在盐度30条件下测得浒苔1h对NO3--N的最大吸收速率(Vmax)为35.4μmol/L(gFW h), 高于李俭平等(2010)1.5h内所测得的Vmax(26.67μmol/L/(gFW h))。这可能由于本实验所使用的实验材料经过了更长时间的饥饿处理(7d), 消耗了浒苔细胞内氮库中更多的氮源, 为外源氮源的吸收和储存提供更大的胞内空间。
无论浒苔对硝酸盐的短时间(1h)最大吸收速率Vmax、还是长时间(24h内)的吸收量都随盐度的下降而增加, 说明盐度的降低能够促进浒苔对硝酸盐的吸收。该过程可能与硝酸盐的主动运输有关, 在转运蛋白向细胞内主动运输硝酸盐过程中, 氮源是以带正电荷的化合物形式与Na+一起通过带负电荷的海藻细胞膜电位而传递, 同时伴随着K+的外流以维持膜的电位平衡, 但是需要Na+/K+泵重新建立起离子梯度(Flynn, 1991); 而在低盐条件下藻细胞为了维持细胞内外的渗透压平衡, 促进了细胞内部K+向细胞外的流动, 提高了硝酸盐转运蛋白运输效率和硝酸盐的吸收(Cohen et al, 2004b); 同时液泡中其他可溶性物质(包括NH4+)向外释放(Fong et al, 2000), 也为硝酸盐在液泡内的积累提供了额外容纳量, 提高了藻类对硝酸盐的亲和力。在硝酸盐加富条件下, 盐度降低提高了浒苔的硝酸还原酶活性(Zhu et al, 2016), 提高了硝酸盐的同化效率, 降低细胞内的硝酸盐储存量, 从而促进了藻类对硝酸盐的吸收。
本实验中相对于盐度30, 浒苔在盐度15条件下具有更高的NO3--N最大吸收速率, 与Cohen等(2004b)对肠浒苔的研究结果相一致, 同时浒苔在低盐度(5)条件下所表现出对NO3--N高吸收速率和亲和力有利于浒苔快速吸收来自于淡水中的NO3--N, 保持在河口地区的竞争优势。
本实验中浒苔在三个盐度条件下对硝酸盐的快速吸收发生在起始的3h内, 其后对硝酸盐的吸收导致培养液中的硝酸盐近乎线性的衰减, 说明浒苔的硝酸盐转运与石莼(Ulva rigida)存在相似的机制(Corzo et al, 1994), 其硝酸盐转运蛋白能够被硝酸盐快速激活, 盐度下降通过提高浒苔对NO3--N的亲和力, 从而提高转运蛋白的转运效率。在盐度30时, 浒苔对高浓度(200—300μmol/L)的硝酸盐以近乎线性的方式吸收, 可能由于海水中的硝酸盐经常处于较低水平, 藻类对硝酸盐采取主动吸收的机制, 但是当硝酸盐浓度上升到一定水平时, 藻类也可能同时采取被动吸收的方式提高以快速利用间歇出现的硝酸盐。
3.2 盐度降低对浒苔吸收铵氮的影响本实验中浒苔短时间(1h)吸收铵氮的Vmax (139.54μmol/L/(gFW h))远大于李俭平等(2010)实验结果中的29.54μmol/L/(gFW h)。可能因为相对于短期(2d)而言, 长期(7d)的饥饿胁迫能够消耗更多细胞所储存的铵氮, 从而提高了对铵氮的吸收速率。盐度下降提高了藻类对铵氮的短时间吸收能力(Vmax), 说明盐度降低促进了铵氮向细胞内的渗透; 但是同时盐度下降也提高了半饱和常数(Ks), 降低了浒苔对铵氮的亲和力, 因此藻类在24h对铵氮的吸收随盐度下降而减少, 也从另外一个角度说明铵氮是以被动吸收的形式进入细胞内部。
研究发现肠浒苔(U. intestinalis)和石莼(U. expansa)在高浓度硝酸盐(250, 840μmol/L)培养2周后, 水体中出现了铵氮的积累, 其浓度与培养液中的硝酸盐浓度正相关, 说明铵氮作为藻类利用硝酸盐同化作用的产物, 当其含量超出细胞需求时也会排出细胞外(Fong et al, 2004)。本实验结果说明, 铵氮进入抑或流出藻体, 不只与细胞与细胞内外铵氮的浓度有关, 而且与盐度的变化有关。正常盐度(30)条件下细胞内外的渗透压是平衡的, 铵氮进入藻细胞的途径是单向的; 而盐度降低导致藻细胞内部渗透压的提高, 从而可能抑制外源性离子的进入或者内源性离子向细胞外部的流出。比如在300μmol/L铵氮处理组中, 藻体在盐度15条件下6h后停止吸收铵氮, 说明细胞的内外的铵氮浓度达到了一定的平衡; 而在低盐度(5)条件下, 藻体在3h连续吸收铵氮则向水体释放铵氮, 9h后重新从培养液中吸收铵氮, 可能与细胞内外的渗透压达到平衡有关。高浓度铵氮对生物具有一定的毒性, 因此其渗出细胞的过程是否涉及主动运输, 需要进一步研究。
3.3 不同盐度下浒苔吸收硝酸盐与铵氮的差异本研究中, 盐度30条件下浒苔展现出优先吸收NH4+的特点, 这与肠浒苔(U. intestinalis)一致。Cohen等(2004a)对肠浒苔的研究发现, 当以600μmol/L NH4NO3-N添加氮源时, 经过24h的连续吸收, NH4+从300μmol/L减少到50μmol/L, 而NO3-从300μmol/L减少到150μmol/L, 说明该藻类优先吸收NH4+-N, 但是也同时吸收NO3--N, 该策略有利于河口地区的绿潮藻应对不同来源的多重氮源。Ale等(2011)对石莼(U. lactuca)的研究表明无论是单独添加还是一起添加NO3--N或NH4+-N (50μmol/L), 其对NH4+-N吸收速率都大于对NO3--N的吸收; 并且其50μmol/L NH4+-N加富条件下石莼的最大生长速率(16.4± 0.18%/d)也高于50μmol/L NO3--N处理组(9.4± 0.72%/d)。上述结果表明石莼属(Ulva)的藻类似乎更加偏好于铵氮, 尽管海水的氮源大多以硝酸盐的形式存在。
Vmax具有独特的生态学意义, 特别是当营养盐以短期间隙式方式(in short pulse)供给(比如动物排泄)时(D’Elia et al, 1978)。本研究中, 在三个盐度条件下, 浒苔对铵氮的最大吸收速率Vmax都大于对硝酸盐的最大吸收速率Vmax。浒苔在盐度下降时对铵氮的高效吸收能力的提高有利于该藻应对来源于养殖淡水及生活污水的高含量铵氮间歇性补充, 在此过程中水体的盐度通常同时出现下降。
在正常盐度(30)条件下, 浒苔对铵氮的Vmax都大于其对硝酸盐的Vmax, 与李俭平等(2010)的实验结果一致, 而吴婷(2013)等研究实验显示相反的结果, 可能由于本实验中的材料经过了7d的营养饥饿处理, 消耗了藻细胞内部大部分的硝酸盐和铵氮, 而吴婷(2013)的实验材料经过了2d的营养饥饿处理, 藻类可能通过硝酸还原酶的作用将其所储存的硝酸盐还原为铵氮, 减少了细胞内硝酸盐的含量并增加铵氮存在一定的积累, 从而阻碍了铵氮的吸收, 并可能导致该实验中48h内浒苔对硝酸盐的吸收量大于对铵氮的吸收量。
吴婷(2013)与史华明(2009)的研究发现在盐度30条件下浒苔对NH4-N的亲和力大于其对NO3-N的亲和力(Ks值越大, 亲和力越小), 本研究显示盐度下降(15和5)条件下, 浒苔对铵氮的半饱和常数Ks都小于对硝酸盐, 说明低盐条件下浒苔仍然能够保持对铵氮较高的亲和力。浒苔在盐度降低条件下所保持的高效吸收铵氮能力, 有助于其优先获得在河口和径流中偶然出现的铵氮。
硝酸盐进入细胞后经过硝酸还原酶的作用转化铵氮, 而盐度降低导致浒苔细胞内部铵氮的外渗, 减少了铵氮对硝酸还原酶的负反馈作用以及与硝酸盐的位点竞争作用, 这也可能是导致浒苔在低盐度条件下硝酸盐吸收量高于正常盐度条件的原因之一。而硝酸盐经过主动运输, 很快被还原为铵氮并进入细胞蛋白合成系统, 因此低盐度条件并未引起硝酸盐的释放。
3.4 盐度降低对浒苔磷酸盐吸收的影响磷酸盐(PO43--P)吸收分为表面吸附和细胞吸收两个步骤(Yao et al, 2011), 据此推测, 在盐度5实验初期阶段介质中的PO43--P浓度的下降可能是由于细胞壁的吸附作用, 而不是向细胞内的转移; PO43--P的释放可能与低盐度5的渗透胁迫有关。盐度下降所产生的细胞内高渗透条件也阻止了Na+向细胞内的转移, 对磷与Na+的共同运输机制产生负面影响(Ullrich et al, 1982; Weiss et al, 2001), 进一步减少了藻类对磷的吸收。中等盐度(15)也可能导致细胞内物质的流失, 浒苔仍然能够正常吸收PO43--P, 意味着浒苔对PO43--P的同化效率提高, 从而抵消了盐度下降的影响。
4 结论本研究主要发现: (1)与盐度30相比, 在低盐度(15和5)时, 浒苔对NO3--N的1h最大吸收速率(Vmax)和亲和力(Vmax/Ks)分别提高280%和350%左右, 半饱和常数(Ks)下降15%左右, 并能够维持对NO3--N的高效吸收(24h); (2)盐度15和5时, 浒苔对NH4+-N的1h最大吸收速率(Vmax)分别提高40%和200%, 亲和力(Vmax/Ks)分别提高20%和180%, Ks分别提高15%和30%, 但是盐度降低对NH4+-N的长效吸收产生负面影响, 甚至在盐度5条件下出现吸收高浓度NH4+-N后再释放的现象; (3)与盐度30相似, 盐度15条件下浒苔能够快速吸收PO43--P, 而盐度5则导致藻细胞内的PO43--P在早期阶段快速流失, 并在后期不能有效吸收PO43--P。本实验的结果表明, 降低盐度有利于浒苔对氮源的快速吸收, 在盐度15下浒苔能够实现对硝酸盐和磷盐的高效吸收; 这对认识浒苔在低盐富营养化环境下生长生殖的生物学机制有重要意义。
| 叶静, 张喆, 李富超, 等, 2006. 大型绿藻浒苔转化表达系统选择标记的筛选. 生物技术通报,(3): 63–67 DOI:10.3969/j.issn.1002-5464.2006.03.015 |
| 史华明, 2009.浒苔对氮磷吸收和释放及与中肋骨条藻竞争关系的初步研究.青岛: 中国海洋大学硕士学位论文, 20-23 http://cdmd.cnki.com.cn/article/cdmd-10423-2009172481.htm |
| 刘静雯, 董双林, 2004. 氮饥饿细基江蓠繁枝变型和孔石莼氨氮的吸收动力学特征. 海洋学报, 26(2): 95–103 DOI:10.3321/j.issn:0253-4193.2004.02.011 |
| 李俭平, 赵卫红, 付敏, 等, 2010. 氮磷营养盐对浒苔生长影响的初步探讨. 海洋科学, 34(4): 45–48 |
| 吴婷, 2013.营养盐对浒苔生长的影响及浒苔对不同氮源吸收特性的初步研究.青岛: 中国海洋大学硕士学位论文, 28-33 http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D326577 |
| 高嵩, 石晓勇, 王婷, 2012. 浒苔绿潮与苏北近岸海域营养盐浓度的关系研究. 环境科学, 33(7): 2204–2209 |
| 温珊珊, 张寒野, 何文辉, 等, 2008. 真江蓠对氨氮去除效率与吸收动力学研究. 水产学报, 32(5): 794–803 |
| Ale M T, Mikkelsen J D, Meyer N S, 2011. Differential growth response of Ulva lactuca to ammonium and nitrate assimilation. J Appl Phycol, 23: 345–351 DOI:10.1007/s10811-010-9546-2 |
| Berges J A, Montagnes D J S, Hurd C L, et al, 1994. Fitting ecological and physiological data to rectangular hyperbolae:a comparison of methods using Monte Carlo simulations. Marine Ecology Progress Series, 114: 175–183 DOI:10.3354/meps114175 |
| Cohen R A, Fong P, 2004a. Nitrogen uptake and assimilation in Enteromorpha intestinalis (L.) Link (Chlorophyta):using 15N to determine preference during simultaneous pulses of nitrate and ammonium. Journal of Experimental Marine Biology and Ecology, 309(1): 67–77 DOI:10.1016/j.jembe.2004.03.009 |
| Cohen R A, Fong P, 2004b. Physiological responses of a bloom-forming green macroalga to short-term change in salinity, nutrients, and light help explain its ecological success. Estuaries, 27(2): 209–216 DOI:10.1007/BF02803378 |
| Corzo A, Niell F X, 1994. Nitrate-reductase activity and in vivo nitrate-reduction rate in Ulva rigida illuminated by blue light. Marine Biology, 120(1): 17–23 |
| D'Elia C F, De Boer J A, 1978. Nutritional studies of two red algae. Ⅱ. Kinetics of ammonium and nitrate uptake. Journal of Phycology, 14(3): 266–272 DOI:10.1111/jpy.1978.14.issue-3 |
| Flynn K J, 1991. Algal carbon-nitrogen metabolism:a biochemical basis for modelling the interactions between nitrate and ammonium uptake. Journal of Plankton Research, 13(2): 373–387 DOI:10.1093/plankt/13.2.373 |
| Fong P, Fong J J, Fong C R, 2004. Growth, nutrient storage, and release of dissolved organic nitrogen by Enteromorpha intestinalis in response to pulses of nitrogen and phosphorus. Aquatic Botany, 78(1): 83–95 DOI:10.1016/j.aquabot.2003.09.006 |
| Fong P, Zedler J B, 2000. Sources, sinks, and fluxes of nutrients (N+P) in a small highly modified urban estuary in southern California. Urban Ecosystems, 4(2): 125–144 DOI:10.1023/A:1011359311384 |
| Harrison P J, Parslow J S, Conway H L, 1989. Determination of nutrient uptake kinetic parameters:a comparison of methods. Marine Ecology Progress Series,, 52: 301–312 DOI:10.3354/meps052301 |
| Largo D B, Sembrano J, Hiraoka M, et al, 2004. Taxonomic and ecological profile of 'green tide' species of Ulva (Ulvales, Chlorophyta) in central Philippines. Hydrobiologia, 512(1-3): 247–253 DOI:10.1023/B:HYDR.0000020333.33039.4b |
| Liu F, Pang S J, Zhao X B, et al, 2012. Quantitative, molecular and growth analyses of Ulva microscopic propagules in the coastal sediment of Jiangsu province where green tides initially occurred. Marine Environmental Research, 74: 56–63 DOI:10.1016/j.marenvres.2011.12.004 |
| Liu F, Pang S J, Chopin T, et al, 2013. Understanding the recurrent large-scale green tide in the Yellow Sea:temporal and spatial correlations between multiple geographical, aquacultural and biological factors. Marine Environmental Research, 83: 38–47 DOI:10.1016/j.marenvres.2012.10.007 |
| Luo M B, Liu F, 2011. Salinity-induced oxidative stress and regulation of antioxidant defense system in the marine macroalga Ulva prolifera. Journal of Experimental Marine Biology and Ecology,, 409(1-2): 223–228 DOI:10.1016/j.jembe.2011.08.023 |
| Luo M B, Liu F, Xu Z L, 2012. Growth and nutrient uptake capacity of two co-occurring species, Ulva prolifera and Ulva linza. Aquatic Botany, 100: 18–24 DOI:10.1016/j.aquabot.2012.03.006 |
| Murphy J, Riley J P, 1958. A single-solution method for the determination of soluble phosphate in sea water. Journal of the Marine Biological Association of the United Kingdom, 37(1): 9–14 DOI:10.1017/S0025315400014776 |
| Runcie J W, Larkum A W D, 2001. Estimating internal phosphorus pools in macroalgae using radioactive phosphorus and trichloroacetic acid extracts. Analytical Biochemistry, 297(2): 191–192 DOI:10.1006/abio.2001.5347 |
| Runcie J W, Ritchie R J, Larkum A W D, 2003. Uptake kinetics and assimilation of inorganic nitrogen by Catenella nipae and Ulva lactuca. Aquatic Botany, 76(2): 155–174 DOI:10.1016/S0304-3770(03)00037-8 |
| Runcie J W, Ritchie R J, Larkum A W D, 2004. Uptake kinetics and assimilation of phosphorus by Catenella nipae and Ulva lactuca can be used to indicate ambient phosphate availability. Journal of Applied Phycology, 16(3): 181–194 DOI:10.1023/B:JAPH.0000048504.76029.b4 |
| Smetacek V, Zingone A, 2013. Green and golden seaweed tides on the rise. Nature, 504(7478): 84–88 DOI:10.1038/nature12860 |
| Ullrich W R, Glaser E, 1982. Sodium-phosphate cotransport in the green alga Ankistrodesmus braunii. Plant Science Letters, 27(2): 155–161 DOI:10.1016/0304-4211(82)90144-4 |
| Weiss M, Haimovich G, Pick U, 2001. Phosphate and sulfate uptake in the halotolerant alga Dunaliella are driven by Na+-symport mechanism. Journal of Plant Physiology, 158(12): 1519–1525 DOI:10.1078/0176-1617-00584 |
| Yao B, Xi B D, Hu C M, et al, 2011. A model and experimental study of phosphate uptake kinetics in algae:considering surface adsorption and P-stress. Journal of Environmental Sciences, 23(2): 189–198 DOI:10.1016/S1001-0742(10)60392-0 |
| Zhu M, Liu Z P, Shao H B, et al, 2016. Effects of nitrogen and phosphate enrichment on the activity of nitrate reductase of Ulva prolifera in coastal zone. Acta Physiologiae Plantarum, 38: 169 DOI:10.1007/s11738-016-2178-7 |
 2018, Vol. 49
2018, Vol. 49


