
中国海洋湖沼学会主办。
文章信息
- 赵瑾, 马莹莹, 解威峰, 吴春辉, 姜鹏. 2018.
- ZHAO Jin, MA Ying-Ying, XIE Wei-Feng, WU Chun-Hui, JIANG Peng. 2018.
- 盐度与种间竞争对漂浮生态型浒苔微繁体萌发和生长的影响
- EFFECTS OF SALINITY AND INTERSPECIES COMPETITION ON PROPAGULE GERMINATION AND SEEDLING GROWTH OF FLOATING ECOTYPE OF ULVA PROLIFERA
- 海洋与湖沼, 49(5): 991-998
- Oceanologia et Limnologia Sinica, 49(5): 991-998.
- http://dx.doi.org/10.11693/hyhz20180400101
-
文章历史
- 收稿日期:2018-04-19
- 收修改稿日期:2018-07-07
2. 青岛海洋科学与技术国家实验室海洋生物学与生物技术功能实验室 青岛 266237;
3. 中国科学院海洋大科学研究中心 青岛 266071;
4. 中国科学院大学 北京 100049
2. Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China;
3. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
4. University of Chinese Academy of Sciences, Beijing 100049, China
自2007年以来, 黄海绿潮每年夏季周期性暴发, 规模居世界首位, 对近海生态环境造成严重影响, 给海水养殖业、旅游业带来严重经济损失(Liu et al, 2013a)。黄海绿潮的典型特征之一是漂浮藻的长距离漂移, 这与国际上其他海域发生于封闭海湾的绿潮显著不同。卫星遥感数据显示, 绿潮每年最早出现于江苏如东外海, 之后在风场和表层流场作用下向北漂移且生物量迅速增加, 最终大量藻体到达山东半岛沿岸(Keesing et al, 2011)。通过形态和分子鉴定, 已确定优势种为石莼属浒苔(Ulva prolifera), 黄海绿潮系单一物种的连续暴发(Huo et al, 2013; Zhao et al, 2013)。浒苔在我国有广泛分布, 在黄海主要分布在江苏沿海, 山东沿海也有少量分布(Tseng, 1983; 杨震等, 2009)。进一步种下水平的遗传分析表明, 漂浮浒苔在遗传上高度均一, 且与黄海岸基定生的浒苔群体不同, 是一种特殊的生态型(Zhao et al, 2011, 2015)。基于漂浮生态型浒苔的遗传特殊性, 已开发出高度特异的SCAR(sequence characterized amplified region)分子标记, 适用于大量绿藻样本的快速鉴定(Zhao et al, 2015)。
尽管遗传分析结果表明, 漂浮生态型浒苔不是山东半岛南岸的本地类群(Jiang et al, 2008; Zhao et al, 2015), 但在绿潮暴发后期, 堆积的藻体会形成大量孢子囊(Gao et al, 2010), 并释放大量微繁体(Miao et al, 2018), 短期内对山东半岛南岸构成了严重的繁殖体压力。漂浮生态型浒苔能否在半岛南岸定居为定生群体, 与绿潮未来的变化趋势密切相关, 其北侵风险值得特别关注。梁成伟等(2010)和Liu等(2010)分别对青岛沿海春季岸基定生绿藻、与冬季水体中绿藻微繁体的物种组成进行了分析, 均未发现黄海绿潮的优势种浒苔。笔者于2014—2015年对青岛沿海定生石莼属绿藻及其微繁体的物种组成和季节变化规律进行了周年调查, 在近800号定生绿藻样本中仅发现两株漂浮生态型浒苔, 说明漂浮生态型尚未在青岛沿海大面积定生; 同时, 发现环境中漂浮生态型微繁体的存在时间较短, 到10月份即无检出, 也说明其在青岛沿海的定居受到限制(Zhao et al, 2018)。明确漂浮生态型浒苔在山东半岛南岸定居的关键限制因素, 对于预测其扩散范围、评估黄海绿潮未来发展变化趋势具有重要意义。
温度和盐度是决定海藻地理分布格局的关键环境因子(Scherner et al, 2013; Marcelino et al, 2015)。与江苏如东沿海相比, 青岛沿海虽纬度略高, 但两地冬季表层海水最低温度均在5℃左右(Liu et al, 2012), 海水盐度则存在较明显差异, 青岛沿海盐度值在32左右, 而江苏沿海由于受地表径流等因素影响, 海水盐度多在30以下, 一般为25—28(Huo et al, 2013, 2014)。对裂片石莼(U. fasciata)的研究表明, 在相同温度、不同盐度培养条件下, 其生殖细胞的萌发率和藻体日生长率存在显著差异(Mantri et al, 2011)。还发现, 浒苔在日本沿海主要分布于盐度较低的河口咸水区, 而近缘种缘管浒苔(U. linza)则主要分布在盐度较高的海岸(Shimada et al, 2008)。由此我们推测, 盐度可能同样影响漂浮生态型浒苔生殖细胞的萌发与幼苗生长, 从而限制其在青岛沿海的北侵定居。另外, 对大型海藻如海黍子(Sargassum muticum)、裙带菜(Undaria pinnatifida)生物入侵过程的研究表明, 本地固有的生物群落对于入侵生物具有抵御作用(Deysher et al, 1981; Edgar et al, 2004), 种间竞争的作用同样需要考虑。为验证这一假设, 我们在绿潮暴发后期浒苔于青岛沿海大量堆积期间, 采集了潮间带表层沉积物样本, 分别在盐度25和32下进行培养, 试验不同盐度对漂浮生态型浒苔生殖细胞萌发占比、萌发率和幼苗生长的影响, 分析漂浮生态型与定生类群、以及青岛本地定生近缘种对盐度的适应性差异, 以期分析漂浮生态型浒苔尚未在青岛沿海大规模定生的可能原因。
1 材料与方法 1.1 潮间带表层沉积物样本的采集于2015年7月下旬青岛沿海有大量绿潮浒苔堆积期间, 选择7个站位(图 1), 分别采集潮间带表层沙质沉积物样本约400g, 放入保温箱中, 并在3h内带回实验室。7月下旬到8月上旬, 青岛沿海表层海水温度在24—25℃, 气温在22—32℃。
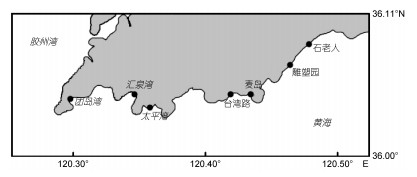 |
| 图 1 青岛潮间带表层沉积物样本采集站位 Fig. 1 Sampling locations of surface sediments in Qingdao intertidal zone |
石莼属绿藻微繁体的培养参考Liu等(2013b)的方法。将各站位采集的表层沉积物样本平均分作两份, 每份称取150g, 分别放入1000mL的无菌烧杯中, 加入500mL盐度分别为25和32的无菌VSE(Von Stosch’s Enriched)培养液, 充分搅拌后用孔径为75μm的筛绢进行过滤, 转移过滤液到500mL的无菌烧杯中, 加入250μL饱和GeO2溶液以抑制硅藻生长(Shea et al, 2007)。将烧杯置于光照培养箱中(江南, 宁波), 在25℃, 100μmol photons/(m2·s), 12:12h光暗周期的条件下进行培养。培养3—4周后, 烧杯中石莼属绿藻幼苗长度可达10 cm, 主要附着在烧杯底部。于每个烧杯底部随机选取3个1cm2的样方, 刮取其中所有绿藻幼苗留待分子鉴定。
1.3 石莼属绿藻样本的分子鉴定用植物基因组提取试剂盒(天根, 北京)提取幼苗单株样本的DNA。ITS分子标记的引物序列及反应程序参考Leskinen等(1997)的方法, 引物由上海生物工程有限公司合成。扩增产物用Super GelRed(US Everbright Inc., 美国)染色的1.0%琼脂糖凝胶进行电泳, 目的片段用琼脂糖凝胶DNA回收试剂盒(天根, 北京)回收纯化后, 送上海桑尼生物科技有限公司测序。下载GenBank中石莼属物种的19条ITS序列作为参考序列, 以盘苔(Blidingia minima)ITS序列为外群, 用Clustal X(Larkin et al, 2007)软件进行多序列比对及序列相似性分析, 利用MEGA 4.0软件(Tamura et al, 2007)中的邻接法(NJ)构建系统发育树, 基于聚类情况进行物种水平的分子鉴定。由于浒苔与近缘种缘管浒苔聚类为单一LPP簇(Shimada et al, 2008), 需再结合具明显差异的形态特征进行区分(Tseng, 1983; 丁兰平等, 2009)。对于物种鉴定结果为浒苔的样本, 进一步用SCAR分子标记经PCR扩增鉴定是否为漂浮生态型, 所用引物、反应程序与鉴定标准参考Zhao等(2015)的方法。
1.4 单藻培养条件下生殖细胞萌发率与幼苗平均日生长量的测定为分析在单藻培养条件下盐度对萌发率与幼苗生长的影响, 选取实验室保存的不同浒苔株系和青岛本地的近缘种缘管浒苔(表 1), 开展不同盐度下生殖细胞萌发与幼苗生长的对比实验, 其中H521是在青岛沿海定生的漂浮生态型浒苔。用切段的方法诱导各样本生殖细胞形成与放散(Hiraoka et al, 2003), 取放散的生殖细胞悬液, 用细胞计数板计算细胞浓度。分别取1μL生殖细胞悬液加入到盛有10mL盐度分别为25和32VSE培养液的平皿中, 置于光照培养箱(江南, 宁波)中进行培养, 培养条件为25℃, 100μmol photons/(m2·s), 12:12h光暗周期。培养2周后, 对新生幼苗进行计数并计算生殖细胞在不同盐度下的萌发率。从每个平皿中取10株幼苗, 用滤纸吸干水后用万分之一天平(赛多利斯, 德国)称重, 记录起始重量(w0), 之后合并转入一个平皿, 在相同盐度及培养条件下继续培养7—8天, 培养天数记为d, 取出幼苗并用滤纸吸干水分, 使用万分之一的天平称重, 记录重量(w1)。因初始幼苗长度仅为2—3mm, 实测w0均为零值, 无法计算日生长率, 所以本研究以单株幼苗的平均日生长量(w1-w0)/(10d)来表征幼苗的生长速率。实验设置3个重复, 通过单因素方差分析, 比较各株系绿藻的生殖细胞萌发率与幼苗生长速率在不同盐度条件下是否存在显著差异。
| 样本编号 | 采集时间 | 采集地点 | 物种 | 状态 |
| S096 | 2007.07.29 | 山东青岛, 鱼鸣嘴 | 浒苔(漂浮生态型) | 漂浮 |
| U161 | 2011.07.04 | 江苏连云港, 灌西 | 浒苔 | 定生 |
| H521 | 2014.12.22 | 山东青岛, 栈桥 | 浒苔(漂浮生态型) | 定生 |
| UL | 2016.03.06 | 山东青岛, 汇泉湾 | 缘管浒苔 | 定生 |
经过3—4周的培养, 在25、32两种盐度条件下, 从各站位表层沉积物样本中均萌发生长出石莼属绿藻幼苗, 分子鉴定幼苗总计353株(编号ss302—ss599, ss660—ss714)。ITS序列聚类分析的结果表明, 样本聚为7簇, 分别为LPP簇249株, 曲浒苔(U. flexuosa)40株, 孔石莼(U. pertusa)24株, 硬石莼(U. rigida)3株, 扁浒苔(U. compressa)2株, U. sapora 33株, 还有一种未定名的U. sp. 2株(图 2)。LPP簇的绿藻幼苗在形态上明显分为两类, 一类为管状密集分枝的藻体, 根据Tseng(1983)对石莼属绿藻的形态分类标准, 鉴定为浒苔(U. prolifera), 共157株; 另一类为披针形片状藻体, 无分枝或仅基部有少量分枝, 鉴定为缘管浒苔(U. linza), 共92株。对鉴定为浒苔的幼苗, 进一步用漂浮生态型高度特异的SCAR标记进行检测, 阳性率为97%。
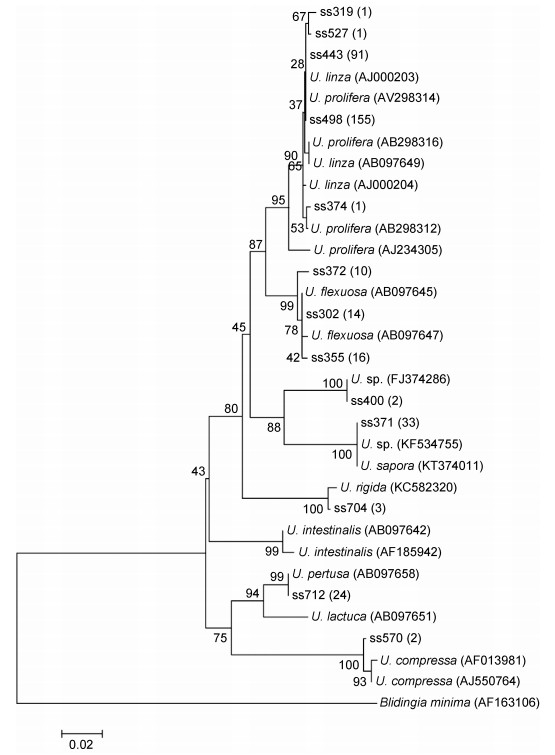 |
| 图 2 用NJ法构建的表层沉积物培养绿藻幼苗ITS序列系统发育树 Fig. 2 The NJ phylogenetic tree based on ITS sequences from Ulva spp. seedlings cultured from surface sediments 注:括号里的数字代表具有相同ITS序列的样本数 |
分别统计25与32两种盐度条件下, 表层沉积物样本中萌发的石莼属绿藻各物种幼苗的数量, 结果发现, 在所有7个站位中, 盐度对漂浮生态型浒苔幼苗在萌发幼苗总数中的绝对数量与相对占比均表现出一致的显著影响, 即高盐条件会显著降低漂浮生态型浒苔幼苗的数量与占比(P<0.01, 图 3)。在盐度25条件下, 漂浮生态型浒苔在7个站位中的占比最高为79%(石老人), 最低为47%(太平湾), 平均占比为62%;而在32盐度条件下, 其占比最高为48%(石老人), 最低为8%(麦岛), 平均占比仅为27%, 不足25盐度条件下平均值的1/2。同样, 其中漂浮生态型浒苔的平均幼苗数, 也仅为25盐度条件下的28%。漂浮生态型浒苔在所有7个站位中均有检出, 且在盐度为25条件下萌发占比均在45%以上。据此估算, 7月份青岛沿海表层沉积物中漂浮生态型浒苔微繁体的密度达到约2400株/kg。
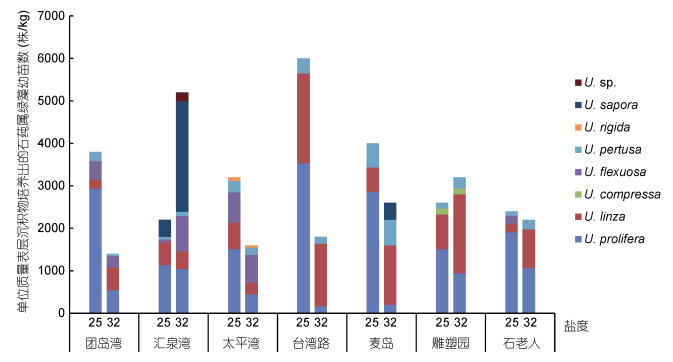 |
| 图 3 不同盐度条件下各站位表层沉积物样本中培养出的石莼属绿藻幼苗物种组成与占比 Fig. 3 Species composition and proportion of Ulva spp. germinated from surface sediments in different salinities |
结果还表明, 盐度主要改变各站位萌发绿藻各物种的相对丰度, 对物种组成则影响不大。在麦岛, U. sapora仅在32盐度条件下萌发; 在汇泉湾, U. sp.也仅在32盐度条件下萌发, 且U. sapora占比接近25盐度条件下的3倍, 说明U. sapora与U. sp.可能严格偏好高盐环境。其他5种青岛本地定生石莼属绿藻, 缘管浒苔、扁浒苔、曲浒苔、孔石莼和硬石莼, 在32盐度条件下的幼苗占比, 基本都明显高于25条件, 说明青岛本地定生种更偏好于高盐环境。缘管浒苔是浒苔的近缘种, 在青岛沿海丰度较高, 其受盐度影响的变化趋势与浒苔显著不同。盐度从25到32, 在浒苔幼苗占比降低的相同趋势下, 除了汇泉湾站位, 其余站位中占比升幅最大的通常是缘管浒苔, 由此推测, 缘管浒苔可能是青岛沿海漂浮生态型浒苔定居的主要竞争者。
2.3 盐度对单藻培养条件下生殖细胞萌发与幼苗生长的影响在单藻培养条件下, 结果表明, 盐度对浒苔各株系及缘管浒苔生殖细胞萌发率的影响均不显著(P>0.05)。但值得注意的是, 无论25还是32盐度条件, 基因型同属漂浮生态型的海上漂浮浒苔S096与已在青岛沿海定生的H521, 其萌发率均远低于定生浒苔群体U161和近缘种缘管浒苔UL, 不及二者的1/10。结果还发现, 盐度对缘管浒苔幼苗的平均日生长量没有显著影响(P>0.05), 但对浒苔各株系均有极显著影响(P<0.01), U161、S096、H521三个组中高盐条件下的平均日生长量分别仅为低盐条件的37.5%、75.0%和28.3%(图 4—5)。
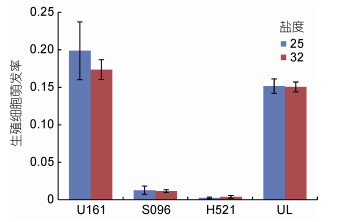 |
| 图 4 盐度对浒苔不同株系与缘管浒苔生殖细胞萌发率的影响 Fig. 4 Effect of salinity on germination rates of different U. prolifera strains and U. linza |
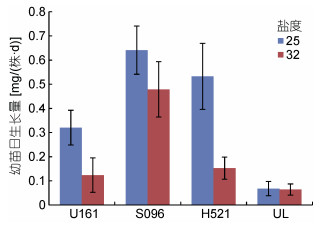 |
| 图 5 盐度对浒苔不同株系与缘管浒苔幼苗日生长量的影响 Fig. 5 Effect of salinity on the daily growth of different U. prolifera strains and U. linza |
对青岛沿海7个站位萌发绿藻的分子鉴定结果表明, 7月份表层沉积物中石莼属绿藻微繁体共包括8个物种:浒苔、缘管浒苔、扁浒苔、曲浒苔、孔石莼、硬石莼、U. sapora和一个U. sp., 具有较高的物种多样性。Liu等(2010)利用分子方法鉴定了青岛沿海冬季水体中绿藻微繁体的物种组成, 共发现其中的6个种, 未发现曲浒苔与浒苔, 说明与其他种类相比, 漂浮生态型浒苔微繁体在青岛沿海水体中存留的时间非常有限。Miao等(2018)利用基于ITS序列的RFLP方法, 分析了7月份青岛沿海水体中绿藻微繁体的物种组成, 共发现其中的5个种, 未检出曲浒苔、硬石莼、U. sapora三个种, 同样发现浒苔占绝对优势。
绿潮暴发期, 漂浮生态型浒苔对青岛沿海施加的繁殖体压力取决于生殖细胞的释放总量及其萌发率。结果表明, 在25的盐度条件下, 自表层沉积物萌发出的漂浮生态型平均占比达到62%, 这与Miao等(2018)针对同期青岛沿海水体样本中漂浮生态型微繁体的调查结果相吻合。值得注意的是, 对于漂浮生态型浒苔生殖细胞, 无论25还是32的盐度条件, 其单藻培养下的萌发率均不足本地近缘种缘管浒苔的1/10, 提示现实环境中其释放总量可能十倍于其他所有物种的总和。由此可以确定, 在绿潮暴发期, 漂浮生态型浒苔对对青岛沿海构成了巨大的繁殖体压力。
对于漂浮生态型浒苔在新栖息地的定居, 微繁体萌发与幼苗生长是两个重要阶段。我们发现, 盐度对这两个阶段均构成重要影响, 但却具有不同的影响方式。首先, 针对微繁体的萌发阶段, 在单藻培养条件下, 盐度对所有材料的萌发率均无影响, 但在多种藻类共存的环境样本中, 盐度则通过种间竞争对萌发率表现出显著的影响, 总体表现为, 青岛的高盐条件更加有利于当地种的胜出, 而苏北海域的低盐条件会显著提高漂浮生态型浒苔的萌发率。其次, 针对幼苗的生长阶段, 盐度可以直接产生影响, 高盐条件会显著降低浒苔所有受试群体幼苗的生长速率, 对缘管浒苔则无显著影响, 在两个近缘种之间具有明显的差异。Shimada等(2008)对整个日本沿海石莼属绿藻的研究也关注到浒苔与缘管浒苔间地理分布的差异, 发现浒苔主要分布在盐度较低的河口, 而缘管浒苔生活在盐度较高的沿海区域, 认为浒苔的物种形成是对低盐适应性进化的结果。Ogawa等(2013)进一步考察了不同盐度梯度对石莼属绿藻分布与季节变化规律的影响, 同样发现浒苔主要分布在低盐海区, 并且不同地理居群对盐度的适应范围不同。受长江冲淡水的影响, 江苏海域盐度较山东海域偏低, 这与浒苔和缘管浒苔分别在江苏与青岛沿海优势分布的调查结果相符(丁兰平等, 2009; 杨震等, 2009)。上述研究均未涉及盐度影响分布的方式与机制, 本文的发现可为相关深入研究提供线索。
同时, 本研究还发现, 种间竞争的作用也不容忽视。在单藻种培养条件下, 盐度对漂浮生态型浒苔的萌发率没有显著影响, 但在有本地种存在的环境样本中, 其萌发率在高盐度下显著降低。对外来生物入侵过程的研究表明, 外来生物在到达地定居是一个复杂的生态过程, 是外来生物与到达地资源环境、生物群落相互作用的结果(Mack et al, 2000; Dunstan et al, 2007)。即使到达地的温度、盐度等环境参数在外来生物的生理适应范围内, 依然不一定能形成定居种群。能否定居还与到达地的特征密切相关, 其中本地生物群落结构被认为是关键因素之一(Deysher et al, 1981)。对入侵性海藻物种裙带菜(Undaria pinnatifida)定居建群过程的研究表明, 到达地固有的稳定海藻群落可以有效阻止裙带菜孢子的萌发生长(Edgar et al, 2004)。这提示青岛沿海本地石莼属绿藻的生物群落可能也是限制漂浮生态型浒苔定居的重要因素。较高的盐度更有利于本地种, 推测其与种间竞争的协同作用阻碍了漂浮生态型浒苔的定居建群。
4 结论综上所述, 在绿潮暴发季, 漂浮生态型浒苔在青岛沿海释放了大量的微繁体, 构成了严重的繁殖体压力。相对较高的盐度环境与种间竞争的协同作用以及繁殖体较低的萌发率可能是限制漂浮生态型浒苔在青岛沿海定居的重要因素。由于外来物种定居的过程受到外来生物自身特点以及接受地环境条件等多方面因素的综合影响, 漂浮生态型浒苔的定居可能还受到其它因素的调控, 有待进一步研究。
| 丁兰平, 栾日孝, 2009. 浒苔(Enteromorpha prolifera)的分类鉴定、生境习性及分布. 海洋与湖沼, 40(1): 68–71 DOI:10.3321/j.issn:0029-814X.2009.01.011 |
| 杨震, 王悠, 董开升, 等, 2009. 青岛潮间带大型底栖海藻群落的研究. 中国海洋大学学报, 39(4): 647–651 |
| 梁成伟, 张晓雯, 宿烽, 等, 2010. 绿潮爆发后青岛海域石莼属绿藻的多样性分析. 海洋通报, 29(5): 540–545 DOI:10.3969/j.issn.1001-6392.2010.05.011 |
| Deysher L, Norton T A, 1981. Dispersal and colonization in Sargassum muticum (Yendo) fensholt. Journal of Experimental Marine Biology and Ecology, 56(2-3): 179–195 DOI:10.1016/0022-0981(81)90188-X |
| Dunstan P K, Johnson C R, 2007. Mechanisms of invasions:can the recipient community influence invasion rates?. Botanica Marina, 50(5-6): 361–372 |
| Edgar G J, Barrett N S, Morton A J, et al, 2004. Effects of algal canopy clearance on plant, fish and macroinvertebrate communities on eastern Tasmanian reefs. Journal of Experimental Marine Biology and Ecology, 312(1): 67–87 DOI:10.1016/j.jembe.2004.06.005 |
| Gao S, Chen X Y, Yi Q Q, et al, 2010. A strategy for the proliferation of Ulva prolifera, main causative species of green tides, with formation of sporangia by fragmentation. PLoS One, 5(1): e8571 DOI:10.1371/journal.pone.0008571 |
| Hiraoka M, Dan A, Shimada S, et al, 2003. Different life histories of Enteromorpha prolifera (Ulvales, Chlorophyta) from four rivers on Shikoku Island, Japan. Phycologia, 42(3): 275–284 DOI:10.2216/i0031-8884-42-3-275.1 |
| Huo Y Z, Hua L, Wu H L, et al, 2014. Abundance and distribution of Ulva microscopic propagules associated with a green tide in the southern coast of the Yellow Sea. Harmful Algae, 39: 357–364 DOI:10.1016/j.hal.2014.09.008 |
| Huo Y Z, Zhang J H, Chen L P, et al, 2013. Green algae blooms caused by Ulva prolifera in the southern Yellow Sea:Identification of the original bloom location and evaluation of biological processes occurring during the early northward floating period. Limnology and Oceanography, 58(6): 2206–2218 DOI:10.4319/lo.2013.58.6.2206 |
| Jiang P, Wang J F, Cui Y L, et al, 2008. Molecular phylogenetic analysis of attached Ulvaceae species and free-floating Enteromorpha from Qingdao coasts in 2007. Chinese Journal of Oceanology and Limnology, 26(3): 276–279 DOI:10.1007/s00343-008-0276-0 |
| Keesing J K, Liu D Y, Fearns P, et al, 2011. Inter-and intra-annual patterns of Ulva prolifera green tides in the Yellow Sea during 2007-2009, their origin and relationship to the expansion of coastal seaweed aquaculture in China. Marine Pollution Bulletin, 62(6): 1169–1182 DOI:10.1016/j.marpolbul.2011.03.040 |
| Larkin M A, Blackshields G, Brown N P, et al, 2007. Clustal W and Clustal X version 2.0. Bioinformatics, 23(21): 2947–2948 DOI:10.1093/bioinformatics/btm404 |
| Leskinen E, Pamilo P, 1997. Evolution of the ITS sequences of ribosomal DNA in Enteromorpha (Chlorophyceae). Hereditas, 126(1): 17–23 |
| Liu D Y, Keesing J K, He P M, et al, 2013a. The world's largest macroalgal bloom in the Yellow Sea, China:formation and implications. Estuarine, Coastal and Shelf Science, 129: 2–10 DOI:10.1016/j.ecss.2013.05.021 |
| Liu F, Pang S J, Chopin T, et al, 2010. The dominant Ulva strain of the 2008 green algal bloom in the Yellow Sea was not detected in the coastal waters of Qingdao in the following winter. Journal of Applied Phycology, 22(5): 531–540 DOI:10.1007/s10811-009-9489-7 |
| Liu F, Pang S J, Chopin T, et al, 2013b. Understanding the recurrent large-scale green tide in the Yellow Sea:Temporal and spatial correlations between multiple geographical, aquacultural and biological factors. Marine Environmental Research, 83: 38–47 DOI:10.1016/j.marenvres.2012.10.007 |
| Liu F, Pang S J, Zhao X B, et al, 2012. Quantitative, molecular and growth analyses of Ulva microscopic propagules in the coastal sediment of Jiangsu province where green tides initially occurred. Marine Environmental Research, 74: 56–63 DOI:10.1016/j.marenvres.2011.12.004 |
| Mack R N, Simberloff D, Lonsdale W M, et al, 2000. Biotic invasions:causes, epidemiology, global consequences, and control. Ecological Applications, 10(3): 689–710 DOI:10.1890/1051-0761(2000)010[0689:BICEGC]2.0.CO;2 |
| Mantri V A, Singh R P, Bijo A J, et al, 2011. Differential response of varying salinity and temperature on zoospore induction, regeneration and daily growth rate in Ulva fasciata (Chlorophyta, Ulvales). Journal of Applied Phycology, 23(2): 243–250 DOI:10.1007/s10811-010-9544-4 |
| Marcelino V R, Verbruggen H, 2015. Ecological niche models of invasive seaweeds. Journal of Phycology, 51(4): 606–620 DOI:10.1111/jpy.12322 |
| Miao X X, Xiao J, Pang M, et al, 2018. Effect of the large-scale green tide on the species succession of green macroalgal micro-propagules in the coastal waters of Qingdao, China. Marine Pollution Bulletin, 126: 549–556 DOI:10.1016/j.marpolbul.2017.09.060 |
| Ogawa T, Ohki K, Kamiya M, 2013. Differences of spatial distribution and seasonal succession among Ulva species (Ulvophyceae) across salinity gradients. Phycologia, 52(6): 637–651 DOI:10.2216/13-199.1 |
| Scherner F, Ventura R, Barufi J B, et al, 2013. Salinity critical threshold values for photosynthesis of two cosmopolitan seaweed species:providing baselines for potential shifts on seaweed assemblages. Marine Environmental Research, 91: 14–25 DOI:10.1016/j.marenvres.2012.05.007 |
| Shea R, Chopin T, 2007. Effects of germanium dioxide, an inhibitor of diatom growth, on the microscopic laboratory cultivation stage of the kelp, Laminaria saccharina. Journal of Applied Phycology, 19(1): 27–32 DOI:10.1007/s10811-006-9107-x |
| Shimada S, Yokoyama N, Arai S, et al, 2008. Phylogeography of the genus Ulva (Ulvophyceae, Chlorophyta), with special reference to the Japanese freshwater and brackish taxa. Journal of Applied Phycology, 20(5): 979–989 DOI:10.1007/s10811-007-9296-y |
| Tamura K, Dudley J, Nei M, et al, 2007. MEGA4:molecular evolutionary genetics analysis (MEGA) software version 4.0. Molecular Biology and Evolution, 24(8): 1596–1599 DOI:10.1093/molbev/msm092 |
| Tseng C K, 1983. Common Seaweeds of China. Beijing: Science Press, |
| Zhao J, Jiang P, Liu Z Y, et al, 2011. Genetic variation of Ulva (Enteromorpha) prolifera (Ulvales, Chlorophyta)-the causative species of the green tides in the Yellow Sea, China. Journal of Applied Phycology, 23(2): 227–233 DOI:10.1007/s10811-010-9563-1 |
| Zhao J, Jiang P, Liu Z Y, et al, 2013. The Yellow Sea green tides were dominated by one species, Ulva (Enteromorpha)prolifera, from 2007 to 2011. Chinese Science Bulletin, 58(19): 2298–2302 DOI:10.1007/s11434-012-5441-3 |
| Zhao J, Jiang P, Qin S, et al, 2015. Genetic analyses of floating Ulva prolifera in the Yellow Sea suggest a unique ecotype. Estuarine, Coastal and Shelf Science, 163: 96–102 DOI:10.1016/j.ecss.2015.05.027 |
| Zhao J, Jiang P, Qiu R, et al, 2018. The Yellow Sea green tide:A risk of macroalgae invasion. Harmful Algae, 77: 11–17 DOI:10.1016/j.hal.2018.05.007 |
 2018, Vol. 49
2018, Vol. 49


