
中国海洋湖沼学会主办。
文章信息
- 郑阵兵, 高山, 王广策. 2018.
- ZHENG Zhen-Bing, GAO Shan, WANG Guang-Ce. 2018.
- 2017年绿潮浒苔(Ulva prolifera)生理特征及孢子囊形成情况分析
- PHYSIOLOGICAL CHARACTERISTICS AND SPORANGIUM FORMATION OF GREEN-TIDE SPECIES ULVA PROLIFERA IN 2017
- 海洋与湖沼, 49(5): 999-1005
- Oceanologia et Limnologia Sinica, 49(5): 999-1005.
- http://dx.doi.org/10.11693/hyhz20180200029
-
文章历史
- 收稿日期:2018-02-05
- 收修改稿日期:2018-03-19
2. 青岛海洋科学与技术国家实验室海洋生物学与生物技术功能实验室 青岛 266235;
3. 中国科学院大学 北京 100049;
4. 中国科学院海洋大科学研究中心 青岛 266071
2. Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266235, China;
3. College of Earth Sciences, University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
近几年来, 黄海海域持续暴发的绿潮对我国近海生态平衡造成了严重的破坏。对近海城市尤其是青岛的旅游业以及水产养殖业等造成了巨大的经济损失。其中2008年暴发的绿潮被认为是世界范围内有记录的最大规模绿潮(Hu et al, 2010), 严重影响了奥运会帆船比赛的顺利进行(Sun et al, 2008, Gao et al, 2011)。浒苔(Ulva prolifera)作为绿潮的主要成因种受到了越来越高的重视。
浒苔能适应广泛的环境条件, 在受到高光、高盐和干出胁迫时仍能维持一定的生理活性(Gao et al, 2011, 2012, 2013; Huan et al, 2014)。浒苔通过形成特殊的类囊体膜蛋白复合体以及促进磷酸戊糖途径等多种方式来应对多种环境因子的胁迫(Huan et al, 2014; Gao et al, 2015)。在绿潮暴发期间浒苔生物量巨大并且生长迅速, 在环境条件合适的广阔海域能快速成为优势种。有报道称, 浒苔藻体在野外的平均日生长速率能达到23.2%—23.6%, 甚至最高可达56.2% (Zhang et al, 2013)。这与浒苔暴发海域营养盐组成、溶解氧以及温度等多种因素密切相关(夏斌等, 2009)。此外, 浒苔的生物量多少以及生长速率快慢与藻体生理特征直接相关。最近的研究表明, 苏北浅滩的紫菜养殖区是黄海绿潮暴发的物种来源地。紫菜养殖筏架脱落的绿藻随海流进入外海, 其中浒苔在适宜的环境条件下迅速繁殖生长, 成为优势种(刘材材等, 2017)。良好的生理状态是其快速增殖的前提。通过研究绿潮暴发期间浒苔在不同海域的生理状态可以有效地了解其暴发过程和暴发机理。那么不同海域浒苔的生理活性如何呢?关于这方面的研究鲜有报道。已有研究针对青岛海域浒苔藻体最大光化学量子产量(Fv/Fm)进行了定点测定(曹佳春等, 2013)。但并没有研究对浒苔暴发海域大范围内生理活性进行分析。我们首次跟随科考船进行走航测定, 覆盖面积广, 样品丰富, 便于对绿潮暴发期间浒苔生理活性进行整体了解。此外, 浒苔有多种增殖方式(Lin et al, 2008), 其生活史为同型世代交替。孢子生殖是浒苔快速繁殖的主要生殖方式(王广策等, 2016)。研究发现, 高光、高盐等非生物因子胁迫能促使浒苔孢子囊的形成(王建伟等, 2007), 形成的孢子能够在原有的浒苔藻体上原位萌发形成新的藻体(Gao et al, 2010; Smetacek et al, 2013)。此外, 研究报道称浒苔孢子囊的形成和浒苔光合生理状态密切相关(Gao et al, 2010)。绿潮暴发期间, 浒苔能通过形成孢子囊产生孢子快速积累生物量。那么, 浒苔从紫菜筏架脱落过程中以及在广阔海域的不同区域孢子囊形成情况如何?这方面的研究也鲜有报道。
本文研究了黄海海域浒苔暴发期间多个海区的藻体生理特征以及孢子囊形成情况, 并在浒苔来源区进行了浒苔定点生理状态测定和孢子囊统计分析。以期为绿潮暴发机制研究提供理论指导。
1 材料与方法 1.1 野外实验的站位确定及浒苔样品采集 1.1.1 苏北浅滩紫菜养殖区的定点采集2017年5月中旬, 随科考船在苏北浅滩紫菜养殖区域(33.78°N, 121.29°E)对筏架绠绳上生长的绿藻, 退潮后滩涂散落的绿藻和涨潮时海面上漂浮的绿藻进行为期5天的野外采集。绿藻采集后用干净海水清洗干净。根据藻体形态特征, 仔细挑选出浒苔藻体。
1.1.2 浒苔暴发海域的藻体采集2017年6月8—24日随科考船对浒苔暴发海域的浒苔样本进行采集。采集范围在(33.5°—36.5°N, 120°—124°E)。在该海域范围内每半个经度设定一个断面, 每个断面设定一定数量的站位。对该海域不同经度断面浒苔暴发区进行绿藻藻体采集并用海水清洗干净, 根据藻体形态特征, 仔细挑选出浒苔藻体。本航次为方便浒苔观察, 航次任务均在变天进行。不同站位的藻体采集时间虽有不同, 但所有藻体在测定之前均会在干实验室里黑暗适应10min, 尽量保持藻体测定前环境条件相似。有浒苔采集的断面、站位名称和与其对应的经纬度信息如图 1所示。
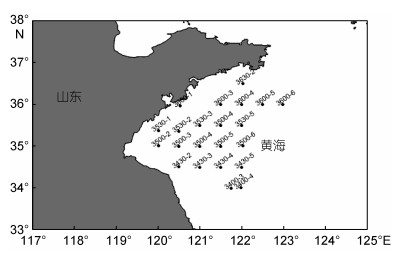 |
| 图 1 浒苔采集站位图 Fig. 1 Map of sample collecting stations |
不同位置采集的浒苔藻体经清洗, 挑选和实验室适应后放于黑暗处10min。对黑暗适应后的浒苔藻体用调制叶绿素荧光仪(Diving-PAM. Walz, 德国)测定其光合生理特征。光合作用是植物生理性状的一个重要指标, 同时也是植物在遭受逆境时最为敏感和反映最为直接的方面(Davison et al, 1996)。本实验测定的生理活性参数包括Fv/Fm, 以及PSII的有效光合量子产量(YⅡ)。其中Fv/Fm代表潜在的最大光化学量子产量, 反映PSⅡ最大的光能转化效率。在正常条件下该参数变化很小, 但在胁迫条件下变化较大。因此它也是反映植物生长环境良好与否的一个非常重要的参数。YⅡ代表植物体光系统Ⅱ实时的光化学量子产量。是反映植物体实际光合作用活性的重要指标。两组参数被广泛用来反映植物光合生理状态。每组实验设计三个生物学重复。
1.3 孢子囊形成及孢子放散的显微镜观察为了研究不同海域浒苔孢子囊形成情况, 作者使用光学显微镜观察了不同采样点浒苔的孢子囊形成、成熟以及孢子释放情况。本次实验为了观察浒苔孢子囊形成过程, 选取了生长状态良好的浒苔藻体进行10天的连续培养和显微镜观察。
2 实验结果 2.1 浒苔暴发海域藻体生理特征测定在研究海域范围内, 共在6个断面上采集到了浒苔。其中, 在3400断面和3630断面上的浒苔生物量较少, 分别只有2个和1个站位有浒苔分布。在3430断面上浒苔分布面积较广, 共在4个站位采集到浒苔。浒苔暴发面积最大的海域出现在3500和3530断面, 有5个站位发现浒苔。对采集的浒苔进行了原位生理状态测定。图 2a—f和图 3a—e列出了6个断面, 共22个站位分布的浒苔生理活性参数Fv/Fm和YⅡ的变化情况。整体而言, 不同断面上浒苔的生理活性差异显著。断面3400、3430和3500分布的浒苔Fv/Fm值显著高于断面3530、3600和3630上的浒苔。在3400-2站位甚至达到0.65左右。断面3430上除3400-3站位外, 浒苔Fv/Fm也在0.4—0.55之间。断面3500上, 浒苔Fv/Fm略有降低(0.35—0.55左右)。表明在所研究海域34°N到35°N之间的浒苔生理活性良好。然而, 相比较而言在断面3530, 3600和3630上, 浒苔的Fv/Fm值显著下降。此三个断面上, 多数站位浒苔Fv/Fm值都在0.3—0.4左右, 甚至在3600-3站位低至0.2左右。表明在所研究海域35.5°N到36.5°N之间的浒苔生理活性低, 状态不良。
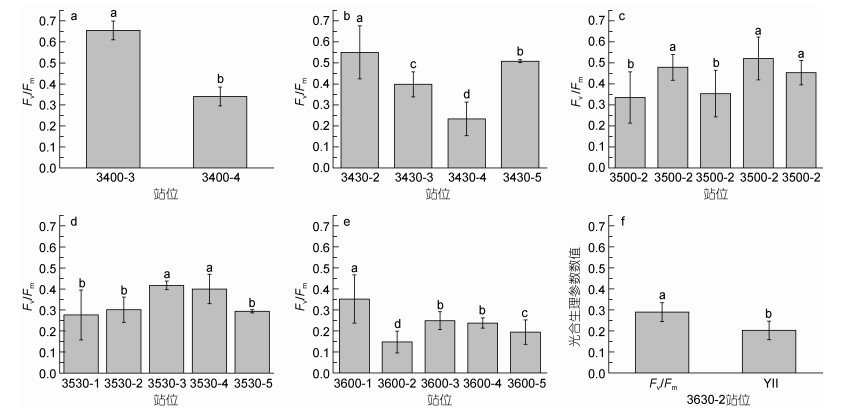 |
| 图 2 不同断面上浒苔Fv/Fm值和YⅡ值 Fig. 2 Fv/Fm and YⅡ values of U. prolifera in different sections 注: a: 3400断面; b: 3430断面; c: 3500断面; d: 3530断面; e: 3600断面; f: 3630断面3630-2站位的Fv/Fm和YⅡ值 |
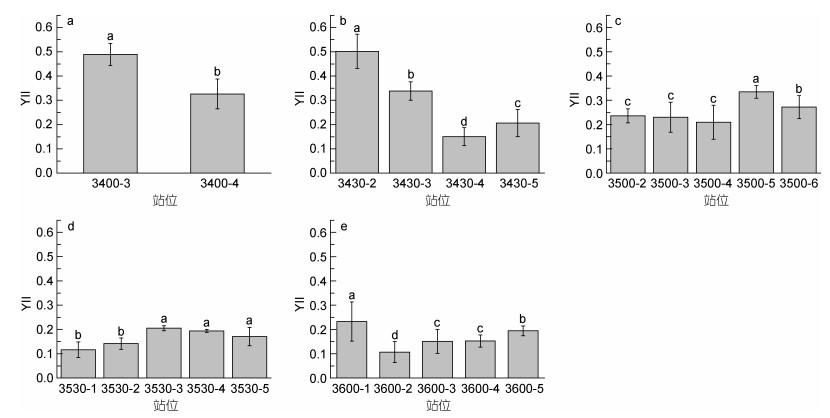 |
| 图 3 不同断面上浒苔YⅡ值 Fig. 3 YⅡ values of U. prolifera in different sections 注: a: 3400断面; b: 3430断面; c: 3500断面; d: 3530断面; e: 3600断面 |
生理活性参数YⅡ反映了光合生物实时的生理状态。图 3中的YⅡ变化情况表明, 在断面3400以及3430的近岸两个站位(3430-2和3430-3), 浒苔YⅡ较高(0.35—0.5左右)然而在断面3500、3530、3600以及3630, 包括断面3430部分远岸站位(3430-4和3430-5)上浒苔YⅡ值显著降低(0.1—0.3左右)。表明断面之间浒苔的实时生理活性差异显著。整体趋势与Fv/Fm趋势类似。
此外, 在同一断面上, 不同站位代表了不同的经度。图 2中在同一断面上, 不同站位的Fv/Fm值差异显著, 尤其在3400和3430断面更为明显。图 3中YⅡ的值在不同站位之间也有明显差异。断面3400, 3430, 3500和3600上, 站位之间的浒苔YⅡ值都有显著变化。这表明, 即使是在同一纬度, 在距离海岸不同距离的海域浒苔的光合生理状态差异明显。
2.2 苏北浅滩浒苔生理活性测定在我国苏北浅滩紫菜养殖海域浒苔主要以三种方式存在:附着生长在紫菜养殖筏架的绠绳上的浒苔, 由于自然或者人为因素使其脱落并在退潮时遗落在浅滩上的浒苔和涨潮时从浅滩上漂浮起来的浒苔并对这三种浒苔生理状态进行了原位测定。图 4a和b分别表示三种方式采集的浒苔Fv/Fm和YⅡ值。可以看出, Fv/Fm值都在0.6—0.8左右, YⅡ的值都在0.5—0.6左右。两个参数的值均明显高于漂浮浒苔。表明, 苏北浅滩的浒苔在进入外海和向北漂移之前的生理状态明显好于暴发海域的浒苔。此外, 漂浮浒苔Fv/Fm值明显比定生在绠绳上的浒苔低。以上结果表明浒苔从绠绳上脱落后进入外海, 长时间受到高光和高盐的胁迫, 导致其生理活性受到较大影响。
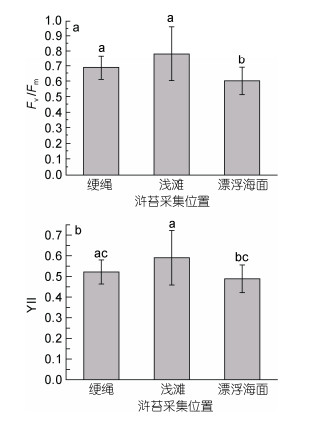 |
| 图 4 苏北紫菜养殖区三种存在方式的浒苔生理参数比较 Fig. 4 The photosynthetic parameters of U. prolifera in Porphyra yezoensis culture area in the north shoal area of Jiangsu Province 注: a; Fv/Fm值; b: YⅡ值 |
通过浒苔藻体的连续培养和显微观察发现在浒苔暴发海域, 浒苔孢子囊能快速形成和成熟(图 5a, b)。在培养了10天后发现大部分浒苔孢子囊已经释放孢子(图 5c)。由此可见, 浒苔在暴发期间孢子囊形成迅速, 孢子释放快。这为浒苔生物量的快速积累提供了可能。
 |
| 图 5 浒苔暴发海域藻体孢子囊形成 Fig. 5 The formation of sporangium of Ulva prolifera in the green-tide outbreak area. 注: a:新鲜采集的浒苔, 设定为观察第0天。b:连续培养4天后的浒苔的显微观察。c:培养10天后的浒苔显微观察。图中刻度尺为5μm |
通过对漂浮浒苔孢子囊形成的观察发现, 在浒苔暴发的海域部分成熟的孢子囊释放的孢子在原来的藻体上直接萌发, 形成了新的藻体(图 6)。原位萌发与正常状态下孢子囊释放的孢子萌发不同, 释放的孢子直接在原来藻体上萌发, 这加快了浒苔繁殖的速率。
 |
| 图 6 漂浮浒苔的原位萌发 Fig. 6 The in-situ generation of the spores of floating U. prolifera |
本次实验重点对绠绳上生长的浒苔和海面上的漂浮浒苔进行了孢子囊统计分析。分别对绠绳上和漂浮的浒苔进行了随机取样。对采集的浒苔进行了孢子囊显微观察并进行了统计分析。研究发现, 漂浮浒苔的孢子囊形成比例远高于绠绳上生长的浒苔。绠绳上的浒苔约有5%的浒苔形成了孢子囊, 然而海面上漂浮的浒苔约有20%形成了孢子囊。
3 讨论 3.1 绿潮暴发期间不同海域浒苔的生理状态显著不同绿潮暴发期间, 浒苔生长迅速, 能在较短时间内大量积累生物量。浒苔的增殖, 生长以及死亡伴随着绿潮暴发的整个过程。现已报道苏北浅滩的紫菜养殖区是浒苔的来源。浒苔从紫菜筏架和网帘上脱落后随海流进入外海, 并逐渐向北漂移。漂移过程中浒苔在适宜的环境条件下迅速增殖并最终形成绿潮, 影响青岛海岸。通过叶绿素荧光测定来反映大型海藻生理活性的方法方便而快速, 并且得到了广泛应用(Figueroa et al, 2003, Schreiber, 2004, Prasil et al, 2008)。本研究中使用调制叶绿素荧光测定仪测定浒苔生理状态。发现不同海域, 包括不同经度及不同纬度上浒苔的生理状态显著不同(图 2, 图 3, 图 4)。总体规律为暴发海域低纬度浒苔生理活性较高, 高纬度位置浒苔活性较低; 在经度上, 外海浒苔生理活性较低, 近海浒苔活性较高。本文认为, 一方面, 浒苔从紫菜筏架和绠绳脱落后其生活环境由近海逐渐变为外海, 包括海水中营养盐组成和含量在内的多种非生物因子变化巨大; 另一方面, 浒苔由附着生长变为漂浮生长, 其生活方式发生了改变。在这两种因素共同作用下浒苔生理活性有所下降(图 4)。从紫菜养殖海域进入外海的浒苔虽然生理活性有所下降, 但是仍然保持较好的生理状态。较高的光合生理活性不仅为浒苔孢子囊的形成提供了能量来源, 更在孢子囊的形成以及孢子的释放方面起重要的调控作用(Rochaix, 2011)。在此期间, 浒苔迅速增殖并大量积累生物量(图 8)。
 |
| 图 8 绿潮暴发期间34°N, 121°E海域的浒苔分布 Fig. 8 Distribution of U. prolifera in the area of 34°N/121°E during a green-tide outbreak |
随着浒苔逐渐向北漂移, 到3530和3600断面浒苔的生理活性不断下降(图 2, 图 3)。虽然其生理活性低, 但由于前期大量积累的浒苔生物量仍然在青岛海岸大量堆积, 影响青岛海岸。
3.2 漂浮浒苔的孢子囊比例显著高于定生浒苔浒苔有多种生殖方式, 孢子生殖是其重要的增殖方式。浒苔孢子囊的形成受到多种因素的共同调控。Hui等(2016)报道了浒苔孢子囊形成的过程及光合生理特征对孢子囊形成和孢子释放的影响。在绿潮暴发期间, 浒苔通过孢子生殖快速生长, 生物量快速增加。孢子囊的形成以及孢子的释放是浒苔得以快速积累的直接原因。在紫菜筏架和绠绳上定生的浒苔生理状态良好, 但是孢子囊形成比例较低(图 7)。正常环境条件下, 定生浒苔不易引起绿潮等生态灾害。一旦浒苔漂浮进入外海, 在适宜的环境条件下浒苔孢子囊快速形成, 成熟并释放孢子(图 5), 释放的孢子又快速形成新的藻体。这与之前的研究报道(梁宗英等, 2008, 范士亮等, 2012, Zhang et al, 2013)结果相符。良好的营养条件以及适合的光强和温度都能促进浒苔的快速繁殖(Schramm, 1999, Nelson et al, 2008), 此外浒苔由定生到漂浮状态后, 会长时间受到高光、高盐胁迫。浒苔在这些胁迫下会快速形成大量的孢子囊, 并且能快速成熟, 释放孢子。此外, 由于我们样品采集时间不同, 我们不得不考虑在这段时间内, 海水温度的改变以及光照强度的变化都可能是浒苔生理状态变化及孢子囊形成的重要原因。释放到海水中的孢子一方面由于环境条件适宜, 能快速萌发形成新藻体。另一方面, 浒苔的原位萌发对生物量的大量快速积累有重要贡献。释放的孢子没有随海流漂走而是在原来的藻体上直接萌发, 这在一定程度上缩短了浒苔孢子萌发的时间。并且, 萌发的新藻体和原始藻体会连在一起, 形成大的绿潮斑块。浒苔在不同海域生理活性及孢子囊形成比例不同是多方面因素共同引起的。经纬度的不同背后是理化因素的不同, 包括温度, 光照, 营养盐及溶解氧在内的多种理化因子的改变是导致浒苔快速增殖并至暴发的关键环境因子。作者认为这是一个多因素共同作用的结果。本研究只是从表观生理参数测定方面做了部分工作, 并提出藻体良好的生理状态和孢子囊的快速形成以及孢子的大量释放在绿潮暴发过程中起到了至关重要的作用, 但导致其生理活性变化及孢子囊形成的具体因子还有待于更多的研究。
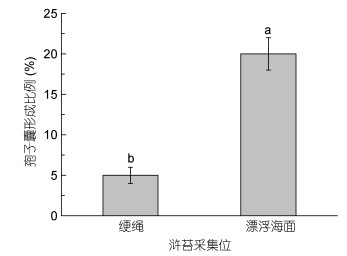 |
| 图 7 苏北浅滩海面漂浮浒苔和绠绳上附着生长的浒苔孢子囊形成比例统计 Fig. 7 Comparison in sporangium formation of U. prolifera attached to P. yezoensis culture raft and floating thalli |
绿潮暴发期间, 浒苔在暴发海域光合生理状态差异明显。总体而言, 在绿潮暴发海域靠近浒苔来源地生理状态良好, 但孢子囊形成比例较低。随着浒苔往北漂移其生理活性逐渐下降, 但孢子囊形成比例升高。本文推测, 较高的藻体生理活性和较高的孢子囊形成比例以及浒苔的原位萌发对漂浮浒苔生物量的快速积累有重要贡献。
| 王广策, 唐学玺, 何培民, 等, 2016. 浒苔光合作用等关键生理过程对环境因子响应途径的研究进展. 植物生理学报, 52(11): 1627–1636 |
| 王建伟, 阎斌伦, 林阿朋, 等, 2007. 浒苔(Enteromorpha prolifera)生长及孢子释放的生态因子研究. 海洋通报, 26(2): 60–65 DOI:10.3969/j.issn.1001-6392.2007.02.009 |
| 刘材材, 徐韧, 何培民, 等, 2017. 南黄海绿潮暴发与紫菜养殖的关系. 海洋科学, 41(2): 35–43 |
| 范士亮, 傅明珠, 李艳, 等, 2012. 2009-2010年黄海绿潮起源与发生过程调查研究. 海洋学报, 34(6): 187–194 |
| 夏斌, 马绍赛, 崔毅, 等, 2009. 黄海绿潮(浒苔)暴发区温盐、溶解氧和营养盐的分布特征及其与绿潮发生的关系. 渔业科学进展, 30(5): 94–101 DOI:10.3969/j.issn.1000-7075.2009.05.016 |
| 曹佳春, 吴青, 张建恒, 等, 2013. 青岛海域漂浮浒苔光合生理特性及藻体状态等级评价研究. 上海海洋大学学报, 22(6): 922–927 |
| 梁宗英, 林祥志, 马牧, 等, 2008. 浒苔漂流聚集绿潮现象的初步分析. 中国海洋大学学报(自然科学版), 38(4): 601–604 |
| Davison I R, Pearson G A, 1996. Stress tolerance in intertidal seaweeds. Journal of Phycology, 32(2): 197–211 DOI:10.1111/j.0022-3646.1996.00197.x |
| Figueroa F L, Conde-Álvarez R, Gómez I, 2003. Relations between electron transport rates determined by pulse amplitude modulated chlorophyll fluorescence and oxygen evolution in macroalgae under different light conditions. Photosynthesis Research, 75(3): 259–275 DOI:10.1023/A:1023936313544 |
| Gao S, Chen X Y, Yi Q Q, et al, 2010. A strategy for the proliferation of Ulva prolifera, main causative species of green tides, with formation of sporangia by fragmentation. PLoS One, 5(1): e8571 DOI:10.1371/journal.pone.0008571 |
| Gao S, Gu W H, Xiong Q, et al, 2015. Desiccation enhances phosphorylation of PSⅡ and affects the distribution of protein complexes in the thylakoid membrane. Physiologia Plantarum, 153(3): 492–502 DOI:10.1111/ppl.2015.153.issue-3 |
| Gao S, Niu J F, Chen W Z, et al, 2013. The physiological links of the increased photosystem Ⅱ activity in moderately desiccated Porphyra haitanensis (Bangiales, Rhodophyta) to the cyclic electron flow during desiccation and re-hydration. Photosynthesis Research, 116(1): 45–54 DOI:10.1007/s11120-013-9892-4 |
| Gao S, Shen S D, Wang G C, et al, 2011. PSI-driven cyclic electron flow allows intertidal macro-algae Ulva sp. (Chlorophyta) to survive in desiccated conditions. Plant and Cell Physiology, 52(5): 885–893 DOI:10.1093/pcp/pcr038 |
| Gao S, Wang G C, 2012. The enhancement of cyclic electron flow around photosystem Ⅰ improves the recovery of severely desiccated Porphyra yezoensis (Bangiales, Rhodophyta). Journal of Experimental Botany, 63(12): 4349–4358 DOI:10.1093/jxb/ers082 |
| Hu C M, Li D Q, Chen C S, et al, 2010. On the recurrent Ulva prolifera blooms in the Yellow Sea and East China Sea. Journal of Geophysical Research:Oceans, 115(C5): C05017 |
| Huan L, Xie X J, Zheng Z B, et al, 2014. Positive correlation between PSI response and oxidative pentose phosphate pathway activity during salt stress in an intertidal Macroalga. Plant and Cell Physiology, 55(8): 1395–1403 DOI:10.1093/pcp/pcu063 |
| Hui W, Lin A P, Gu W H, et al, 2016. The sporulation of the green alga Ulva prolifera is controlled by changes in photosynthetic electron transport chain. Scientific Reports, 6: 24923 DOI:10.1038/srep24923 |
| Lin A P, Shen S D, Wang J W, et al, 2008. Reproduction diversity of Enteromorpha prolifera. Journal of Integrative Plant Biology, 50(5): 622–629 DOI:10.1111/jipb.2008.50.issue-5 |
| Nelson T A, Haberlin K, Nelson A V, et al, 2008. Ecological and physiological controls of species composition in green macroalgal blooms. Ecology, 89(5): 1287–1298 DOI:10.1890/07-0494.1 |
| Prasil O, Suggett D J, Cullen J J, et al, 2008. Aquafluo 2007:chlorophyll fluorescence in aquatic sciences, an international conference held in Nové Hrady. Photosynthesis Research, 95(1): 111–115 |
| Rochaix J D, 2011. Reprint of:Regulation of photosynthetic electron transport. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 1807(8): 878–886 DOI:10.1016/j.bbabio.2011.05.009 |
| Schramm W, 1999. Factors influencing seaweed responses to eutrophication:some results from EU-project EUMAC. Journal of Applied Phycology, 11(1): 69–78 DOI:10.1023/A:1008076026792 |
| Schreiber U, 2004. Pulse-amplitude-modulation (PAM) fluorometry and saturation pulse method: An overview. In: Papageorgiou G C, Govindjee eds. Chlorophyll a Fluorescence. Netherlands: Springer, 279-319 |
| Smetacek V, Zingone A, 2013. Green and golden seaweed tides on the rise. Nature, 504(7478): 84–88 DOI:10.1038/nature12860 |
| Sun S, Wang F, Li C L, et al, 2008. Emerging challenges:Massive green algae blooms in the Yellow Sea. Nature Proceedings, 2266: 1–5 |
| Zhang J H, Huo Y Z, Yu K F, et al, 2013. Growth characteristics and reproductive capability of green tide algae in Rudong coast, China. Journal of Applied Phycology, 25(3): 795–803 DOI:10.1007/s10811-012-9972-4 |
 2018, Vol. 49
2018, Vol. 49


