
中国海洋湖沼学会主办。
文章信息
- 耿慧霞, 颜天, 于仁成, 张清春, 孔凡洲, 周名江. 2018.
- GENG Hui-Xia, YAN Tian, YU Ren-Cheng, ZHANG Qing-Chun, KONG Fan-Zhou, ZHOU Ming-Jiang. 2018.
- 浒苔孢子在不同材料基质上的附着萌发差异性研究
- COMPARATIVE STUDY ON GERMINATION OF ULVA PROLIFERA SPORES ON DIFFERENT SUBSTRATES
- 海洋与湖沼, 49(5): 1006-1013
- Oceanologia et Limnologia Sinica, 49(5): 1006-1013.
- http://dx.doi.org/10.11693/hyhz20180400075
-
文章历史
- 收稿日期:2018-04-02
- 收修改稿日期:2018-06-04
2. 青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室 青岛 266237;
3. 中国科学院大学 北京 100049;
4. 中国科学院海洋大科学研究中心 青岛 266071
2. Laboratory for Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
近年来, 全球范围内绿潮(green tide)的发生频率及规模都有增长趋势。自2007年起, 我国黄海海域已经连续10年暴发大规模绿潮, 其原因种为浒苔(Ulva prolifera)。每年5—7月, 浒苔在黄海海域的大规模暴发已成为一类严重的生态灾害, 给山东和江苏沿海地区造成了巨大的经济损失(Zhou et al, 2015)。大量相关研究表明江苏沿岸的紫菜养殖筏架是绿潮浒苔的主要来源(Pang et al, 2010; Liu et al, 2013)。现场调查和实验研究还表明, 苏北浅滩的养殖池、水体和底泥中大量存在的浒苔微观繁殖体可能是绿潮早期发展的“种源”, 为黄海绿潮的暴发提供了重要储备(刘峰等, 2012; Liu et al, 2012)。浒苔微观繁殖体的附着萌发期是其生活史中一个必不可少的阶段, 针对浒苔微观繁殖体附着萌发特性的研究具有重要意义。浒苔微观繁殖体发育成藻体首先要经过附着才能萌发, 附着基质是微观繁殖体生根、繁殖并能够稳定生长的基本条件, 而附着基质的选择是浒苔生活史中非常关键的一步。
微观繁殖体是浒苔的有性生殖和无性生殖生活史过程中非常重要的阶段。大型绿藻的微观繁殖体通常包括微观断枝、孢子、配子和合子这些无细胞壁保护的裸露单细胞以及它们发育的不同微观阶段幼体(Fletcher et al, 1992)。在海水中, 处于显微阶段的这些微观繁殖体可以自由游动或漂浮, 寻找合适的附着基质进行萌发生长。孢子和配子是浒苔两种形态的生殖细胞。孢子通常具有4鞭毛, 配子具有2鞭毛; 孢子个体一般大于配子, 大小分别为(8.65±0.34)和(6.18±0.25)μm (Liu et al, 2015); 浒苔配子还有雌雄之分, 雄配子与雌配子在放散后会通过游动互相选择, 然后接合形成合子, 再进一步发育形成小苗(叶乃好等, 2008), 此外, 配子还能够不发生接合直接固着萌发形成小苗(王晓坤等, 2007)。
现场调查结果表明, 苏北浅滩的紫菜养殖筏架一般由竹竿、梗绳和和养殖网衣组成(图 1)。前期研究发现, 浒苔配子的附着萌发效果以塑料和木片最好, 网衣、塑料绳等附着效果也较好, 而在橡胶材料表面完全没有观察到浒苔配子的萌发(Geng et al, 2015), 吴洪喜等(2000)报道了浒苔微观繁殖体在塑料、木板等材料上附着差异的初步观察结果, 发现浒苔附着基以木板效果最佳, 细砂、海泥、竹片最差, 但并未开展科学定量研究, 也没有区分浒苔孢子和配子。而不同材料附着基对浒苔孢子萌发的影响如何, 孢子与配子的附着萌发特性有何异同点, 目前还没有得到比较明确的认识, 亟待开展相关研究。事实上, 浒苔越冬孢子的环境适应性很强(Schories, 1995), 能够高效适应和忍耐盐度变化和温度变化, 可能成为绿潮暴发的天然“种子”库, 对于黄海绿潮的发生可能具有更加重要的作用。
 |
| 图 1 紫菜养殖筏架的基本结构 Fig. 1 Structure of Pyropia aquaculture rafts 注: a:紫菜养殖筏架; b, e:养殖网衣; c:竹竿; d:梗绳 |
本研究选取浒苔的孢子作为实验材料, 以各种材料的附着基为实验对象开展了一系列实验, 旨在分析其附着和萌发特征, 以期比较不同材料附着基对浒苔孢子附着萌发影响的差异性, 探寻紫菜养殖筏架成为绿潮浒苔来源的原因, 从而有助于更深入地了解浒苔微观繁殖体的附着萌发特性, 希望可以加深对绿潮发生和发展机制的探究, 同时为将来浒苔绿潮的治理和防控提供理论依据。
1 材料与方法 1.1 实验生物 1.1.1 浒苔的采集与鉴定于2011年10月20日从苏北浅滩海域(33.13°N, 121.10°E)采集浒苔(UP-S4), 使用灭菌海水反复冲洗以去除表面附着物, 在实验室内暂养。挑选的浒苔藻株除了进行形态特征鉴定外, 还辅以分子生物学检测(ITS序列和5S rDNA间隔区序列分析), 最终确定其为浒苔(Liu et al, 2015)。首先用肉眼观察藻体的外形特征, 包括藻体颜色、主枝结构、分枝状况等, 并在光学显微镜下观察细胞的形态大小和排列方式、叶绿体和淀粉核形态等, 再结合分子生物学手段, 综合以上信息最终确定为浒苔。
1.1.2 浒苔的培养方法实验室内浒苔的培养介质为f/2培养基(盐度30—33, pH值8.2—8.3), 另外添加1‰的VH (维生素H)和1mg/L SeO2; 温度(20±1)℃、盐度30±1, pH值8.2—8.3, 光强50μmol/(m2·s)(光:暗周期为14L:10D), 待孢子囊和配子囊形成后供实验用。
1.1.3 浒苔孢子和配子的收集与鉴定选取成熟的浒苔藻体, 经过12h、20℃黑暗干出后重新恢复培养, 在装有消毒海水的培养皿中继续培养, 适当地给予强光刺激, 待其释放出孢子或配子后从培养皿中收集其微观繁殖体, 收集后通过趋光性和镜检进行鉴定。实验用浒苔在实验室培养条件下实现了孢子体/配子体世代交替生长。浒苔的世代类型主要是通过释放的生殖细胞类型来判断。若观察到浒苔藻体释放的生殖细胞为孢子, 则认为释放孢子的浒苔藻体为孢子体世代, 同理, 若观察到浒苔藻体释放的生殖细胞为配子, 则认为释放配子的浒苔藻体为配子体世代。浒苔孢子和配子通过形态学观察及趋光性检测来判断, 本研究并未区分雌雄配子。
形态学观察:将刚释放的浒苔生殖细胞在显微镜下(DM 2000, LEICA, 德国)观察大小、形态及鞭毛数。孢子个体大小为8—12μm, 形态呈长椭圆形, 前端透明, 后端为绿色的色素体, 细胞内含有一个蛋白核和一个眼点, 顶生四根鞭毛使其可以快速运动; 配子形态及结构类似于孢子, 但个体稍小, 大小约为6—10μm, 顶生两根鞭毛。
趋光性检测:将刚释放的生殖细胞置于培养皿中, 提供单侧光[约200μmol/(m2·s)]照射, 以判断生殖细胞的趋光性。孢子在趋光性检测中呈现负趋光, 并聚集在未被光照射的培养皿一侧; 配子呈现明显的正趋光, 并聚集在单侧光照射的培养皿一侧(Hiraoka et al, 2010)。
1.2 实验材料实验选用不同材料的附着基, 共包括三类:紫菜养殖筏架相关材料(塑料、竹片、塑料网衣、尼龙网衣)、浅滩和养殖池相关材料(石块、细砂、海泥)以及其他材料(木片、藻段、玻璃、鱼粉袋、橡胶), 大部分材料均为绿潮发生海域常见的材料, 其中玻璃作为对照。
各附着基的规格和尺寸如下:所有片状材料的附着基(塑料、竹片、木片和橡胶)裁剪成直径9cm的圆形, 使其平铺在培养皿的底部; 对于养殖网衣则是以网目长度为1cm, 塑料网衣和尼龙网衣的公称直径约1mm; 其他材料包括细砂、海泥和石块均匀平铺在培养皿的底部, 藻段和鱼粉袋经过处理后用细绳固定在塑料片上置于培养皿底部。
1.3 实验方法 1.3.1 浒苔生殖细胞的附着时限实验选取成熟的浒苔藻体, 经过12h、20℃黑暗干出后重新恢复培养, 在装有消毒海水的培养皿中继续培养, 适当地给予强光刺激, 待其释放出生殖细胞后从培养皿中收集孢子, 计数后稀释到1×105cells/mL, 同时在装有30mL消毒海水的培养皿中分别放入一定面积或长度的塑料、玻璃、木片、竹片、网衣、细砂、石块附着基(各种材料在放进玻璃缸之前都要进行煮沸消毒灭菌, 材料大小要适中), 每组设置3个平行, 在相同的条件下黑暗避光培养, 每隔2h观察并计数培养皿中孢子/配子的密度。当孢子密度较高时, 用血球计数板在10×40倍镜视野下计数, 再通过换算得到孢子的密度; 当孢子密度较低时, 用细胞计数板进行多次计数, 取其平均值, 再进一步推算孢子密度。
附着率计算公式为:
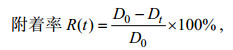
式中, D0为浒苔孢子的起始密度, Dt为孢子在t时刻的密度。
1.3.2 不同材料对浒苔生殖细胞附着萌发影响的对比实验选取成熟的浒苔藻体, 对其进行盐度变化、强光照射等刺激, 使其释放出生殖细胞后从培养皿中收集孢子并进行计数, 同时在装有30mL消毒海水的培养皿中分别放入一定面积或长度的塑料片、玻璃片、木片、竹片、塑料网衣、尼龙网衣、鱼粉袋、细砂、海泥、石块、藻段附着基(各种材料在放进玻璃缸之前都要进行煮沸消毒灭菌, 藻段则是用95%的酒精进行脱色处理), 每组设置3个平行, 然后分别加入一定数量的孢子, 使其密度达到2×104cells/mL, 在相同的条件下黑暗避光培养48h。完成附着后, 在光照条件下继续培养, 分别放入烧杯中(600mL消毒海水)培养, 每隔3天更换新的f/2培养液以保证充分的营养盐。待幼苗长出后(10天左右)在解剖镜下进行计数。此外, 为比较浒苔孢子和配子附着萌发的差异性, 设置两组对照实验, 附着基材料均为玻璃, 培养液分别为鱼粉溶液、橡胶浸泡液和灭菌海水, 实验方法同上。
待幼苗长出后(10天左右)在解剖镜(Nikon SMZ 800)下计数。尽量全部计数, 如果萌发幼苗数较高, 则在解剖镜视野中随机取10个5mm×5mm的视野进行计数并求出平均值。待其小苗长至3—5cm时, 进行生物量和长度的测定。长度的测定为随机抽取50株幼苗测量其长度, 最终以它们的平均值作为幼苗的长度; 生物量的测定是将幼苗全部刮下, 直接称出湿重。对于网衣材料, 进行浒苔幼苗计数时, 将网衣拆开, 逐条计数, 进而推算出附着基上的小苗总数。
1.4 数据统计分析不同附着基上萌发幼苗数的差异性利用统计软件SPSS和Origin进行分析, 多种材料的差异性比较(P<0.01)通过单因素方差分析(ANOVA, analysis of variance)得到, 两种材料的差异性比较通过t-检验得到。通过Shapiro-Wilks方法对数据进行正态性检验, 通过Levene方法对数据进行方差齐性检验。
2 结果与分析 2.1 浒苔孢子的附着时限水体中自由游动的浒苔孢子在释放后前2—4h附着率已达83.5%±4.7%, 在前2h内的附着速率最快, 并且在不同材料的附着基质(包括塑料、玻璃、木片、竹片、细砂、石块和网衣)上都能完成附着(图 2), 浒苔孢子在各附着基上的附着率并没有显著差异。
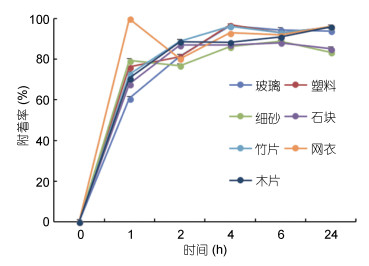 |
| 图 2 浒苔孢子在不同材料上的附着率 Fig. 2 Attachment rate of U. prolifera spores on various substrates |
浒苔孢子在不同材料附着基上的附着率没有显著差异, 但萌发数却存在显著差别, 且在筏架的主要材料塑料上的萌发数显著高于在浅滩和养殖池相关材料(海泥、细砂、石块)上的萌发数(图 3), 在橡胶上没有发现孢子的萌发。从不同材料上单位面积萌发的幼苗数来看:塑料>藻段、玻璃>鱼粉袋>竹片、木片>石块、海泥和细砂>橡胶。
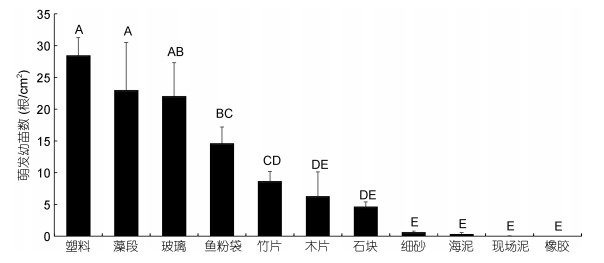 |
| 图 3 浒苔孢子在不同材料上的萌发数 Fig. 3 Comparison in the number of spore germlings on various materials 注:在无菌海水中进行培养, 图中为平均值(n = 3)和标准误差, 不同字母表示存在显著性差异, P<0.01 |
同时, 萌发数较高的材料上萌发的浒苔幼苗的生物量也相对高(图 4)。其中, 浒苔孢子在塑料上的萌发数最高, 此外, 不同材质的网衣也比较适于孢子附着(图 5), 且浒苔孢子在两种网衣上萌发的幼苗生物量没有显著差异。
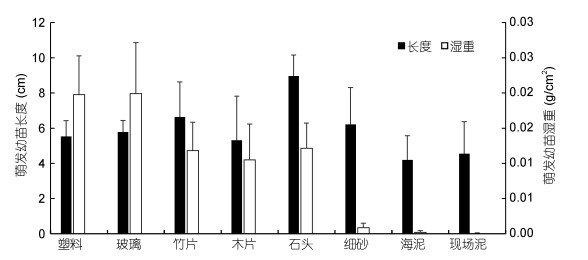 |
| 图 4 浒苔孢子在不同材料上萌发幼苗的湿重和长度比较 Fig. 4 The length and wet weight of the spore germlings on various materials |
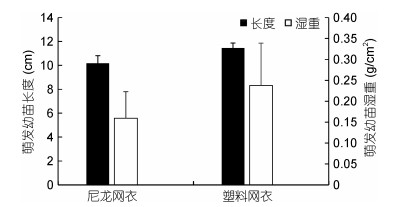 |
| 图 5 浒苔孢子在不同材料的网衣上萌发幼苗的湿重和长度比较 Fig. 5 The length and wet weight of spore germlings on different types of nettings |
浒苔孢子和配子在不同材料附着基上的萌发有共性, 也有差异(图 6)。孢子和配子在筏架相关材料如塑料、竹片上的萌发数均显著高于在海泥以及细砂上的萌发数。而孢子在藻段上的萌发数显著高于配子, 配子在木片上萌发数显著高于孢子。
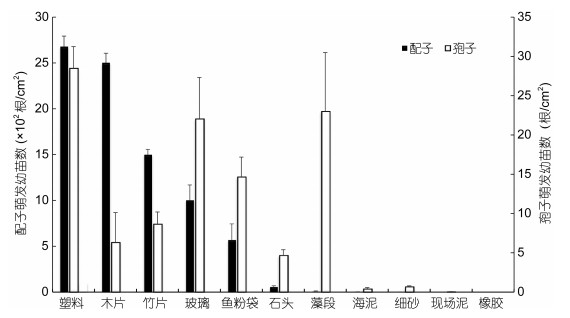 |
| 图 6 浒苔孢子和配子在不同材料上萌发幼苗数的比较 Fig. 6 Comparison of gamete and spore germlings on various materials |
浒苔配子在橡胶浸出液和鱼粉溶液中萌发数量与对照组有极显著差异(P<0.01), 均显著低于对照组, 鱼粉溶液中浒苔幼苗萌发数为对照组的12.4%±1.5%, 橡胶浸出液中浒苔幼苗萌发数仅为对照组的1.7%±0.3%, 而浒苔孢子在两者中的萌发数量则与对照组无显著性差异(图 7)。
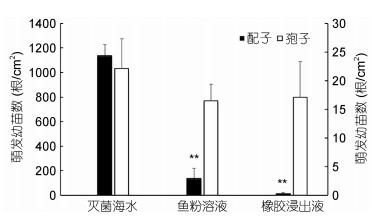 |
| 图 7 浒苔孢子和配子在不同溶液中萌发幼苗数的比较 Fig. 7 Comparison of gamete and spore germlings in different solutions 注: n = 3, *表示有显著性差异, P<0.01 |
浒苔生殖细胞的附着包括最初的接触和随后的固着过程, 附着基质是浒苔生根、繁殖并能够稳定生长的基本条件, 因此附着基质的选择是浒苔生根并良好生长的关键一环, 也是开始建群的第一步。本研究发现, 浒苔孢子的附着萌发效果以塑料最好, 其次是网衣, 而在浅滩相关材料(石块、细砂和海泥)上的萌发数则非常低。这有助于解释紫菜养殖筏架成为漂浮浒苔主要来源的原因。另外, 各附着基上萌发幼苗数量较高的材料上浒苔生物量也较高。朱明等(2011)的研究发现塑料片、紫菜养殖网绳和网布上孢子附着量较多, 吴洪喜等(2000)发现浒苔附着基以木板效果最佳; 兰色尼龙网、白色ABS塑料和石头次之; 细砂、海泥、竹片最差, 这与本研究结果具有一致性。本研究还发现浒苔生殖细胞在老的浒苔藻段上也可以完成附着和萌发。张华伟等(2011)的研究发现浒苔孢子能够在母体藻段上萌发, 而本研究发现浒苔孢子和配子还能在非母体的藻段上萌发, 而且在解剖显微镜下还能够在藻体表面观察到浒苔幼苗的假根, 但是萌发率并不高。值得注意的是, 因实验需要, 本研究中所采用的藻段预先经过酒精脱色处理, 这一过程会减弱浒苔藻体本身对其他生物的化感效应, 在反演现场情况时仍需要进一步的研究。不同材料对浒苔附着萌发效果的影响值得引起重视, 同时, 不同材料对浒苔微观繁殖体附着萌发的机制还有待进一步研究。
浒苔孢子的萌发可能会受到附着基的材质、粗糙度以及表面微生物膜的影响(Callow et al, 2000, 2006)。已有的研究结果表明, 不同材料的表面特性对微藻的附着有很大影响(Schories, 1995), 此外, 附着基的粒径大小以及形状都会对浒苔微观繁殖体的萌发产生影响, 室内研究也证明浒苔幼苗萌发率与附着基粒径大小呈正相关, 粒径大于250pm的附着基比较利于游孢子的附着和萌发, 小于125pm时萌发率则很低(22%) (Schumacher et al, 2007; Park et al, 2011)。此外, 覆盖在附着基表层的生物膜也有可能促进或者抑制浒苔微观繁殖体的附着萌发(Holmström et al, 1996; Qian et al, 2007)。
3.2 浒苔孢子和配子附着萌发差异性的比较浒苔孢子和配子在不同材料附着基上的附着萌发情况既有共性, 也存在差异。孢子和配子在所有材料上的附着率均没有显著差别, 但萌发率有所差别。对比分析可以看出, 浒苔孢子与配子在不同材料上的附着萌发特性比较一致, 附着萌发效果均以塑料最好, 而在浅滩相关材料(石块、细砂和海泥)上的萌发数则非常低。然而, 孢子和配子的附着萌发还存在显著差异性, 如浒苔孢子在藻段上的萌发显著高于配子, 同时孢子在不适宜的环境条件下(鱼粉溶液和橡胶溶液)萌发数也显著高于配子, 这可能与浒苔孢子的环境适应能力更强有关, 孢子即使在不利的环境条件下仍然能够保持活性。鱼粉经过长时间的储存变质会产生挥发性物质, 鱼粉的变质还会导致pH值的变化, 这些对微观繁殖体的存活均有很大影响(王建伟等, 2007; Sousa et al, 2007), 而浒苔孢子在不适宜的环境中仍然能够保持较高的萌发率。
3.3 紫菜养殖筏架在黄海绿潮早期形成中的作用相较于浅滩和养殖池相关材料(海泥、细砂和石块), 紫菜养殖筏架相关材料(塑料、竹片、麻绳、塑料绳、尼龙绳、塑料网衣和尼龙网衣)更加适合于浒苔孢子和配子的附着萌发。现场调查也发现紫菜养殖筏架上附生大量绿藻, 这说明, 由于人类活动的影响而出现在海洋中的人工材料更加适合于浒苔孢子和配子的萌发。同时, 浒苔微观繁殖体萌发数较高的材料上绿藻的生物量也高。江苏沿岸的紫菜养殖业自2006年开始兴盛, 养殖区覆盖面积可达到20000公顷(Liu et al, 2010)。据统计, 2015—2016年, 江苏省近岸紫菜养殖筏架可达44—45亿张, 占据的海域面积可达50万亩, 基于这些数据以及紫菜养殖筏架的基本结构, 我们粗略地估算筏架可供附着的面积能够达到约8×107m2。而筏架相关材料非常适合于浒苔微观繁殖体的附着萌发, 因此, 紫菜养殖筏架巨大的表面积无疑为广泛分布于江苏沿岸的浒苔的微观繁殖体(Song et al, 2015)提供了良好的附着基。据统计, 每年仅从紫菜养殖筏架上收集的绿藻就能达到上千吨(Liu et al, 2010; Fan et al, 2015)。因此, 本研究进一步证明江苏沿岸的紫菜养殖筏架更适合浒苔微观繁殖体的附着萌发, 为浅滩保留的浒苔微观繁殖体提供了大量附着基, 在黄海绿潮的早期形成过程中发挥了重要作用。
3.4 防附着材料的选择绿潮发生初期, 微观繁殖体的大量附着萌发提供了重要的生物量基础, 适宜的附着材料将极大地加剧绿潮暴发的规模, 反之, 如果选取有效的替代材料, 将会显著减少浒苔的附着及萌发, 进而降低其生物量, 避免其大规模的暴发。本研究发现橡胶对浒苔微观繁殖体的萌发有强烈的抑制作用, 其表面完全没有发现萌发的浒苔幼苗。另外, 孢子和配子在鱼粉袋以及鱼粉溶液中的萌发数量均显著低于在塑料上的萌发数。现场调查研究也发现, 牡蛎养殖户经常用鱼粉袋包裹竹竿以防止藤壶的附着。这一方法在现场应用中收到明显的成效, 包裹了鱼粉袋的竹竿上藤壶的附着明显减少了。借鉴以上做法, 通过选择简便易得、造价低廉、环境友好的防附着材料, 在不影响紫菜生长的基础上, 可以减少绿潮早期发生的初始生物量, 具有广泛的应用前景。
4 结论浒苔生殖细胞的附着萌发期是浒苔生活史中的关键阶段。本研究发现浒苔孢子在不同附着基上的萌发数量存在显著差异性, 相较于浅滩、礁石和养殖池相关材料(细砂、海泥、石块), 紫菜养殖筏架相关材料(塑料、竹片、网衣)表现出了更好的附着性。可见, 江苏沿岸紫菜养殖筏架为浒苔生殖细胞提供了大量的良好的附着基, 在绿潮早期形成过程中发挥了“放大器”的作用, 而防附着材料的选用将成为绿潮防控的重要途径。
| 王建伟, 阎斌伦, 林阿朋, 等, 2007. 浒苔(Enteromorpha prolifera)生长及孢子释放的生态因子研究. 海洋通报, 26(2): 60–65 DOI:10.3969/j.issn.1001-6392.2007.02.009 |
| 王晓坤, 马家海, 叶道才, 等, 2007. 浒苔(Enteromorpha prolifera)生活史的初步研究. 海洋通报, 26(5): 112–116 DOI:10.3969/j.issn.1001-6392.2007.05.018 |
| 叶乃好, 张晓雯, 毛玉泽, 等, 2008. 黄海绿潮浒苔(Enteromorpha prolifera)生活史的初步研究. 中国水产科学, 15(5): 853–859 DOI:10.3321/j.issn:1005-8737.2008.05.019 |
| 朱明, 刘兆普, 徐军田, 等, 2011. 浒苔孢子放散与附着萌发特性及其干出适应性的初步研究. 海洋科学, 35(7): 1–6 |
| 刘峰, 逄少军, 2012. 黄海浒苔绿潮及其溯源研究进展. 海洋科学进展, 30(3): 441–449 DOI:10.3969/j.issn.1671-6647.2012.03.015 |
| 吴洪喜, 徐爱光, 吴美宁, 2000. 浒苔实验生态的初步研究. 浙江海洋学院学报(自然科学版), 19(3): 230–234 DOI:10.3969/j.issn.1008-830X.2000.03.007 |
| 张华伟, 马家海, 胡翔, 等, 2011. 绿潮漂浮浒苔繁殖特性的研究. 上海海洋大学学报, 20(4): 600–606 |
| Callow M E, Callow J A, 2000. Substratum location and zoospore behaviour in the fouling alga Enteromorpha. Biofouling, 15(1-3): 49–56 DOI:10.1080/08927010009386297 |
| Callow J A, Callow M E, 2006. Biofilms. Progress in Molecular and Subcellular Biology, 42: 141–169 |
| Fan S L, Fu M Z, Wang Z L, et al, 2015. Temporal variation of green macroalgal assemblage on Porphyra aquaculture rafts in the Subei Shoal, China. Estuarine, Coastal and Shelf Science, 163: 23–28 DOI:10.1016/j.ecss.2015.03.016 |
| Fletcher R L, Callow M E, 1992. The settlement, attachment and establishment of marine algal spores. British Phycological Journal, 27(3): 303–329 DOI:10.1080/00071619200650281 |
| Geng H X, Yan T, Zhou M J, et al, 2015. Comparative study of the germination of Ulva prolifera gametes on various substrates. Estuarine, Coastal and Shelf Science, 163: 89–95 DOI:10.1016/j.ecss.2014.12.026 |
| Hiraoka M, Yoshida G, 2010. Temporal variation in isomorphic phase and sex ratios of a natural population of Ulva pertusa (Chlorophyta). Journal of Phycology, 46(5): 882–888 DOI:10.1111/jpy.2010.46.issue-5 |
| Holmström C, James S, Egan S, et al, 1996. Inhibition of common fouling organisms by marine bacterial isolates ith special reference to the role of pigmented bacteria. Biofouling, 10(1-3): 251–259 DOI:10.1080/08927019609386284 |
| Liu D Y, Keesing J K, Dong Z J, et al, 2010. Recurrence of the world's largest green-tide in 2009 in Yellow Sea, China:Porphyra yezoensis aquaculture rafts confirmed as nursery for macroalgal blooms. Marine Pollution Bulletin, 60(9): 1423–1432 DOI:10.1016/j.marpolbul.2010.05.015 |
| Liu D Y, Keesing J K, He P M, et al, 2013. The world's largest macroalgal bloom in the Yellow Sea, China:Formation and implications. Estuarine, Coastal and Shelf Science, 129: 2–10 DOI:10.1016/j.ecss.2013.05.021 |
| Liu D Y, Keesing J K, Xing Q G, et al, 2009. World's largest macroalgal bloom caused by expansion of seaweed aquaculture in China. Marine Pollution Bulletin, 58(6): 888–895 DOI:10.1016/j.marpolbul.2009.01.013 |
| Liu F, Pang S J, Zhao X B, et al, 2012. Quantitative, molecular and growth analyses of Ulva microscopic propagules in the coastal sediment of Jiangsu province where green tides initially occurred. Marine Environmental Research, 74: 56–63 DOI:10.1016/j.marenvres.2011.12.004 |
| Liu Q, Yu R C, Yan T, et al, 2015. Laboratory study on the life history of bloom-forming Ulva prolifera in the Yellow Sea. Estuarine, Coastal and Shelf Science, 163: 82–88 DOI:10.1016/j.ecss.2014.08.011 |
| Park C S, Hwang E K, 2011. An investigation of the relationship between sediment particles size and the development of green algal mats (Ulva prolifera) on the intertidal flats of Muan, Korea. Journal of Applied Phycology, 23(3): 515–522 DOI:10.1007/s10811-010-9620-9 |
| Pang S J, Liu F, Shan T F, et al, 2010. Tracking the algal origin of the Ulva bloom in the Yellow Sea by a combination of molecular, morphological and physiological analyses. Marine Environmental Research, 69(4): 207–215 DOI:10.1016/j.marenvres.2009.10.007 |
| Qian P Y, Lau S C K, Dahms H U, et al, 2007. Marine biofilms as mediators of colonization by marine macroorganisms:implications for antifouling and aquaculture. Marine Biotechnology, 9(4): 399–410 DOI:10.1007/s10126-007-9001-9 |
| Schories D, 1995. Sporulation of Enteromorpha spp. (Chlorophyta) and overwintering of spores in sediments of the Wadden Sea, Island Sylt, North Sea. Netherland Journal of Aquatic Ecology, 29(3-4): 341–347 DOI:10.1007/BF02084233 |
| Schumacher J F, Carman M L, Estes T G, et al, 2007. Engineered antifouling microtopographies-effect of feature size, geometry, and roughness on settlement of zoospores of the green alga Ulva. Biofouling, 23(1): 55–62 DOI:10.1080/08927010601136957 |
| Song W, Li Y, Fang S, et al, 2015. Temporal and spatial distributions of green algae micro-propagules in the coastal waters of the Subei Shoal, China. Estuarine, Coastal and Shelf Science, 163: 29–35 DOI:10.1016/j.ecss.2014.08.006 |
| Sousa A I, Martins I, Lillebø A I, et al, 2007. Influence of salinity, nutrients and light on the germination and growth of Enteromorpha sp. spores. Journal of Experimental Marine Biology and Ecology, 341(1): 142–150 DOI:10.1016/j.jembe.2006.09.020 |
| Zhou M J, Liu D Y, Anderson D M, et al, 2015. Introduction to the Special Issue on green tides in the Yellow Sea. Estuarine, Coastal and Shelf Science, 163: 3–8 DOI:10.1016/j.ecss.2015.06.023 |
 2018, Vol. 49
2018, Vol. 49


