中国海洋湖沼学会主办。
文章信息
- 孔凡洲, 姜鹏, 魏传杰, 张清春, 李继业, 刘一霆, 于仁成, 颜天, 周名江. 2018.
- KONG Fan-Zhou, JIANG Peng, WEI Chuan-Jie, ZHANG Qing-Chun, LI Ji-Ye, LIU Yi-Ting, YU Ren-Cheng, YAN Tian, ZHOU Ming-Jiang. 2018.
- 2017年春、夏季黄海35°N共发的绿潮、金潮和赤潮
- CO-OCCURENCE OF GREEN TIDE, GOLDEN TIDE AND RED TIDES ALONG THE 35°N TRANSECT IN THE YELLOW SEA DURING SPRING AND SUMMER IN 2017
- 海洋与湖沼, 49(5): 1021-1030
- Oceanologia et Limnologia Sinica, 49(5): 1021-1030.
- http://dx.doi.org/10.11693/hyhz20180400082
-
文章历史
- 收稿日期:2018-04-08
- 收修改稿日期:2018-06-20
2. 青岛海洋科学与技术国家实验室 海洋生态与环境科学功能实验室 青岛 266237;
3. 中国科学院海洋研究所 实验海洋生物学重点实验室 青岛 266071;
4. 青岛海洋科学与技术国家实验室 海洋生物学与生物技术功能实验室 青岛 266237;
5. 中国科学院海洋大科学研究中心 青岛 266071;
6. 中国科学院海洋研究所 工程技术部 青岛 266071;
7. 国家海洋局北海环境监测中心 青岛 266033;
8. 中国科学院大学 北京 100049
2. Laboratory of Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China;
3. CAS Key Laboratory of Experimental Marine Biology, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;
4. Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China;
5. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
6. Engineering and Technology Department, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;
7. North China Sea Environmental Monitoring Center, State Oceanic Administration, Qingdao 266033, China;
8. University of Chinese Academy of Sciences, Beijing 100049, China
近年来, 由微藻和大型藻类形成的有害藻华事件在世界范围内持续增加。常见的大型藻藻华主要包括由石莼属(Ulva)绿藻等形成的绿潮(green tide)和由马尾藻属(Sargassum)褐藻等形成的金潮(golden tide)两大类。绿潮常见于西欧、北美和东南亚的沿海国家, 而金潮主要分布在北大西洋墨西哥湾和百慕大群岛附近。在大西洋中部的马尾藻海, 即是因海面漂浮大量马尾藻而得名。近年来, 大西洋的漂浮马尾藻影响海域呈现扩张态势。2011年到2015年, 南大西洋巴西沿岸多地暴发金潮(Sissini et al, 2017); 2011年, 非洲西海岸也暴发大规模金潮, 其规模为该海域之前8年总量的200倍(Smetacek et al, 2013)。
自2007年以来, 我国黄海海域连年发生大规模浒苔绿潮, 每年的分布面积达数万平方公里。绿潮早期出现在苏北浅滩区, 在风和海流作用下进入南黄海, 并在山东半岛南岸大量堆积, 不仅导致环境污染, 也损害了旅游业和养殖业发展, 造成了巨大的经济损失。2013年浒苔绿潮暴发期间, 在日照、青岛近岸海域还发现了一定量的漂浮马尾藻, 其平均生物量仅占绿藻总量的1%, 但局部海域可达20%。大量漂浮马尾藻的出现不仅造成了金潮这一新的有害藻华问题, 也增大了对浒苔绿潮的监测和治理难度(国家海洋局北海分局, 2014)。与绿潮和金潮等大型藻藻华相比, 由微藻引起的赤潮近年来在南黄海海域报道较少, 主要出现在海州湾海域。2017年黄海浒苔绿潮发生期间, 现场调查不仅发现了浒苔(Ulva prolifera)、扁浒苔(U. compressa)、曲浒苔(U. flexuosa)和缘管浒苔(U. linza)等绿藻, 还发现了大量的铜藻(Sargassum horneri)(姜鹏等, 未发表数据)。同时, 沿南黄海35°N断面还多次发现赤潮现象。这一罕见的绿潮、金潮和赤潮共发现象, 在一定程度上反映了黄海海域藻华灾害的严峻程度, 亟需进行深入研究。
南黄海35°N断面西起海州湾底部, 是南黄海东西向最长的断面。海州湾近岸海域营养盐浓度高、富营养化问题严重, 是南黄海的赤潮多发区。此外, 该断面位于苏北浅滩北部外缘, 与浅滩区相比海水透明度增加, 加之春、夏季水温上升, 温、盐跃层的出现使得水体稳定性增加, 环境条件适宜浒苔和马尾藻等大型藻类的生长, 有利于绿潮和金潮的形成和发展。本研究于2017年4—6月期间, 对沿南黄海35°N断面的大型漂浮藻类及赤潮微藻进行了定量观测, 分析了该海域大型漂浮藻类的生物量和分布状况, 以及赤潮微藻的种类和丰度状况, 以期为揭示黄海海域藻华灾害的形成机理和演变规律, 针对性地开展有害藻华预报、预警和防控提供科学依据。
1 材料与方法 1.1 研究海区与站位布设2017年4月至6月期间, 搭载“科学三号”考察船在黄海开展了两航次综合调查, 其中于4月22—23日(Ⅰ)、5月21—22日(Ⅱ)、6月9—10日(Ⅲ)和6月20—21日(Ⅳ)连续4次对35°N断面各站位进行了水温、盐度和大型漂浮藻类的定量观测(图 1)。图中L站为5月21日走航过程中, 开展大面积漂浮藻类采样的临时加站。此外, 第Ⅰ次35°N断面调查中未观测3500-02a站, 第Ⅳ次调查中未观测3500-10站。
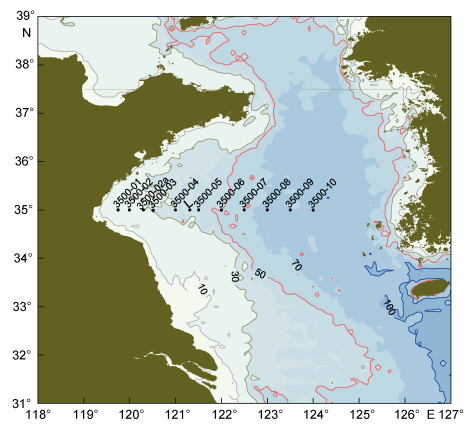 |
| 图 1 南黄海35°N断面采样站位示意图 Fig. 1 Illustration of the sampling sites along the transect 35°N in the southern Yellow Sea |
采用船载SBE911 CTD观测水温、盐度等水文要素和叶绿素a荧光。CTD使用前进行标定和质量控制, 并剔除测量数据中因电压信号转换产生的异常点。
1.2.2 大型漂浮藻类采集与定量分析现场调查中采用拖网采集大型漂浮藻类样品, 拖网网口边长1m, 网眼边长1cm。采样时船速保持2—3海里/小时, 浮拖5—10分钟。分别对拖入网中的绿藻和马尾藻称重, 根据拖网距离, 计算漂浮绿藻和马尾藻的生物量(t/km2)。依据各站漂浮藻类生物量及站点之间距离, 以拖网边长1m作为宽度, 分段求出各站位附近海域大型漂浮藻类生物量, 最后求和得到沿35°N断面(3500-01至3500-10站)长约400km、宽1m的海域中漂浮藻类的总生物量。
各站位漂浮藻类的平均生物量(B, 单位为t/km2)用公式(1)计算:
 (1)
(1)其中, W为拖网获取漂浮藻类质量(g); a为海里与千米的换算值=1.852×1000m/kn; V为调查船对地速度(kn/h); T为拖网时间(h); L为网口边长=1m。
沿35°N断面(距离400km, 宽1m)的漂浮藻类总生物量(SB, 单位为t)用公式(2)计算:
 (2)
(2)式中, Bi为第i站的漂浮藻类平均生物量(t/km2); Di为3500-01站到第i站的距离(km); n为每航次采样站位数; 1≤i≤n-1;第Ⅳ次调查由于未观测3500-10站, 以邻近的3500-09站位的漂浮藻类平均生物量代替, 使每次调查35°N长度相同。
1.2.3 赤潮藻种鉴定和计数调查过程中于2017年5月21日和2017年6月21日分别在3500-02a站和3500-05站两次发现赤潮。在赤潮区采集表层海水, 混匀后用100μL移液器吸取100μL海水, 置于100μL浮游植物计数框内, 在Nikon E100正置显微镜下观察, 对优势种进行鉴定并计算其丰度(cells/L)。
赤潮发生区浮游植物丰度(Ai, 单位为cells/L)用公式(3)表示:
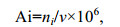 (3)
(3)式中, ni为第i种浮游植物总细胞数的计数结果(cells); v为海水体积(100μL)。
2 结果与分析 2.1 水温、盐度和叶绿素a含量对35°N断面海水水温的4次调查结果(图 2)显示, 2017年4月至6月期间海水水温持续上升, 指示了近岸表层海水逐渐升温的过程。4月在断面中部水深10—20m的位置开始出现温跃层, 但并不显著; 5月下旬自3500-02a站5m水深至3500-07站30m水深区形成了明显的温跃层, 自3500-07至3500-10站, 温度随水深的变化比较平缓; 6月温跃层进一步发育, 位置有变深的趋势。各航次水温高值区都出现在120°30′—122°30′E一带水深10m以浅的水体中。比较张启龙等(2016)的研究成果, 4月121°30′—123°E, 水深25m以深为青岛冷水团, 其东侧外缘已与黄海冷水团的边缘锋区接触(于非等, 2006)。此次沿35°N断面的调查中, 4月断面东部底层冷水应为黄海冷水团, 西部为青岛冷水团; 5月以后青岛冷水团范围缩小, 黄海冷水团沿陆坡上升过程中, 形成垂直的等温线, 在122°E左右受到残留青岛冷水团的阻挡, 出现比较明显的上升过程。
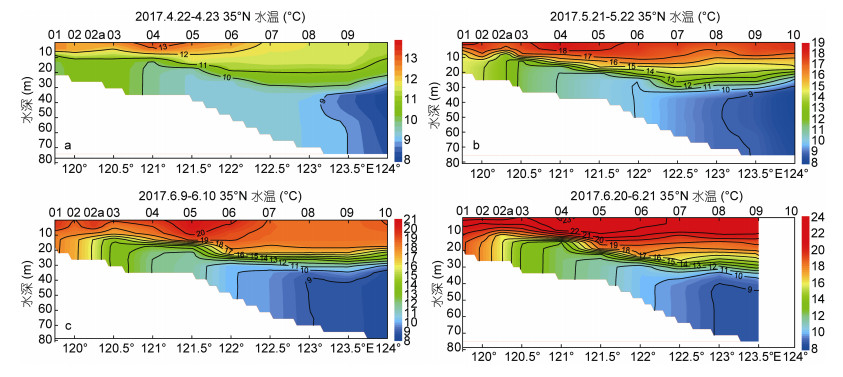 |
| 图 2 沿南黄海35°N断面的水温剖面分布图(单位: ℃) Fig. 2 Profile of seawater temperature along the transect 35°N in the southern Yellow Sea (units: ℃) 注:图中a, b, c, d分别代表2017年4月22—23日、5月21—22日、6月9—10日和6月20—21日的调查结果 |
对35°N断面海水盐度的4次调查结果(图 3)显示, 从5月下旬至6月下旬, 表层海水等盐线持续东移, 显示近岸冲淡水的影响范围逐渐扩大。121°30′— 124°E一带的高盐水团指示了黄海暖流残留部分的变化过程, 受上层冲淡水影响, 呈现出向下扁压的趋势, 并在底层向东西两侧外扩。在35°N断面122°E以西部分10m至20m水深区出现明显的盐跃层, 自5月下旬开始, 一直维持到6月下旬。
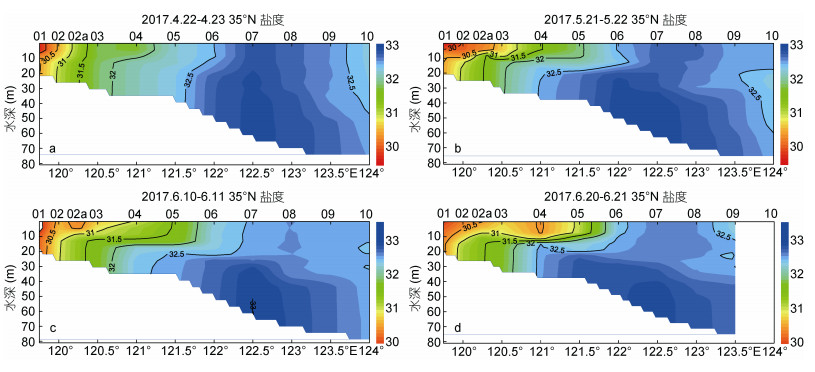 |
| 图 3 沿南黄海N35°断面的盐度剖面分布图 Fig. 3 Profile of salinity along the transect 35°N in the southern Yellow Sea 注:图中a, b, c, d分别代表2017年4月22—23日、5月21—22日、6月9—10日和6月20—21日的调查结果 |
对35°N断面叶绿素a含量的4次调查结果(图 4)显示, 4月叶绿素a含量较低, 最高值出现在3500-08站水深30m处, 自此处向东至3500-09和3500-10站的表层为叶绿素a高值区, 其含量普遍高于4μg/L, 在一定程度上反映了南黄海春季藻华现象。5月下旬至6月下旬的三次调查中, 叶绿素a高值区分布状况相似, 均位于自120°E表层至123°—124E°水深30m处的狭长条带区, 与温跃层基本重合。5月下旬叶绿素a最大值出现在3500-02a站表层, 水体呈褐色, 叶绿素a含量为18μg/L; 6月下旬叶绿素a高值区分布更广, 几乎涵盖35°N断面121°30′E以西的全部上层水体。
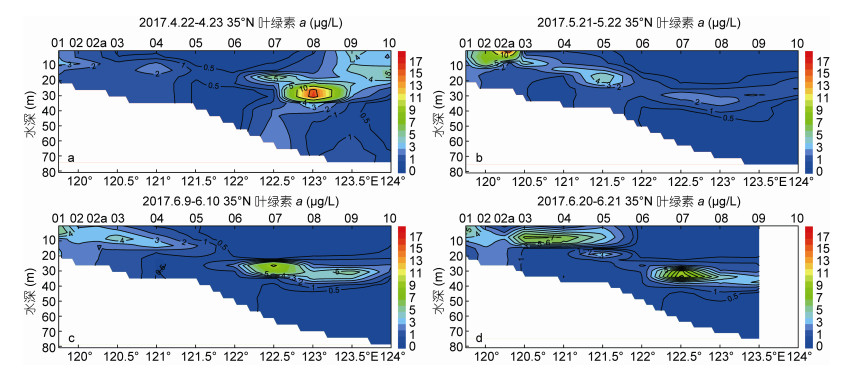 |
| 图 4 沿南黄海N35°断面的叶绿素a剖面分布图(单位: μg/L) Fig. 4 Profile of chlorophyll a along the transect 35°N in the southern Yellow Sea (units: μg/L) 注:图中a, b, c, d分别代表2017年4月22—23日、5月21—22日、6月9—10日和6月20—21日的调查结果 |
对沿南黄海35°N断面大型漂浮藻类的4次调查结果(图 5)显示, 4月份漂浮藻类生物量很低, 漂浮马尾藻生物量最高值出现在3500-07站, 仅有0.06t/km2。5月21日至22日, 除3500-03站外各站位都出现了漂浮马尾藻和绿藻, 主要分布在断面中部L站至3500-09站一带, 马尾藻生物量最高值出现在L站(101t/km2), 绿藻生物量最高值出现在3500-06站(24.3t/km2), L站以西仅发现少量绿藻, 未发现马尾藻。6月9日至6月10日, 各站位均有大型漂浮藻类出现, 其分布状况与第二次调查相似, 但生物量明显增加。大部分站位漂浮绿藻生物量介于1—50t/km2之间, 最高生物量出现在3500-03站(428t/km2); 马尾藻生物量最高值也出现在3500-03站(378t/km2), 此外3500-06和3500-09马尾藻生物量也相对较高, 分别为14.8和23.0t/km2。6月20至6月21日的第Ⅳ次调查, 马尾藻和绿藻的分布状况没有变化, 但生物量明显下降, 马尾藻生物量最高值出现在3500-04站(30.1t/km2), 绿藻生物量最高值出现在3500-05站(37.9t/km2)。
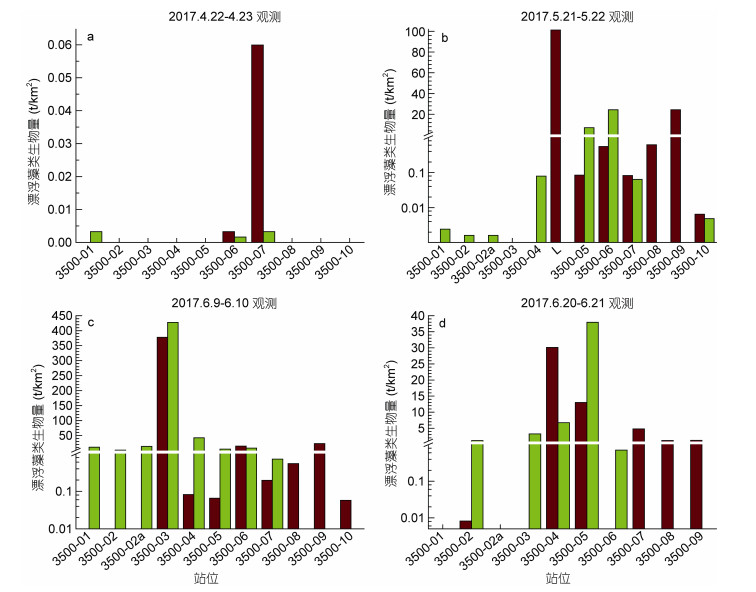 |
| 图 5 沿南黄海35°N断面大型漂浮藻类生物量分布状况(单位: t/km2) Fig. 5 Distribution patterns of macroalgae along the transect 35°N in the southern Yellow Sea (units: t/km2) 注:图中a, b, c, d分别代表2017年4月22—23日、5月21—22日、6月9—10日和6月20—21日的调查结果; 绿色柱代表漂浮绿藻生物量, 褐色柱代表马尾藻生物量 |
按照宽度1m计算, 2017年4月至6月期间沿35°N断面的大型漂浮绿藻和马尾藻生物量如表 1所示。可以看出, 漂浮绿藻和马尾藻的生物量在此期间均呈现出先增加再降低的趋势, 在6月上旬达到最高, 在每个调查时间段两者生物量基本相当。
| 调查时间 | 马尾藻 | 绿藻 |
| 2017年4月22日—4月23日 | 0.0029 | 0.00027 |
| 2017年5月21日—5月22日 | 4.9 | 0.95 |
| 2017年6月9日—6月10日 | 14.0 | 16.8 |
| 2017年6月20日—6月21日 | 2.4 | 2.2 |
现场采集的马尾藻样品颜色具有明显差别。以2017年5月下旬采集的马尾藻样品为例(图 6a, b), 自35°N断面中部采集的马尾藻样品多呈深褐色(图 6a), 而自断面东侧站位采集的马尾藻则呈现金黄色(图 6b)。马尾藻颜色的差别可能在一定程度上反映了海域营养盐浓度的差异。
 |
| 图 6 2017年5月和6月不同站位采集的大型漂浮藻类 Fig. 6 Floating macro-algae collected at different sites in the southern Yellow Sea in May and June, 2017 注: a: 2017年5月21日L站采集的马尾藻和绿藻样品; b: 2017年5月22日采自36°N, 124°E的马尾藻样品; c: 2017年6月21日3500-05站绿潮、金潮和赤潮共发的现场图片 |
2017年调查期间, 分别于2017年5月21日和6月21日在3500-02a站和3500-05站两次发现赤潮。对浮游植物优势种的鉴定和计数结果表明, 3500-2a站浮游植物优势种为米氏凯伦藻(K. mikimotoi)和骨条藻(Skeletonema sp.), 3500-05站浮游植物优势种为赤潮异弯藻(H. akashiwo)和角毛藻(Chaetoceros sp.), 赤潮区表层海水中浮游植物细胞密度见表 2。在6月21日3500-05站赤潮区附近存在大量马尾藻和绿藻, 部分藻类有腐烂分解现象(现场图片见图 6c)。赤潮区与船载SBE911 CTD记录的叶绿素a高值区基本吻合(图 4b, 4d)。
| 浮游植物 | 站位3500-02a | 站位3500-05 |
| 角毛藻(Chaetoceros sp.) | 1.3×106 | |
| 赤潮异弯藻(Heterosigma akashiwo) | 0.4×106 | |
| 米氏凯伦藻(Karenia mikimotoi) | 106 | |
| 东海原甲藻(Prorocentrum donghaiense) | 104 | |
| 三角棘原甲藻(P. triestinum) | 104 | |
| 二刺原多甲藻(Peridinium bipes) | 104 | |
| 骨条藻(Skeletonema sp.) | 3×105 |
金潮是由漂浮状态的马尾藻暴发性增殖引起的海洋生态灾害, 同绿潮一样, 金潮也会引发一系列生态环境问题, 对旅游业和养殖业造成不利影响。由马尾藻形成的金潮现象近年来在全球呈现上升趋势, 受到高度关注(Smetacek et al, 2013)。以往报道中, 大面积的漂浮马尾藻主要出现在大西洋中部的马尾藻海, 近年来南大西洋部分沿海国家也受到了漂浮马尾藻的影响。在太平洋海域, 很早就有关于东海陆架区漂浮铜藻分布的报道(Komatsu et al, 2007), 这些漂浮铜藻主要分布在东海200m等深线外侧陆架区与黑潮之间, 在风和海流作用下, 也可以越过黑潮进入太平洋海域(Komatsu et al, 2014; Mizuno et al, 2014)。近年来, 在北太平洋东岸海域也出现了漂浮铜藻, 且影响海域面积不断扩张(Marks et al, 2015; Kaplanis et al, 2016)。由马尾藻形成的金潮有可能发展成为全球性的藻华灾害问题。
在黄、东海海域, 金潮的威胁正在逐渐显现。遥感资料的分析结果显示, 我国近海自2010—2012年起就有大量马尾藻出现在黄海外海(蔡永超等, 2014; Qi et al, 2017), 只是没有在沿海地区登陆, 因而没有引起足够重视。2017年, 黄海海域暴发大规模金潮(青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室, 2017)。遥感资料显示, 2017年1—6月、10—12月江苏省近岸海域均有大量漂浮马尾藻分布, 最大覆盖面积约240 km2, 给江苏沿海紫菜养殖业造成了巨大经济损失(江苏省海洋与渔业局, 2018)。Xing等(2017)通过高分辨率卫星图片, 反演了2016年10月至2017年1月期间马尾藻自黄海中部向南漂移影响苏北浅滩的过程。Qi等(2017)通过MODIS卫星图像回溯了2017年黄、东海马尾藻金潮的发生过程, 在此期间漂浮马尾藻的分布面积达到16万km2, 超过了同期绿潮分布面积。2017年春、夏季黄海大规模马尾藻金潮的出现表明黄海海域已经受到绿潮和金潮的双重影响, 藻华种类更趋复杂多样。
3.2 黄海绿潮、金潮的时空分布状况及其影响因素对2017年南黄海海域35°N断面的调查表明, 绿潮和金潮表现出了相似的消长规律, 即从4月份开始在调查海域出现, 至6月初生物量达到最高, 6月下旬开始下降。两者在空间分布上也有一定的重叠, 主要分布在断面中部L站至3500-07站一带。对比调查区环境因子的变化可以看出, 绿潮和金潮的时空分布主要受到水温、地形和季风的影响。结合对南黄海其他海域的调查资料, 4月漂浮绿藻主要分布在苏北浅滩内, 马尾藻主要分布在苏北浅滩东侧外缘, 尚未到达调查区域; 进入5月后, 漂浮藻类在季风影响下向北漂移到调查海区, 且水温快速上升, 浒苔和马尾藻的生物量开始快速增加, 35°N断面西部站位(3500-01和3500-02站)位于海州湾内, 漂浮藻类受海州湾南部陆地边界阻挡, 很难到达湾内站位, 因此漂浮藻类主体位于L站至3500-07站之间; 到6月上旬, 水温继续增加到20℃左右, 为马尾藻和浒苔生长的最适温度, 其生物量达到最高, 同时, 受东南季风影响, 断面西部海州湾内各站位浒苔的生物量也有明显增加; 6月下旬, 海水温度已经超过浒苔的最适生长温度, 其生长开始受到抑制, 生物量开始下降。
绿潮和金潮在35°N断面上的分布虽有重叠, 但也存在一定的差异, 自L站以西主要为绿藻, 而自3500-07站以东则主要为马尾藻。目前, 对于南黄海浒苔绿潮的来源和早期发展过程已有较多研究(衣立等, 2010; 范士亮等, 2012)。根据多年来绿潮现场调查和卫星遥感资料的分析结果, 南黄海漂浮绿藻主体起源于苏北浅滩, 并在风和海流的作用下逐渐漂离浅滩区。受水温和风向等因素影响, 绿潮规模和漂移路径具有一定的年际变化, 但总体上沿南黄海西部向北漂移(矫新明等, 2017; 刘帆等, 2017)。而金潮的来源目前仍不清楚, 有调查发现漂浮马尾藻出现在长江口东侧和苏北浅滩外缘。绿潮和金潮沿35°N断面分布状况的差异有可能在一定程度上反映了两者来源的差别。
现场调查发现, 采自不同海域的马尾藻颜色具有明显差别。122°E以东海域采集的马尾藻呈金黄色, 在122°E以西(120°30′—121°30′E)海域, 现场采集的马尾藻多呈褐色。以往研究表明, 在日本Usujiri外海采集的铜藻岩藻黄素含量存在季节变化(Terasaki et al, 2017)。对不同光照和营养条件下裙带菜的色素分析也发现, 低光和高营养条件下, 岩藻黄素含量明显增加(Endo et al, 2017); 而高营养盐条件下, 叶绿素a含量明显增加, 也会影响铜藻的颜色。对调查期间海水中营养盐的分析结果显示, 沿35°N断面无机氮浓度呈现自近岸向外海逐渐降低的趋势(王俊杰等, 2018)。近岸区海水浑浊, 营养盐丰富, 适合马尾藻生长, 能够累积更多的岩藻黄素和叶绿素a, 因而藻体呈现褐色; 而断面东侧各站位营养盐浓度普遍较低, 且由于海水层化的影响, 表层海水中的营养盐得不到补充, 马尾藻在营养条件不良的情况下, 可能通过利用自身物质维持生长, 岩藻黄素和叶绿素a含量降低, 从而呈现出金黄色。
3.3 黄海的赤潮调查期间, 沿35°N断面先后发现了两次赤潮。与渤海、东海和南海相比, 黄海海域的赤潮问题并不严重, 但海州湾是黄海的赤潮高发区。自2005年至2012年, 海州湾海域几乎每年都有赤潮发生, 赤潮面积从几百平方公里至上千平方公里不等, 赤潮生物种类多样, 既包括骨条藻、海链藻和短角弯角藻等硅藻, 也有链状裸甲藻等甲藻, 卡盾藻等针胞藻, 以及一些种类不详的赤潮生物。2008年8月, 海州湾内连云港近岸海域发生有毒微小亚历山大藻(Alexandrium minutum)赤潮, 造成菲律宾蛤仔(Ruditapes phillippinarum)染毒, 致使6人中毒, 1人死亡(于仁成等, 2016)。本研究在5月下旬35°N断面发现的米氏凯伦藻赤潮, 即位于海州湾海域。2009年7月, 连云港附近海域也曾发生过210km2的米氏凯伦藻赤潮(国家海洋局, 2010)。以往曾有研究表明浒苔能够分泌克生物质, 抑制米氏凯伦藻生长(霍元子等, 2010), 但2017年5月米氏凯伦藻赤潮发生期间, 该海域漂浮绿藻的生物量很低(0.0016t/km2), 漂浮绿藻产生的克生物质可能不足以对米氏凯伦藻产生抑制作用。米氏凯伦藻赤潮区位于海州湾湾口附近, 存在无机氮污染问题(方南娟等, 2013)。2017年5月下旬, 35°N断面海州湾海域表层海水中无机氮平均浓度超过10μmol/L(王俊杰等, 2018), 以硝酸盐为主(姚庆祯等, 待发表), 推测米氏凯伦藻赤潮应为局部海域富营养化引起的。
2017年6月21日在3500-05站发现赤潮异弯藻赤潮, 同时, 现场还存在高生物量的漂浮绿藻和马尾藻。调查时现场水温接近23℃, 绿藻和马尾藻生长状态不良, 部分已经开始腐烂分解(图 6c)。虽然大型绿藻、红藻等能够分泌克生化合物抑制微藻生长(王悠等, 2006; 贾睿等, 2012), 但也有研究表明, 藻体沉降分解会释放营养物质, 为赤潮生物利用, 甚至导致赤潮等次生灾害(Valiela et al, 1997)。赤潮发生期间, 沿35°N断面表层海水中无机氮组成具有明显的区域差异, 120°15′E以西各站位的无机氮以硝酸盐为主, 其浓度约为铵盐的1—2倍; 120°30′—121°00′E之间各站位硝酸盐与铵盐浓度相当; 而在3500-05站(121°30′E)以东, 无机氮则以铵盐为主, 表明沿35°N断面自近岸向外海无机氮营养盐存在结构性变化(姚庆祯等, 未发表数据)。曾有研究表明, 腐烂分解的浒苔能够产生大量氨氮, 但是赤潮异弯藻能够耐受高浓度氨氮造成的毒性效应, 在添加浒苔腐烂分解液后能够快速生长(Wang et al, 2012)。3500-05站位于121°30′E附近, 水体层化强烈(韦钦胜等, 2010), 上层海水中无机氮浓度较低, 且以氨氮为主。推测表层海水中出现的赤潮异弯藻赤潮是因漂浮绿藻和马尾藻腐烂分解释放的氨氮导致。
3.4 黄海绿潮、金潮和赤潮共发2017年黄海海域出现了大规模绿潮、金潮和赤潮共同发生的现象。以往曾有两种大型藻如刚毛藻、浒苔、江蓠、裙带菜等共同形成藻华的报道(Teichberg et al, 2010), 但三类藻华在相同或者相邻海域共发的现象非常罕见。这一现象反映了黄海海域海洋环境的持续恶化。一方面南黄海溶解无机氮、磷浓度自20世纪80年代至今显著增加(李鸿妹, 2015), 为藻华的形成提供了重要的物质基础(Smetacek et al, 2013); 另一方面, 黄海海域人类活动对生境的改变也在一定程度上加剧了黄海海域的有害藻华问题。此外, 本研究对三类有害藻华的现场调查结果也表明, 大型藻华的衰亡有可能导致赤潮等次生灾害效应, 这使得黄海海域的有害藻华问题更趋复杂。未来一段时期内, 绿潮、金潮和赤潮等有害藻华可能会在黄海海域频发, 对南黄海生态系统健康和沿海地区社会经济发展构成持续威胁。应针对这些不同的藻华灾害问题, 制定有针对性的预报、预警和防控措施, 提前发现, 提早预防, 尽快处理, 将损失降低到最小。
4 结论2017年春、夏季, 沿黄海35°N断面出现罕见的绿潮、金潮和赤潮三类有害藻华共发现象, 三者分布区域存在交叉重叠。绿潮主要分布在断面西部, 金潮主要分布在断面东部, 在121°30′—122°30′E绿潮与金潮分布重叠。两种大型藻华在35°N断面上的时空分布特征反映了水温、季风和地形的影响, 以及潜在的藻华来源差异。调查期间记录到两次赤潮现象, 其中米氏凯伦藻赤潮5月份在断面西侧海州湾附近海域出现, 是海域富营养化的反映; 赤潮异弯藻赤潮于6月下旬在断面东侧海域出现, 可能受到大型藻腐烂分解产生营养物质的刺激作用。黄海海域多类藻华灾害的发生将对海洋渔业、水产养殖、景观和生态服务功能产生严重影响, 藻华灾害防控将会更加困难。应针对这些不同灾害过程, 制定有针对性的预报、预警和防控预案, 并采取管控措施, 改善海域生态环境。
| 于非, 张志欣, 刁新源, 等, 2006. 黄海冷水团演变过程及其与邻近水团关系的分析. 海洋学报, 28(5): 26–34 |
| 于仁成, 刘东艳, 2016. 我国近海藻华灾害现状、演变趋势与应对策略. 中国科学院院刊, 31(10): 1167–1174 |
| 王悠, 俞志明, 宋秀贤, 等, 2006. 大型海藻与赤潮微藻以及赤潮微藻之间的相互作用研究. 环境科学, 27(2): 274–280 DOI:10.3321/j.issn:0250-3301.2006.02.015 |
| 王俊杰, 于志刚, 董明帆, 等, 2018. 2017年春、夏季南黄海西部营养盐的分布特征及其与浒苔暴发的关系. 海洋与湖沼, 49(5): 1045–1053 |
| 韦钦胜, 傅明珠, 葛人峰, 等, 2010. 南黄海冷水域35°N断面化学水文学特征及营养盐的季节变化. 环境科学, 31(9): 2063–2074 |
| 方南娟, 梅肖乐, 2013. 海州湾近岸海域水质现状与趋势分析. 水产养殖, 34(1): 28–31 DOI:10.3969/j.issn.1004-2091.2013.01.007 |
| 刘帆, 费鲜芸, 王旻烨, 等, 2017. 黄、东海海域浒苔时空分布变化特征研究. 海洋环境科学, 36(3): 416–421 |
| 衣立, 张苏平, 殷玉齐, 2010. 2009年黄海绿潮浒苔爆发与漂移的水文气象环境. 中国海洋大学学报, 40(10): 15–23 |
| 江苏省海洋与渔业局, 2018. 2017年江苏省海洋灾害公报.南京: 江苏省海洋与渔业局 |
| 李鸿妹, 2015.营养盐与黄海浒苔绿潮暴发关系的探究.青岛: 中国海洋大学 http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2884257 |
| 张启龙, 刘志亮, 齐继峰, 等, 2016. 青岛冷水团的消亡机理研究. 海洋学报, 38(5): 27–33 DOI:10.3969/j.issn.0253-4193.2016.05.003 |
| 青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室, 2017.专家预测今年黄海绿潮规模将显著低于往年海洋国家实验室召开2017年黄海浒苔绿潮发展态势研讨会. (2017-06-12). http://www.qnlm.ac/page?a=5&b=3&c=40&d=3&p=detail |
| 范士亮, 傅明珠, 李艳, 等, 2012. 2009-2010年黄海绿潮起源与发生过程调查研究. 海洋学报, 34(6): 187–194 |
| 国家海洋局, 2010. 2009年中国海洋灾害公报.北京: 国家海洋局 https://wenku.baidu.com/view/b9dd9ec65fbfc77da269b130.html |
| 国家海洋局北海分局, 2014. 2013年北海区海洋灾害公报.青岛: 国家海洋局北海分局 http://www.ncsb.gov.cn/n1/upload/180207171729471316/180207173226441085.PDF |
| 贾睿, 吴敏, 蔡春尔, 等, 2012. 浒苔对赤潮异湾藻的克生作用. 水产学报, 36(4): 562–567 |
| 矫新明, 袁广旺, 毛成责, 等, 2017. 2015年南黄海海域浒苔时空分布特征. 杭州师范大学学报(自然科学版), 16(1): 51–56 DOI:10.3969/j.issn.1674-232X.2017.01.014 |
| 蔡永超, 孙彬, 马家海, 等, 2014. 我国南黄海海域漂浮铜藻的分子生物学鉴定. 海洋渔业, 36(2): 102–106 DOI:10.3969/j.issn.1004-2490.2014.02.002 |
| 霍元子, 田千桃, 徐栅楠, 等, 2010. 浒苔对米氏凯伦藻生长的克生作用. 海洋环境科学, 29(4): 496–499, 508 DOI:10.3969/j.issn.1007-6336.2010.04.010 |
| Endo H, Okumura Y, Sato Y, et al, 2017. Interactive effects of nutrient availability, temperature, and irradiance on photosynthetic pigments and color of the brown alga Undaria pinnatifida. Journal of Applied Phycology, 29(3): 1683–1693 DOI:10.1007/s10811-016-1036-8 |
| Kaplanis N J, Harris J, Smith J E, 2016. Distribution patterns of the non-native seaweeds Sargassum horneri (Turner) C. Agardh and Undaria pinnatifida (Harvey) suringar on the san diego and pacific coast of North America. Aquatic Invasions, 11(2): 111–124 DOI:10.3391/ai |
| Komatsu T, Mizuno S, Natheer A, et al, 2014. Unusual distribution of floating seaweeds in the East China Sea in the early spring of 2012. Journal of Applied Phycology, 26(2): 1169–1179 DOI:10.1007/s10811-013-0152-y |
| Komatsu T, Tatsukawa K, Filippi J B, et al, 2007. Distribution of drifting seaweeds in eastern East China Sea. Journal of Marine Systems, 67(3-4): 245–252 DOI:10.1016/j.jmarsys.2006.05.018 |
| Marks L M, Salinas-Ruiz P, Reed D C, et al, 2015. Range expansion of a non-native, invasive macroalga Sargassum horneri (Turner) C. Agardh, 1820 in the eastern Pacific. BioInvasions Records, 4(4): 243–248 DOI:10.3391/bir |
| Mizuno S, Ajisaka T, Lahbib S, et al, 2014. Spatial distributions of floating seaweeds in the East China Sea from late winter to early spring. Journal of Applied Phycology, 26(2): 1159–1167 DOI:10.1007/s10811-013-0139-8 |
| Qi L, Hu C M, Wang M Q, et al, 2017. Floating algae blooms in the East China Sea. Geophysical Research Letters, 44(22): 11501–11509 DOI:10.1002/2017GL075525 |
| Sissini M N, De Barros Barreto M B B, Széchy M T M, et al, 2017. The floating Sargassum (Phaeophyceae) of the South Atlantic Ocean-likely scenarios. Phycologia, 56(3): 321–328 DOI:10.2216/16-92.1 |
| Smetacek V, Zingone A, 2013. Green and golden seaweed tides on the rise. Nature, 504(7478): 84–88 DOI:10.1038/nature12860 |
| Teichberg M, Fox S E, Olsen Y S, et al, 2010. Eutrophication and macroalgal blooms in temperate and tropical coastal waters:nutrient enrichment experiments with Ulva spp. Global Change Biology, 16(9): 2624–2637 |
| Terasaki M, Kawagoe C, Ito A, et al, 2017. Spatial and seasonal variations in the biofunctional lipid substances (fucoxanthin and fucosterol) of the laboratory-grown edible Japanese seaweed (Sargassum horneri Turner) cultured in the open sea. Saudi Journal of Biological Sciences, 24(7): 1475–1482 DOI:10.1016/j.sjbs.2016.01.009 |
| Valiela I, McClelland J, Hauxwell J, et al, 1997. Macroalgal blooms in shallow estuaries:controls and ecophysiological and ecosystem consequences. Limnology and Oceanography, 42(5): 1105–1118 |
| Wang C, Yu R C, Zhou M J, 2012. Effects of the decomposing green macroalga Ulva (Enteromorpha) prolifera on the growth of four red-tide species. Harmful Algae, 16(2): 12–19 |
| Xing Q G, Guo R H, Wu L L, et al, 2017. High-resolution satellite observations of a new hazard of golden tides caused by floating Sargassum in winter in the Yellow Sea. IEEE Geoscience and Remote Sensing Letters, 14(10): 1815–1819 DOI:10.1109/LGRS.2017.2737079 |
 2018, Vol. 49
2018, Vol. 49


