中国海洋湖沼学会主办。
文章信息
- 安德玉, 邢前国, 魏振宁, 李琳. 2018.
- AN De-Yu, XING Qian-Guo, WEI Zhen-Ning, LI Lin. 2018.
- 黄海典型漂浮大型藻类光谱特征分析
- SPECTRAL FEATURES AND ANALYSIS OF TYPICAL FLOATING MACROALGAE IN THE YELLOW SEA
- 海洋与湖沼, 49(5): 1054-1060
- Oceanologia et Limnologia Sinica, 49(5): 1054-1060.
- http://dx.doi.org/10.11693/hyhz20171200331
-
文章历史
- 收稿日期:2017-12-29
- 收修改稿日期:2018-07-04
2. 中国科学院大学 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
漂浮大型藻类是海洋生态系统中重要的组成部分之一, 具有较高的营养价值、药用价值和生态价值(Ambrosio et al, 2003; Sukatar et al, 2006; Cho et al, 2010; Jiao et al, 2010)。在沿海地区, 漂浮藻类(如马尾藻)可以成为沙丘植物的天然肥料, 有助于防止海岸侵蚀(Tsoar, 2005; Anthony et al, 2006)。但漂浮大型藻类的过度繁殖, 不仅会对海洋生态环境造成危害, 而且会在清理上耗费大量的人力、物力、财力。近年来, 绿潮、金潮等生态灾害的频发(de Széchy et al, 2012; Gower et al, 2013; Maurer et al, 2015; Oyesiku et al, 2015), 对海洋生态环境、经济和人类生活产生了很大影响。马尾藻是引起金潮灾害的主要藻种, 美国德克萨斯州每年清理海滩上的马尾藻都要花费至少290万美元(Webster et al, 2013)。浒苔是引起绿潮灾害的主要藻种, 2008年中国的黄海绿潮严重威胁了青岛奥帆比赛的顺利进行, 造成巨大的经济损失和严重的社会影响。及时获取漂浮大型藻类的分布信息, 对于藻类灾害的预测、防控及其清理等具有重要意义。
遥感具有范围广、信息多、更新快、多角度的优点, 能够迅速判断漂浮藻类分布情况, 是漂浮藻类分布监测与估算的主要手段之一。利用遥感技术提取漂浮大型藻类信息的主要方法有监督分类法(Casal et al, 2011, 2012)、最大叶绿素指数法(MCI)(Gower et al, 2006)、海表面藻类爆发指数法(SABI)(Alawadi, 2010)、漂浮藻类指数法(FAI)(Hu, 2009)、虚拟基线漂浮藻类指数法(VB-FAH)(Xing et al, 2016)、水色指数算法(Hu et al, 2012)等, 均具有较好的提取结果。
近年, 绿潮、金潮在黄海、东海出现(Xing et al, 2017)。尤其是2017年, 黄海“三潮”齐发, 增加了防治的难度。及时识别藻种信息, 可为藻类灾害的防控提供决策支持。漂浮大型藻类光谱特征是遥感识别藻类的重要基础, 本研究将基于实测高光谱和多光谱成像数据分析漂浮大型藻类光谱特征, 尝试利用光谱特征区分浒苔和马尾藻, 为高光谱和多光谱数据结合进行漂浮大型藻类的识别监测研究提供参考。
1 数据与方法 1.1 漂浮大型藻类样品采集本研究于2017年6月9日—6月19日进行了野外调查与采样, 此次调查区域为黄海120°0′26″—123°30′7″E, 33°37′29″—36°30′1″N的海区内。航次中对不同规模的漂浮大型藻类分别进行采集, 样本需沥干、遮光冷藏, 共采集样本10份, 同时记录样点的海温、透明度、经纬度等信息; 本航段的主要漂浮大型藻类为浒苔(Ulva prolifera)、马尾藻(Sargassum horneri)(图 1, 表 1)。
 |
| 图 1 a:采样位置; b:马尾藻和浒苔样本照片 Fig. 1 a: The sampling location; b:The photos of Sargassum horneri and Ulva prolifera |
| 样本编号 | 时间(hh:mm dd/mm/yyyy) | 海温(℃) | 气温(℃) | 透明度(m) | 水深(m) | 样本 |
| S1 | 10:47 09/6/2017 | 21.1 | 22.0 | 14.00 | 77 | 马尾藻 |
| S2 | 15:28 12/6/2017 | 23.4 | 21.9 | 0.70 | 15 | 马尾藻 |
| S3 | 20:30 13/6/2017 | 18.6 | 19.5 | × | 68 | 马尾藻 |
| S4 | 09:10 14/6/2017 | × | 20.2 | 0.85 | 18 | 马尾藻 |
| U1 | 20:22 09/6/2017 | 20.8 | 21.8 | × | 50 | 浒苔 |
| U2 | 09:53 10/6/2017 | 20.8 | 20.5 | 5.50 | 29 | 浒苔 |
| U3 | 13:40 15/6/2017 | 23.4 | 23.3 | 1.50 | 21 | 浒苔 |
| U4 | 05:34 17/6/2017 | 21.0 | 22.0 | 6.00 | 45 | 浒苔 |
| U5 | 14:11 18/6/2017 | 22.3 | 22.8 | 12.50 | 39 | 浒苔 |
| U6 | 16:29 19/6/2017 | 24.7 | 23.2 | 10.00 | 24 | 浒苔 |
选择晴朗的天气进行浒苔和马尾藻样本高光谱测量, 采用的光谱仪为USB4000(Ocean Optics Inc.), 波长范围为345.30—1046.12nm, 光谱分辨率为0.2nm; 样本平铺到牛皮纸上, 先测参考板的辐射亮度值, 再测样本的辐射亮度值, 重复三次取平均值, 反射率计算公式为
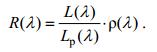 (1)
(1)式中: R(λ)代表被测物体的反射率, L(λ)代表地物辐射亮度值, Lp(λ)代表参考板辐射亮度值, ρ(λ)是参考板的反射率。
为消除噪声影响, 采用移动平均的方法进行平滑处理。考虑到潜在的实际高光谱图像应用, 如HICO、HyspIRI等(娄明静等, 2013), 原始光谱分辨率经重采样处理成5nm, 对重采样后的数据进行分析研究。
1.2.2 多光谱数据采集及处理将10份样本与参考板分别放到牛皮纸上, 采用ADC Snap多光谱相机进行拍摄。该相机的光谱范围为520—920nm, 其红、绿、蓝三通道分别对应近红外、红光、绿光波段, 相当于Landsat TM数据的4、3、2波段; 基于公式(1)计算多光谱相机图像各波段的反射率。
1.3 高光谱数据及多光谱数据的一致性分析采用均值法和指数法进行漂浮大型藻类高光谱与多光谱反射率之间的一致性分析。鉴于前人研究提出并使用的几个藻类指数中, FAI和VB-FAH(式2)相对于其他指数受外界环境的影响较小, 有利于检测漂浮大型藻类(Hu, 2009; Xing et al, 2016)。但FAI计算需要短波红外波段, 而本研究多光谱相机缺乏该波段, 因此选择VB-FAH指数作为指标。
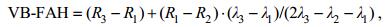 (2)
(2)式中, Ri代表i波段的反射率, λi代表i波段的波长。
具体方法是:利用ENVI软件的ROI模块及统计功能得到10个样本在每个波段上的反射率平均值及VB-FAH, 记为Rmean_M、VB-FAHM; 基于多光谱相机三个波段的范围计算10个样本的高光谱反射率平均值, 记为Rmean_H, 并用其计算VB-FAH, 记为VB- FAHH。通过Rmean_M与Rmean_H、VB-FAHM与VB-FAHH之间的相对误差来判断两者是否具有一致性。相对误差小, 说明一致性较好; 反之, 一致性较差。
1.4 光谱指数的建立由于比值法能够较好地减少背景因素的影响, 扩大光谱差异, 因此通过分析浒苔和马尾藻的光谱特征, 建立比值光谱指数RI(Ratio Index, 公式3), 以更好地区分浒苔和马尾藻。
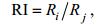 (3)
(3)式中, Ri和Rj分别代表i波段和j波段的反射率。
鉴于多光谱相机的波段与光谱仪不同, 比值光谱指数可能不适用。因此本研究尝试利用多光谱相机的三个波段设计多光谱指数, 采用阈值法进行浒苔和马尾藻的区分, 并进行精度评价。精度评价的主要方法如下:
采用VB-FAH指数提取藻类信息, 在此基础上, 利用多光谱指数设置阈值区分马尾藻和浒苔。通过公式(4)计算区分精度。阈值选取以能够较大程度地区分马尾藻和浒苔为原则(即马尾藻区分精度与浒苔区分精度交叉点), 并与VB-FAH的区分结果作对比。
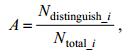 (4)
(4)式中, A代表区分精度; Ndistinguish_i代表区分结果中每个样本的浒苔或马尾藻像元数之和; Ntotal_i代表每个样本中提取的浒苔或马尾藻总像元数; i代表样本编号。
2 结果和讨论 2.1 浒苔和马尾藻光谱特征分析浒苔和马尾藻的光谱特征表现为可见光反射率低, 近红外反射率高, 具有明显的“红边”现象, 但差异明显(图 2)。其差异主要体现在:
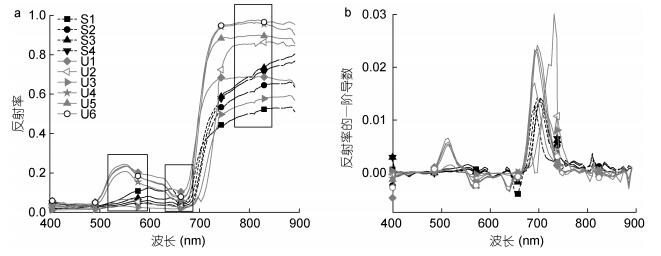 |
| 图 2 a:漂浮藻类高光谱反射率曲线; b:漂浮藻类反射率的一阶导数 Fig. 2 a: Hyperspectral reflectance curve of the floating macroalgae; b: The first derivative of spectral reflectance 注:图a中黑色框代表多光谱图像的三个波段的范围; 图中实线和虚线分别代表浒苔和马尾藻 |
(1) 可见光波段范围内反射率的峰值位置和数量不同(图 2a )。浒苔光谱反射率峰值多位于554nm(绿峰); 马尾藻光谱反射率峰值位于600nm、640nm, 两个反射率峰值的大小相近, 两者之间存在一较浅的反射谷(628nm), 是由于马尾藻中叶绿素c的吸收而形成的, 而浒苔中不含叶绿素c(Rodríguez et al, 2017)。
(2) 反射率随波长的变化不同(图 2b)。体现在:
① 480—550nm, 浒苔光谱反射率的一阶导数为正值, 反射率增加; 而马尾藻光谱反射率的一阶导数接近于0, 反射率变化不大。
② 550—600nm, 浒苔光谱反射率的一阶导数为负值, 反射率减小; 而马尾藻为正值, 反射率增加。
③ 625—650nm, 浒苔光谱反射率的一阶导数小于马尾藻。
上述差异的主要原因是两者所含的主要色素不同, 浒苔含有叶绿素a、b和叶黄素; 马尾藻含有叶绿素a、c和岩黄藻素。受藻类色素吸收的影响, 光谱响应不同(Rodríguez et al, 2017)。
综上所述, 500—650nm波段范围内浒苔和马尾藻的光谱特征差异最为明显, 可尝试利用浒苔绿峰(R554)和马尾藻可见光反射峰(R600、R640)及600—640nm之间的反射率最小值(R628)区分浒苔和马尾藻, 与前人的研究结果较为一致。Hu等(2015)的研究提到利用632nm和580nm、650nm的反射率特征可以区分马尾藻与其他海面漂浮物质; Rodríguez等(2017)通过藻类的吸收光谱特征结合藻类色素含量对藻类进行分类, 结果表明区分绿藻和褐藻的特征波段范围为510—528nm、596—601nm以及645nm。
2.2 漂浮藻类多光谱反射率与高光谱反射率之间的一致性分析从光谱反射率图像看多光谱相机的三波段对应于高光谱反射率的三个特征区域, 即可见光峰值、红谷及近红外反射率高峰区; 绿、红波段对应浒苔和马尾藻高光谱反射率一阶导数差异明显的区域(图 2)。从光谱反射率平均值看, Rmean_M和Rmean_H之间的相对误差在红波段和近红外波段均小于8%, 在绿波段小于15.6%, 两者较为一致(图 3b)。从藻类指数看, VB-FAHM与VB-FAHH的数值区间相近, 相对误差为10.12%, 较为一致(图 3d)。综上所述, 多光谱反射率与高光谱反射率之间具有一致性, 说明单点测量的窄波段高光谱反射率与整体测量的宽波段多光谱反射率结合研究的方法具有可行性。已有学者根据海藻高光谱特征, 通过卫星影像数据, 进行绿藻和马尾藻区分试验(Casal et al, 2012;蔡晓晴等, 2014)。
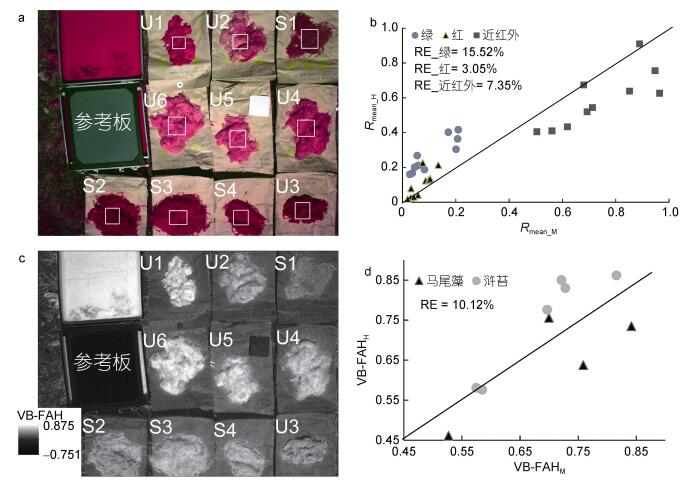 |
| 图 3 a: ADC Snap多光谱反射率图像; b:多光谱反射率均值(Rmean_M)与高光谱反射率均值(Rmean_H)对比; c:基于多光谱反射率计算的指数VB-FAH; d: VB-FAHM和VB-FAHH对比 Fig. 3 a: The multispectral reflectance image from ADC Snap; b: Comparison between Rmean_M and Rmean_H; c: The calculation results of the index (VB-FAH) based on the multispectral reflectance; d: Comparison between VB-FAHM and VB-FAHH 注:图a中白色框代表每个样本选择的ROI范围, 图c、d中的RE代表相对误差 |
为更好地体现浒苔和马尾藻的光谱差异, 本研究基于上述特征, 选择R554、R600、R628和R640, 计算两两之间比值。结果显示, 漂浮大型藻类的比值光谱指数R600/R554、R640/R554和R640/R628差异较大:浒苔的光谱指数小于1, 马尾藻的光谱指数大于1(表 2)。尤其是R628/R554指数, 浒苔均小于0.59, 仅是马尾藻的1/3—1/2, 差异最大, 可尝试利用该指数区分浒苔和马尾藻。
|
R600/R554 | R628/R554 | R640/R554 | R628/R600 | R640 /R600 | R640/R628 |
| S1 | 1.462 | 1.261 | 1.406 | 0.863 | 0.962 | 1.115 |
| S2 | 1.221 | 0.908 | 1.008 | 0.744 | 0.826 | 1.111 |
| S3 | 1.343 | 1.098 | 1.211 | 0.818 | 0.902 | 1.102 |
| S4 | 1.242 | 0.987 | 1.084 | 0.795 | 0.873 | 1.099 |
| U1 | 0.811 | 0.741 | 0.588 | 0.913 | 0.725 | 0.794 |
| U2 | 0.999 | 0.566 | 0.517 | 0.567 | 0.517 | 0.913 |
| U3 | 0.703 | 0.635 | 0.572 | 0.903 | 0.813 | 0.900 |
| U4 | 0.629 | 0.526 | 0.386 | 0.837 | 0.614 | 0.734 |
| U5 | 0.657 | 0.569 | 0.416 | 0.866 | 0.633 | 0.731 |
| U6 | 0.687 | 0.607 | 0.450 | 0.883 | 0.655 | 0.742 |
鉴于浒苔和马尾藻的光谱差异主要是由两者所含色素含量的不同而造成的, 因此根据浒苔和马尾藻反射光谱曲线在红波段的反射谷特征以及反射率随波长的变化不同的特征, 采用邢前国等(2013)提出的反射谷深度指数(Trough-depth, T-depth)来区分浒苔和马尾藻(式5, 图 4)。该指数能够很好地表征潮滩表层沉积物叶绿素含量(邢前国等, 2013)。
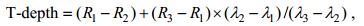 (5)
(5)
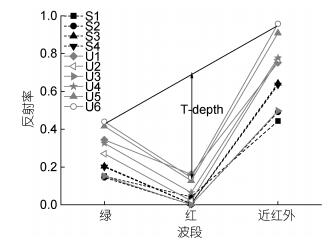 |
| 图 4 每个样本的多光谱反射率均值 Fig. 4 The average of multispectral reflectance of each sample |
式中, Ri、λi分别代表多光谱相机的第i波段的平均反射率和中心波长。
对于浒苔和马尾藻的区分, T-depth阈值确定为0.30, 区分精度分别为69.6%±30.0%, 69.6%±24.3% (图 5a); VB-FAH阈值确定为0.44, 区分精度分别为68.5%±31.5%, 68.5%±24.7%(图 5c)。从区分精度看, T-depth指数区分精度高于VB-FAH。从错分像元数看, T-depth的错分像元数小于VB-FAH(表 3)。从单个样本区分精度看, 60%的样本T-depth区分精度高于VB-FAH(表 3)。综合来看, T-depth指数区分结果稍优于VB-FAH的区分结果。
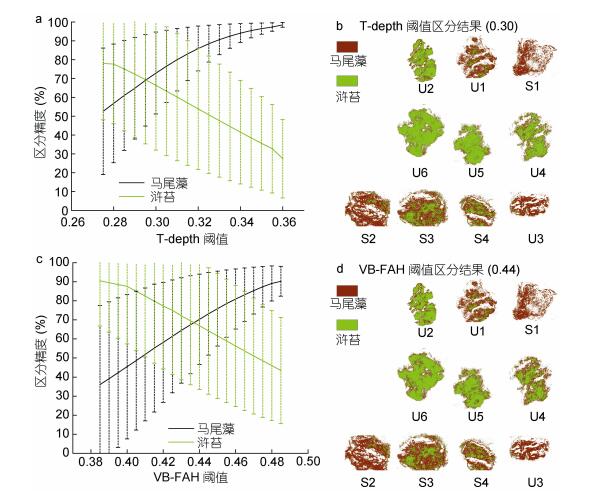 |
| 图 5 T-depth和VB-FAH阈值区分精度 Fig. 5 The accuracy of the results obtained by using the threshold value of the T-depth and VB-FAH 注:虚线是误差线, 代表以该阈值区分浒苔或马尾藻的每个样本的区分精度的标准差 |
| T-depth | VB-FAH | ||
| 马尾藻 | S1 | 99.82 | 99.46 |
| S2 | 84.02 | 85.55 | |
| S3 | 50.79 | 48.67 | |
| S4 | 52.06 | 53.35 | |
| 浒苔 | U1 | 22.58 | 29.23 |
| U2 | 82.02 | 85.82 | |
| U3 | 13.87 | 9.15 | |
| U4 | 79.64 | 70.27 | |
| U5 | 84.81 | 83.15 | |
| U6 | 88.32 | 87.66 | |
| 错分像元数 | 马尾藻 | 62839 | 63128 |
| 浒苔 | 93926 | 97512 | |
(1) 浒苔和马尾藻的Rmean_M与Rmean_H、VB-FAHM和VB-FAHH之间具有较好的一致性, 说明高光谱数据和多光谱数据结合研究海藻区分及其分布监测具有可行性, 为区域海藻灾害监测研究提供参考。
(2) 浒苔和马尾藻因其生理状态、色素含量等不同, 其光谱特征在可见光和近红外波段会显示差异。由光谱特征波长反射率R554、R600、R628和R640计算的比值光谱指数中, R640/R554指数差异最明显, 能够较好地区分浒苔和马尾藻。T-depth指数在浒苔和马尾藻的区分上, 精度分别为69.6%±30.0%、69.6%± 24.3%, 区分精度较好, 说明从光谱特征上识别海藻种类具有可行性。
本研究光谱分析是基于现场采集的浒苔和马尾藻端元光谱, 对于不同生长季节与环境状态的光谱特征及在卫星影像上的实际应用还需进一步研究。
致谢 本研究的海藻样品数据来源于中国科学院烟台海岸带研究所2017年6月科学三号浒苔联合调查航次, 作者对参与本航次的成员深表感谢!| 邢前国, 禹定峰, 娄明静, 等, 2013. 基于现场光谱的潮滩表层沉积物叶绿素-a含量遥感模式. 光谱学与光谱分析, 33(8): 2188–2191 DOI:10.3964/j.issn.1000-0593(2013)08-2188-04 |
| 娄明静, 邢前国, 施平, 2013. 海岸带高光谱遥感与近海高光谱成像仪(HICO). 遥感技术与应用, 28(4): 627–632 |
| 蔡晓晴, 崔廷伟, 秦平等, 2014.基于GOCI的浒苔、马尾藻绿潮光谱特征与可分性研究.见: 中国灾害防御协会风险分析专业委员会第六届年会.北京: 中国灾害防御协会风险分析专业委员会, 774-779 |
| Alawadi F, 2010. Detection of surface algal blooms using the newly developed algorithm surface algal bloom index (SABI). In: Proceedings Volume 7825, Remote Sensing of the Ocean, Sea Ice, and Large Water Regions. Toulouse, France: SPIE, 782506 |
| Ambrosio A L, Sanz L, Sánchez E I, et al, 2003. Isolation of two novel mannan-and L-fucose-binding lectins from the green alga Enteromorpha prolifera:biochemical characterization of EPL-2. Archives of Biochemistry and Biophysics, 415(2): 245–250 DOI:10.1016/S0003-9861(03)00232-7 |
| Anthony E J, Vanhee S, Ruz M H, 2006. Short-term beach-dune sand budgets on the North Sea coast of France:sand supply from shoreface to dunes, and the role of wind and fetch. Geomorphology, 81(3-4): 316–329 DOI:10.1016/j.geomorph.2006.04.022 |
| Casal G, Kutser T, Domínguez-Gómez J A, et al, 2011. Mapping benthic macroalgal communities in the coastal zone using CHRIS-PROBA mode 2 images. Estuarine, Coastal and Shelf Science, 94(3): 281–290 DOI:10.1016/j.ecss.2011.07.008 |
| Casal G, Sánchez-Carnero N, Domínguez-Gómez J A, et al, 2012. Assessment of AHS (Airborne Hyperspectral Scanner) sensor to map macroalgal communities on the Ría de vigo and Ría de Aldán coast (NW Spain). Marine Biology, 159(9): 1997–2013 DOI:10.1007/s00227-012-1987-5 |
| Cho M, Yang C, Kim S M, et al, 2010. Molecular characterization and biological activities of watersoluble sulfated polysaccharides from Enteromorpha prolifera. Food Science and Biotechnology, 19(2): 525–533 DOI:10.1007/s10068-010-0073-3 |
| de Széchy M T M, Guedes P M, Baeta-Neves M H, et al, 2012. Verification of Sargassum natans (Linnaeus) Gaillon (Heterokontophyta:Phaeophyceae) from the Sargasso Sea off the coast of Brazil, western Atlantic Ocean. Check List, 8(4): 638–641 |
| Gower J, Hu C M, Borstad G, et al, 2006. Ocean color satellites show extensive lines of floating Sargassum in the Gulf of Mexico. IEEE Transactions on Geoscience and Remote Sensing, 44(12): 3619–3625 DOI:10.1109/TGRS.2006.882258 |
| Gower J, Young E, King S, 2013. Satellite images suggest a new Sargassum source region in 2011. Remote Sensing Letters, 4(8): 764–773 DOI:10.1080/2150704X.2013.796433 |
| Hu C M, 2009. A novel ocean color index to detect floating algae in the global oceans. Remote Sensing of Environment, 113(10): 2118–2129 DOI:10.1016/j.rse.2009.05.012 |
| Hu C M, Feng L, Hardy R F, et al, 2015. Spectral and spatial requirements of remote measurements of pelagic Sargassum macroalgae. Remote Sensing of Environment, 167: 229–246 DOI:10.1016/j.rse.2015.05.022 |
| Hu C M, Lee Z P, Franz B A, 2012. Chlorophyll a algorithms for oligotrophic oceans:a novel approach based on three-band reflectance difference. Journal of Geophysical Research:Oceans, 117(C1): C01011 |
| Jiao L L, Jiang P, Zhang L P, et al, 2010. Antitumor and immunomodulating activity of polysaccharides from Enteromorpha intestinalis. Biotechnology and Bioprocess Engineering, 15(3): 421–428 DOI:10.1007/s12257-008-0269-z |
| Maurer A S, De Neef E, Stapleton S, 2015. Sargassum accumulation may spell trouble for nesting sea turtles. Frontiers in Ecology and the Environment, 13(7): 394–395 DOI:10.1890/1540-9295-13.7.394 |
| Oyesiku O O, Egunyomi A, 2015. Identification and chemical studies of pelagic masses of Sargassum natans (Linnaeus) gaillon and S. fluitans (Borgessen) borgesen (brown algae), found offshore in Ondo State, Nigeria. African Journal of Biotechnology, 13(10): 1188–1193 |
| Rodríguez Y C, Gómez J A D, Sánchez-Carnero N, et al, 2017. A comparison of spectral macroalgae taxa separability methods using an extensive spectral library. Algal Research, 26: 463–473 DOI:10.1016/j.algal.2017.04.021 |
| Sukatar A, Karabay-Yavaşsoglu N U, Ozdemir C, et al, 2006. Antimicrobial activity of volatile component and various extracts of Enteromorpha linza (Linnaeus) J. Agardh from the coast of Izmir, Turkey. Annals of Microbiology, 56(3): 275–279 |
| Tsoar H, 2005. Sand dunes mobility and stability in relation to climate. Physica A:Statistical Mechanics and its Applications, 357(1): 50–56 DOI:10.1016/j.physa.2005.05.067 |
| Webster R K, Linton T D, 2013. Development and implementation of Sargassum early advisory system (SEAS). Shore & Beach, 81(3): 1–6 |
| Xing Q G, Guo R H, Wu L L, et al, 2017. High-Resolution satellite observations of a new hazard of golden tides caused by floating Sargassum in Winter in the Yellow Sea. IEEE Geoscience and Remote Sensing Letters, 14(10): 1815–1819 DOI:10.1109/LGRS.2017.2737079 |
| Xing Q G, Hu C M, 2016. Mapping macroalgal blooms in the Yellow Sea and East China Sea using HJ-1 and Landsat data:Application of a virtual baseline reflectance height technique. Remote Sensing of Environment, 178: 113–126 DOI:10.1016/j.rse.2016.02.065 |
 2018, Vol. 49
2018, Vol. 49


