中国海洋湖沼学会主办。
文章信息
- 耿慧霞, 于仁成, 颜天, 张清春, 孔凡洲, 周名江. 2018.
- GENG Hui-Xia, YU Ren-Cheng, YAN Tian, ZHANG Qing-Chun, KONG Fan-Zhou, ZHOU Ming-Jiang. 2018.
- 应用甾醇类生物标志物追踪绿潮后期漂浮绿藻沉降区的方法
- USING STEROL BIOMARKERS TO TRACE DEPOSITION AREAS OF FLOATING GREEN ALGAE AFTER GREEN TIDES
- 海洋与湖沼, 49(5): 1094-1102
- Oceanologia et Limnologia Sinica, 49(5): 1094-1102.
- http://dx.doi.org/10.11693/hyhz20180400083
-
文章历史
- 收稿日期:2018-04-08
- 收修改稿日期:2018-06-26
2. 青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室 青岛 266071;
3. 中国科学院大学 北京 100049;
4. 中国科学院海洋大科学研究中心 青岛 266071
2. Laboratory for Marine Ecology and Environmental Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
自2007年起, 黄海海域连续11年在春、夏季发生由绿藻浒苔(Ulva prolifera)形成的绿潮(green tide)灾害。有别于国际上其他常见的绿潮现象, 黄海海域发生的绿潮具有几个重要特点, 即生物量极高、影响范围广和长距离迁移。黄海绿潮起源于苏北浅滩海域, 大量漂浮绿藻在风和海流的作用下漂移至山东半岛附近海域, 绿潮期间绿藻生物量可达数百万吨(Liu et al, 2010)。绿潮后期部分藻类在岸边堆积, 少量被打捞, 但由于人工打捞力量有限, 大部分绿藻最终都将沉入海底。数百万吨的绿藻沉降分解过程中会释放出有机态营养物质, 这有可能改变局部海域生源要素的生物地球化学过程, 影响浮游植物群落结构, 甚至造成赤潮等次生生态灾害。绿藻沉降后腐烂分解过程中还会产生硫化氢和氨氮等有毒化学物质, 对海洋生物具有毒性效应(Wang et al, 2012), 有可能改变底栖生物群落的组成。但是, 到目前为止, 对于黄海绿潮的生态效应仍限于理论上的推测, 这主要是由于对绿潮后期漂浮绿藻的沉降区域缺乏了解。实际上, 要追踪漂浮绿藻的沉降区非常困难, 一方面, 现有的遥感等观测手段无法实现对藻类沉降过程的追踪; 另一方面, 沉降的绿藻会很快腐烂分解, 也加大了追踪的难度。因此, 亟需一种有效的手段或指标来追踪漂浮绿藻的沉降区域。目前, 仅有Lü等(2008)通过数值模拟方法分析了2008年青岛近岸海域沉降绿藻在潮流影响下的分布区域, 但研究范围局限于近岸, 并未涉及黄海海域大量漂浮绿藻的沉降情况。
沉积物中的生物标志物, 如甾醇(Safe et al, 1974; Volkman et al, 1998; Menzel et al, 2003)、色素(Harris et al, 1996; Dahl et al, 2004)、生物硅(Nelson et al, 1995)、脂肪酸(Canuel et al, 1997)和有机碳、氮(Balakrishna et al, 2005)等, 常用于指示沉积物中有机质的来源。甾醇是一种常见的生物标志物, 它普遍存在于真核生物中, 对于保持细胞膜稳定性、生物繁殖和信号转导等过程具有重要作用。目前已报道的植物甾醇超过200种, 海藻中已发现近30种甾醇。部分甾醇具有种属专一性, 仅在特定植物中出现, 但也有植物中同时含有多种甾醇化合物(Volkman, 2003), 且其含量会因温度和营养盐等环境因子影响而发生变动(Piepho et al, 2012)。甾醇的化学性质比较稳定, 能够在沉积物中稳定存在。因此, 甾醇常被作为生物标志物用于生物地球化学研究。例如, 以甲藻甾醇(dinosterol)作为甲藻的生物标志物; 以菜子甾醇(brassicasterol)作为硅藻的标志物等。在海洋有机地球化学研究中, 常通过沉积物中甾醇含量、组成及变化反映浮游植物群落组成情况和长期演变特征(Wu et al, 2016)。
已有研究表明, 28-异褐藻甾醇广泛存在于浒苔、孔石莼、肠浒苔、缘管浒苔、石莼等石莼属绿藻中, 是这些绿藻中的主要甾醇成分(Gibbons et al, 1967, 1968; Patterson, 1974; Okano et al, 1979;纪明候, 1997)。28-异褐藻甾醇尽管在其他生物中也有检出, 但含量极低, 因此, 这种甾醇对石莼属绿藻具有一定的特异性指示作用。28-异褐藻甾醇是浒苔中的主要甾醇成分, 尽管其含量随季节变化有所波动, 但始终占据优势, 因此, 以28-异褐藻甾醇作为绿潮藻类的生物标志物应具有一定的可行性。前期研究分析了我国近海硅藻、甲藻、绿藻和海金藻等典型有害藻华原因种的甾醇组成, 进一步证实黄海绿潮原因种浒苔中存在28-异褐藻甾醇(Geng et al, 2017)。综上所述, 28-异褐藻甾醇具有作为绿潮藻类生物标志物的潜力, 然而其有效性还有待验证。
黄海海域大规模绿潮的连年暴发对沿海地区造成了巨大的经济损失, 然而对其生态效应的认识仍非常有限, 而追踪黄海海域漂浮绿藻的沉降区对于揭示绿潮的生态效应非常关键, 具有重要意义。本研究尝试以28-异褐藻甾醇作为绿潮藻类的生物标志物, 开展绿潮后期漂浮绿藻沉降区追踪的方法研究, 一方面通过室内模拟实验验证其稳定性, 另一方面通过对青岛近岸海域绿藻沉降区沉积物中28-异褐藻甾醇的分析, 进一步验证将其作为沉降绿藻标志物的有效性。研究结果将有助于进一步追踪黄海绿潮后期大量漂浮绿藻的沉降区, 进而探讨黄海绿潮的生态效应及其导致次生灾害的可能性。
1 材料与方法 1.1 样品采集 1.1.1 浒苔样品的采集与培养实验用浒苔(UP-TDW藻株和UP-YS藻株)分别于2012年7月和2015年7月采自青岛团岛湾海域和黄海绿潮现场。使用灭菌海水反复冲洗浒苔样品去除表面附着物后, 挑取单株浒苔样品, 通过形态特征和分子生物学方法对浒苔样品进行藻种鉴定, 并在实验室内进行连续传代培养。实验室内浒苔的培养介质为f/2海水培养基(盐度30±1, pH值8.2—8.3), 另外添加1‰的VH (Vitamin H)和1mg/L SeO2; 温度(20±1)℃, 光强50 μmol/(m2·s)(光:暗周期为14L:10D)。
1.1.2 绿藻沉降区沉积物样品采集分别于2015年7月9日在青岛团岛湾海域、2016年9月6日和9月25日在青岛崂山区王哥庄峰山近岸海域采集表层沉积物样品(图 1), 这些海域在绿潮发生后均有较多绿藻聚积沉降。取样时用自制有机玻璃管(直径10cm)直接插管获得沉积物样品, 取表层10cm, 采集后装入洁净的样品袋中混合均匀, 于-20℃冷冻保存。
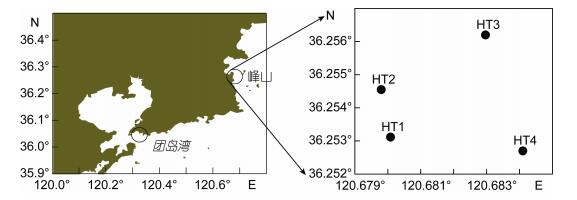 |
| 图 1 青岛近岸绿藻沉降区采样站位示意图 Fig. 1 Illustration of the sampling sites in the coastal waters of Qingdao affected by deposited green algae |
实验用试剂包括甲醇、氢氧化钾、正己烷、二氯甲烷、5α-胆甾烷、六甲基苯、99%BSTFA+1%TMCS[双(三甲基硅烷基)三氟乙酰胺+1%三甲基氯硅烷]等。所用甾醇标准样品均购自Sigma-Aldrich, 包括5α-胆甾烷、六甲基苯、胆甾醇和褐藻甾醇等, 28-异褐藻甾醇目前在国内尚无法获得标准样品, 分析过程中借助其同分异构体褐藻甾醇进行定性确认和定量分析。
1.3 样品分析方法 1.3.1 甾醇分析方法 1.3.1.1 沉积物中甾醇提取方法沉积物样品经冷冻干燥仪(Alpha 1-2 LD, Christ, Germany)冻干后, 用陶瓷研钵研细, 过100μm筛绢后, 室内模拟实验样品称重1g, 现场样品称重10g, 加入250mL锥形瓶中; 对于浒苔样品, 取200mg湿重的藻体, 于-50℃冷冻干燥, 然后用陶瓷研钵研细, 加入玻璃试管中待用。两者提取方法一致, 首先加入5α-胆甾烷作为内标用于计算回收率, 用二氯甲烷和甲醇混合溶剂(体积比为2︰1)分三次超声萃取, 每次20min, 收集残留物并重复萃取步骤, 提取滤膜中的总有机物, 将萃取液离心分离后, 全部转移至梨形旋蒸瓶内, 用旋转蒸发仪浓缩。蒸干后加入10mL 6%的氢氧化钾-甲醇溶液), 于80℃水浴皂化1h, 冷却至室温后, 用正己烷分3次进行萃取, 每次2mL, 离心后吸出上层液体, 将其蒸发浓缩后用氮气吹至近干, 加入衍生试剂99%BST-FA+1%TMCS[双(三甲基硅烷基)三氟乙酰胺+1%三甲基氯硅烷], 将其转化为三甲基硅醚衍生物(TMS-醚), 于70℃衍生1h, 冷却后加入六甲基苯作为定量内标, 48 h内用气相色谱-质谱联用仪(GC-MS)进行分析鉴定。
1.3.1.2 甾醇定性定量分析方法样品中的甾醇采用气-质联用设备进行分析(GC-MS, Agilent 7890A GC-5975C MS, 配备自动进样器)。石英毛细管色谱柱为: 30m×0.25mm×0.25μm SPB-50色谱柱(美国SUPELCO公司)。气相色谱条件为:进样体积1μL, 分流比10︰1, 载气为高纯氦气, 流速为1.0mL/min, 恒流。进样口温度300℃, 程序升温从100℃开始, 以15℃/min升至250℃, 以1℃/min升至280℃, 再以5℃/min升至300℃, 恒温10min, 总共56.7min。质谱条件: EI离子源; 电离能为70eV。浒苔中甾醇成份分析在全扫描(FS, Full Scan)模式下进行, 扫描范围50—650amu; 沉积物中甾醇含量分析在选择离子扫描模式(SIM, selected ion monitoring)下进行, 定量离子和特征离子选择如表 1所示。
| 甾醇化合物 | 保留时间(min) | 定量离子(m/z) | 定性离子(m/z) |
| 六甲基苯 | 10.969 | 147 | 162 |
| 5α-胆甾烷 | 34.413 | 217 | 149, 357 |
| 胆甾醇 | 38.342 | 329 | 368 |
| 褐藻甾醇 | 42.2 | 386 | 296, 484 |
| 28-异褐藻甾醇 | 42.4 | 386 | 296, 484 |
甾醇分析运用Agilent MSD Chem Station软件, 结合GC-MS-TIC图中各组分的质谱, 根据标准样品保留时间和特征离子进行定性和定量分析。为测定回收率, 在样品提取前加入100μL的5α-胆甾烷(10μg/mL)作为回收内标, 按照样品预处理的方法, 将每个样品中内标的峰面积(S1)与5α-胆甾烷直接进样得到的峰面积(S2)进行对比得到回收率, 计算方法为ω%=(S1/S2)×100%。
1.4 浒苔腐烂分解模拟实验将现场采集的浒苔用灭菌海水反复冲洗, 去除其表面的泥沙和其它附着物, 用吸水纸吸干后, 于-20℃条件下冷冻保存。实验前将冷冻浒苔在室温下解冻, 用灭菌海水清洗后, 用滤纸吸去多余水分并称重。实验用泥采自胶州湾。实验容器为250mL玻璃烧杯, 实验海水为青岛市太平角近岸海域的天然海水, 经砂滤后泵至实验室使用。
实验中共设置6组浒苔生物量(2.5、5、12.5、25、50、100g/L), 每组设置3个平行, 实验在250mL烧杯中进行, 每个玻璃烧杯中预先称取干燥底泥30g(干重), 加入采集自汇泉湾经砂滤池过滤的天然海水200mL, 静置一晚后, 分组加入相应重量的浒苔开始实验。为模拟现场环境, 所有烧杯先用封口膜封口, 再用塑料袋封口, 橡皮筋扎紧, 于生化培养箱中静置, 实验在黑暗条件下进行, 实验过程中温度保持在20℃。每隔15天采集沉积物样品3g(湿重), 如果发现有未腐烂的浒苔就将其分离, 取样时用自制的去头注射器分别从烧杯边缘和中心位置垂直插入取样, 并于-20℃下冷冻保存, 用于分析浒苔腐烂分解过程中沉积物内留存的甾醇生物标志物含量变动情况。
1.5 沉积物中甾醇稳定性模拟实验实验所用表层沉积物样品于2016年9月6日采自峰山近岸海域。设置3个平行处理, 每一处理组取500g沉积物(湿重)加入1000mL烧杯中, 并加入经砂滤池过滤的天然海水600mL, 用封口膜封口, 再用塑料袋密封扎紧, 于生化培养箱中静置。实验温度为20℃, 整个实验过程在黑暗条件下进行。每隔1个月采集沉积物样品3g(湿重), 取样方式同1.4, 于-20℃下冷冻保存, 用于分析沉积物中留存的甾醇类生物标志物的含量变动情况。
1.6 数据统计方法采用SPSS 13.0统计软件对试验数据进行统计分析。计算浒苔腐烂分解后生物量与其对应沉积物中甾醇含量的Pearson相关系数, 建立两者的线性关系, 通过决定性系数R2和P值来确定两者的相关程度。P < 0.05为显著相关, P < 0.01为极显著相关。
2 结果 2.1 浒苔中的甾醇组成情况从南黄海海域采集的两株浒苔中共检测出两种甾醇, 包括28-异褐藻甾醇和胆甾醇。其中, 从团岛湾采集的浒苔(UP-TDW)中检测到两种甾醇, 而另一株从黄海海域采集的浒苔(UP-YS)中则仅检测到28-异褐藻甾醇。28-异褐藻甾醇是两株浒苔的主要甾醇成分, 比例为90.8%—100%, 含量为50—100μg/g(表 2)。28-异褐藻甾醇的质谱图与其同分异构体褐藻甾醇几乎完全一致(图 2), 但两者的保留时间不同, 可以据此鉴别28-异褐藻甾醇。
| 藻种 | 株系 | 甾醇含量百分比(%) | |
| 胆甾醇 | 28-异褐藻甾醇 | ||
| 浒苔Ulva prolifera | UP-TDW | 9.20 | 90.8 |
| 浒苔Ulva prolifera | UP-YS | — | 100 |
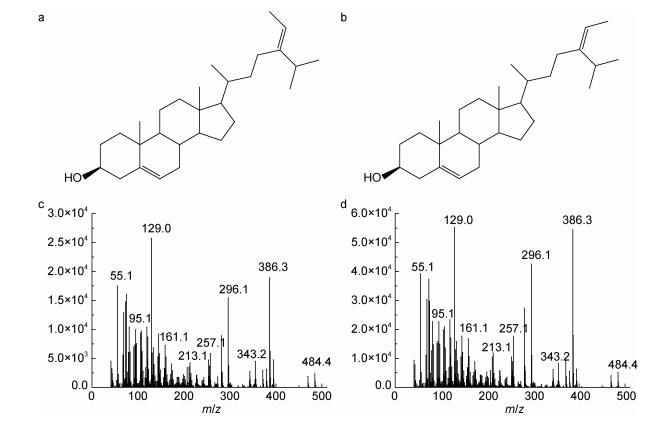 |
| 图 2 褐藻甾醇和28-异褐藻甾醇的结构式和质谱图 Fig. 2 Chemical structures and mass spectra of fucosterol and 28-isofucosterol a, c:褐藻甾醇; b, d: 28-异褐藻甾醇 |
通过模拟实验研究了浒苔腐烂分解后沉积物中留存的28-异褐藻甾醇含量变化情况, 结果表明低生物量组(2.5、5、12.5g/L)的浒苔在1—2个月之内就已完全腐烂分解, 沉积物中28-异褐藻甾醇的含量在1个月后基本维持稳定; 高浓度组(25、50、100g/L)浒苔在96天之内仍未完全分解, 沉积物中28-异褐藻甾醇含量保持上升趋势(图 3);分析浒苔腐烂分解后64天和96天沉积物中28-异褐藻甾醇含量与浒苔生物量的关系发现, 两者之间呈显著正相关关系(图 4)。
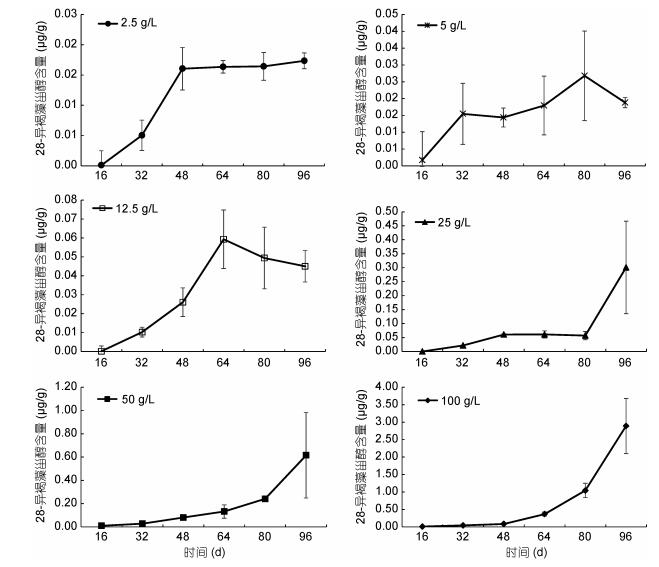 |
| 图 3 浒苔腐烂分解过程中沉积物内28-异褐藻甾醇含量变化 Fig. 3 Variation of 28-isofucosterol content in sediment during the decomposition of green alga U. prolifera. |
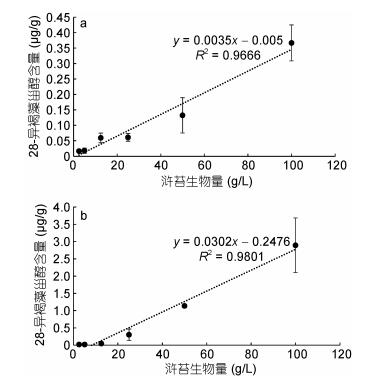 |
| 图 4 浒苔腐烂分解后其生物量与沉积物中28-异褐藻甾醇含量的关系 Fig. 4 Relationship between 28-isofucosterol content in sediment and decomposed biomass of green alga U. prolifera a腐烂后64天; b.腐烂后96天 |
沉积物中甾醇稳定性模拟实验过程中, 28-异褐藻甾醇的含量随时间有明显变化。在20℃和黑暗条件下, 沉积物中28-异褐藻甾醇含量能够基本保持稳定, 1个月后其含量有明显下降, 实验结束时(4个月)仅以较低含量(约0.1μg/g)保持稳定(图 5)。
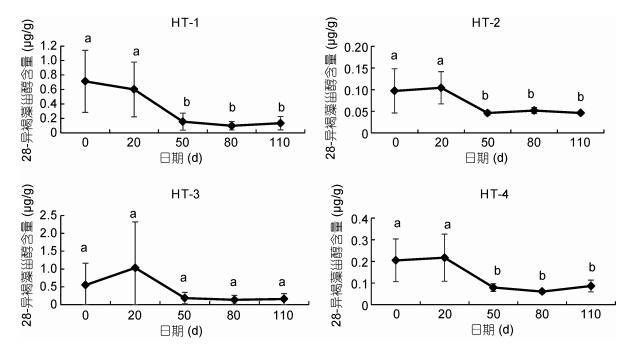 |
| 图 5 室内甾醇稳定性模拟实验期间沉积物中28-异褐藻甾醇含量变化情况 Fig. 5 Variation of 28-isofucosterol content in sediment during the simulation experiment to study the stability of 28-isofucosterol 注: HT-1—4表示采样站位, 图中所示为平均值(n=3)和标准误差, 不同字母表示存在显著性差异, P < 0.05 |
青岛近岸两处绿藻沉降区采集的沉积物样品中均可检测到高含量的28-异褐藻甾醇。2015年7月9日从团岛湾采集的样品中, 28-异褐藻甾醇含量为(0.193±0.040)μg/g。在峰山近岸采集的样品中28-异褐藻甾醇含量极高, 在绿潮发生后含量有明显变化, 其中2016年9月6日HT-1站位样品中28-异褐藻甾醇含量达到(0.712±0.312)μg/g, 9月6日峰山近岸样品中28-异褐藻甾醇含量平均值为(0.391± 0.192)μg/g, 至9月25日峰山近岸绿藻沉降区28-异褐藻甾醇含量下降至(0.107±0.042)μg/g(表 3)。
| 站位 | 采样日期 | 28-异褐藻甾醇含量(μg/g) |
| 团岛湾 | 20150709 | 0.193±0.040 |
| HT-1* | 20160906 | 0.712±0.312 |
| HT-1* | 20160925 | 0.189±0.101 |
| HT-2* | 20160906 | 0.097±0.051 |
| HT-2* | 20160958 | 0.062±0.009 |
| HT-3* | 20160906 | 0.551±0.310 |
| HT-3* | 20160925 | 0.088±0.027 |
| HT-4* | 20160906 | 0.205±0.098 |
| HT-4* | 20160925 | 0.088±0.028 |
| 注: *样品HT-1—4均采自受到沉降绿藻影响的青岛王哥庄峰山近岸海域 | ||
甾醇是一类比较稳定的脂类化合物, 在海洋生物地球化学研究中经常用于指示有机质的来源。已有研究表明, 28-异褐藻甾醇广泛存在于石莼属绿藻中, 包括浒苔、石莼、孔石莼、肠浒苔、缘管浒苔和曲折刚毛藻等, 而且是这些绿藻的主要甾醇成分。尽管28-异褐藻甾醇也存在于豌豆、褐藻和泡叶藻等其他植物中, 但含量极低(Bolger et al, 1969; Knights, 1970; Itoh et al, 1980), 可以认为其对石莼属绿藻具有相对较高的特异性, 其同分异构体褐藻甾醇则是褐藻的主要甾醇成分(Ikekawa et al, 1968)。在前期研究中, 通过对中国近海绿藻、甲藻、硅藻和海金藻中19种/株藻华原因种的甾醇组成分析, 发现不同藻类的甾醇组成有较大差别, 同一类群下不同藻种之间也存在差异性, 但28-异褐藻甾醇仅在黄海绿潮原因藻种——浒苔中检出, 且是其主要甾醇成分(Geng et al, 2017)。以往研究(Okano et al, 1983)表明, 尽管浒苔中28-异褐藻甾醇含量随季节变化有所波动, 但其始终占据优势。考虑到黄海绿潮主要出现在6—7月, 浒苔中28-异褐藻甾醇含量的波动应该不会对其作为绿潮藻类的生物标志物产生影响。黄海绿潮发生初期, 苏北浅滩紫菜筏架上附生绿藻种类较多, 包括浒苔、缘管浒苔、扁浒苔、曲浒苔、盘苔等, 然而从养殖筏架脱落后, 漂浮至黄海海域的绿藻中浒苔所占比例迅速攀升, 在绿潮暴发期间占据绝对优势(Zhang et al, 2015)。因此, 我们认为绿潮发生后在黄海海域表层沉积物中检测到的28-异褐藻甾醇应当主要来自绿潮原因种浒苔, 28-异褐藻甾醇的分布和含量变动情况可以反映局部海域受绿潮藻类影响的情况。
3.2 以沉积物中28-异褐藻甾醇追溯绿潮后期漂浮藻类沉降区的可行性和应用前景绿潮已经在我国南黄海海域连续11年发生, 由于其生物量高、危害大, 受到广泛关注(Zhou et al, 2015), 但其对黄海海域生态系统的潜在影响并未得到充分认识。黄海绿潮过程中, 大量绿藻的生长、漂移和腐烂分解会显著影响黄海海域生源要素的迁移转化过程, 进而影响浮游植物群落组成, 甚至引发次生灾害。据估算, 黄海绿潮期间, 生物量达数百万吨的浒苔能够吸收约36万吨碳、2.3万吨氮和400吨磷, 这会直接影响海域浮游植物的生长。通过对遥感资料的分析, 有学者认为绿潮发展过程会抑制浮游植物生长, 从而对南黄海海域浮游植物的现存量造成影响(Xing et al, 2015)。更为令人关注的是, 在绿潮后期, 随着大规模绿藻漂移, 绿藻中的生源要素也随之从一个海域迁移到另外一个海域, 并在绿潮后期绿藻腐烂分解过程中释放到海水中(丁月旻, 2014)。室内模拟实验研究发现, 绿藻分解后会释放氮、磷等营养物质, 其中氮主要以还原态形式存在。浒苔分解液对不同种类微藻生长的影响具有明显差别, 它能够抑制硅藻生长, 对亚历山大藻和东海原甲藻等甲藻的生长则影响不大, 而对于赤潮异弯藻的生长则有显著的促进作用(Wang et al, 2012)。因此, 绿藻腐烂分解过程有可能改变海域营养盐结构, 甚至改变浮游植物群落的结构组成。此外, 绿潮消退后沉降绿藻的腐烂分解还可能造成局部水体缺氧, 分解产生的有毒硫化物也会对海洋动物造成毒害, 还有可能改变底栖生物群落结构。然而, 当前对于黄海海域大量漂浮绿藻的沉降区域还缺乏认知, 这极大地限制了对于绿潮生态效应的认识。本研究结果表明, 28-异褐藻甾醇是黄海绿潮原因藻种浒苔的主要甾醇成分, 能够特异性地指示绿潮藻类, 有潜力作为黄海绿潮原因种浒苔的生物标志物。
通过本研究的模拟实验发现, 沉降后的绿藻能够在1—2个月内完成腐烂分解, 而且沉积物中甾醇标志物含量与腐烂分解的浒苔生物量呈正相关。同时, 沉积物中的28-异褐藻甾醇能够在沉积物中至少稳定保存1个月。这表明通过对绿潮后期沉积物中28-异褐藻甾醇含量的及时采样分析, 应当能够追溯到绿潮后期漂浮藻类的沉降区域。基于本研究结果, 绿潮后期采样时段应当以1—2个月为宜, 时间较短不利于绿藻的腐烂分解, 而时间较长时沉积物中28-异褐藻甾醇则可能出现降解或扩散, 都有可能对实验结果造成影响。
现场调查发现, 青岛近岸绿潮沉降区的沉积物中均可以检测到高含量的28-异褐藻甾醇。在峰山近岸采集样品中28-异褐藻甾醇含量甚至高达0.7μg/g。在样品采集过程中, 可以观察到该处沉积物样品呈黑色, 且有有机质腐败产生的刺激性气味, 推测与漂浮绿藻沉降后的腐烂分解过程有关。绿潮藻类沉降区高含量的28-异褐藻甾醇一方面证明了沉积物中28-异褐藻甾醇与大量漂浮绿藻的沉降密切相关, 另一方面也表明近岸海域大量漂浮藻类的沉降可能会对近岸水产养殖业和生态环境造成威胁。值得注意的是, 浒苔沉降后留存在沉积物中的28-异褐藻甾醇含量在1个月后迅速下降, 这可能与绿潮消退后28-异褐藻甾醇的降解或稀释、扩散有关, 与实验室内模拟实验结果基本一致。已有研究表明, 甾醇和脂肪酸等有机物在表层(0—2.5cm)沉积物中降解速率较高(Canuel et al, 1996), 因此, 要通过沉积物中28-异褐藻甾醇追溯绿藻沉降区域, 还应在藻类沉降后短期内开展现场调查。
4 结论本研究结合现场调查和室内实验, 分析了28-异褐藻甾醇作为绿潮藻类生物标志物的可行性, 验证了28-异褐藻甾醇作为绿潮藻类生物标志物的稳定性和有效性。28-异褐藻甾醇作为绿潮藻类的生物标志物具有实用价值, 可以应用于现场调查, 作为指示绿潮藻类沉降区的有效指标。基于此, 在浒苔沉降后1—2个月内开展现场调查, 通过表层沉积物中28-异褐藻甾醇的含量来反映绿潮藻类的沉降区域, 应当可以查清黄海海域大量漂浮绿藻的最终归宿, 为分析黄海海域绿潮后期大量漂浮浒苔的沉降区域和初步评估其沉降量提供技术支持, 也有助于全面理解黄海绿潮的生态效应。
致谢 感谢中国科学院海洋研究所杨红生课题组对本研究中样品采集工作给予的帮助, 以及中国科学院海洋研究所分析测试中心彭全材高级工程师在仪器使用方面提供的技术支持。| 丁月旻, 2014.黄海浒苔绿潮中生源要素的迁移转化及对生态环境的影响.青岛: 中国科学院(海洋研究所)博士学位论文, 82-84 |
| 纪明候, 1997. 海藻化学. 北京: 科学出版社, 553-570 |
| Balakrishna K, Probst J L, 2005. Organic carbon transport and C/N ratio variations in a large tropical river:Godavari as a case study, India. Biogeochemistry, 73(3): 457–473 DOI:10.1007/s10533-004-0879-2 |
| Bolger L M, Rees H H, Goad L J, et al, 1969. Incorporation of[2-14C] mevalonic acid into 28-isofucosterol by leaves of Pisum sativum. Biochemical Journal, 114(4): 892–893 DOI:10.1042/bj1140892 |
| Canuel E A, Freeman K H, Wakeham S G, 1997. Isotopic compositions of lipid biomarker compounds in estuarine plants and surface sediments. Limnology and Oceanography, 42(7): 1570–1583 DOI:10.4319/lo.1997.42.7.1570 |
| Canuel E A, Martens C S, 1996. Reactivity of recently deposited organic matter:degradation of lipid compounds near the sediment-water interface. Geochimica et Cosmochimica Acta, 60(10): 1793–1806 DOI:10.1016/0016-7037(96)00045-2 |
| Dahl K A, Repeta D J, Goericke R, 2004. Reconstructing the phytoplankton community of the Cariaco Basin during the Younger Dryas cold event using chlorin steryl esters. Paleoceanography and Paleoclimatology, 19(1): PA1006 |
| Geng H X, Yu R C, Chen Z F, et al, 2017. Analysis of sterols in selected bloom-forming algae in China. Harmful Algae, 66: 29–39 DOI:10.1016/j.hal.2017.04.008 |
| Gibbons G F, Goad L J, Goodwin T W, 1967. The sterols of some marine red algae. Phytochemistry, 6(5): 677–683 DOI:10.1016/S0031-9422(00)86007-0 |
| Gibbons G F, Goad L J, Goodwin T W, 1968. The identification of 28-isofucosterol in the marine green algae Enteromorpha intestinalis and Ulva lactuca. Phytochemistry, 7(6): 983–988 DOI:10.1016/S0031-9422(00)82185-8 |
| Harris P G, Zhao M, Rosell-Melé A, et al, 1996. Chlorin accumulation rate as a proxy for quaternary marine primary productivity. Nature, 383(6595): 63–65 DOI:10.1038/383063a0 |
| Ikekawa N, Morisaki N, Tsuda K, et al, 1968. Sterol compositions in some green algae and brown algae. Steroids, 12(1): 41–48 DOI:10.1016/S0039-128X(68)80078-9 |
| Itoh T, Sakurai S, Tamura T, et al, 1980. Occurrence of 24(E)-ethylidene sterols in two solanaceae seed oils and rice bran oil. Lipids, 15(1): 22–25 DOI:10.1007/BF02534113 |
| Knights B A, 1970. Sterols in Ascophyllum nodosum. Phytochemistry, 9(4): 903–905 DOI:10.1016/S0031-9422(00)85204-8 |
| Liu D Y, Keesing J K, Dong Z J, et al, 2010. Recurrence of the world's largest green-tide in 2009 in Yellow Sea, China:Porphyra yezoensis aquaculture rafts confirmed as nursery for macroalgal blooms. Marine Pollution Bulletin, 60(9): 1423–1432 DOI:10.1016/j.marpolbul.2010.05.015 |
| Lü X G, Qiao F L, 2008. Distribution of sunken macroalgae against the background of tidal circulation in the coastal waters of Qingdao, China, in summer 2008. Geophysical Research Letters, 35(23): L23614, https://agupubs.onlinelibrary.wiley.com/doi/pdf/10.1029/2008GL036084 |
| Menzel D, Van Bergen P F, Schouten S, et al, 2003. Reconstruction of changes in export productivity during Pliocene sapropel deposition:a biomarker approach. Palaeogeography, Palaeoclimatology, Palaeoecology, 190: 273–287 DOI:10.1016/S0031-0182(02)00610-7 |
| Nelson D M, Treguer P, Brzezinski M A, et al, 1995. Production and dissolution of biogenic silica in the ocean:revised global estimates, comparison with regional data and relationship to biogenic sedimentation. Global Biogeochemical Cycles, 9(3): 359–372 DOI:10.1029/95GB01070 |
| Okano M, Aratani T, 1979. Constituents in marine algae. 1. Seasonal variation of sterol, hydrocarbon, fatty acid, and phytol fractions in Ulva pertusa. Bulletin of the Japanese Society of Scientific Fisheries, 45(3): 389–393 DOI:10.2331/suisan.45.389 |
| Okano M, Mizui F, Funaki Y, et al, 1983. Seasonal variation of sterol, hydrocarbon, fatty acid and phytol fractions in Enteromorpha prolifera (Muller) J. Agardh. Bulletin of the Japanese Society of Scientific Fisheries, 49(4): 621–626 DOI:10.2331/suisan.49.621 |
| Patterson G W, 1974. Sterols of some green algae. Comparative Biochemistry and Physiology Part B:Comparative Biochemistry, 47(2): 453–457 DOI:10.1016/0305-0491(74)90075-3 |
| Piepho M, Martin-Creuzburg D, Wacker A, 2012. Phytoplankton sterol contents vary with temperature, phosphorus and silicate supply:a study on three freshwater species. European Journal of Phycology, 47(2): 138–145 DOI:10.1080/09670262.2012.665484 |
| Safe L M, Wong C J, Chandler R F, 1974. Sterols of marine algae. Journal of Pharmaceutical Sciences, 63(3): 464–466 DOI:10.1002/jps.2600630338 |
| Volkman J K, 2003. Sterols in microorganisms. Applied Microbiology and Biotechnology, 60(5): 495–506 DOI:10.1007/s00253-002-1172-8 |
| Volkman J K, Barrett S M, Blackburn S I, et al, 1998. Microalgal biomarkers:a review of recent research developments. Organic Geochemistry, 29(5-7): 1163–1179 DOI:10.1016/S0146-6380(98)00062-X |
| Wang C, Yu R C, Zhou M J, 2012. Effects of the decomposing green macroalga Ulva (Enteromorpha) prolifera on the growth of four red-tide species. Harmful Algae, 16: 12–19 DOI:10.1016/j.hal.2011.12.007 |
| Wu P, Bi R, Duan S S, et al, 2016. Spatiotemporal variations of phytoplankton in the East China Sea and the Yellow Sea revealed by lipid biomarkers. Journal of Geophysical Research:Biogeosciences, 121(1): 109–125 DOI:10.1002/2015JG003167 |
| Xing Q G, Hu C M, Tang D L, et al, 2015. World's largest macroalgal blooms altered phytoplankton biomass in summer in the Yellow Sea:satellite observations. Remote Sensing, 7(9): 12297–12313 DOI:10.3390/rs70912297 |
| Zhang Q C, Liu Q, Yu R C, et al, 2015. Application of a fluorescence in situ hybridization (FISH) method to study green tides in the Yellow Sea. Estuarine, Coastal and Shelf Science, 163: 112–119 DOI:10.1016/j.ecss.2014.09.005 |
| Zhou M J, Liu D Y, Anderson D M, et al, 2015. Introduction to the special issue on green tides in the Yellow Sea. Estuarine, Coastal and Shelf Science, 163: 3–8 DOI:10.1016/j.ecss.2015.06.023 |
 2018, Vol. 49
2018, Vol. 49


