
中国海洋湖沼学会主办。
文章信息
- 张倩, 宋金明, 李学刚, 彭全材, 袁华茂, 李宁, 段丽琴. 2018.
- ZHANG Qian, SONG Jin-Ming, LI Xue-Gang, PENG Quan-Cai, YUAN Hua-Mao, LI Ning, DUAN Li-Qin. 2018.
- pH对SPE-HPLC-ESI-Q-TOF-MS检测海水中小分子活性物质的影响研究
- EFFECT OF pH ON EXTRACTION OF SMALL-MOLECULAR BIOACTIVE SUBSTANCES FROM SEAWATER BY SPE-HPLC-ESI-Q-TOF-MS
- 海洋与湖沼, 49(6): 1230-1242
- Oceanologia et Limnologia Sinica, 49(6): 1230-1242.
- http://dx.doi.org/10.11693/hyhz20180300056
-
文章历史
- 收稿日期:2018-03-19
- 收修改稿日期:2018-07-10
2. 青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室 青岛 266237;
3. 中国科学院大学 北京 100049;
4. 中国科学院海洋大科学研究中心 青岛 266071
2. Laboratory of Marine Ecology and Environmental Sciences, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
海洋中溶解有机物(dissolved organic matter, DOM)是地球上最大且最具异质性的活性碳库, 其浓度、组成和循环在过去20多年中吸引了众多学者的关注与研究(宋金明等, 2008, 2018; Kujawinski et al, 2009)。海洋DOM大部分由难以被生物利用的腐殖质等物质组成, 但其中也有大量具有生物活性的分子, 其独特的生物或生理作用不仅为人类研发新药物或材料提供启示, 而且在生态系统中也发挥着重要作用, 特别是其中的化感物质可以显著促进或抑制浮游植物的生长(宋金明等, 2018)。然而, 由于这些活性物质来源多种多样, 化学组成十分复杂, 包括氨基酸、糖类、脂肪酸、酚、萜、大环内酯、环聚醚、嘌呤碱等(Kujawinski et al, 2009; 彭全材等, 2014; Assunção et al, 2017), 在海水中单组份有机物的浓度极低(通常小于1mmol/L), 而海水又是一种含有大量无机盐的复杂基质(Dittmar et al, 2008; Koprivnjak et al, 2009), 沉积物的再悬浮与颗粒物的形成与分解有严重干扰有机组分的检测(宋金明等, 2018), 使得检测这些活性物质在海洋环境中的存在形态和含量变得极其困难, 探究它们在生态系统中发挥何种作用只能依靠实验室模拟培养和野外观测现象来猜测(Song et al, 2018)。这些物质中仅有少量组分可以确定为已知物质, 其余绝大部分只能划分到大类, 缺乏分子层面的描述(张倩等, 2017)。
如何提取海水中的有机活性物质是探知其组成和含量的关键一环。为进行更精确的分子鉴定, 从理论上来说所得提取物应脱去大体积的海水、完全脱盐, 保留下足量、有组分代表性的DOM, 且处理步骤不能引入污染(Dittmar et al, 2008; Koprivnjak et al, 2009; 孙玲玲等, 2018)。经过几十年的努力, 基于固相萃取小柱的DOM提取方法已经建立并且广泛应用于各种环境样品, 与XAD树脂或超滤法相比, 使用固相萃取小柱富集提取海水中的有机活性物质不需要冗长的前处理过程, 提取效率高, 操作流程简单方便, 极大地降低了人工操作对提取效率的影响程度, 使结果更具可重复性(Dittmar et al, 2008)。不同固相萃取填料分离得到的提取物组成有所差异, PPL填料倾向于保留高比例的含氮化合物, C18填料对于高饱和度的分子更具亲和力, 亲水-疏水平衡(Hydrophilic- Lipophilic Balanced, HLB)填料对极性和非极性分子都有较好的提取效果, 并且对于酸碱和干燥等不利条件有很好的耐受性, 尤其适用于野外采样的现场处理, 已被广泛应用于从海水中检测各类有机物(韩典峰等, 2016)。
使用固相萃取法提取海水DOM时, 通常需要对水样进行预处理, 但不同文献报道的预处理方法及原因各不相同。采用常规固相萃取法提取海水DOM时, 通常需要加酸酸化以防止金属离子络合和提高提取效率(Cawley et al, 2016)。Cawley等(2016)鉴定南极盐湖间隙水中的溶解有机物时将水样酸化至2。在用HLB小柱提取自然水体中的药物、抗生素(张金等, 2015)、雌激素(廖涛等, 2013)和酰胺类除草剂(吴春英等, 2016)时, 通常将水样pH调节为3以获得最大提取效率。顾佳萍(2011)研究软骨藻酸的提取条件时也发现, 采用较大量(500mL)海水时pH为3能收获最大提取效率。袁圣柳等(2013)用HLB小柱提取生活污水中的抗精神病药物时将水样pH调节至7。陈猛等(2009)探究水样pH对于HLB小柱提取自然水体中农药残留的影响时发现, 水样pH在6—8.5的变化对于提取效率没有影响。采用HLB小柱提取海水中的除草剂(韩典峰等, 2016)、兽药(洪家俊等, 2013)、农药(孙静等, 2015)和有机磷酯(陈玫宏等, 2017)时, 也不需调节水样pH就可获得理想的回收率。但Dittmar等(2008)用盐酸将海水pH酸化至2, 并以未酸化和加NaOH调节pH至12的水样作为对照, 发现其对有机酸和酚类的提取效率仅为酸化水样的三分之一。这些成果充分说明在前处理环节选择合适的样品pH对取得理想的提取和检测结果至关重要。但到目前为止, 用固相萃取法提取海水DOM的最适pH仍存在争议。虽然一些研究在定性分析海水中的天然溶解有机物时将海水pH酸化至2(Cawley et al, 2016; Hertkorn et al, 2016; LaRowe et al, 2017; Li et al, 2017), 但这些报道均基于受人类活动影响很小、溶解有机物来源相对简单的大洋或极地水体, 而近海海水中的溶解有机物种类更加多样, 组成成分与大洋溶解有机物有较大差异, 其中来源于人类活动的活性有机物分子占很大比例。针对近海海水特殊的有机物组成情况(梁宪萌等, 2016), 应选用何种pH条件对其中的活性分子萃取效果最好?不同样品pH对表征其分子组成又有什么影响?这些问题尚未见具体分析。基于样品pH对HLB固相萃取小柱的重要影响, 本文重点研究了不同pH条件下用HLB固相萃取小柱提取近海海水中的活性物质(分子)的提取效率, 并使用高效液相色谱-四极杆飞行时间质谱(HPLC-Q- TOF-MS)仪器在负离子(ESI-)模式下定性分析检测解析提取物的具体分子组成。
1 材料与方法 1.1 仪器与试剂电喷雾四极杆飞行时间质谱(ESI-Q-TOF MS)(德国Bruker公司); 1260 Infinity液相色谱系统(美国Agilent公司); 固相萃取装置(美国Agilent公司); 氮吹仪; GM-0.33A型隔膜真空泵(天津津腾实验设备有限公司); Seven Excellence多参数pH计(美国梅特勒-托利多集团); VarioTOC总有机碳分析仪(德国Elementar公司); 连续流动分析仪(德国QuAAtro公司)。
InfinityLab Poroshell 120 EC-C18色谱柱(美国Agilent公司); Supel-Select HLB小柱(美国Sigma- Aldrich公司); GF/F滤膜(英国Whatman公司); 甲醇和乙腈(HPLC级, 德国Merck公司), NaCl(分析纯, 国药集团化学试剂有限公司)。超纯水系统(18 MΩ cm)由本实验室Milli-Q超纯水系统(美国Milli-pore公司)制备。
所有玻璃器皿及滤膜均经过马弗炉高温灼烧(560℃, 6h), 并用超纯水洗净烘干。
1.2 实验方法 1.2.1 海水样品采集实验用海水采集自南黄海海滨青岛汇泉湾, 采水使用的玻璃广口瓶事先经过560℃灼烧5h, 用超纯水冲洗干净并烘干, 采水前用样品海水润洗, 采得样品立即运回实验室进行下一步处理。
1.2.2 海水样品前处理海水样品采集后立即使用干净的玻璃滤器通过Whatman GF/F玻璃纤维膜(预先450℃灼烧5h并用样品海水浸洗)过滤, 用pH计测定海水pH和盐度, 留出部分样品储存于配有聚四氟乙烯垫片和旋口瓶盖的玻璃瓶中, -20℃保存以备溶解有机碳(dissolved organic carbon, DOC)和溶解有机氮(dissolved organic nitrogen, DON)测定。剩余样品分为7组, 分别用盐酸酸化至pH为2、3、4、5、6、7和不酸化。
本文选择以亲水改性苯乙烯聚合物为填料的HLB固相萃取小柱进行实验, 使用步骤依据厂家提供的推荐方案, 过柱流程均通过固相萃取装置实现。正式进样前依次用6mL甲醇和6mL酸化至与样品相同pH的超纯水活化HLB小柱。保持柱床湿润, 以不超过10mL/min的流速将500mL样品通过小柱。随后用至少15mL酸化至样品pH的超纯水淋洗填料, 以保证完全除盐。继续减压抽干5min使填料干燥, 将小柱连接至配有聚四氟乙烯垫片及旋口瓶盖的玻璃样品瓶, 用6mL甲醇:乙腈(50︰50 v/v)以不超过2mL/min的流速洗脱, 洗脱液储存于-20℃以备进一步检测。空白组分别用超纯水和人工海水(35g NaCl /L)经过相同步骤获得。
1.2.3 总DOC及DON测定为比较HLB固相萃取小柱的提取效率, 分别对过滤后的海水样品及其HLB提取物进行DOC定量。样品用浓硫酸酸化至pH值为2, 使用总有机碳分析仪以高温催化氧化-非色散红外吸收法测定DOC含量, 同时以邻苯二甲酸氢钾标准溶液校准, 测量精度为1%, 检测限为0.06mg/L。用连续流动分析仪测定样品中NH4-N、NO3-N和NO2-N的浓度, 三者之和即为溶解无机氮(DIN)含量(即样品中的本底氮含量), 同时利用微波协助-过硫酸钾氧化法消解样品中其他形式的N, 将其转化为NO3-N, 再用连续流动分析仪测定消解后样品中三种形态的氮含量, 得到溶解态总氮含量(DTN), DON含量为DTN与DIN含量的差值。提取物DOC和DON按如下方法测定:取一定量的HLB洗脱液, 氮吹至干燥, 用超纯水重新溶解, 洗脱液的测定结果根据固相萃取的浓缩系数进行相应换算, 再与海水样品DOC和DON相除以计算提取效率。
1.2.4 HPLC-ESI-Q-TOF-MS条件色谱条件: Infinity Lab Poroshell 120 EC-C18色谱柱(3.0×50mm, 2.7μm), 柱温20℃; 进样量20μL; 流动相由水(A)和乙腈(B)组成, 流速为0.2mL/L, 梯度洗脱程序: 0—1min, 10% B; 1—2min, 10%—35% B; 2—12.5min, 35%—75% B; 12.5—22min, 90% B; 22—25min, 10% B。质谱条件:样品以120μL/h的速度通过ESI离子化进样, 质谱用ESI(-)模式运行, 毛细管电压为3500V, 进样口电压为20V, 载气流速4L/min, 温度为200℃。采用全扫描模式, 质谱扫描范围50—1800m/z。二级质谱碰撞能分别为5、10、20和40V。每日进样前以小分子混合校正液校正仪器, 质量准确度小于0.1ppm。液相进样的同时加入甲酸钠内标作为校正。
1.2.5 数据处理及统计学分析ESI-Q-TOF-MS产生的原始数据采用DataAnalysis软件进行质谱峰识别和分子式计算, 得到包含质荷比、响应值、信噪比和计算分子式的数据表, 然后用Excel软件进行数据处理。主成分分析(PCA)由Past软件进行, 由于样品中各质谱峰的响应值高低差距非常大, 故将响应值取对数作为矩阵分析, 并用1替换原本为0的响应值(log1=0)。用DataAnalysis软件进行质谱峰自动识别和匹配, 匹配分子式为C0-∞H0-∞O0-∞N0-10P0-3S0-3Cl0-3, 考虑[M-H]-和[M+Cl]-加合模式, 质量误差小于5ppm, 匹配评分大于70。当匹配结果不唯一时, 选用匹配评分最高的分子式。
HPLC-ESI-Q-TOF-MS数据通过云端代谢组学数据处理平台XCMS Online (https://xcmsonline.scripps.edu)进行特征检测和保留时间校正、归类, 得到一系列以m/z、保留时间和响应强度表示的特征离子(Tautenhahn et al, 2012; Gowda et al, 2014; Benton et al, 2015)。仅选用保留时间大于0.3min、峰高相差4倍以上且具有对应的加合离子或同位素离子的特征离子作为有效特征离子。通过二级质谱推算这些差异特征离子的结构式, 通过Chemspider数据库检索, 选择质量误差小于0.05ppm的结果, 结合文献报道确认相应的物质。
2 结果与讨论 2.1 海水不同pH条件下的提取效率用HLB小柱对不同pH的海水样品进行提取, DOM提取效率为7.9%—42.3%(表 1)。天然海水DOM组成成分复杂, 不同组分分子间的分子量和极性均有很大差异, 很难用单一填料获得很高的提取效率, 同类方法对海洋DOM的提取效率通常在10%—50%之间(Li et al, 2017), 因此除pH为5和6的样品外, 其余pH条件下的提取效率均在正常范围内。总体来说人工海水样品的DOM提取效率高于天然海水, 可能是因为人工海水中的DOM含量组成成分较为简单, 相对容易提取。天然海水与人工海水DOM提取效率的差异表明盐度不是影响HLB小柱提取效率的最主要因素, DOM本身的组成成分和具体结构特性作用更加突出。有趣的是, DOM提取效率与海水pH值之间并不是单调递增或递减的关系, 而是在pH介于5—6之间出现最低值, 对此可能的解释是pH对于DOM提取效率的影响不仅仅是通常认为的防止金属离子络合和共沉淀, 而且在不同的pH环境下有机分子本身的解离状态也会发生变化, 从而影响其在固相萃取填料吸附位点上的吸附状态, 造成提取效率变化。HLB小柱对pH调节为7的海水样品DOM提取效率最高, pH为2的次之, 但是具体哪一种pH条件对于海水中小分子活性物质的提取效率最高, 还需结合提取物的具体分子组成来分析。
| 样品名称 | pH | 盐度 | DOC (mg/L) |
提取物DOC (mg/L) |
DON (μg/L) |
提取物DON (μg/L) |
C/N | 提取物C/N | 提取效率 |
| 超纯水空白 | 7.05 | 0 | n.d. | n.d. | n.d. | n.d. | — | — | — |
| 2.00 | 2.13 | n.d. | n.d. | — | — | ||||
| 人工海水空白 | 6.02 | 35.64 | 1.05 | 0.24 | 64.82 | 16.57 | 18.9 | 16.9 | 23.2% |
| 2.00 | 37.47 | 0.41 | 13.32 | 35.9 | 39.3% | ||||
| 海水样品 | 8.08 | 30.65 | 2.70 | 0.34 | 101.49 | 12.18 | 31.0 | 32.6 | 12.7% |
| 7.00 | 30.65 | 1.14 | 10.91 | 21.9 | 42.3% | ||||
| 6.00 | 30.73 | 0.24 | 9.46 | 29.6 | 9.0% | ||||
| 5.00 | 30.75 | 0.21 | 10.85 | 22.6 | 7.9% | ||||
| 4.00 | 30.30 | 0.49 | 26.32 | 21.7 | 18.3% | ||||
| 3.00 | 30.59 | 0.45 | 11.44 | 45.9 | 16.8% | ||||
| 2.00 | 32.38 | 0.55 | 14.44 | 44.4 | 20.3% |
按照1.2.4节建立的ESI-Q-TOF-MS质谱条件直接进样分析海水样品及空白对照, 图 1为空白溶剂、高纯水空白、人工海水空白和海水的质谱总离子流图。从图中可以看出, 超纯水空白在质谱上的响应强度最高, 人工海水次之, 其响应强度与溶剂空白类似, 天然海水的响应强度最低, 这说明天然海水有严重的基质效应, 会干扰质谱分析的准确性, 使其具体DOM组分难以分辨。观察不同pH的同种样品质谱响应强度, 发现pH越小, 响应强度越低。这说明调节样品pH加入的酸增大了样品的离子强度, 使样品基质效应对分析的干扰更大, 可能对某些低含量物质的定量检测造成不利影响。
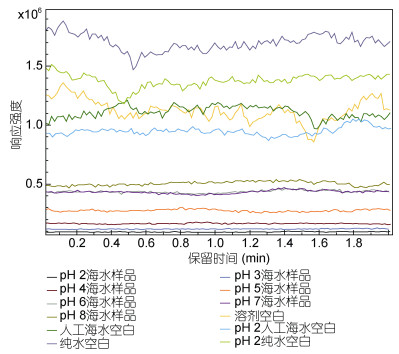 |
| 图 1 空白溶剂、超纯水空白、人工海水空白和海水提取物的质谱总离子流图 Fig. 1 Total ion chromatograms of solvent, ultrapure water, artificial seawater, and natural seawater extracts |
选取相对强度大于0.1%、信噪比大于20且不出现在仪器空白中的m/z谱峰视为有效峰。结合质谱图(图 2)和有效峰数目(表 2)发现, 随着样品pH的降低, 谱峰数目随之增加, 而总质谱响应值降低, 造成目标谱峰与背景噪音之间的差别减小, 有效峰数目不是随样品pH降低而单调递增的, 但总体看来还是pH为2时有效峰数目最多, 表示将水样pH调节至2有利于检出更多种有机分子, 对定性分析海水溶解有机物的分子组成最为有利。除了与pH的正相关关系外, 质谱响应值与样品盐度也表现出了明显的关联性, 人工海水空白响应值明显低于纯水空白, 说明样品间响应值的降低与样品离子强度差异带来的基质效应有关。随着加酸酸化, 样品的离子强度增加, 酸化到pH为2时盐度比原水样增加了两个单位左右(表 1), 随之而来的基质效应会对检测响应值较低的物质造成不利影响, 这表示在对特定有机物进行定量检测时, 还需结合具体物质的提取效率选择合适的pH条件。
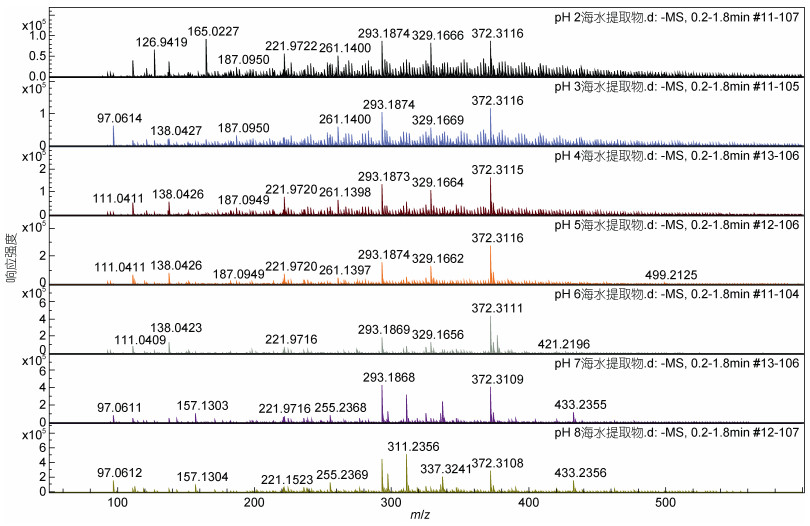 |
| 图 2 不同pH海水样品提取物的质谱图 Fig. 2 Mass spectrum of seawater extracts at different pH values |
| 样品名称 | 纯水空白 | 人工海水空白 | 海水样品 | ||||||||
| pH | 7.05 | 2.00 | 6.02 | 2.00 | 8.08 | 7.00 | 6.00 | 5.00 | 4.00 | 3.00 | 2.00 |
| #有效峰 | 628 | 599 | 730 | 832 | 1042 | 1065 | 1335 | 1532 | 1420 | 1355 | 1570 |
| #总分子式 | 45 | 37 | 52 | 56 | 214 | 235 | 257 | 401 | 413 | 400 | 494 |
| 平均响应值 | 103210 | 86634 | 60691 | 46552 | 14202 | 12834 | 12548 | 9005 | 10139 | 11275 | 9633 |
| 平均m/z | 293.26 | 292.55 | 280.01 | 274.21 | 344.04 | 333.07 | 332.48 | 343.37 | 311.76 | 290.65 | 324.90 |
| %CHO | 15.6 | 10.8 | 15.4 | 10.5 | 6.5 | 6.4 | 5.8 | 8.2 | 8.2 | 6.2 | 5.7 |
| %CHON | 66.7 | 64.9 | 51.9 | 55.4 | 35.0 | 32.3 | 25.7 | 24.9 | 28.6 | 25.2 | 24.9 |
| %N | 78.3 | 81.6 | 67.9 | 73.2 | 73.8 | 74.9 | 68.5 | 68.1 | 72.4 | 71.5 | 69.4 |
| %S | 13.3 | 13.5 | 23.1 | 23.2 | 40.6 | 43.8 | 55.2 | 50.6 | 49.2 | 51.5 | 54.4 |
| %P | 17.8 | 16.2 | 13.5 | 7.1 | 21.0 | 21.7 | 28.0 | 27.4 | 21.1 | 23.5 | 24.5 |
| %Cl | 0 | 0 | 0 | 7.1 | 16.4 | 20.4 | 12.4 | 15.7 | 14.0 | 7.5 | 15.2 |
| #Ca | 15.5 | 15.3 | 14.1 | 13.6 | 16.3 | 14.8 | 16.2 | 16.4 | 14.4 | 14.0 | 15.1 |
| #Cla | 0.0 | 0.0 | 0.0 | 0.1 | 0.2 | 0.2 | 0.1 | 0.2 | 0.1 | 0.1 | 0.2 |
| #Ha | 28.0 | 27.7 | 26.8 | 25.1 | 26.1 | 24.5 | 21.9 | 20.7 | 18.4 | 18.2 | 17.7 |
| #Na | 2.6 | 2.7 | 2.5 | 2.9 | 3.1 | 3.3 | 2.7 | 2.8 | 3.0 | 2.8 | 2.8 |
| #Oa | 1.8 | 1.7 | 1.7 | 1.4 | 2.2 | 2.2 | 1.8 | 2.1 | 2.1 | 1.5 | 2.2 |
| #Pa | 0.2 | 0.2 | 0.2 | 0.1 | 0.3 | 0.3 | 0.4 | 0.4 | 0.3 | 0.3 | 0.3 |
| #Sa | 0.2 | 0.1 | 0.3 | 0.3 | 0.5 | 0.6 | 0.7 | 0.7 | 0.6 | 0.6 | 0.7 |
| H/C | 1.8 | 1.8 | 1.9 | 1.8 | 1.6 | 1.7 | 1.3 | 1.3 | 1.3 | 1.3 | 1.2 |
| O/C | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 | 0.2 | 0.1 | 0.1 | 0.1 | 0.1 | 0.1 |
| C/N | 6.1 | 5.7 | 5.6 | 4.7 | 5.2 | 4.5 | 6.0 | 5.8 | 4.8 | 4.9 | 5.4 |
| RDB | 4.2 | 4.2 | 3.3 | 3.8 | 5.9 | 5.2 | 7.9 | 8.7 | 7.8 | 7.7 | 9.0 |
| 注: #有效峰:有效峰数目; #总分子式:解析出的总分子式数目; %CHO:由C、H、O三种原子组成的分子占总分子式种类的比例; %CHON:由C、H、O、N四种原子组成的分子占总分子式种类的比例; %N、%S、%P、%Cl:含有N、S、P、Cl原子的分子占总分子式种类的比例; #Ca、#Cla、#Ha、#Na、#Oa、#Pa、#Sa:平均C、Cl、H、N、O、P、S原子数; RDB:环加双键当量 | |||||||||||
限于Q-TOF质谱的分辨率, 为保证计算出分子式的准确度, 在对质谱峰进行分子式指认时只选取相对响应值大于1%的有效峰用DataAnalysis软件进行质谱峰的自动识别和分子式指认, 采用考虑C、H、O、N、S、P和Cl元素下匹配度最高的分子式, 各样品能被指认为特定分子式的谱峰统计情况如下表(表 2)。实际海水样品中能被指认为特定分子式的谱峰个数仅占总有效峰数目的20%—30%, 总体来说随着海水pH的降低, 指认出的分子式种类增加, 当海水pH为2时指认出的分子式种类最多。
海水中天然有机物的元素组成通常以C、H和O为主, 仅含有这三种元素的有机物占检出总有机物的39%—62% (张耀玲, 2013; LaRowe et al, 2017), 但本文采集的海水样品中仅由C、H、O三种元素组成的化合物不足全部检出种类的10%, 绝大部分鉴别出的分子式带有杂原子, C、H、O、N四种元素组成的分子占总分子式的24.9%—35.0%, 含S原子的分子接近总分子种类的一半, 含P原子的分子约占24%, 含Cl原子的分子在空白组中几乎不存在, 而在天然海水中占7.5%—20.4%。提取物的具体分子组成与提取方法有关, 用XAD树脂提取水体DOM倾向于保留元素组成较为简单的物质, 提取物中由C、H、O三种元素组成的物质可达50%以上(Cawley et al, 2016; Derrien et al, 2017), 电渗析(Koprivnjak et al, 2009; 张耀玲, 2013)和常用的几种SPE小柱(包括C18、PPL和本实验采用的HLB填料)(Li et al, 2017)对含杂原子分子的保留度较高, 因此提取物中仅由C、H、O三种元素组成的化合物占总检出种类的比例较少。鉴于空白组测定结果中含有大量含N化合物, 有理由猜测在萃取过程中, 是否存在部分用于填料亲水改性的含氮基团(通常是N-乙烯基吡咯烷酮结构)脱落, 与样品DOM一起被洗脱, 对检测结果造成干扰。但空白组提取物中DOC和DON含量不高(表 1), 尤其是纯水空白提取物中DOC和DON均低于检测限, 且样品与提取物的总C/N比均大于20, 说明填料渗漏出的N不足以对检测结果造成这样大的干扰。本文海水样品分子组成与文献报道差异较大的原因还有可能是新鲜的近海海水与大洋深层海水DOM分子组成本身具有很大差异。目前对海水DOM具体分子组成的研究集中于贫营养的大洋(LaRowe et al, 2017)、南极盐湖(Cawley et al, 2016)或某些具有特殊生态系统的近岸海区, 如红树林河口区(张耀玲, 2013)等, 像本文采用的这种同时受到人为因素和自然因素影响的海水其DOM分子组成如何尚缺乏足够的数据参考。但近海海水中的有机物来源更加复杂, 影响因素多种多样, 与大洋海水相比有机氮磷的种类更为丰富(宋金明, 2004)。人类日常生活及工业生产过程会向环境中释放大量有机磷类杀虫剂、多氯联苯、卤代烃、亚硝胺、含硫农药及药物等有机污染物(汪珊等, 2005; 彭全材等, 2014; 刘清泉等, 2016), 这些带有杂原子的化合物在近海水体中经历复杂的生物、化学过程后形成多种多样的加合或降解产物, 因此, 相较于大洋海水, 近海海水中含有N、P、S、Cl等杂原子的分子种类繁多, 占总DOM分子种类的比例也更高, 造成了本文中这种宏观C/N比较高但微观C/N比很低、含有杂原子的分子占总分子式种类的比例很高的现象。
对空白样品和不同pH的样品质谱峰及其响应强度进行主成分分析(图 3), 发现选择不同pH条件进行萃取时, 解析出的有机分子组成特征存在差异, 横坐标代表的主成分1解释了34.2%的差异, 纵坐标代表的主成分2解释了19.5%的差异。代表不同样品的点分别落在4个象限内, 据此将它们分成空白、中性、弱酸性和强酸性4组, 同组样品间分子组成特征相近, 不同组别的分子组成特征差异较大。虽然强酸性组的质谱峰分布更加分散, 但由于总有效峰数目的增加, 平均m/z值反而比中性组低。由C、H、O这3种原子组成的分子所占比例在4个组别中仅有微弱差异, 中性组由C、H、O、N这4种原子组成的分子所占比例略高, 含Cl原子的分子占比也比酸性条件下的提取物高, 在强酸组中检出含S分子的几率更高, 弱酸组对含P分子的选择性略高于强酸组。随着海水pH的降低, 提取物分子组分的平均RDB值更高, 即含有环和双键等不饱和基团或碳链结构的分子更多。许多常见的生物活性分子含有N、S、P等杂原子(如氨基、亚氨基、巯基、磷酸基等)或含有不饱和基团(如羰基、酯、酐、酰胺等), 因此弱酸性组和强酸性组比中性组检出生物活性分子的几率更高。但由于弱酸性组的提取效率太低, 综合考虑还是强酸性组对生物活性分子的提取效果更好, 其中尤以海水pH调节为2效果最好。
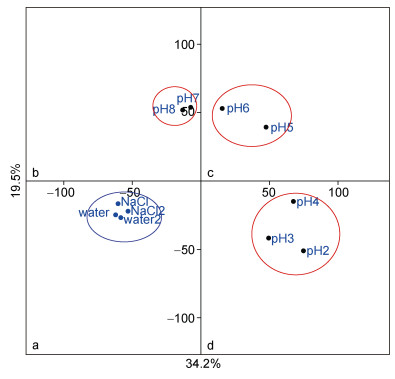 |
| 图 3 空白组及海水不同pH条件下提取物组成的主成分分析图 Fig. 3 PCA of extracts of blanks and seawater in different pH values 注: a:空白组; b:中性组; d:弱酸组; d:强酸组 |
当以m/z作为横坐标时, 从图 4中可以直观地看出组分分子的质量分布情况。HLB固相萃取法提取到的海水DOM以小分子为主, 主体质量落在100—600m/z之间。中性环境下提取得到的物质分子量集中在200—500m/z间, 随着样品pH的降低, 提取物的分子量分布范围更加广泛。本文中的HLB提取物主要由小分子高饱和度的脂或烃和一系列分子量稍高的不饱和化合物组成, 分子量较高的化合物倾向于有更低的H/C比值。
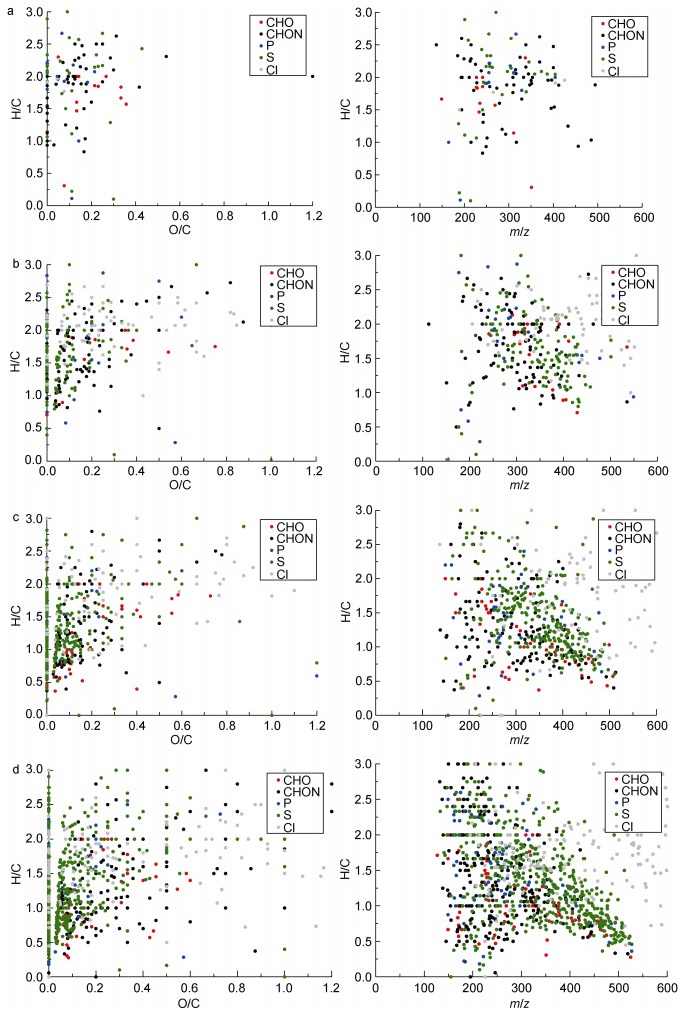 |
| 图 4 空白组(a)、中性组(b)、弱酸组(c)和强酸组(d)的van Krevelen图及m/z-H/C图 Fig. 4 The van Krevelen and m/z-H/C diagrams of blanks (a), seawater in neutral (b), weak acidic pH (c), and strong acidic groups (d) |
许多生物相关的分子都有特定的H/C比和O/C比, 因此它们在van Krevelen图中有特定且唯一的表示区域(Derrien et al, 2017), 如:脂类(1.5≤H/C≤2.0, 0≤O/C≤0.3)、蛋白质(1.5≤H/C≤2.2, 0.3≤O/C≤ 0.67)、糖类(1.5≤H/C≤2.4, 0.67≤O/C≤1.2)缩合的芳环结构(0.2≤H/C≤0.7, 0≤O/C≤0.67)、木质素(0.7≤H/C≤1.5, 0.1≤O/C≤0.67)、不饱和碳氢化合物(0.7≤H/C≤1.5, 0≤O/C≤0.1)和单宁(0.5≤H/C≤1.5, 0.65≤O/C≤1)。对这4组样品分别做van Krevelen图(图 4)可以看出, 中性组的组分分子在van Krevelen坐标中的分布最为集中, 主要是脂质和不饱和烃, 在图的右下方几乎没有组分分子点存在。随着海水pH的降低, 组分分子在van Krevelen坐标中的分布更加分散, 表示提取出的物质种类更多, 分子异质性高。在中性组中几乎没有出现的木质素、蛋白质和糖类在酸性条件下能被提取出来, 含有高不饱和结构的芳香族、烯类和脂环类物质种类也在酸性条件下增加, 这说明前处理时样品pH的减小更有利于检测含有高不饱和基团的生物组分分子。强酸性组提取出的DOM在van Krevelen坐标中的分布情况更接近于文献中报道的典型天然水体DOM的分子组成(张耀玲, 2013; LaRowe et al, 2017; Rathgeb et al, 2017)。目前已有报道的生物活性分子虽然性质各异, 结构多样, 但大部分是带有这样高不饱和基团的多肽、多糖、酮、酯、有机酸等物质(Song, 2010; 吴梧桐等, 2000; 张倩等, 2017), 表明强酸性的样品前处理条件更适合用以提取海水中的小分子活性物质。
由于弱酸性组的提取效率太低, 不利于从复杂的海水基质中提取低含量的活性分子, 因此下文的讨论中均排除弱酸性组, 仅比较中性组和强酸性组的组成差异。
为了更直观地比较中性组和强酸性组中检出分子的差异, 图 5将两组检出的分子峰响应强度比值(单组峰强度/两组峰强度之和)同时置于van Krevelen坐标中, 观察不同区域的分子丰度差异。所有分子点都分布在van Krevelen坐标的左上部分, 显然, 强酸组更易检出的分子更多, 分布范围也更广泛, 在H/C比为1、O/C比小于0.2的区域最为集中, 说明更易在较低pH条件下检出的分子的种类相对丰富, 以不饱和或带有芳环结构的碳氢化合物为主。中性pH条件下检出的分子点则主要分布于H/C大于1.5、O/C小于0.3的区域, 说明中性pH条件对脂类的选择性更高。与生物相关的脂类大部分作为储能物质(如脂肪)和结构分子(如磷脂), 仅有固醇具有生物活性, 而固醇属于类异戊二烯类物质, 通常以环戊烷多氢菲为基本结构并且带有羟基, 具有较高的不饱和度和含氧量, 这些物质在较低pH条件下也能获得不错的提取效果, 说明强酸性pH条件对活性分子的检测解析效果更好。
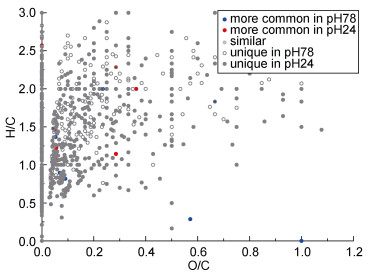 |
| 图 5 中性组与强酸组测得分子峰的响应强度比例图 Fig. 5 The peak magnitude ratios of seawater in the neutral and strongly acidic groups 注:红色圆点表示该分子在强酸性条件下检出的几率更高, 蓝色圆点表示该分子在中性条件下检出几率更高, 浅灰色圆点表示该分子在两种条件下检出的几率一致。只在中性组中出现的分子式用深灰色中空圆点表示, 而只在强酸性组中出现的分子式用深灰色实心圆点表示 |
在归一化质量相同的前提下, 较高的Kendrick质量亏损(KMD)值表示该分子有更高的氧化程度或不饱和度, 由KMD值推导出的分子信息用Kendrick图可以有效描述(Liu et al, 2011)。Kendrick图以归一化质量为横坐标, KMD值为纵坐标。在图中, 双键当量(DBE)或氧含量不同的分子由于KMD值不同, 从而在垂直方向上区分开来, 而DBE和氧含量相同的CH2同系物则出现在同一行中(间隔14Da)。对只在强酸组出现、只在中性组出现和二者共有的DOM分子作Kendrick图(图 6), 图 6a是常规的Kendrick图, 即KMD值由将CH2结构单元质量视为14.00计算得到。随着归一化质量的增加, KMD值也随之增加, 这是因为高质量的分子通常具有更高的芳香化或氧化程度。两种pH条件提取得到的DOM分子有一定程度的重叠, 在两种pH条件下都能提取出的分子主要是不饱和度和氧化度较低的小分子。在较低pH条件下提取得到的DOM分子具有更高的KMD值(代表强酸性组分子的点出现在Kendrick图的上方), 表示较低的样品pH有利于提取具有高不饱和度和氧化程度的分子, 这些分子中含有芳环和羰基、羧基等不饱和含氧基团的可能性更高。图 6b是将O原子质量视为16.00计算得到KMD值作出的Kendrick图, 这种改良的Kendrick图能够区分氧含量或不饱和度增加导致的KMD值升高。两组样品的重叠部分与图 6a一致, 都是不饱和度和含氧量较低的小分子物质。但代表强酸性组分子的点出现在图的上方, 表示低pH条件下提取得到的DOM分子不饱和度主要由含氧基团贡献, 而中性pH条件下得到的DOM分子不饱和度主要由双键、芳环等不饱和碳链结构贡献。结合两种Kendrick图可以推测, 较低的pH条件更有利于提取带有含氧不饱和基团(如:羧基、羰基)和环氧结构的分子, 而这些结构容易形成活性位点, 更有可能具有生物活性。
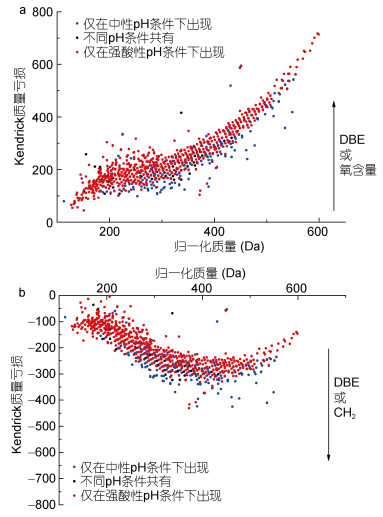 |
| 图 6 中性组和强酸组组分分子的Kendrick图 Fig. 6 The Kendrick mass defect plots of extracts of the neutral and strong acidic seawater 注: a:将CH2结构单元的质量归一化为14.00; b:将O原子的质量归一化为16.00。蓝色的点表示只在中性组中出现的分子, 红色的点表示只在强酸性组中出现的分子, 黑色的点表示在两组都出现的分子。DBE:双键当量; CH2:分子结构相差一个或几个CH2结构单元 |
HPLC-ESI-Q-TOF-MS数据由XCMS在线数据处理平台分析, 对保留时间进行校正后的总离子流色谱图(TIC)如图 7所示, 虚线表示强酸组提取物, 实线表示中性组提取物。样品pH为2、3、4的TIC较为重合, 样品pH为7和8的TIC出峰相似, 两组间则有明显差异, 保留时间在2—8min和16min左右时差异最为显著。
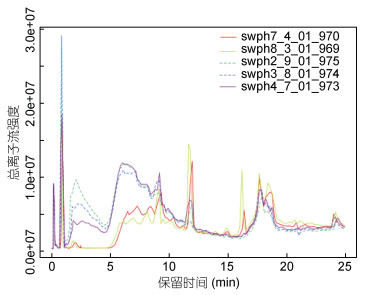 |
| 图 7 进行保留时间校正后中性组和强酸组DOM提取物的总离子流色谱图 Fig. 7 Total ion chromatogram of seawater extracts in the neutral and strong acidic groups after retention time correction 注:图中红色实线表示pH为7的海水提取物, 黄色实线表示pH为8的海水提取物, 绿色虚线表示pH为2的海水提取物, 蓝色虚线表示pH为3的海水提取物, 紫色实线表示pH为4的海水提取物 |
排除保留时间小于0.3min、峰高相差小于4倍和没有对应的同位素或加合离子峰的特征离子, 通过XCMS进行两组对比共找出150个具有统计学差异(P < 0.05)的特征, 其中66个具有显著差异(P < 0.01), 20个具有极显著差异(P < 0.001)。在所有具有统计学差异的特征离子中, 在强酸组中更显著的特征离子有119个, 在中性组中更显著的有31个(图 8), 表明较低的样品pH条件对更多种有机物有较好的提取表征效果, 这些有机物的特征离子m/z通常小于600。观察这些具有显著差异的特征离子在保留时间上的分布(图 9)发现, 强酸组的差异特征离子出峰较早, 保留时间多小于10min, 说明较低的样品pH条件对于极性较大的分子有更好的提取效果, 其中样品pH值为2时响应值最高, 更适合从天然水体中提取活性分子。
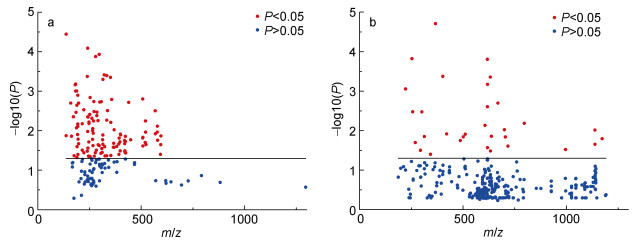 |
| 图 8 强酸组(a)和中性组(b)中的显著特征离子 Fig. 8 The significant characteristic ions in seawater extract in the strong acidic (a) and neutral (b) groups 注:图中每个点代表一个具有特定保留时间和m/z值的特征离子, 其中蓝色的点表示t-检验中P值大于0.05(即不具有统计学差异)的特征离子, 红色的点表示P值小于0.05(具有统计学差异)的特征离子 |
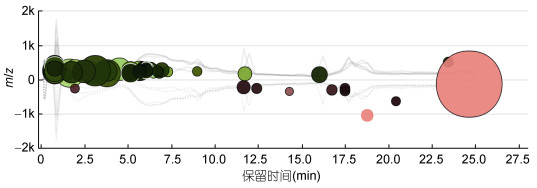 |
| 图 9 强酸组(绿色)和中性组(红色)的差异特征离子分布图 Fig. 9 Differential significant characteristic ions of strong acidic (green) and neutral (red) groups 注:横坐标为保留时间, 纵坐标为m/z。图中表示差异离子的点颜色的深浅表示P值大小, 点的直径大小表示两组间该特征离子峰高的差异倍数 |
用DataAnalysis软件指认以上差异特征离子对应的分子式, 用二级质谱推断其结构并通过Chemspider、Pubchem、Metlin和KEGG等数据库检索验证, 解析出以下19种有机分子在中性和强酸性海水pH条件下提取和表征效果有显著差异(表 3), 其中只有两种在中性pH条件下提取效果更好, 其余17种有机物均更适宜在强酸性pH条件下提取。强酸组提取物中含有的有机物种类丰富, 包括常与生物活动相关的糖苷、脂肪酸、甾酮、胺等, 这也证明了强酸性海水pH条件更适合从海水中提取生物活性分子。
| pH | 名称 | 类别 | 分子式 | 保留时间(min) | 定性离子(m/z) | 误差(ppm) |
| 中性 | 醋酸-13-十四烯酯 | 酯 | C16H30O2 | 17.7 | 253.2173 | 3.7 |
| {1-[5-(6-氨基-2-丁氧基-8-氧代-7, 8-二氢-9H-嘌呤-9-基)戊基]-3-哌啶基}乙酸 | 酸 | C21H34N6O4 | 18.6 | 433.2568 | -3.1 | |
| 酸性 | 1-{2-[2-(2-羟乙氧基)乙氧基]乙氧基}-5-己烯-2-醇 | 醇 | C12H24O5 | 3.9 | 247.1551 | 1.7 |
| (1S)-1, 5-脱水-2, 6-二脱氧-2-(羟甲基)-1-(3-甲氧基-3-氧代丙基)-L-甘露醇 | 醇 | C11H20O6 | 2.4 | 247.1187 | 0.5 | |
| 3-(2, 2-二甲基-4-氧代-4H-1, 3-二恶英-6-基)-2-羟基-2-甲基丙酸甲酯 | 酯 | C11H16O6 | 2.0 | 243.0874 | -1.0 | |
| 邻苯二甲酸单丁酯 | 酯 | C12H14O4 | 6.6 | 221.0819 | -0.1 | |
| 水杨酸苄酯 | 酯 | C14H10O4 | 5.8 | 241.0506 | 1.6 | |
| 9-醛基壬酸 | 脂肪酸 | C9H16O3 | 5.3 | 171.1027 | 0.5 | |
| (2Z, 6Z)-8-乙酰氧基-5-羟基-2, 6-十二碳二烯酸 | 脂肪酸 | C14H22O5 | 6.2 | 269.1394 | 2.2 | |
| 2, 4-二氯苯甲酸 | 酸 | C7H3Cl2O2 | 5.2 | 188.9516 | 0.1 | |
| 3-(1-甲基-2-氧代环己基)丙酸 | 酸 | C10H16O3 | 5.8 | 183.1027 | 1.7 | |
| 辛基丙二酸 | 酸 | C11H20O4 | 6.5 | 215.1289 | -0.1 | |
| 3-[2-(甲氧基甲氧基)乙氧基]-2-氧代丁醛 | 醛 | C8H14O5 | 1.6 | 189.0768 | 1.1 | |
| 6-过氧羟基-6-甲氧基-5-甲基-4-(2-甲基-1, 3-二氧戊环-2-基)己醛 | 醛 | C12H22O6 | 3.2 | 261.1344 | 0.6 | |
| 4, 4-二甲基-5-[(3R)-1, 2, 4-三氧戊环-3-基]-2-戊酮 | 酮 | C9H16O4 | 3.8 | 187.0976 | 0.8 | |
| 17-羟基-16-甲基-19-硫烷-4-雄烯酮 | 甾酮 | C20H30O2S | 5.7 | 333.1894 | -4.9 | |
| 辛基葡萄糖苷 | 糖苷 | C14H28O6 | 5.3 | 291.1813 | 1.1 | |
| 辛基-6-O-乙酰-α-D-吡喃半乳糖苷 | 糖苷 | C16H30O7 | 6.2 | 333.1919 | 0.4 | |
| 6-{4-[4-环丙基-5-(1H-1, 2, 4-三唑-1-甲基)-4H-1, 2, 4-三唑-3-基]-1-哌啶基}-4-嘧啶胺 | 胺 | C17H22N10 | 6.2 | 365.1956 | -0.6 |
本文研究探讨了海水7种不同pH条件下HLB小柱对近海海水中活性分子的提取效率, 发现中性pH条件和强酸性pH条件都能获得较高提取效率, pH为5和6时提取效率不佳。随着海水pH的降低, 质谱图上可识别的谱峰数目增加, 样品pH为2时有效峰数目最多, 即能表征出的分子种类最多, 更适合分析海水DOM的分子组成特征。不同样品pH条件下提取物的分子组成有所差异, 中性pH条件适合提取饱和度较高的小分子有机物, 而强酸性pH条件提取出的物质分子异质性更高, 不但能提取出部分高饱和小分子, 对带有含氧不饱和基团的酸、酮等活性小分子和木质素、蛋白质、糖类等生物分子的提取效果尤其好, 更适合用以分析近海海水中的小分子活性有机物。当样品pH为2时, HPLC-ESI-Q-TOF-MS对极性分子的响应值最高, 尤其适于从海水中分离提取活性物质。综合提取效率、有效峰数目和分子组成特征考虑, 用HLB固相萃取小柱提取海水中小分子活性物质时, 将海水样品pH调节为2较为适宜。现有文献分析远离人为因素影响的大洋或极地水体DOM组成时常将海水pH值酸化至2, 有机物来源多样、受人类影响较多的近海水体则没有统一的处理标准。本文结果表明将水样pH值酸化至2这一处理条件在分析海水DOM组成时具有一定程度上的通用性, 此时对近海海水样品总体DOM的提取效率较高, 通过HPLC-Q-TOF-MS在ESI(-)模式下检测解析出的分子种类最多, 尤其有利于分析带有生物活性基团或能形成生物活性位点的有机分子。
| 刘清泉, 陈景文, 蔡喜运, 2016. Fe-TAML催化降解水体中含硫污染物的研究.见: 中国化学会第十三届全国水处理化学大会暨海峡两岸水处理化学研讨会论文集.南京: 中国化学会, 224 |
| 孙静, 徐雄, 李春梅, 等, 2015. 固相萃取-超高效液相色谱-串联质谱法同时检测地表水中的35种农药及降解产物. 分析化学, 43(8): 1145–1153 |
| 孙玲玲, 宋金明, 于颖, 等, 2018. 荣成湾14种海洋经济生物体中的重金属水平与食用风险初步评价. 海洋与湖沼, 49(1): 52–61 |
| 吴春英, 白鹭, 谷风, 等, 2016. 固相萃取-超高效液相色谱-串联质谱法同时测定地表水中的18种酰胺类除草剂. 理化检验-化学分册, 52(5): 602–606 |
| 吴梧桐, 王友同, 吴文俊, 2000. 海洋活性物质研究若干进展. 药物生物技术, 7(3): 179–183 DOI:10.3969/j.issn.1005-8915.2000.03.015 |
| 汪珊, 孙继朝, 张宏达, 等, 2005. 我国水环境有机污染现状与防治对策. 海洋地质动态, 21(10): 5–10 |
| 宋金明, 2004. 中国近海生物地球化学. 济南: 山东科学技术出版社, 14 |
| 宋金明, 徐永福, 胡维平, 等, 2008. 中国近海与湖泊碳的生物地球化学. 北京: 科学出版社, 1-533 |
| 宋金明, 李学刚, 2018. 海洋沉积物/颗粒物在生源要素循环中的作用及生态学功能. 海洋学报, 40(10): 1–13 DOI:10.3969/j.issn.0253-4193.2018.10.001 |
| 宋金明, 李学刚, 袁华茂, 等, 2018. 渤黄东海生源要素的生物地球化学. 北京: 科学出版社, 1-859 |
| 张金, 宗栋良, 常爱敏, 等, 2015. 水环境中典型抗生素SPE-UPLC-MS/MS检测方法的建立. 环境化学, 34(8): 1446–1452 |
| 张倩, 宋金明, 李学刚, 等, 2017. 水环境中的信息有机物与"水域生态讯息学"的提出. 海洋科学, 41(3): 138–150 |
| 张耀玲, 2013.近海环境中天然有机质的分离与表征.上海:华东师范大学博士学位论文, 6-138 |
| 陈猛, 陆婉清, 韩燕, 等, 2009. 固相萃取-气相色谱法对河水与海水中36种农药残留的同时测定. 分析测试学报, 28(12): 1378–1383 DOI:10.3969/j.issn.1004-4957.2009.12.006 |
| 陈玫宏, 徐怀洲, 宋宁慧, 等, 2017. 高效液相色谱-串联质谱法同时测定水体和沉积物中12种有机磷酸酯类化合物. 分析化学, 45(7): 987–995 |
| 洪家俊, 陈秋兰, 易启同, 等, 2013. 海水中多种类兽药残留测定准确度的评价和改善方法. 厦门大学学报(自然科学版), 52(5): 675–683 |
| 袁圣柳, 李晓锋, 姜晓满, 等, 2013. 自动固相萃取-高效液相色谱串联质谱法测定生活污水中13种抗精神病药物. 分析化学, 41(1): 49–56 |
| 顾佳萍, 2011.记忆缺失性贝毒-软骨藻酸新型固相萃取材料的制备及其应用.上海:上海交通大学硕士学位论文, 79-86 |
| 梁宪萌, 宋金明, 段丽琴, 等, 2016. 胶州湾沉积物重金属形态不同浸取方法的比较与污染讯息指示作用初探. 海洋学报, 38(10): 12–21 DOI:10.3969/j.issn.0253-4193.2016.10.002 |
| 彭全材, 宋金明, 李琛, 等, 2014. 胶州湾5种海藻中的多不饱和脂肪酸与有机氯农药共摄入风险的评估研究. 海洋与湖沼, 45(1): 80–87 |
| 韩典峰, 宫向红, 刘小静, 等, 2016. 固相萃取/气相色谱-质谱法测定海水中16种除草剂. 分析测试学报, 35(7): 839–843 DOI:10.3969/j.issn.1004-4957.2016.07.010 |
| 廖涛, 吴晓翠, 王少华, 等, 2013. 固相萃取-气相色谱/质谱联用法同时检测水体中9种环境雌激素. 分析化学, 41(3): 422–426 |
| Assunção J, Guedes A C, Malcata F X, 2017. Biotechnological and pharmacological applications of biotoxins and other bioactive molecules from dinoflagellates. Marine Drugs, 15(12): 393 DOI:10.3390/md15120393 |
| Benton H P, Ivanisevic J, Mahieu N G, et al, 2015. Autonomous metabolomics for rapid metabolite identification in global profiling. Analytical Chemistry, 87(2): 884–891 |
| Cawley K M, Murray A E, Doran P T, et al, 2016. Characterization of dissolved organic material in the interstitial brine of Lake Vida, Antarctica. Geochimica et Cosmochimica Acta, 183: 63–78 DOI:10.1016/j.gca.2016.03.023 |
| Derrien M, Lee Y K, Hur J, 2017. Comparing the spectroscopic and molecular characteristics of different dissolved organic matter fractions isolated by hydrophobic and anionic exchange resins using fluorescence spectroscopy and FT-ICR-MS. Water, 9(8): 555 DOI:10.3390/w9080555 |
| Dittmar T, Koch B, Hertkorn N, et al, 2008. A simple and efficient method for the solid-phase extraction of dissolved organic matter (SPE-DOM) from seawater. Limnology and Oceanography:Methods, 6(6): 230–235 DOI:10.4319/lom.2008.6.230 |
| Gowda H, Ivanisevic J, Johnson C H, et al, 2014. Interactive XCMS online:simplifying advanced metabolomic data processing and subsequent statistical analyses. Analytical Chemistry, 86(14): 6931–6939 DOI:10.1021/ac500734c |
| Hertkorn N, Harir M, Cawley K M, et al, 2016. Molecular characterization of dissolved organic matter from subtropical wetlands:a comparative study through the analysis of optical properties, NMR and FTICR/MS. Biogeosciences, 13(8): 2257–2277 DOI:10.5194/bg-13-2257-2016 |
| Koprivnjak J F, Pfromm P H, Ingall E, et al, 2009. Chemical and spectroscopic characterization of marine dissolved organic matter isolated using coupled reverse osmosis-electrodialysis. Geochimica et Cosmochimica Acta, 73(14): 4215–4231 DOI:10.1016/j.gca.2009.04.010 |
| Kujawinski E B, Longnecker K, Blough N V, et al, 2009. Identification of possible source markers in marine dissolved organic matter using ultrahigh resolution mass spectrometry. Geochimica et Cosmochimica Acta, 73(15): 4384–4399 DOI:10.1016/j.gca.2009.04.033 |
| LaRowe D E, Koch B P, Robador A, et al, 2017. Identification of organic compounds in ocean basement fluids. Organic Geochemistry, 113: 124–127 DOI:10.1016/j.orggeochem.2017.07.017 |
| Li Y, Harir M, Uhl J, et al, 2017. How representative are dissolved organic matter (DOM) extracts? A comprehensive study of sorbent selectivity for DOM isolation. Water Research, 116: 316–323 DOI:10.1016/j.watres.2017.03.038 |
| Liu Z F, Sleighter R L, Zhong J Y, et al, 2011. The chemical changes of DOM from black waters to coastal marine waters by HPLC combined with ultrahigh resolution mass spectrometry. Estuarine, Coastal and Shelf Science, 92(2): 205–216 DOI:10.1016/j.ecss.2010.12.030 |
| Rathgeb A, Causon T, Krachler R, et al, 2017. From the peat bog to the estuarine mixing zone:common features and variances in riverine dissolved organic matter determined by non-targeted analysis. Marine Chemistry, 194: 158–167 DOI:10.1016/j.marchem.2017.06.012 |
| Song J M, 2010. Biogeochemical Processes of Biogenic Elements in China Marginal Seas. Springer-Verlag GmbH & Zhejiang University Press, 1-662 |
| Song J M, Qu B X, Li X G, et al, 2018. Carbon sinks/sources in the Yellow and East China Seas-Air-sea interface exchange, dissolution in seawater, and burial in sediments. Science China Earth Sciences, 61 |
| Tautenhahn R, Cho K, Uritboonthai W, et al, 2012. An accelerated workflow for untargeted metabolomics using the metlin database. Nature Biotechnology, 30(9): 826–828 |
 2018, Vol. 49
2018, Vol. 49


